ELEMENTI DI CHIMICA CLASSI SECONDE SAPPIAMO GI Tutto











- Slides: 21

ELEMENTI DI CHIMICA CLASSI SECONDE

SAPPIAMO GIÀ … • Tutto ciò che ci circonda è MATERIA • Le forme sotto cui si presenta la materia sono dette SOSTANZE • La molecola è la parte più piccola in cui si può suddividere una sostanza senza che perda le sue caratteristiche • La molecola è una combinazione di particelle dette ATOMI • Gli atomi sono invisibili

K Au UNA NUOVA TEORIA E SE FOSSIMO COMPOSTI DA PARTICELLE INVISIBILI E INDIVISIBILI? O Democrito 400 a. C. Na H C ATOMO = INDIVISIBILE Ogni atomo ha un simbolo perché è associato ad un elemento.

ALCHIMIA dall’arabo al-kīmiyā’ “(arte della) pietra filosofale” Arte, nata nell’ambiente ellenistico dell’Egitto nel 1° secolo d. C. , che si proponeva la manipolazione e trasformazione dei metalli, e in particolare la loro possibile trasmutazione in oro o in rimedi per il prolungamento della vita. Questa arte è stata coltivata durante tutto il medioevo e l’inizio dell’età moderna, fino al secolo 17°. CHIMICA … una AL di troppo! Scienza che studia la materia in relazione alla sua composizione, alla sua struttura e alle trasformazioni che può subire.

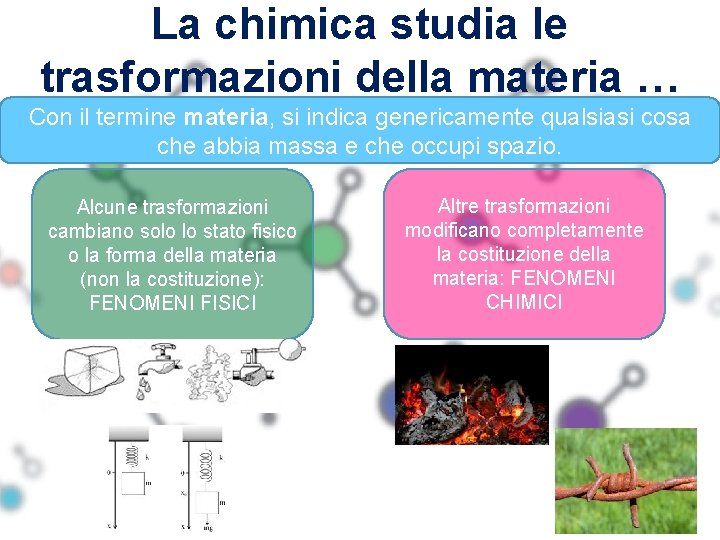
La chimica studia le trasformazioni della materia … Con il termine materia, si indica genericamente qualsiasi cosa che abbia massa e che occupi spazio. Alcune trasformazioni cambiano solo lo stato fisico o la forma della materia (non la costituzione): FENOMENI FISICI Altre trasformazioni modificano completamente la costituzione della materia: FENOMENI CHIMICI

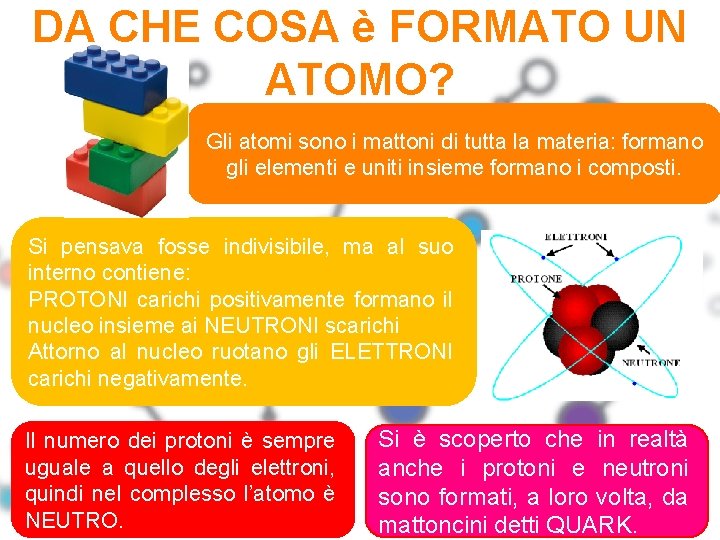
DA CHE COSA è FORMATO UN ATOMO? Gli atomi sono i mattoni di tutta la materia: formano gli elementi e uniti insieme formano i composti. Si pensava fosse indivisibile, ma al suo interno contiene: PROTONI carichi positivamente formano il nucleo insieme ai NEUTRONI scarichi Attorno al nucleo ruotano gli ELETTRONI carichi negativamente. Il numero dei protoni è sempre uguale a quello degli elettroni, quindi nel complesso l’atomo è NEUTRO. Si è scoperto che in realtà anche i protoni e neutroni sono formati, a loro volta, da mattoncini detti QUARK.

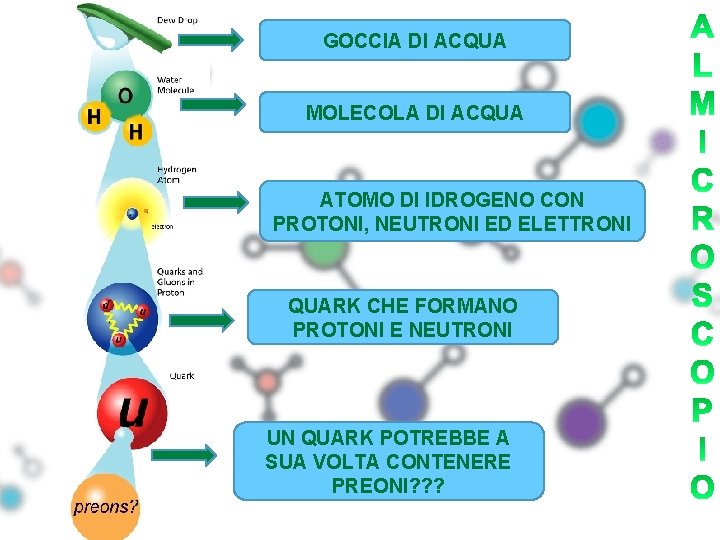
GOCCIA DI ACQUA MOLECOLA DI ACQUA ATOMO DI IDROGENO CON PROTONI, NEUTRONI ED ELETTRONI QUARK CHE FORMANO PROTONI E NEUTRONI UN QUARK POTREBBE A SUA VOLTA CONTENERE PREONI? ? ?

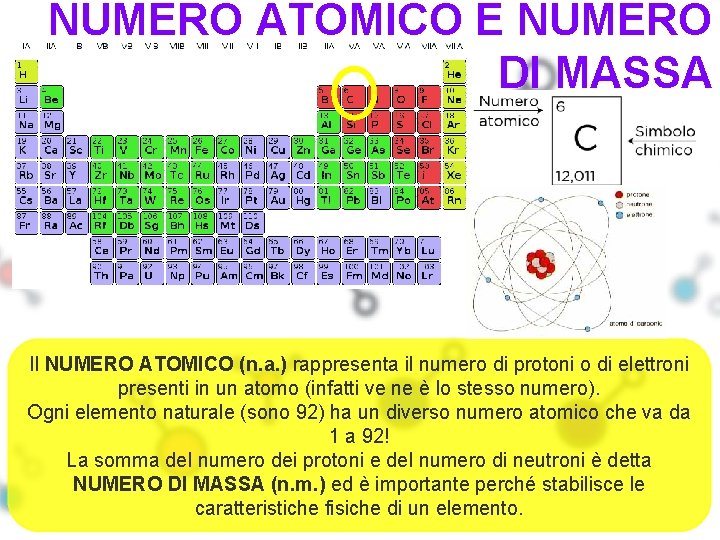
NUMERO ATOMICO E NUMERO DI MASSA Il NUMERO ATOMICO (n. a. ) rappresenta il numero di protoni o di elettroni presenti in un atomo (infatti ve ne è lo stesso numero). Ogni elemento naturale (sono 92) ha un diverso numero atomico che va da 1 a 92! La somma del numero dei protoni e del numero di neutroni è detta NUMERO DI MASSA (n. m. ) ed è importante perché stabilisce le caratteristiche fisiche di un elemento.

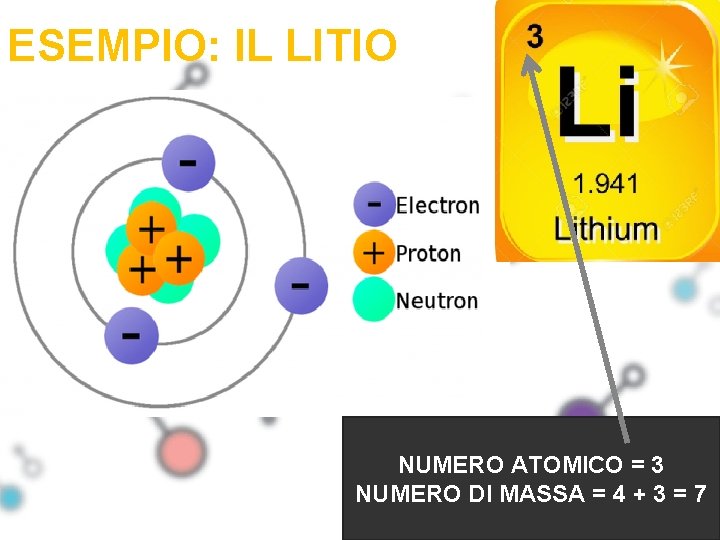
ESEMPIO: IL LITIO NUMERO ATOMICO = 3 NUMERO DI MASSA = 4 + 3 = 7

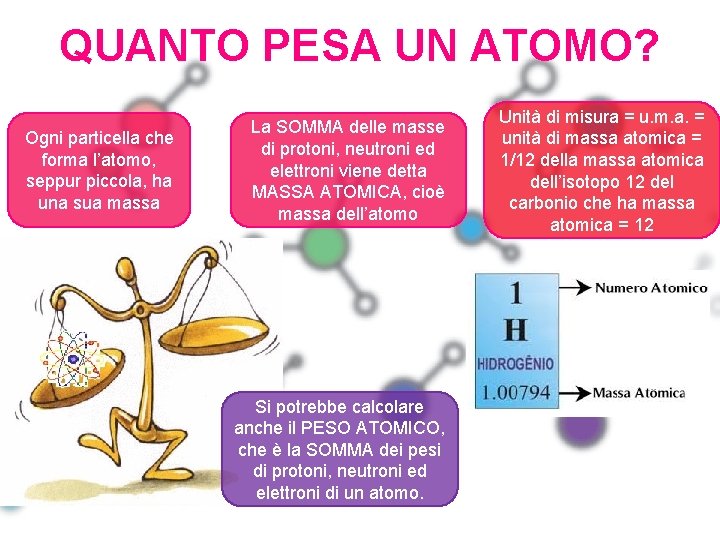
QUANTO PESA UN ATOMO? Ogni particella che forma l’atomo, seppur piccola, ha una sua massa La SOMMA delle masse di protoni, neutroni ed elettroni viene detta MASSA ATOMICA, cioè massa dell’atomo Si potrebbe calcolare anche il PESO ATOMICO, che è la SOMMA dei pesi di protoni, neutroni ed elettroni di un atomo. Unità di misura = u. m. a. = unità di massa atomica = 1/12 della massa atomica dell’isotopo 12 del carbonio che ha massa atomica = 12

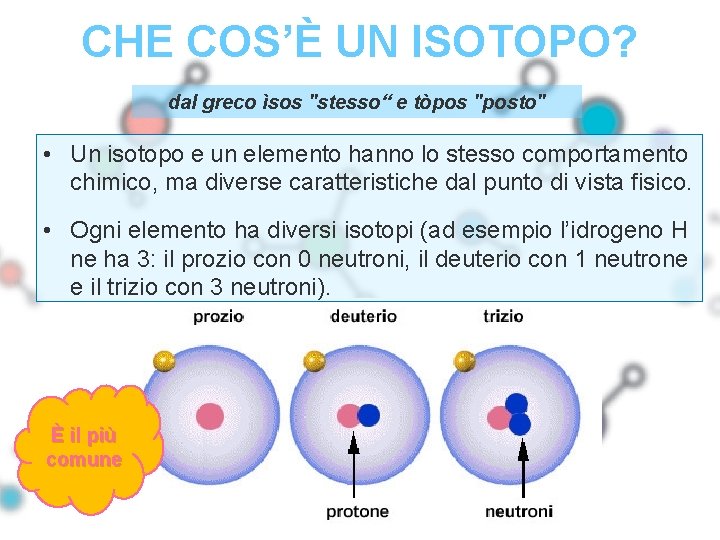
CHE COS’È UN ISOTOPO? • Ogni elemento è caratterizzato da un numero atomico (numero protoni o elettroni) • Il numero di massa (protoni + neutroni) può cambiare, cioè può cambiare il numero di neutroni di un atomo • L’atomo, anche se ha un numero diverso di neutroni, è sempre dello stesso tipo cioè determina lo stesso elemento di partenza ma con un aspetto diverso • Un ISOTOPO è quindi un atomo dello stesso elemento di partenza ma con un numero di neutroni diverso (numero di massa)

CHE COS’È UN ISOTOPO? dal greco ìsos "stesso“ e tòpos "posto" • Un isotopo e un elemento hanno lo stesso comportamento chimico, ma diverse caratteristiche dal punto di vista fisico. • Ogni elemento ha diversi isotopi (ad esempio l’idrogeno H ne ha 3: il prozio con 0 neutroni, il deuterio con 1 neutrone e il trizio con 3 neutroni). È il più comune

ELETTRONI E STRATI ELETTRONICI Gli ELETTRONI ruotano attorno al nucleo su diverse orbite ellittiche dette STRATI ELETTRONICI o GUSCI ELETTRONICI. NUMERO MASSIMO DI GUSCI = 7 Ogni orbita ellittica può contenere un massimo di elettroni: il PRIMO strato al massimo 2 il SECONDO e il TERZO strato al massimo 8 il QUARTO e il QUINTO strato al massimo 18 il SESTO e il SETTIMO strato al massimo 32

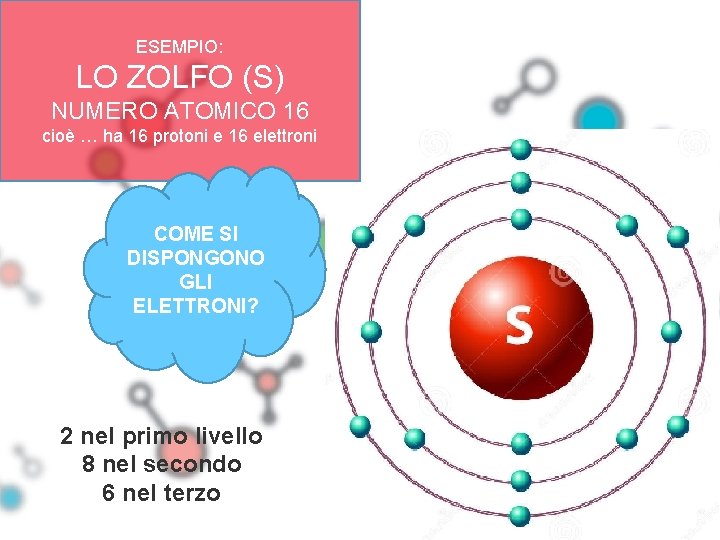
ESEMPIO: LO ZOLFO (S) NUMERO ATOMICO 16 cioè … ha 16 protoni e 16 elettroni COME SI DISPONGONO GLI ELETTRONI? 2 nel primo livello 8 nel secondo 6 nel terzo

Ma che cosa è un elemento? dal latino elementum «principio, rudimento, lettera dell’alfabeto» Si dicono elementi le sostanze semplici di cui sono formati i corpi. In chimica un elemento è una sostanza pura in cui tutti gli atomi costituenti, presi singolarmente, hanno caratteristiche uguali. Es. ossigeno, ferro (NO acqua) SONO 118: 92 NATURALI E GLI ALTRI ARTIFICIALI GLI ARTIFICIALI SONO DETTI TRANSURANICI perché hanno numero atomico superiore all’uranio Ogni atomo ha il suo simbolo (spesso derivato dal nome latino dell’elemento), formato da 1 o 2 lettere dell’alfabeto (la prima maiuscola e la seconda minuscola) che vanno lette separatamente (es. Hg = “acca-gi”)

DOVE TROVO TUTTI GLI ELEMENTI?

ATOMO VS MOLECOLA ELEMENTO VS COMPOSTO composto : messo insieme, risultante dall’unione di più elementi Sono circa 8 milioni i composti esistenti in natura. Un composto è formato da più elementi ed ogni elemento è associato ad un atomo. Un composto quindi è formato da atomi legati tra loro detti MOLECOLA DI ACQUA Formata da 3 atomi: 2 idrogeno H 1 ossigeno O Si legge “acca-due-o” Si scrive H 2 O

COME SI INDICANO MOLECOLE E SOSTANZE? SI USA LA “FORMULA CHIMICA”, che è costituita dai simboli dei vari elementi che compongono la sostanza con un numero in basso a destra che indica quanti atomi di quell’elemento sono presenti nella molecola. “acca-due-o” 2 atomi di idrogeno 1 atomo di ossigeno MOLECOLA DI ACQUA “ci-a-ci-o-tre” 1 atomo di calcio 1 atomo di carbonio 3 atomi di ossigeno MOLECOLA DI CARBONATO DI CALCIO

COME HANNO CREATO LA TAVOLA PERIODICA? 1869 DIMITRIJ IVANOVIC MENDELEEV Nacque in Siberia nel 1834, ultimo di 14 figli. La madre, intuendo la sua grande intelligenza, percorse a piedi e con mezzi di fortuna più di 1500 km fino a San Pietroburgo, per iscriverlo all’università. Dieci giorni dopo morì e le ultime parole che rivolse al figlio furono: “Persevera con il lavoro e non con i discorsi. Cerca pazientemente la verità divina e quella scientifica. ” Si dice che Mendeleev ha ideato la tavola periodica sognando di fare un solitario.

COME È FATTA LA TAVOLA PERIODICA? 7 righe orizzontali = PERIODI 8 colonne verticali = GRUPPI a cui si aggiunge il gruppo degli elementi di transizione Gli elementi dello stesso GRUPPO hanno lo stesso numero di elettroni nell’orbita esterna Al tempo 38 caselle erano vuote Ogni elemento contiene nome, simbolo, numero atomico e peso atomico

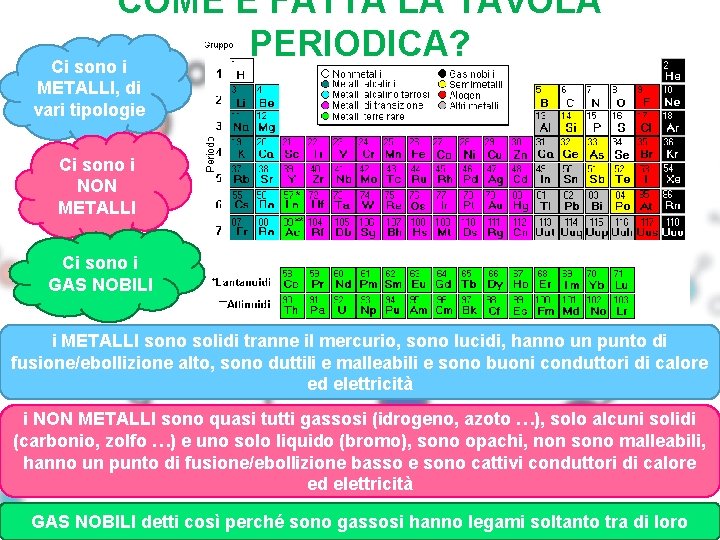
COME È FATTA LA TAVOLA PERIODICA? Ci sono i METALLI, di vari tipologie Ci sono i NON METALLI Ci sono i GAS NOBILI i METALLI sono solidi tranne il mercurio, sono lucidi, hanno un punto di fusione/ebollizione alto, sono duttili e malleabili e sono buoni conduttori di calore ed elettricità i NON METALLI sono quasi tutti gassosi (idrogeno, azoto …), solo alcuni solidi (carbonio, zolfo …) e uno solo liquido (bromo), sono opachi, non sono malleabili, hanno un punto di fusione/ebollizione basso e sono cattivi conduttori di calore ed elettricità GAS NOBILI detti così perché sono gassosi hanno legami soltanto tra di loro