Elektron dalm ve periyodik cetvel Dr Kemal Doymu

















![Soru 1 Mn: [Ar]4 s 2 3 d? Mn d orpitalında kaç elektron olmalıdır? Soru 1 Mn: [Ar]4 s 2 3 d? Mn d orpitalında kaç elektron olmalıdır?](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-22.jpg)



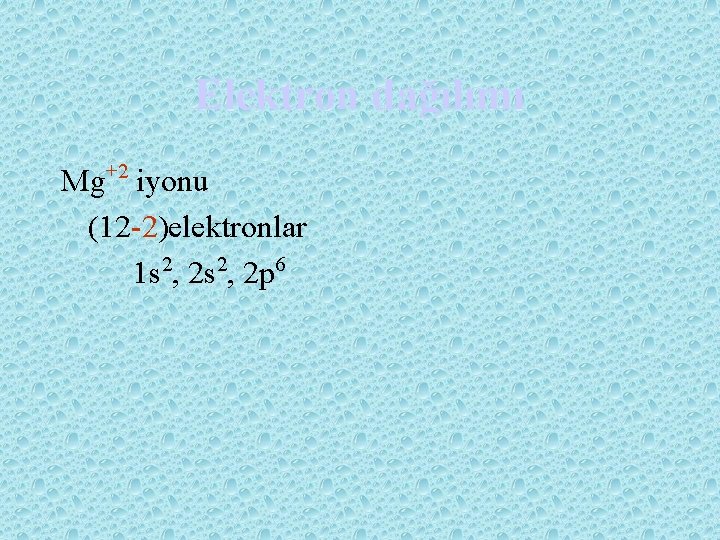









![4. periyot 4 üncü enerji seviyesi ile başlar K: [Ar] 4 s 2 Ca: 4. periyot 4 üncü enerji seviyesi ile başlar K: [Ar] 4 s 2 Ca:](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-38.jpg)

![gruplar • Alkalı metaler Li: [He] 2 s 1 Na: [Ne] 3 s 1 gruplar • Alkalı metaler Li: [He] 2 s 1 Na: [Ne] 3 s 1](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-40.jpg)













- Slides: 58

Elektron dağılımı ve periyodik cetvel Dr. Kemal Doymuş

Elektron dağılımı ve periyodik tabloyu dikkate alarak hangi sorulara cevap verile bilir. • • • 1. İyonlaşma enerjisine 2. Atom çapının büyüklüğüne 3. Elektron ilgisine 4. Para manyetik ve diya manyetiğe 5. Grup ve periyotların bulunmasına 6. İyonlar ve yarı çaplarına

Elektron dağılımı • Bir elektronun yerini belirlemek için, dört kuantum sayısı gerekir. Bu Kuantumlar. n, l, ms dir. • Bir atomun içindeki elektron , cok az manyetik bir alan oluşturtarak bir eksende döndüğü farz edilir. • Bu özelliğe elektronun spini denir.

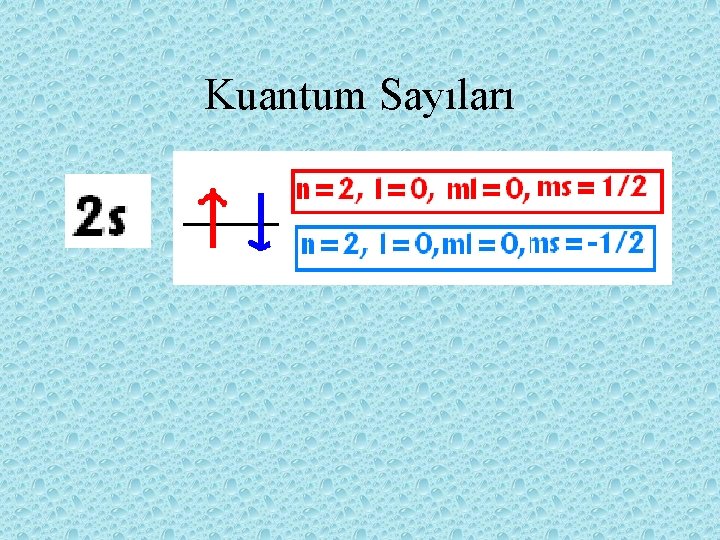
Kuantum Sayıları • 1. Temel Kuantum Sayısı n Harfi ile gösterilir. n= 1 , 2, 3, 4, …. Sayıları alır 2. Açısal momentum sayıları l harfi ile gösterilir. l= 0, 1, 2, 3…. (n-1) sayıları alır

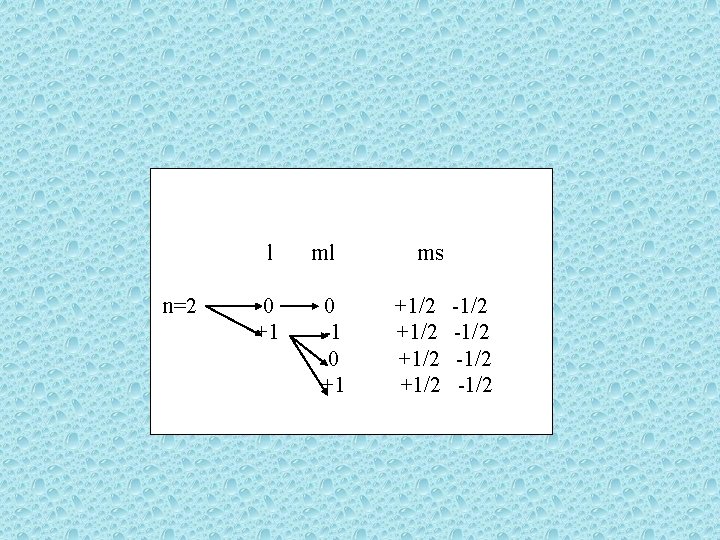
Kuantum Sayıları 3. Manyetik kuantum sayıları ml ile gösterilir. ml= -l, 0, +l değerleri alır 4. Spin kuantum sayıları ms ile gösterilir. ms= + ½, - ½ değerleri alır.

Kuantum Sayıları

Kuantum Sayıları

• Spinin özeliğini kuantum sayısı ms tarafında belirlenir. • ms ; bu değerleri alır. ½ (+ ½ or – ½ ) • bir orbitalde zıt yönlü iki elektron bulunur.

Elektron dağılımı n= 1 l ml ms 0 0 +1/2, -1/2

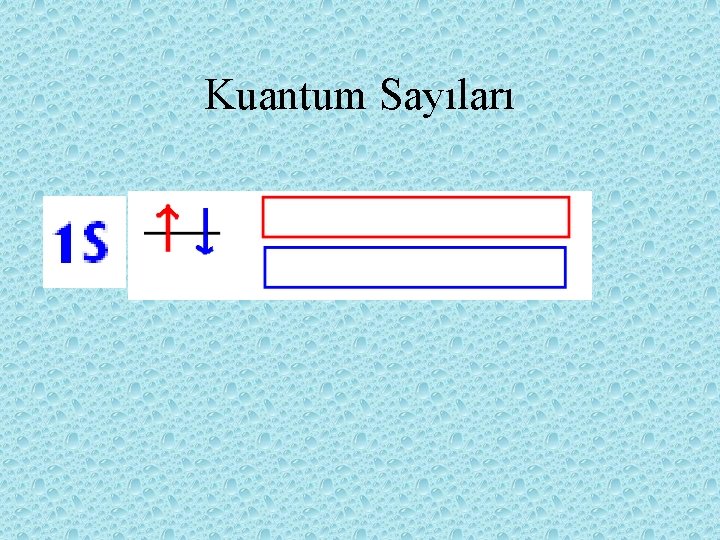
• Çok atomlu atomlar için ise Pauli ilkesi kullanılır. - Bir atomda hiçbir zaman iki elektron aynı dört kuantum sayısına sahip olamaz. Bir orpitale en fazla iki elektron girer, bu elektronlar zıt yönlü girerler

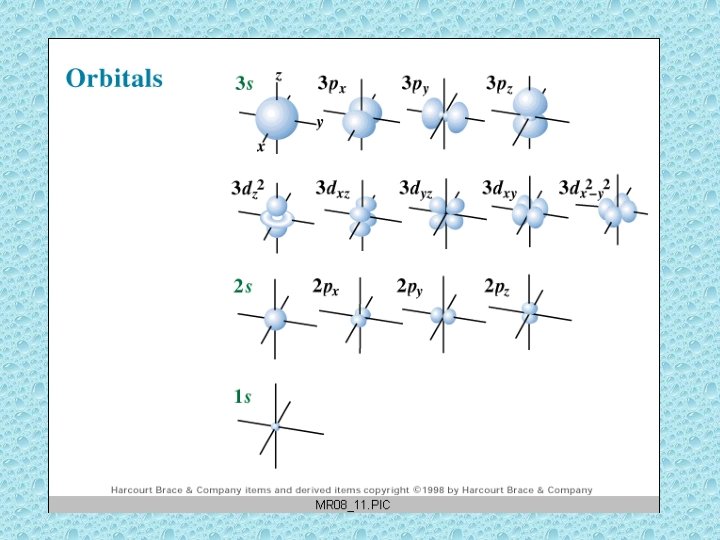
orbital • Çekirdeğin etrafında bir elektron muhtemelen dört orpıtalin birinde bulunabilir. • 4 tip => s p d f • Bir orpital en fazla iki elektron alır.

Pure Atomic Orbitals. Atomik orbitaller s p d f Şekileri küresel halter karışık çok karışık enerji seviyeleri 1 3 5 7


Orbitallerin şekileri http: //www. colby. edu/chemistry/OChem/DEMOS/Orbitals. html


Elektron dolum sırası 1 s 2 s 3 s 4 s 5 s 6 s 7 s 2 p 3 p 4 p 5 p 6 p 3 d 4 d 4 f 5 d 5 f 6 d

Elektron dağılımı H atomu 1 elektron 1 s 1

Elektron dağılımı He atomu 2 elektronlar 1 s 2

Elektron dağılımı Li atomu 3 elektronlar 1 s 2, 2 s 1

Elektron dağılımı Cl atomu 17 elektronlar 1 s 2, 2 p 6, 3 s 2, 3 p 5

Elektron dağılımı As atomu 33 elektonlar 1 s 2, 2 p 6, 3 s 2, 3 p 6, 4 s 2, 3 d 10, 4 p 3 or [Ar] 4 s 2, 3 d 10, 4 p 3
![Soru 1 Mn Ar4 s 2 3 d Mn d orpitalında kaç elektron olmalıdır Soru 1 Mn: [Ar]4 s 2 3 d? Mn d orpitalında kaç elektron olmalıdır?](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-22.jpg)
Soru 1 Mn: [Ar]4 s 2 3 d? Mn d orpitalında kaç elektron olmalıdır? 4, 5, 6

Elektron dağılımı Negatif iyonlar Elektron ilave etmek (s), 1 her bir negatif yük bir elektron demektir. -1 = bir elektron -2 = iki elektron. .

Elektron dağılımı S-2 iyonu (16 + 2)elektronlar 1 s 2, 2 p 6, 3 s 2, 3 p 6

Elektron dağılımı Pozitif iyonlar Elektron uzaklaştırmak demektir, 1 elektron +1 demektir. 2 elektron uzaklaştırmak +2 yük demektir….
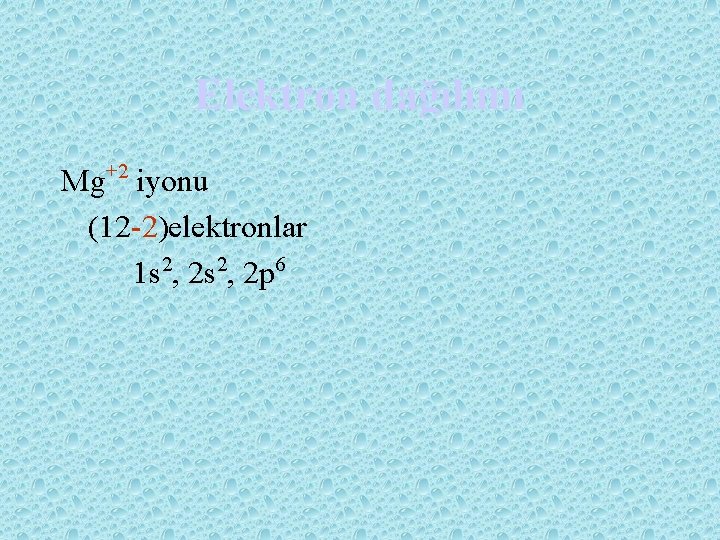
Elektron dağılımı Mg+2 iyonu (12 -2)elektronlar 1 s 2, 2 p 6

Soru 2 Cl valens elektron sayısı kaçtır, Yanı klorun son yörüngesinde kaç elektron vardır. [Ne]3 s 2 3 p 5? 2, 5, 7

soru 3 Cl atomunu soy gaza benzetmek için elektron uzaklaştırılmalımı yoksa elektron ilave etmelimi? .

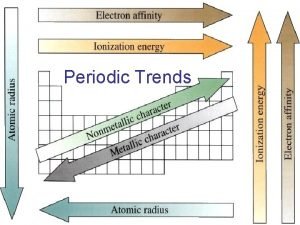
Periyodik tablo • • Atom yarı çapı İyonlaşma enerjisi Elektron afinitesi

Atomic Radius • increase top to bottom down a group – each additional electron “shell” shields the outer electrons from the nuclear charge Zeff = Z - S where Zeff => effective nuclear charge Z => nuclear charge, atomic number S => shielding constant

l n=2 0 +1 ml 0 -1 0 +1 ms +1/2 -1/2

Enerji seviyelerin bölümü • Çok elektronlu bir atomda iki tip elektrostatik etkileşme oluşur. 1)Çekirdek –elektron çekimi 2) elektron- elektron itmesi Sonuçta farklı alt seviyeli enerjiler oluşur.

Orbital enerjisine üç faktör etkiler: 1) Çekirdek yükü artıkça, orbital enerji seviyeleri düşer. 2. Perdeleme etkisi Atoma elektron ilave edildiğinde çekim gücü düşer 3. Karşı etki

• İnşa kuralı ( bu ifade doğrumu? 1. Elektronlar en düşük enerji seviyeden 2. başlanarak dolar 3. HUND’S Kuralı : p , d, f gibi orpitalere elektron önce tek girer sonra çiftleşirler.

1. Periyot 2. atom numarası 1 ile 2 olan element bulundurur. - 1 S Sadece bir atomik orpitale sahıptır. Sadece iki elektron alır. - : 1 s 1 H ‘nin 1 e 1 2 He nin 2 e: 1 s 2

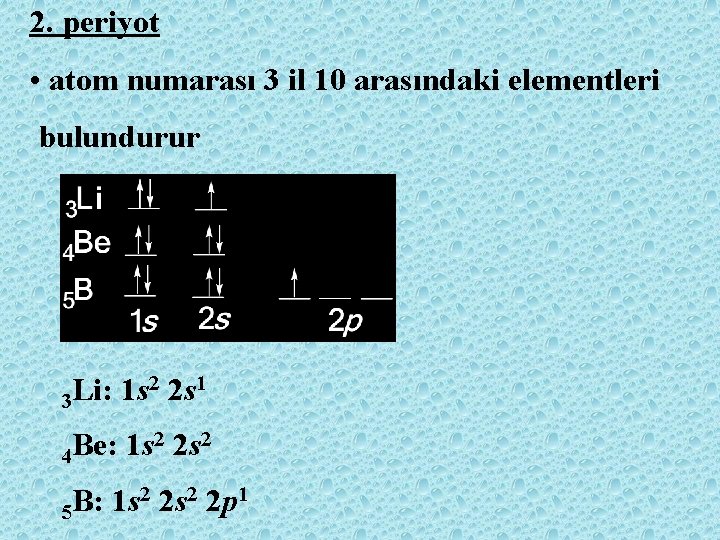
2. periyot • atom numarası 3 il 10 arasındaki elementleri bulundurur 2 2 s 1 Li: 1 s 3 2 2 s 2 Be: 1 s 4 2 2 s 2 2 p 1 B: 1 s 5

3. periyot • Ne sonra , 1 s 2 2 p 6, üçüncü enerji seviyeli Na ile başlar Na Na: 1 s 2 2 p 6 3 s 1 Mg: 1 s 2 2 p 6 3 s 2 • Na bu şekilde de yazılabilir: [Ne] 3 s 1 Mg: [Ne] 3 s 2
![4 periyot 4 üncü enerji seviyesi ile başlar K Ar 4 s 2 Ca 4. periyot 4 üncü enerji seviyesi ile başlar K: [Ar] 4 s 2 Ca:](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-38.jpg)
4. periyot 4 üncü enerji seviyesi ile başlar K: [Ar] 4 s 2 Ca: [Ar] 4 s 2 3 d orbitalı 4 s orpitalinde daha yüksek enerji seviyesine sahiptir. Fakat 4 p den ise daha düşük enerji seviyesine sahip tır - bu yüzden Ca 3 d yi dolmadan 4 s dolar.

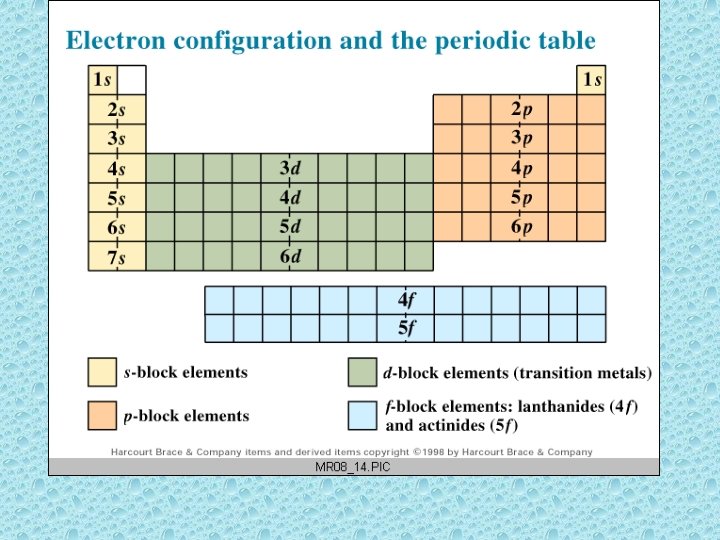
Bazı genel özellikler 1. Bir gruptaki elementler benzer kimyasal özellik gösterir, çünkü diş yörüngedeki elektron dağılımı benzerdir. 2. Grup numarası en yüksek periyotaki elektron sayısına eşittir. 3. Periyot sayısı en yüksek en sayısına eşittir.
![gruplar Alkalı metaler Li He 2 s 1 Na Ne 3 s 1 gruplar • Alkalı metaler Li: [He] 2 s 1 Na: [Ne] 3 s 1](https://slidetodoc.com/presentation_image_h/2b77be8933c6bdebb10eed57f1644314/image-40.jpg)
gruplar • Alkalı metaler Li: [He] 2 s 1 Na: [Ne] 3 s 1 K: [Ar] 4 s 1 • dış yörüngedeki elektron sayısı aynı, • Bu nedenle Na, K, Li aynı grupta

Grup 3 A B: 2 s 2 2 p 1 Al: 3 s 2 3 p 1 Ga: 4 s 2 4 p 1 - genelde: ns 2 np 1 • Grub 1 A ve 2 A: s-blok; s orbitaleri dolar • Grub 3 A-8 A: p-blok; p orpitaleri dolar • geçiş metalleri: d-blok; d orbitaler dolar

iyonlar Na 2 2 6 1 s s p s 1 2 2 3 - F+ e 1 s 2 2 p 5 + Na + e 2 2 6 s s p 1 2 2 - Ne F 2 2 6 s s p 1 2 2 Fe: [Ar] 4 s 2 3 d 6 • - Fe 2+: [Ar] 3 d 6

Atomun yarı çapı • bir gruptan aşağı inildikçe artar Li Cs; 2 s 7 s • bir periyota soldan sağa gidildikçe azalır. etkin çekirdek yükü , Ze artar

• Bir dış yörüngedebir elektron tarafında his edilen yüke etkin çekirdek yükü denir.

İyonlaşma enerjisi • Katyon: bir atom bir ve daha fazla elektron kayıp ettiği zaman oluşur. Na Na+ + e. Mg 2+ + 2 e. Bu iyonların oluşumu için enerjiye gerek vardır. Bir Ei 1, en düşük enerjidir. Bu enerji gaz halinde olan bir atomdan 1 elektron koparmak için verilen enerjidir. H + 1312 k. J H+ + e-

Ca + 590 k. J Ca+ + e- Ei 1 Ca+ + 1145 k. J Ca 2+ + e- Ei 2 Al 3+ Ei 1, Ei 2, Ei 3 • verilen bir element için Ei 1 < Ei 2 < Ei 3

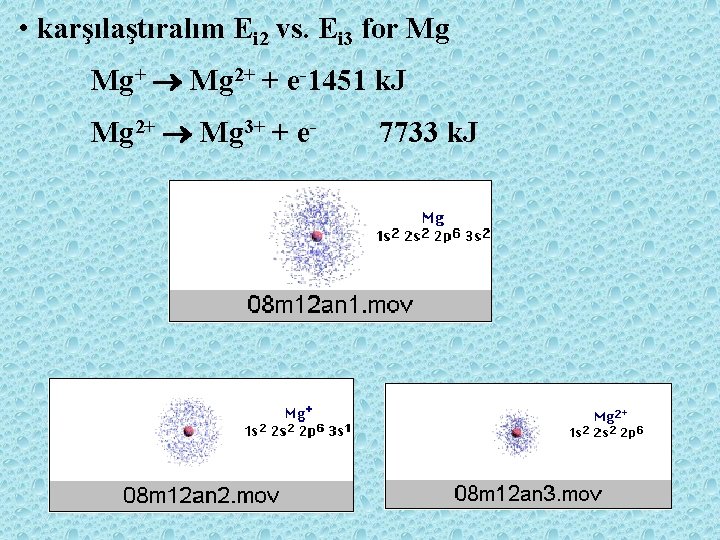
• karşılaştıralım Ei 2 vs. Ei 3 for Mg Mg+ Mg 2+ + e-1451 k. J Mg 2+ Mg 3+ + e- 7733 k. J

• İyonlaşma enerjisi bir gruptan yukardan aşağıya • doru gidildikçe azalır. e. g. Ei for Li > Na > K > Rb > Cs

• Aynı peryota Ei 1 artar Na < Si < Cl • bunun sebebi atomun yarı çapi küçülüyor bu nedenle çekirdeğin elektronu çekmesi artar, elektron koparmak içim daha fazla enerji vermemiz gerekir Be/B ve N/O Ei 1 for B < Be Be: 1 s 2 2 s 2 Be+: 1 s 2 2 s 1

Be: 1 s 2 2 s 2 Be+: 1 s 2 2 s 1 B: 1 s 2 2 p 1 B+: 1 s 2 2 s 2 • Be, de Be+ oluşturmak için N: 1 s 2 2 p 3 N+: 1 s 2 2 p 2 O: 1 s 2 2 p 4 O+: 1 s 2 2 p 3


elektron afinitesi (elektron ilgisi) • iyonlaşma enerjisinin tersidir. Lütfen sizler açıklayınız.

İyonik yari çap • katyonların yari çapı normal atomun yarı çapından daha küçüktür. bu yüzden Li+ < Li 1 s 2 2 s 1 anyonların yari çapı normal atomun yarı çapından daha büyüktür. . Cl: 1 s 2 2 p 6 3 s 2 3 p 5 Cl-: 1 s 2 2 p 6 3 s 2 3 p 6

F orpitaleri


S ve p -orbitalleri

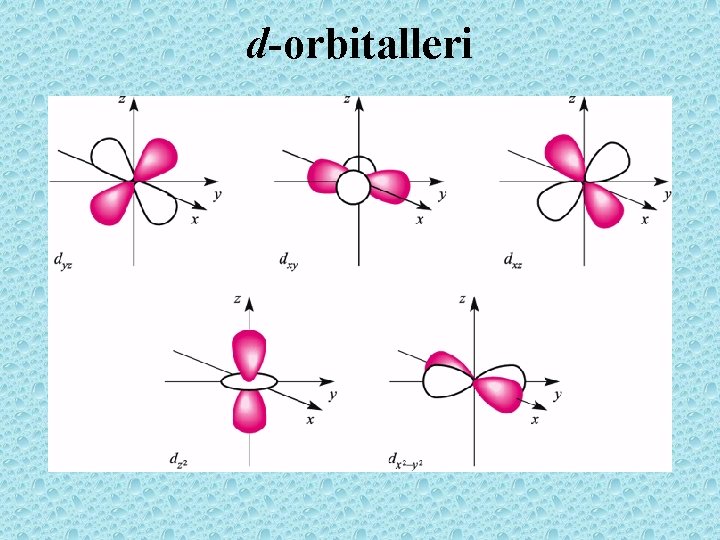
d-orbitalleri

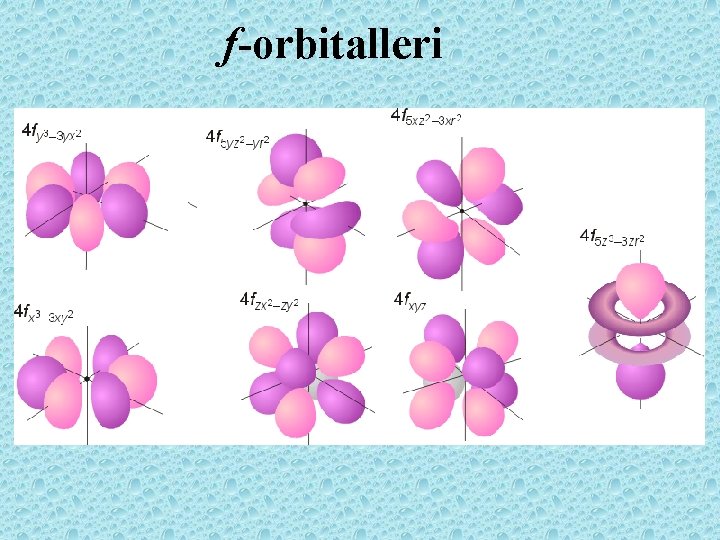
f-orbitalleri
 Cetvel çeşitleri ve isimleri
Cetvel çeşitleri ve isimleri Word de cetvel
Word de cetvel Menurut bohr elektron-elektron dalam atom
Menurut bohr elektron-elektron dalam atom Periyodik sistem
Periyodik sistem Matris satır sütun
Matris satır sütun Sodyum periyodik tablo
Sodyum periyodik tablo Formal yük nedir
Formal yük nedir John newlands periyodik tablosu
John newlands periyodik tablosu Yangın tesisatı periyodik kontrol raporu örneği
Yangın tesisatı periyodik kontrol raporu örneği Modern periyodik sistem
Modern periyodik sistem Makine tezgah periyodik kontrol formu
Makine tezgah periyodik kontrol formu Periodic trends of elements
Periodic trends of elements Dngs
Dngs Peryot
Peryot M. kemal irmak
M. kemal irmak Dr kemal akbay
Dr kemal akbay Kemal šanjta
Kemal šanjta Kemal huseinovic
Kemal huseinovic 1881 turkey
1881 turkey Kemal özeken
Kemal özeken Pskoz
Pskoz Kemal oflazer
Kemal oflazer Kemal erkan
Kemal erkan Yahya kemal beyatlı anadolu lisesi batman
Yahya kemal beyatlı anadolu lisesi batman Atatrk
Atatrk Kemal oflazer
Kemal oflazer Mukaddime i celal
Mukaddime i celal Namık kemal son mermi
Namık kemal son mermi Mustafa kemal'in hayatını etkileyen şehirler
Mustafa kemal'in hayatını etkileyen şehirler Hatay mustafa kemal üni yatay geçiş
Hatay mustafa kemal üni yatay geçiş Yasar kemal zitate
Yasar kemal zitate Ali kemal şehirlioğlu
Ali kemal şehirlioğlu Nn words
Nn words Elektron çekici ve itici gruplar
Elektron çekici ve itici gruplar Elektronhéjak
Elektronhéjak Elektron neutron proton
Elektron neutron proton Pengertian konfigurasi elektron
Pengertian konfigurasi elektron Lambang atom nomor 31
Lambang atom nomor 31 Elektron dağılımı
Elektron dağılımı Manyetik kuantum sayısı
Manyetik kuantum sayısı Contoh isotop
Contoh isotop Farmastil
Farmastil Respirasi menghasilkan
Respirasi menghasilkan Koordinat umum
Koordinat umum Bahan pengalir elektrik
Bahan pengalir elektrik Lekka cząstka elementarna mion elektron lub neutrino
Lekka cząstka elementarna mion elektron lub neutrino Massa elektron
Massa elektron Air sadah
Air sadah Model elektron bebas
Model elektron bebas Elektron em grego
Elektron em grego Katabolisme karbohidrat
Katabolisme karbohidrat Nomor atom helium
Nomor atom helium Tvorba elektron pozitronových párů
Tvorba elektron pozitronových párů Elektron griechisch
Elektron griechisch 2-metil-1-butanamina
2-metil-1-butanamina 54xe konfigurasi elektron
54xe konfigurasi elektron Kuantum sayısı
Kuantum sayısı Unsur yang memiliki elektron valensi terbanyak adalah
Unsur yang memiliki elektron valensi terbanyak adalah Notasi sel volta
Notasi sel volta