ELEKTROKIMIA Mochamad Zakki Fahmi Lecturer of Chemistry Dept















![[mol x Valensi]Logam = [mol x Valensi]elektron x Efisiensi arus Mendekati 100% [mol x Valensi]Logam = [mol x Valensi]elektron x Efisiensi arus Mendekati 100%](https://slidetodoc.com/presentation_image_h/376dc4da70d0eb92113703ee09a694a3/image-29.jpg)



- Slides: 37

ELEKTROKIMIA Mochamad Zakki Fahmi Lecturer of Chemistry Dept. Airlangga University

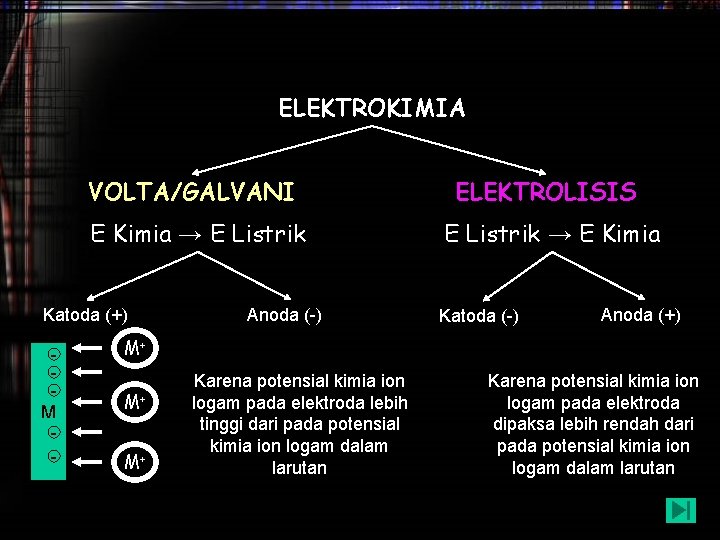
ELEKTROKIMIA VOLTA/GALVANI ELEKTROLISIS E Kimia → E Listrik → E Kimia Katoda (+) M - Anoda (-) Katoda (-) Anoda (+) M+ M+ M+ Karena potensial kimia ion logam pada elektroda lebih tinggi dari pada potensial kimia ion logam dalam larutan Karena potensial kimia ion logam pada elektroda dipaksa lebih rendah dari pada potensial kimia ion logam dalam larutan

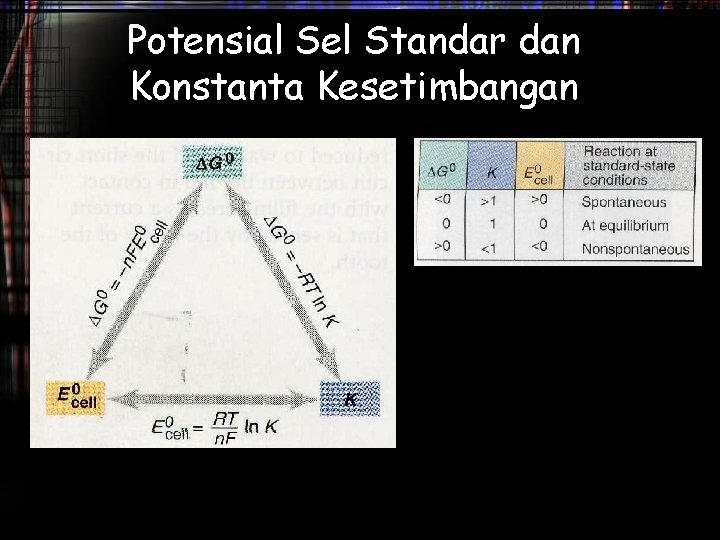
Potensial Sel (Esel) • Energi listrik ini berbanding lurus dengan beda potensial antara kedua elektroda (voltase) atau disebut juga potensial sel (Esel) atau gaya electromotive (emf) • Untuk proses spontan Esel > 0, semakin positif Esel semakin banyak kerja yang bisa dilakukan oleh sel • Satuan yang digunakan 1 V = 1 J/C • Potensial sel sangat dipengaruhi oleh suhu dan konsentrasi, oleh karena itu potensial sel standar diukur pada keadaan standar (298 K, 1 atm untuk gas, 1 M untuk larutan dan padatan murni untuk solid)

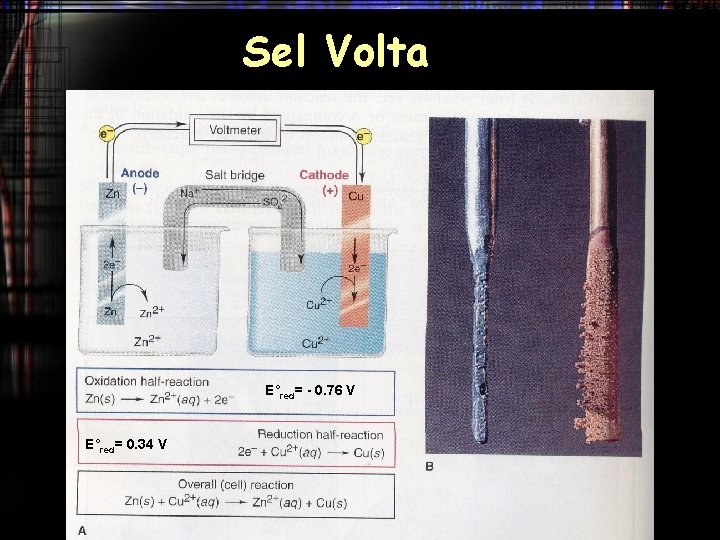
Sel Volta E°red= - 0. 76 V E°red= 0. 34 V

Sel Volta KONVESI (Notasi Sel) Zn(S) | Zn 2+ (aq) | | Cu 2+ (aq)| Cu(S) oksidasi reduksi E°sel = E°reduksi – E°oksidasi = 0. 34 – (- 0. 76) = 1. 1 V Ecell = E°cell - (0. 0591/n)log([Zn 2+ (aq]/[Cu 2+ (aq])

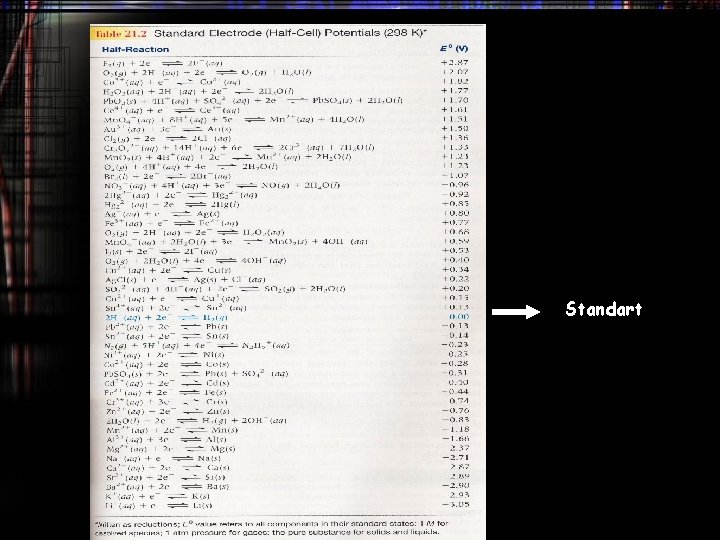
Standart

Potensial Sel Standar dan Konstanta Kesetimbangan

Pertanyaan • Diketahui : 2 Al + 3 Zn 2+ 3 Zn + 2 Al 3+ E°Zn 2+/Zn = -0. 76 V E°Al 3+/Al = -1. 36 V Ternyata memberikann harga Esel = 0. 836 V dan [Al 3+] = 0. 01 M. Tentukan perbandingan [Zn 2+]/[Al 3+] !

Elektroda Hidrogen Standar • Ilmuwan telah menyepakati untuk memilih setengah reaksi rujukan dengan nilai 0 untuk reaksi: 2 H+(aq, 1 M) + 2 e H 2(g, 1 atm) Eorujukan = 0 H 2(g, 1 atm) 2 H+(aq, 1 M) + 2 e –Eorujukan = 0 • Dengan nilai rujukan ini kita bisa menyusun sel volta yang menggunakan elektroda hidrogen standar sebagai salah satu elektrodanya dan mengukur potensial sel dengan alat ukur, kemudian kita dapat menentukan potensial elektroda standar banyak zat secara luas

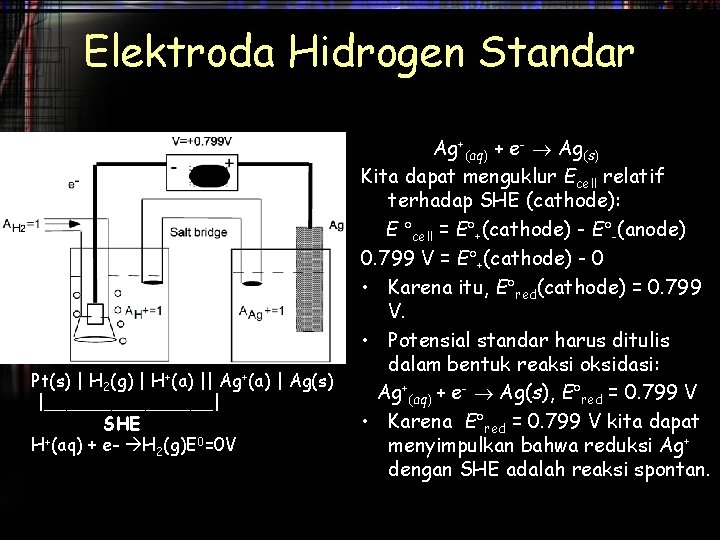
Elektroda Hidrogen Standar Pt(s) | H 2(g) | H+(a) || Ag+(a) | Ag(s) |________| SHE H+(aq) + e- H 2(g)E 0=0 V Ag+(aq) + e- Ag(s) Kita dapat menguklur Ecell relatif terhadap SHE (cathode): E cell = E +(cathode) - E -(anode) 0. 799 V = E +(cathode) - 0 • Karena itu, E red(cathode) = 0. 799 V. • Potensial standar harus ditulis dalam bentuk reaksi oksidasi: Ag+(aq) + e- Ag(s), E red = 0. 799 V • Karena E red = 0. 799 V kita dapat menyimpulkan bahwa reduksi Ag+ dengan SHE adalah reaksi spontan.

Pengukuran p. H Elektroda Hidrogen • Merupakan salah satu aplikasi penting dalam elektrokimia • Potensial elektroda tergantung pada p. H larutan Anoda : ½ H 2(g) → H+(aq)+ e Katoda : H+(std) + e → ½ H 2(g) + H+(std) → H+(aq) + ½ H 2(g) Esel = 0. 059 p. H H+ Sampel Standart

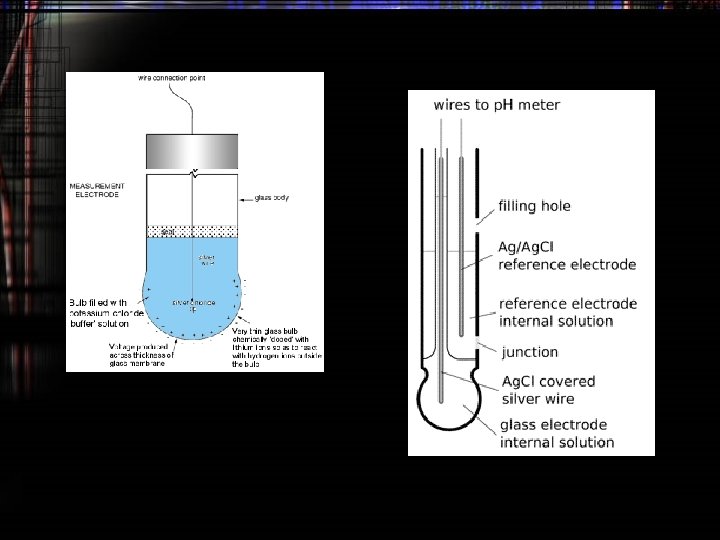
Elektroda Kaca • Elektroda ini digunakan sebagai penganti elektroda hidrogen yang kurang praktis • Elektroda ini terdiri atas kaca yang didalamnya mengandung 0. 1 M HCl dan didalamnya terdapat elektroda Ag/Ag. Cl • Elektroda ini akan dicelupkan pada larutan yang akan diukur p. Hnya. Jika dihubungkan denegan elektroda kalomel akan diperoleh notasi Ag, Ag. Cl | HCl (1 M) |gelas | lart. | | elektroda kalomel E glas = (0. 0591/n)p. H


JENIS ELEKTRODA ACUAN 1. Elektroda Calomel q Notasi : Hg│Hg 2 Cl 2 (jenuh), KCl (x. M)║ q Konsentrasi KCl jenuh lebih mudah dibuat dan lebih sering digunakan, tetapi mudah terpengaruh oleh suhu. q Nilai potensial elektroda kalomel = 0. 242 V q Reaksi yang terjadi pada elektroda Calomel: Hg 2 Cl 2(s) +2 e ↔ 2 Hg(l) + 2 Cl-(aq)

JENIS ELEKTRODA ACUAN 2. Elektroda Ag/Ag. Cl q. Notasi : Ag│Ag. Cl (jenuh), KCl(jenuh)║ q. Reaksi Redoks: Ag+ + e ↔ Ag Ag. Cl + e ↔ Ag + Cl- q. Logam perak sebagai elektroda yang dicelup dalam KCl jenuh dan pasta Ag. Cl. Potensialnya pada 25 o. C adalah 0, 199 V.

Pertanyaan • Suatu elektroda H 2 dengan p(H 2) = 1 atm dihubungkan dengan elektroda kalomel standart. Jika GGL sel 0. 8 V, hitung p. H larutan!

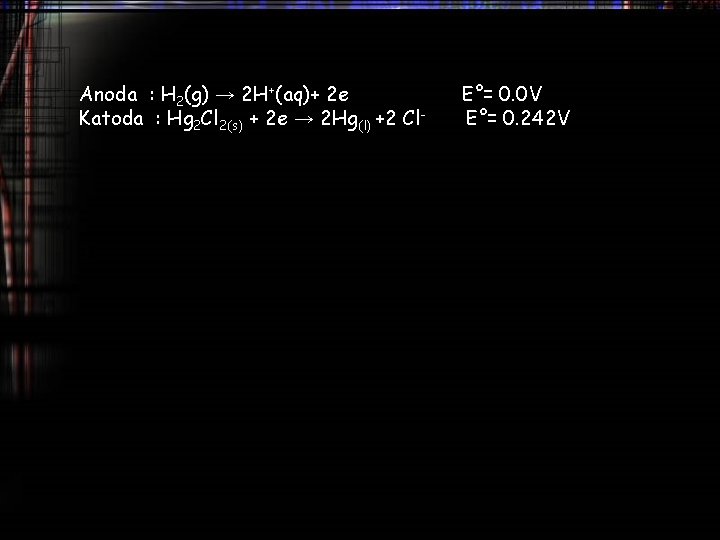
Anoda : H 2(g) → 2 H+(aq)+ 2 e Katoda : Hg 2 Cl 2(s) + 2 e → 2 Hg(l) +2 Cl- E°= 0. 0 V E°= 0. 242 V

Elektrolisis of hair removal…

Is NOT our topic today!

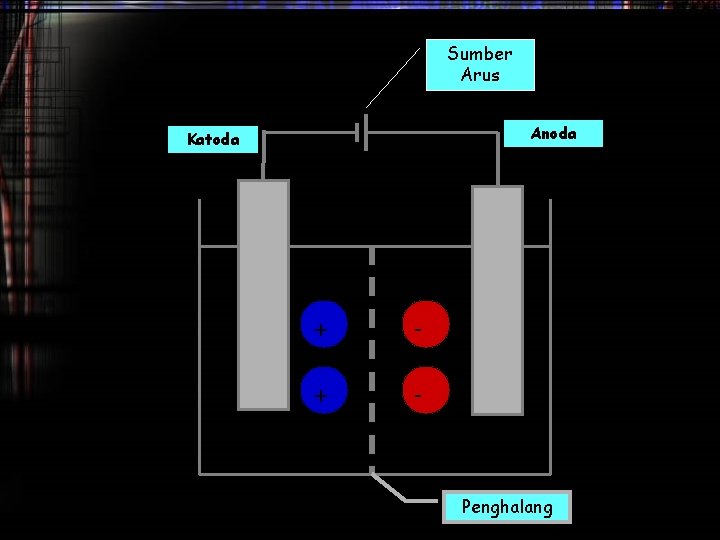
Elektrolisis • Merupakan proses kimia yang memisahkan senyawa dengan arus listrik • Merupakan proses tidak spontan • Mengunakan sumber listrik eksternal yang berperan sebagai pompa elektron dari anoda ke katoda

Sumber Arus Anoda Katoda + - Penghalang

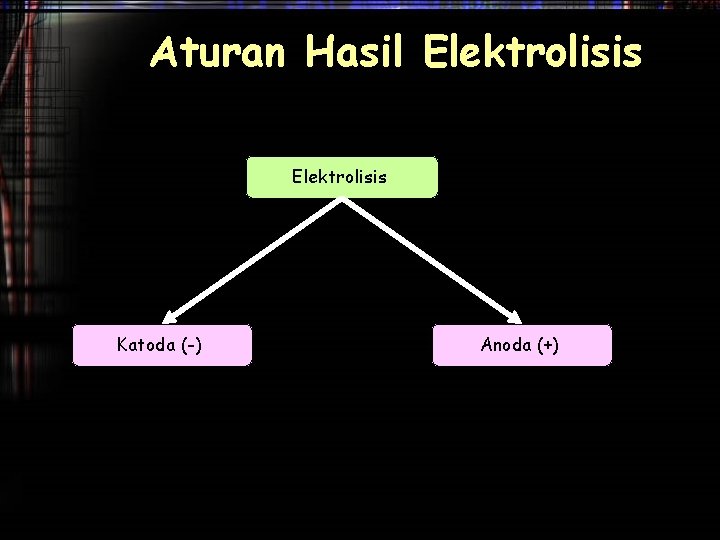
Aturan Hasil Elektrolisis Katoda (-) Anoda (+)

Hasil Elektrolisis Dikatoda • Tergantung pada jenis ion yang datang : 1. Ion logam alkali (IA), Alkali Tanah(IIA) dan Al yang direduksi adalah pelarutnya 2. Ion logam transisi (gol B), yang terreduksi adalah larutannya 3. Bila ion H+ dari asam 4. Bila bentuk leburan /lelehan semua kation direduksi

Hasil Elektrolisis Dianoda • Tergantung pada jenis anionnya • Tergantung pada jenis bahan/material/elektroda 1. Anion oksi (NO 3 -, SO 42 -, dll) tidak teroksidasi, tetapi air yang teroksidasi Anoda 2. Anion Non-oksi (halida) akan teroksidasi

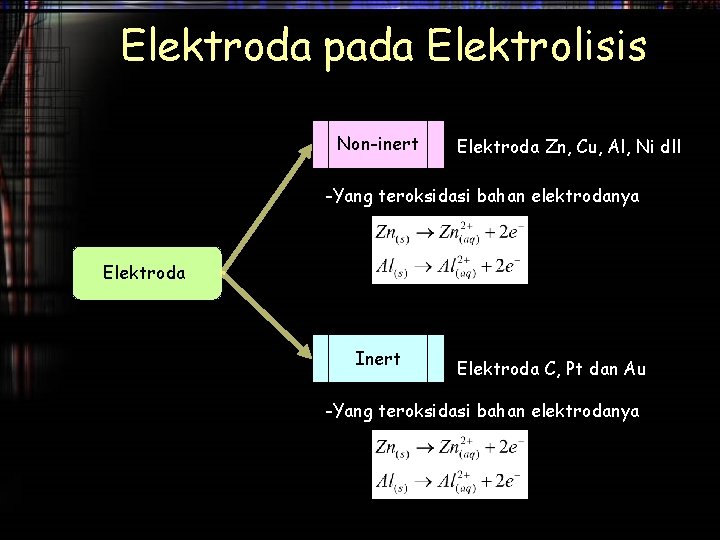
Elektroda pada Elektrolisis Non-inert Elektroda Zn, Cu, Al, Ni dll -Yang teroksidasi bahan elektrodanya Elektroda Inert Elektroda C, Pt dan Au -Yang teroksidasi bahan elektrodanya

Pertanyaan • Bandingkan elektrolisis larutan Na. Cl encer : – Dengan elektroda C – Dengan elektroda Al

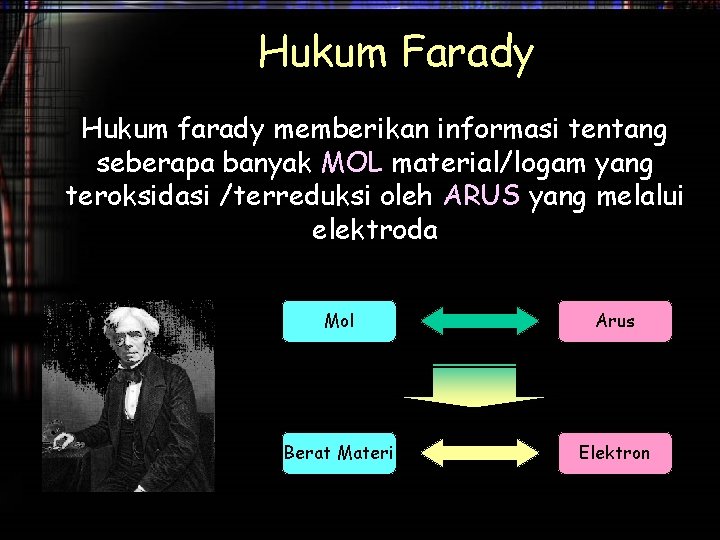
Hukum Farady Hukum farady memberikan informasi tentang seberapa banyak MOL material/logam yang teroksidasi /terreduksi oleh ARUS yang melalui elektroda Mol Arus Berat Materi Elektron

Aspek Kuantitatif Elektrolisis • Analisa kuantitatif didasarkan pada besarnya arus yang digunakan utk. Mengukur material
![mol x ValensiLogam mol x Valensielektron x Efisiensi arus Mendekati 100 [mol x Valensi]Logam = [mol x Valensi]elektron x Efisiensi arus Mendekati 100%](https://slidetodoc.com/presentation_image_h/376dc4da70d0eb92113703ee09a694a3/image-29.jpg)
[mol x Valensi]Logam = [mol x Valensi]elektron x Efisiensi arus Mendekati 100%

Hukum Farady Pertanyaaan • Elektrolisis larutan encer Zn. SO 4 (100 m. L) dg. Arus 10 A selama 965 s dengan efisiensi arus (η) = 80% (ar Zn = 65 dan elektrodea C), tentukan: – Jumlah atom Zn yang diendapkan – Volume gas yang diendapkan pada STP – p. H larutan di daerah Anoda

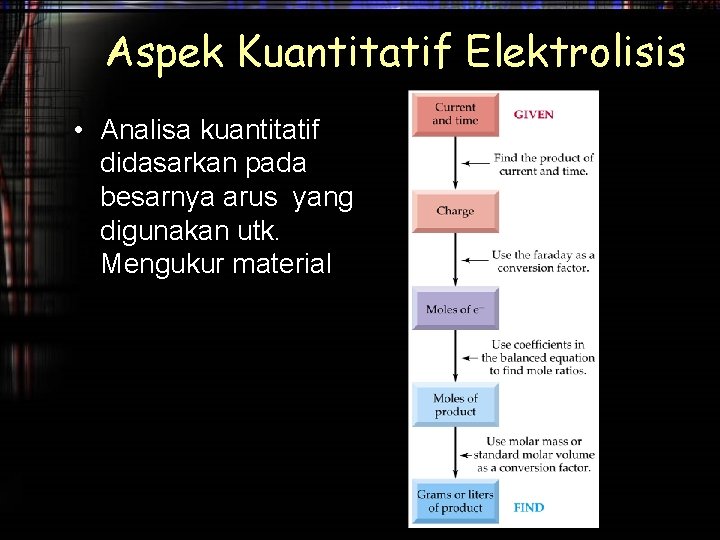
Aplikasi ELEKTROLISIS AIR Anode : 2 H 2 O(l) O 2(g) + 4 H+(aq) + 4 e– Cathode: 4 H 2 O(l) + 4 e– 2 H 2(g) + 4 OH–(aq)

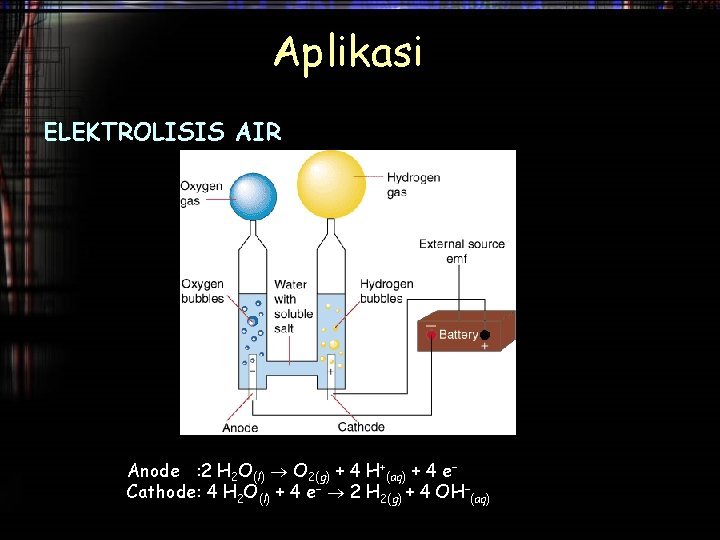
Aplikasi ELEKTROLISIS AIR Model elektrolisis airdengan membran untuk menghasilkan gas yang lebih murni

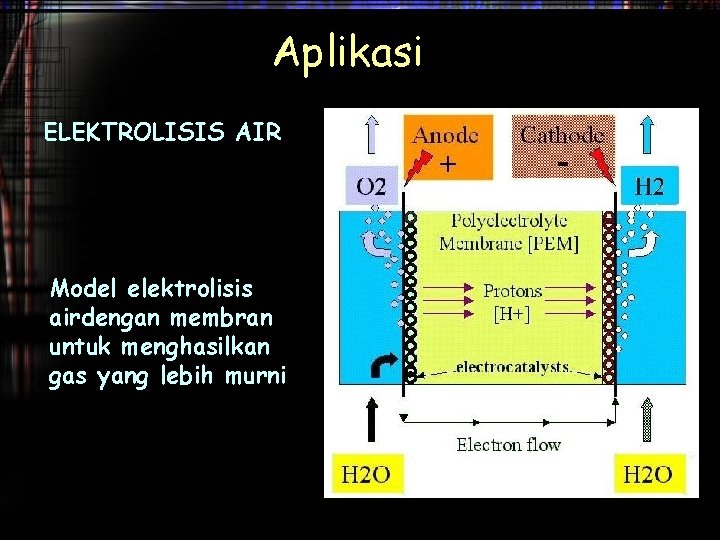
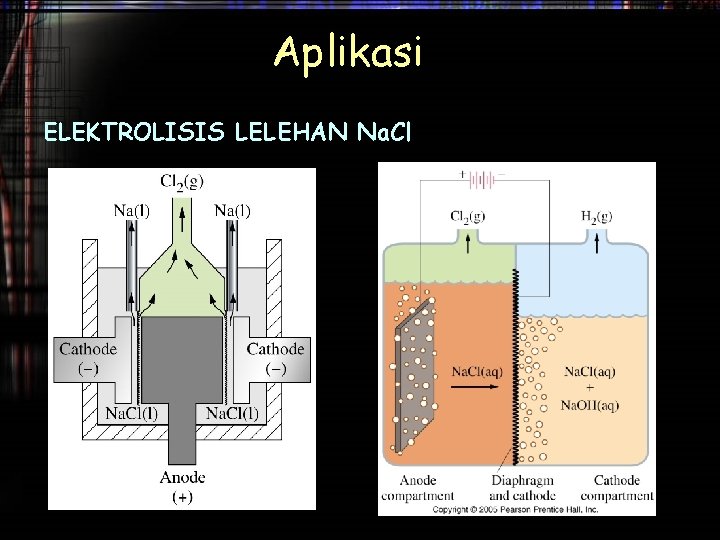
Aplikasi ELEKTROLISIS LELEHAN Na. Cl

Aplikasi ELEKTROLISIS LELEHAN Na. Cl

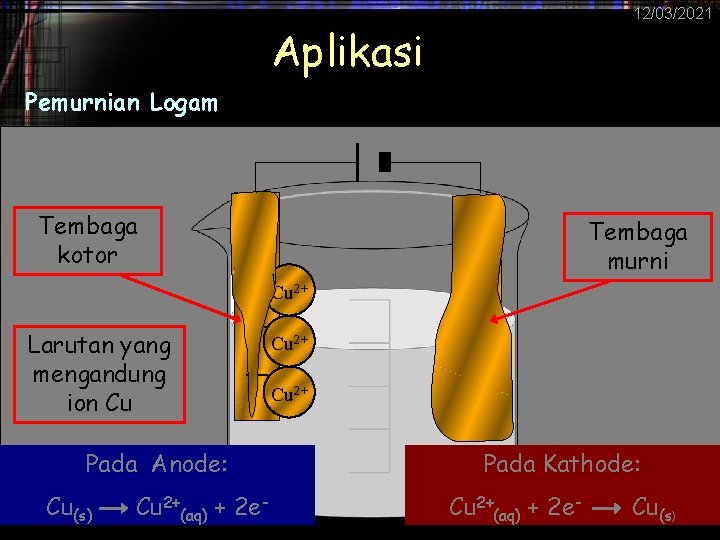
12/03/2021 Aplikasi Pemurnian Logam Tembaga kotor Larutan yang mengandung ion Cu + + Cu Pada Anode: Cu(s) Cu 2+(aq) + 2 e- 2+ --- Tembaga murni 2+ 2+ Pada Kathode: Cu 2+(aq) + 2 e- Cu(s)

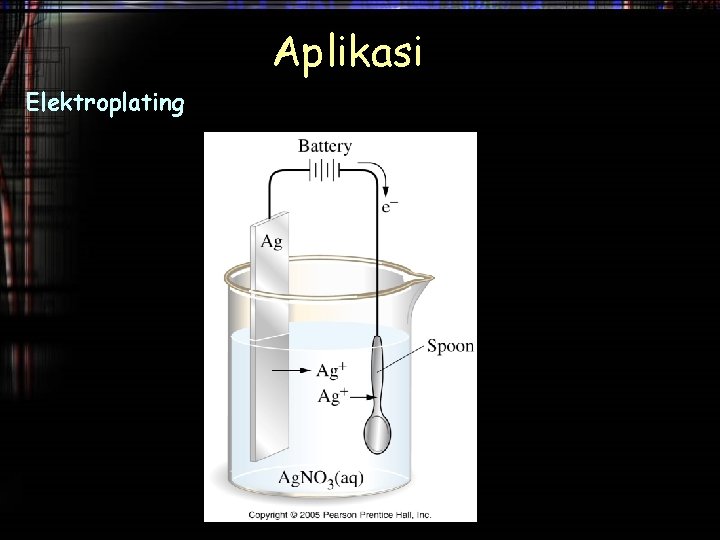
Aplikasi Elektroplating
