Elektrick proud v kapalinch Podmnky pouvn prezentace Staen












- Slides: 45

Elektrický proud v kapalinách Podmínky používání prezentace Stažení, instalace na jednom počítači a použití pro soukromou potřebu jednoho uživatele je zdarma. Použití pro výuku jako podpůrný nástroj pro učitele či materiál pro samostudium žáka, rovněž tak použití jakýchkoli výstupů (obrázků, grafů atd. ) pro výuku je podmíněno zakoupením licence pro užívání software E-učitel příslušnou školou. Cena licence je 250, - Kč ročně a opravňuje příslušnou školu k používání všech aplikací pro výuku zveřejněných na stránkách www. eucitel. cz. Na těchto stránkách je rovněž podrobné znění licenčních podmínek a formulář pro objednání licence. Pro jiný typ použití, zejména pro výdělečnou činnost, publikaci výstupů z programu atd. , je třeba sjednat jiný typ licence. V tom případě kontaktujte autora (info@eucitel. cz) pro dojednání podmínek a smluvní ceny. OK © RNDr. Jiří Kocourek 2013

Elektrický proud v kapalinách © RNDr. Jiří Kocourek 2013

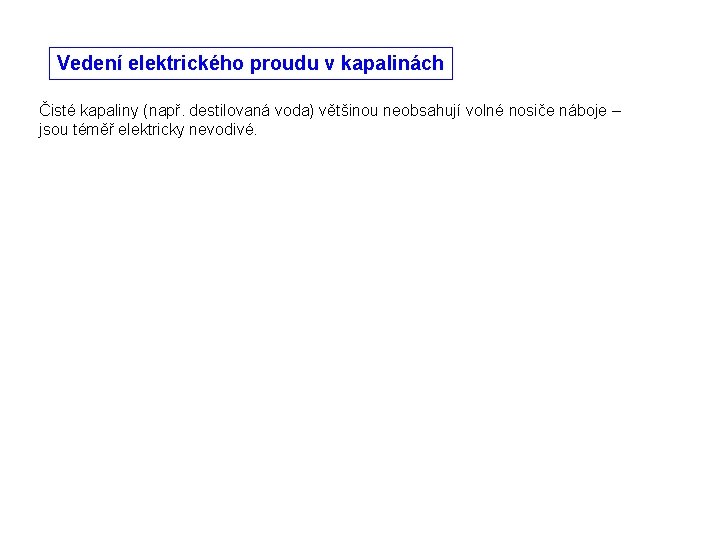
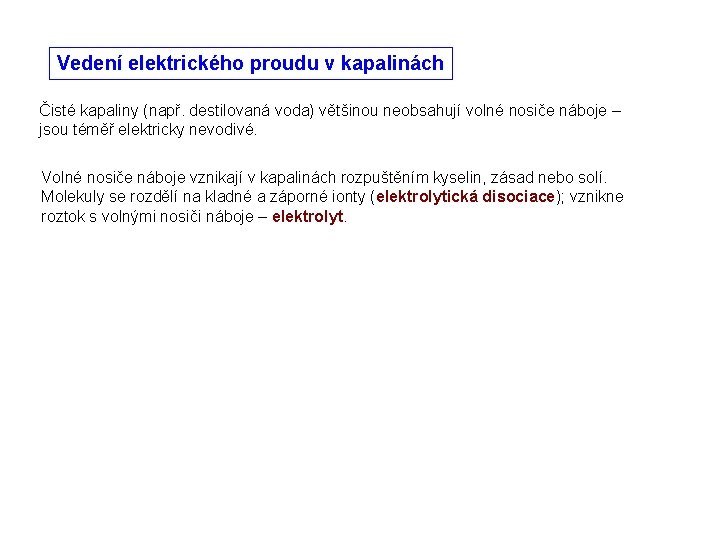
Vedení elektrického proudu v kapalinách Čisté kapaliny (např. destilovaná voda) většinou neobsahují volné nosiče náboje – jsou téměř elektricky nevodivé.

Vedení elektrického proudu v kapalinách Čisté kapaliny (např. destilovaná voda) většinou neobsahují volné nosiče náboje – jsou téměř elektricky nevodivé. Volné nosiče náboje vznikají v kapalinách rozpuštěním kyselin, zásad nebo solí. Molekuly se rozdělí na kladné a záporné ionty (elektrolytická disociace); vznikne roztok s volnými nosiči náboje – elektrolyt.

Vedení elektrického proudu v kapalinách Čisté kapaliny (např. destilovaná voda) většinou neobsahují volné nosiče náboje – jsou téměř elektricky nevodivé. Volné nosiče náboje vznikají v kapalinách rozpuštěním kyselin, zásad nebo solí. Molekuly se rozdělí na kladné a záporné ionty (elektrolytická disociace); vznikne roztok s volnými nosiči náboje – elektrolyt. Příklady: H 2 SO 4 → 2 H+ + SO 42– Na. Cl → Na+ + Cl– KOH → K+ + OH– Cu. SO 4 → Cu 2+ + SO 42–

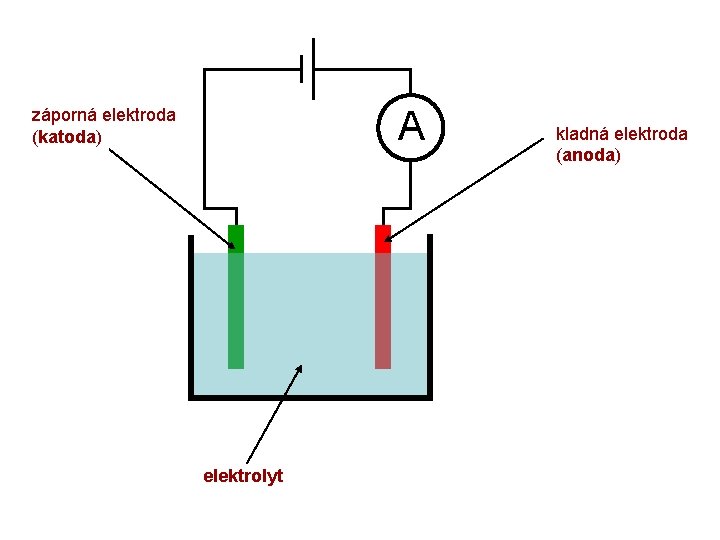
A záporná elektroda (katoda) elektrolyt kladná elektroda (anoda)

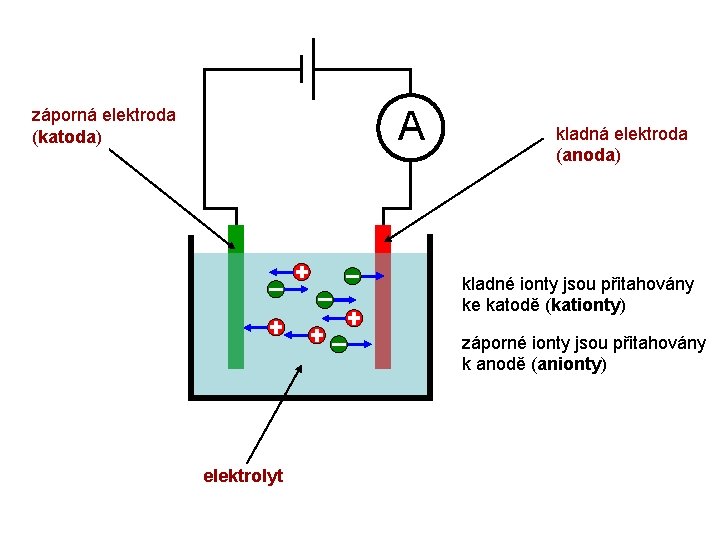
A záporná elektroda (katoda) kladná elektroda (anoda) kladné ionty jsou přitahovány ke katodě (kationty) záporné ionty jsou přitahovány k anodě (anionty) elektrolyt

A záporná elektroda (katoda) kladná elektroda (anoda) kladné ionty jsou přitahovány ke katodě (kationty) záporné ionty jsou přitahovány k anodě (anionty) elektrolyt Proces, který probíhá v kapalině při průchodu elektrického proudu (včetně různých chemických změn), se nazývá elektrolýza.

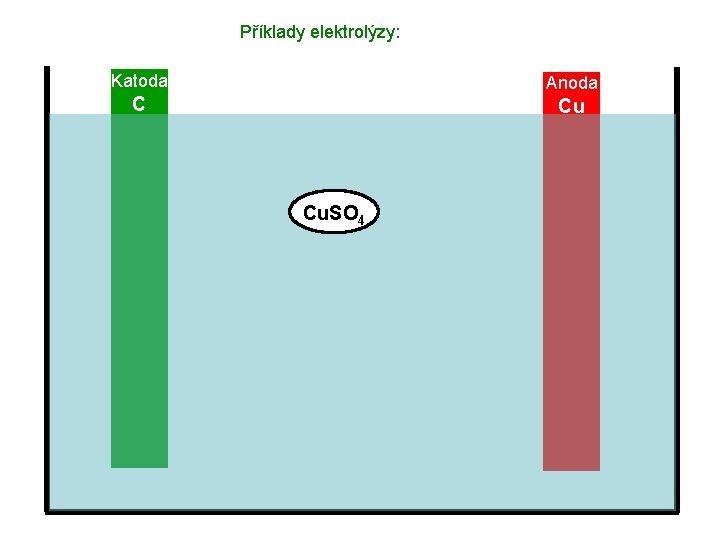
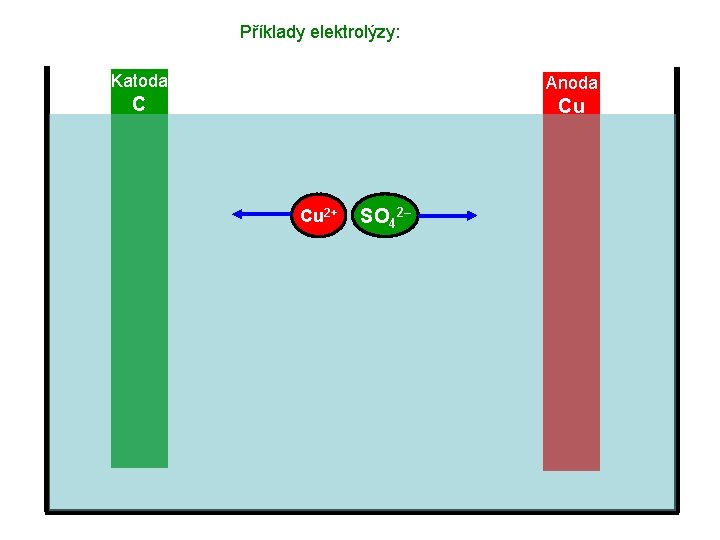
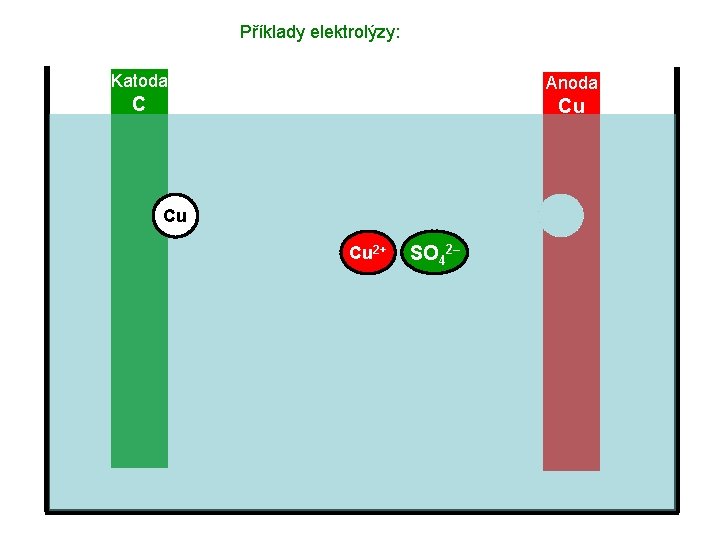
Příklady elektrolýzy: Katoda Anoda C Cu Elektrolyt – roztok Cu. SO 4

Příklady elektrolýzy: Katoda Anoda C Cu Cu. SO 4

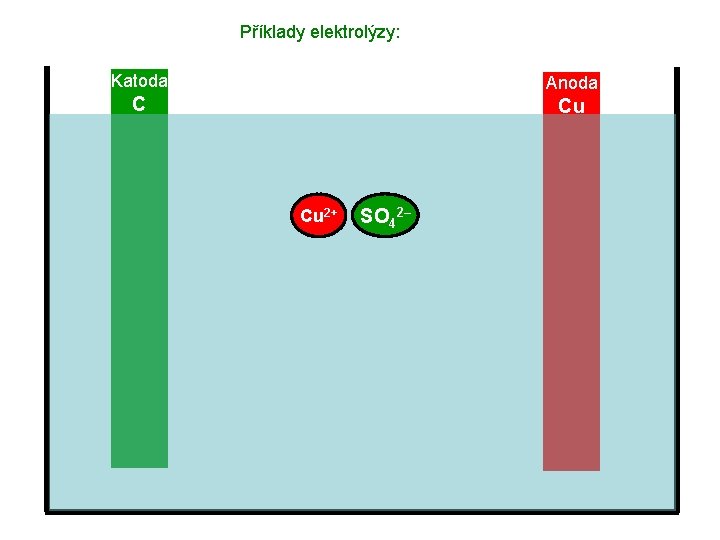
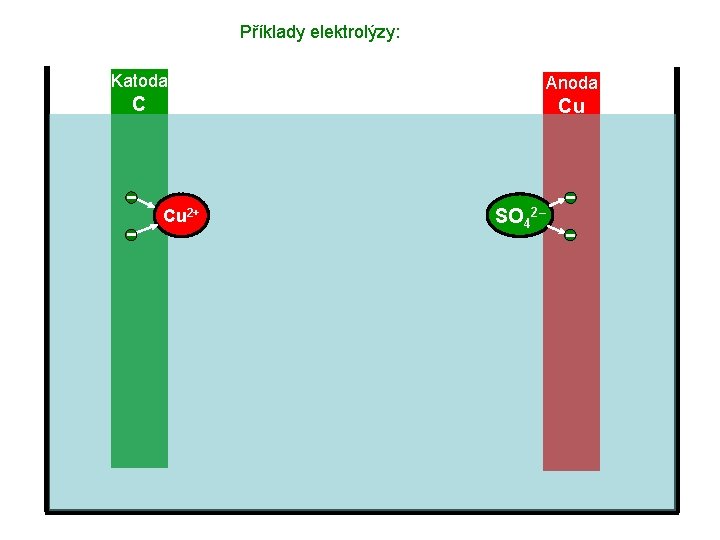
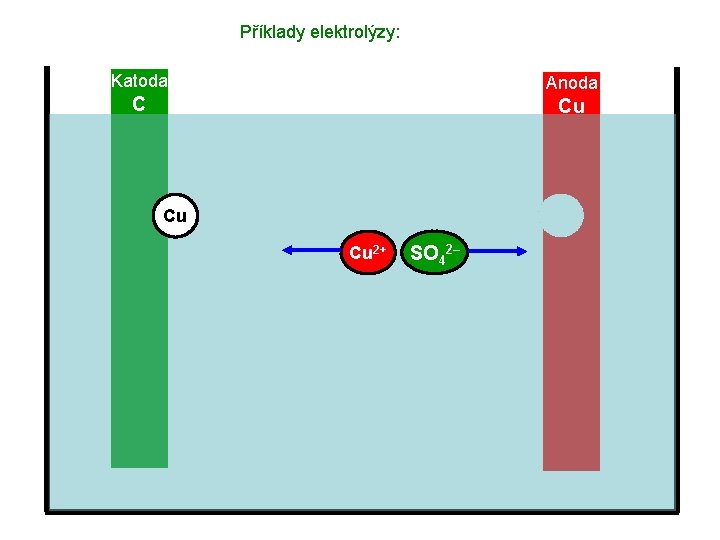
Příklady elektrolýzy: Katoda Anoda C Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda Anoda C Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda C Anoda Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda C Anoda Cu Cu SO 4 Cu

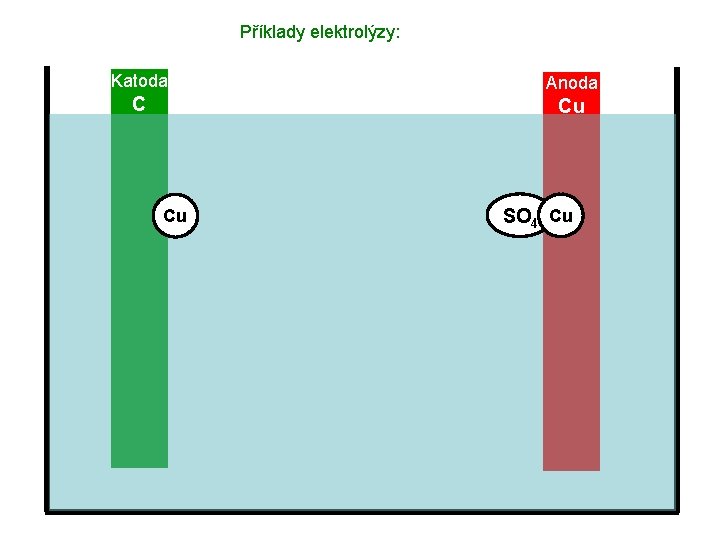
Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu. SO 4

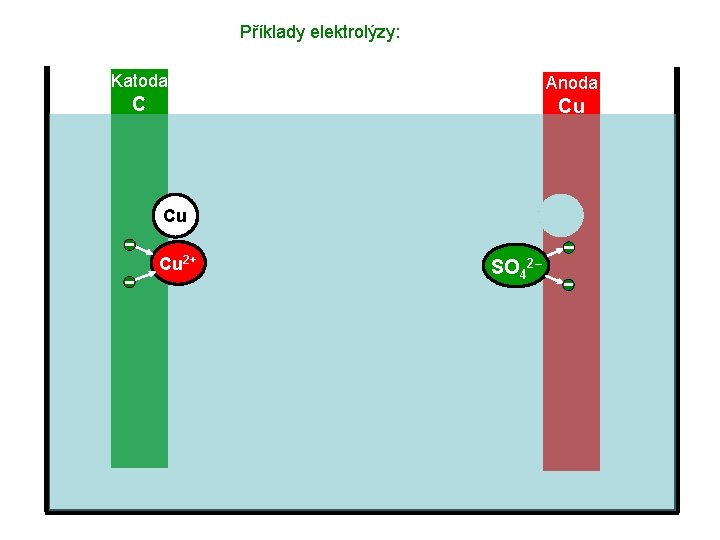
Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu 2+ SO 42–

Příklady elektrolýzy: Katoda C Anoda Cu Cu Cu SO 4 Cu

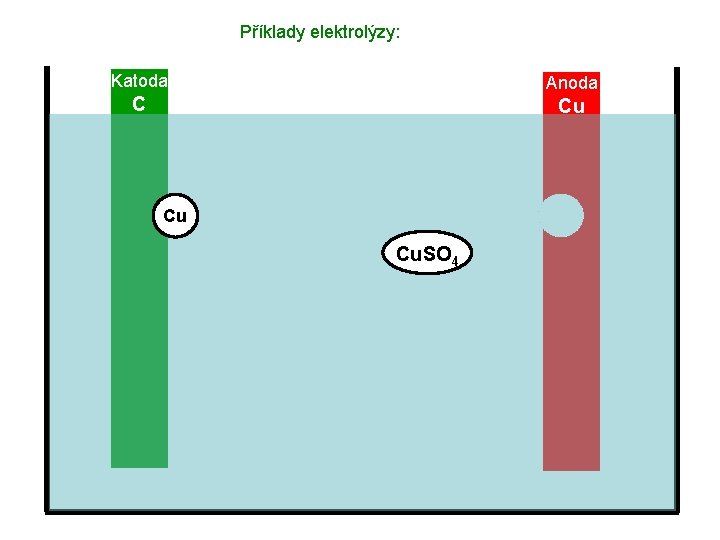
Příklady elektrolýzy: Katoda Anoda C Cu Cu. SO 4

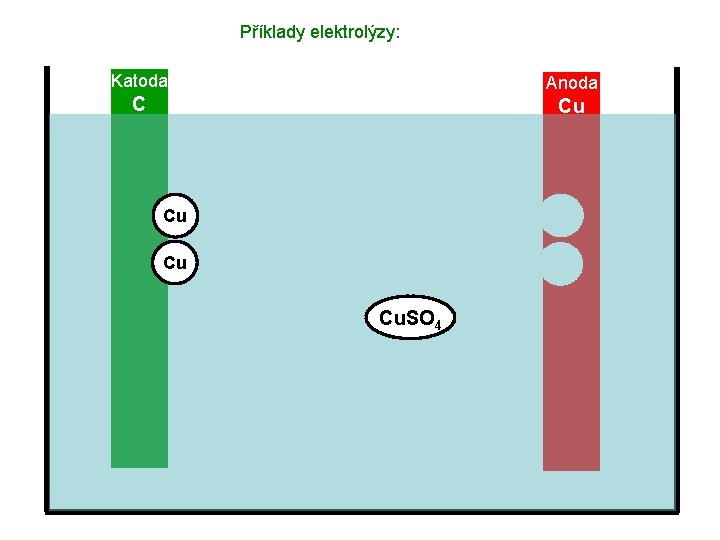
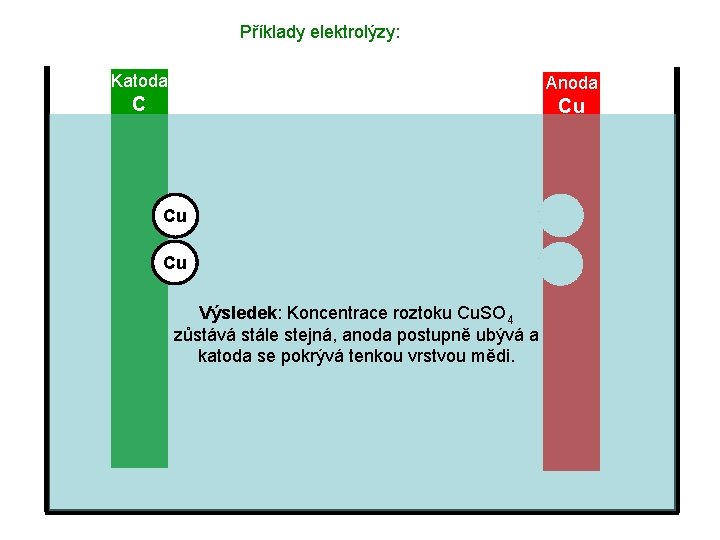
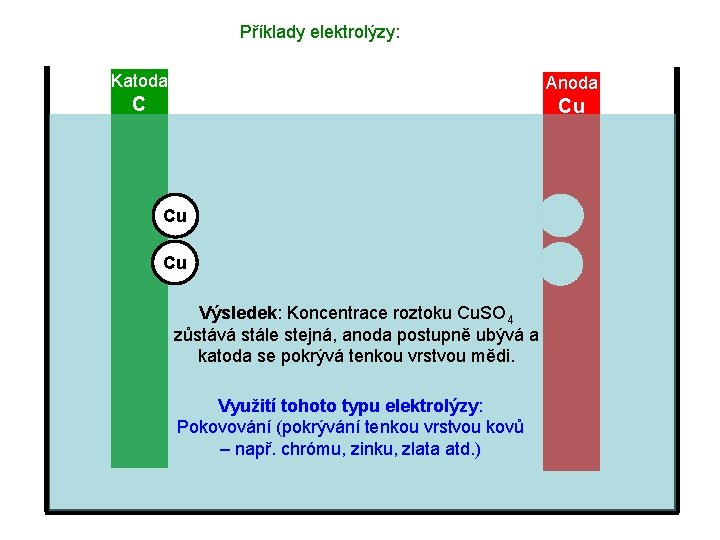
Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu Výsledek: Koncentrace roztoku Cu. SO 4 zůstává stále stejná, anoda postupně ubývá a katoda se pokrývá tenkou vrstvou mědi.

Příklady elektrolýzy: Katoda Anoda C Cu Cu Cu Výsledek: Koncentrace roztoku Cu. SO 4 zůstává stále stejná, anoda postupně ubývá a katoda se pokrývá tenkou vrstvou mědi. Využití tohoto typu elektrolýzy: Pokovování (pokrývání tenkou vrstvou kovů – např. chrómu, zinku, zlata atd. )

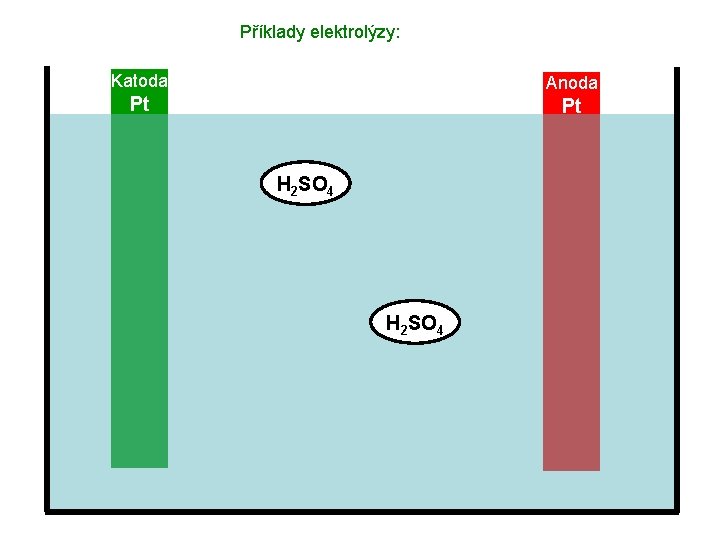
Příklady elektrolýzy: Katoda Anoda Pt Pt Elektrolyt – roztok H 2 SO 4

Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 SO 4

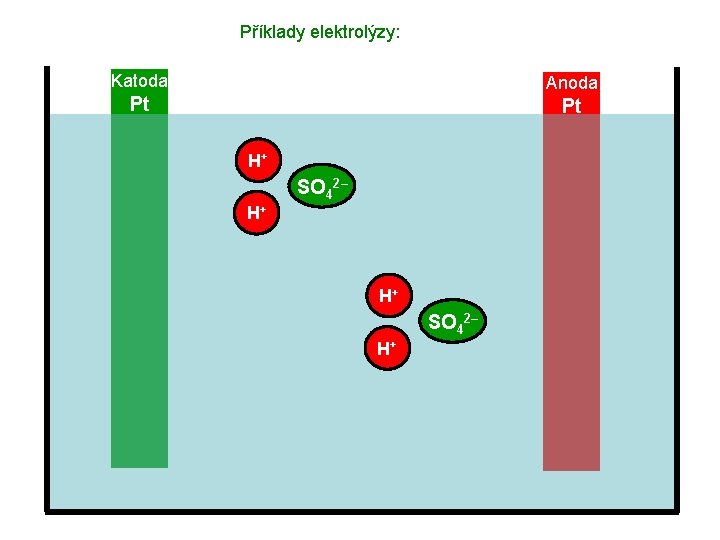
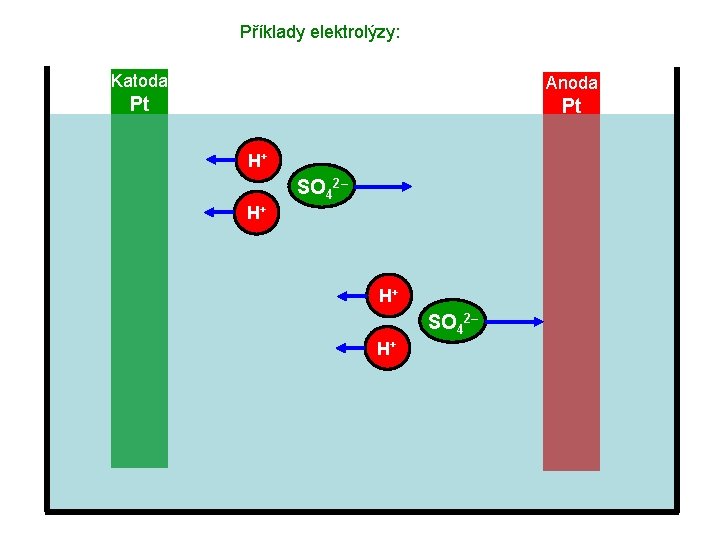
Příklady elektrolýzy: Katoda Anoda Pt Pt H+ SO 42– H+

Příklady elektrolýzy: Katoda Anoda Pt Pt H+ SO 42– H+

Příklady elektrolýzy: Katoda Anoda Pt Pt H+ SO 42– H+

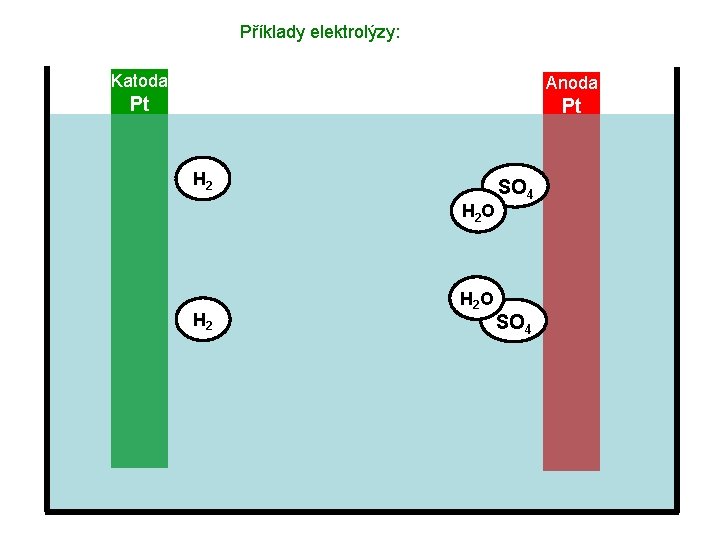
Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 H 2 O SO 4

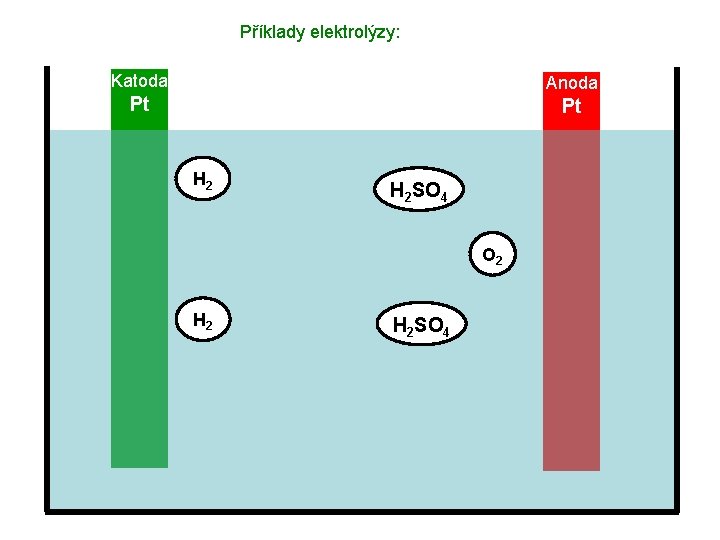
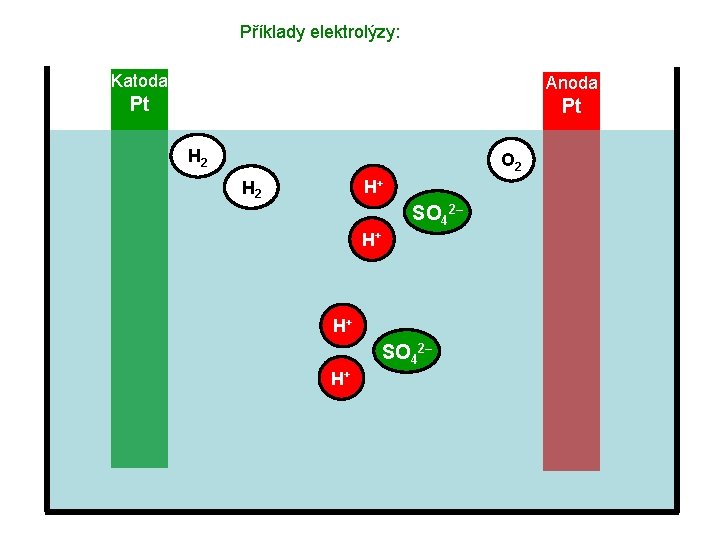
Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 SO 4 O 2 H 2 SO 4

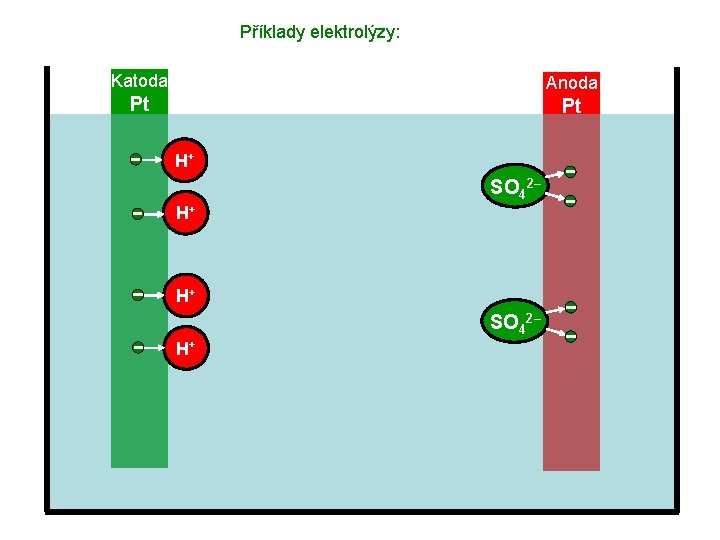
Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 O 2 H+ H 2 SO 42– H+ H+ SO 42– H+

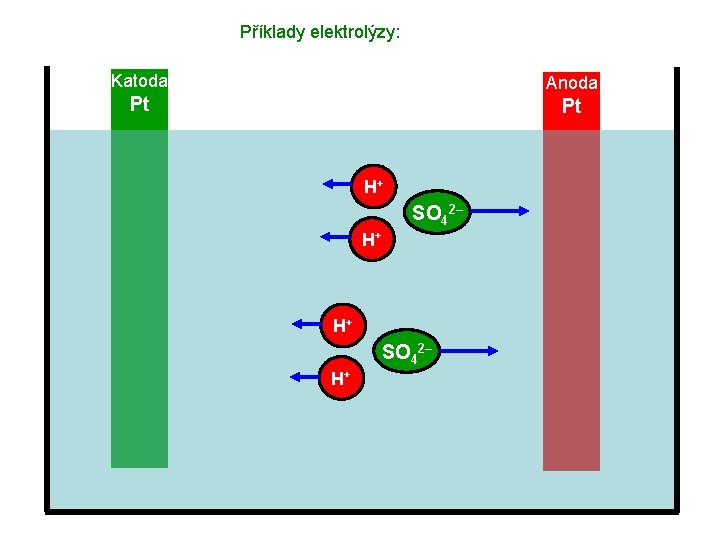
Příklady elektrolýzy: Katoda Anoda Pt Pt H+ SO 42– H+

Příklady elektrolýzy: Katoda Anoda Pt Pt H+ H+ SO 42–

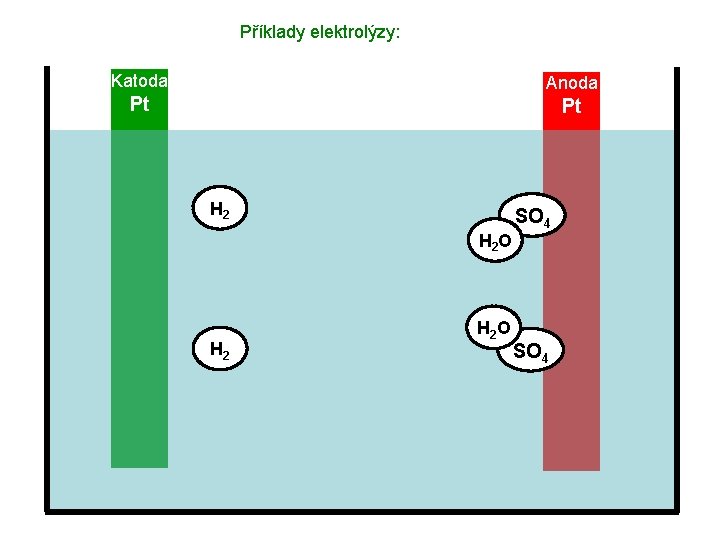
Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 H 2 O SO 4

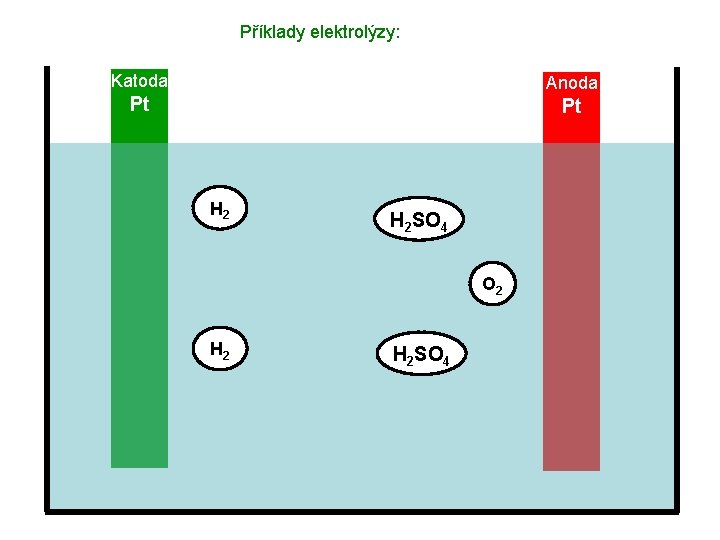
Příklady elektrolýzy: Katoda Anoda Pt Pt H 2 SO 4 O 2 H 2 SO 4

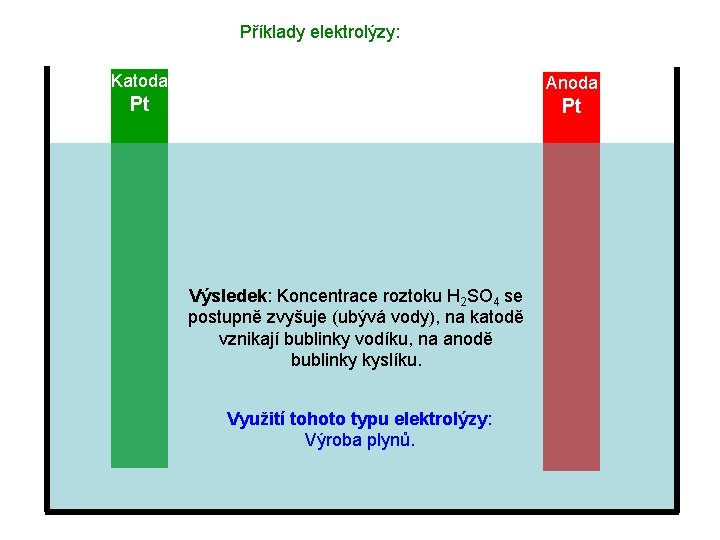
Příklady elektrolýzy: Katoda Anoda Pt Pt Výsledek: Koncentrace roztoku H 2 SO 4 se postupně zvyšuje (ubývá vody), na katodě vznikají bublinky vodíku, na anodě bublinky kyslíku. Využití tohoto typu elektrolýzy: Výroba plynů.

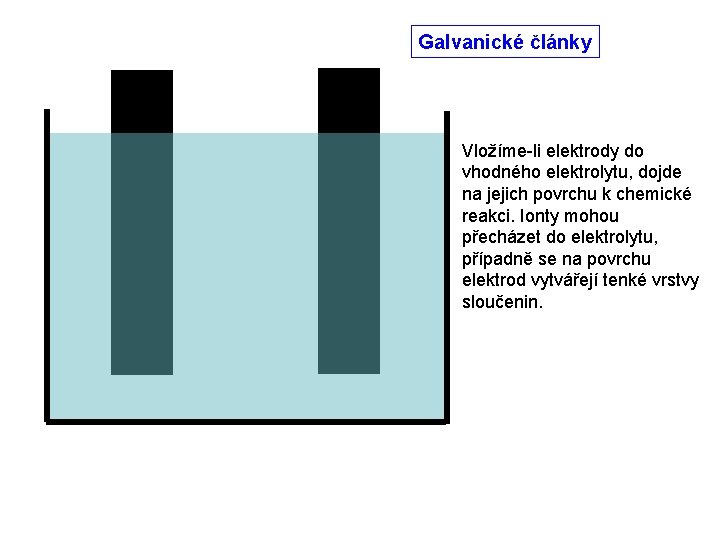
Galvanické články Vložíme-li elektrody do vhodného elektrolytu, dojde na jejich povrchu k chemické reakci. Ionty mohou přecházet do elektrolytu, případně se na povrchu elektrod vytvářejí tenké vrstvy sloučenin.

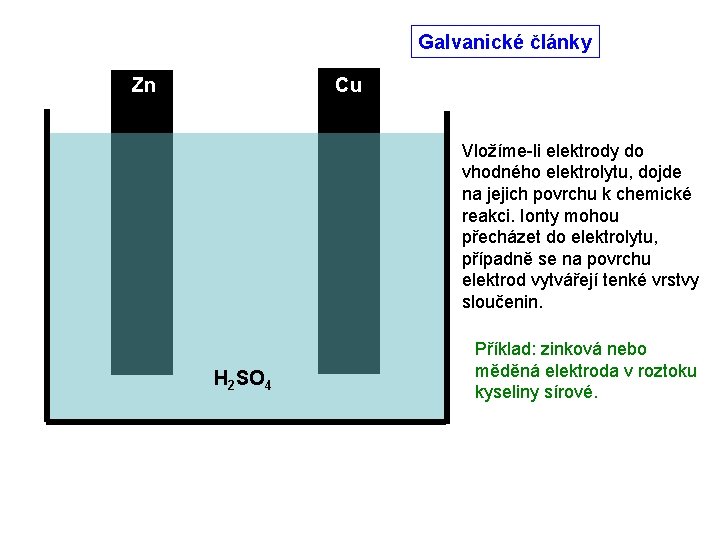
Galvanické články Zn Cu Vložíme-li elektrody do vhodného elektrolytu, dojde na jejich povrchu k chemické reakci. Ionty mohou přecházet do elektrolytu, případně se na povrchu elektrod vytvářejí tenké vrstvy sloučenin. H 2 SO 4 Příklad: zinková nebo měděná elektroda v roztoku kyseliny sírové.

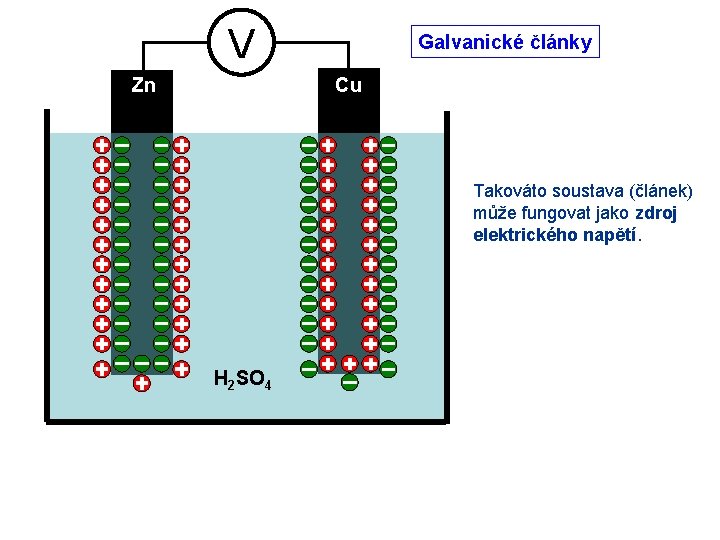
Galvanické články Zn Cu Vložíme-li elektrody do vhodného elektrolytu, dojde na jejich povrchu k chemické reakci. Ionty mohou přecházet do elektrolytu, případně se na povrchu elektrod vytvářejí tenké vrstvy sloučenin. H 2 SO 4 Příklad: zinková nebo měděná elektroda v roztoku kyseliny sírové. V důsledku chemických změn se přeskupí náboje na rozhraní kovu a elektrolytu. Vzniká elektrická dvojvrstva a mezi kovem a elektrolytem se vytvoří elektrické napětí.

V Zn Galvanické články Cu Takováto soustava (článek) může fungovat jako zdroj elektrického napětí. H 2 SO 4

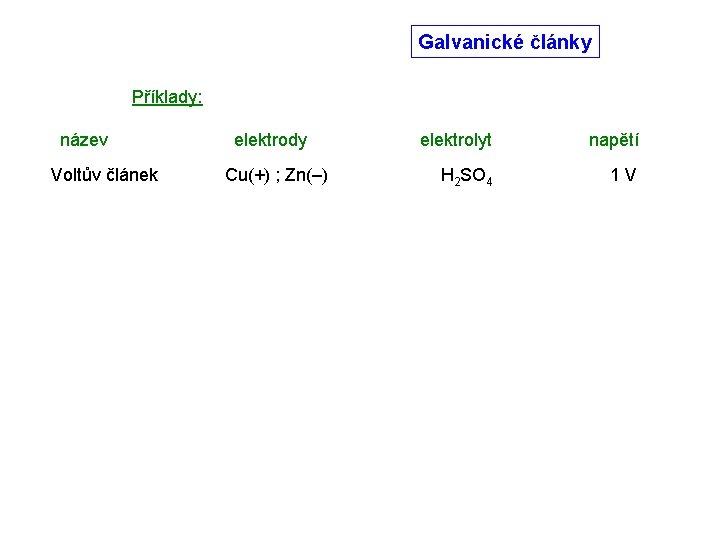
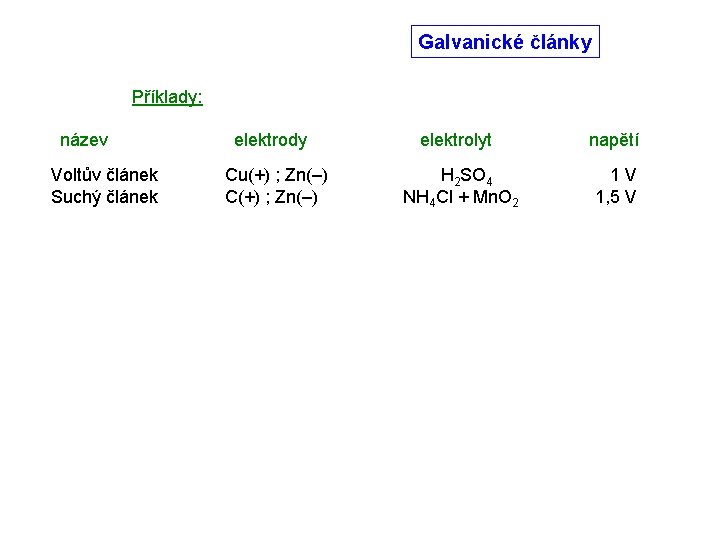
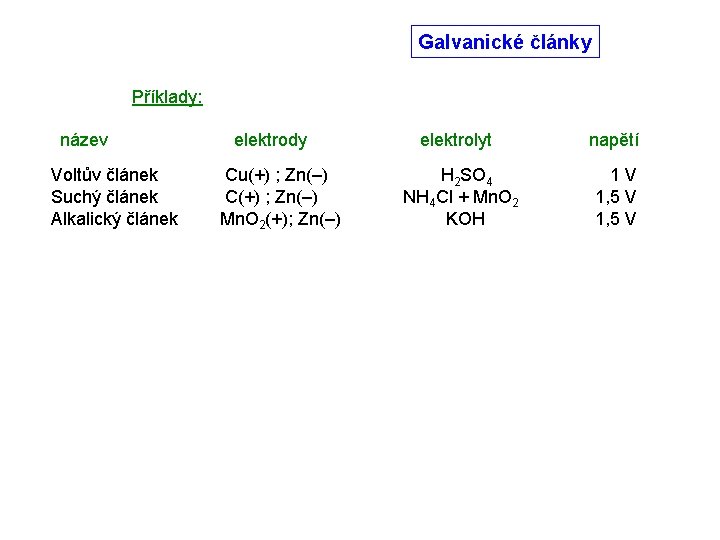
Galvanické články Příklady: název Voltův článek elektrody Cu(+) ; Zn(–) elektrolyt napětí H 2 SO 4 1 V

Galvanické články Příklady: název Voltův článek Suchý článek elektrody Cu(+) ; Zn(–) C(+) ; Zn(–) elektrolyt napětí H 2 SO 4 NH 4 Cl + Mn. O 2 1 V 1, 5 V

Galvanické články Příklady: název Voltův článek Suchý článek Alkalický článek elektrody Cu(+) ; Zn(–) C(+) ; Zn(–) Mn. O 2(+); Zn(–) elektrolyt napětí H 2 SO 4 NH 4 Cl + Mn. O 2 KOH 1 V 1, 5 V

Galvanické články Příklady: název elektrody Voltův článek Cu(+) ; Zn(–) Suchý článek C(+) ; Zn(–) Alkalický článek Mn. O 2(+); Zn(–) Olověný akumulátor Pb (+, –) elektrolyt napětí H 2 SO 4 NH 4 Cl + Mn. O 2 KOH H 2 SO 4 1 V 1, 5 V 2 V Poznámka: Akumulátory jsou zvláštní typy článků, které lze využívat opakovaně. Po připojení k vnějšímu zdroji se změní chemické složení na povrchu elektrod (nabití akumulátoru) a článek je schopen po jistou dobu dodávat elektrický proud. Po vyčerpání kapacity je možno akumulátor znovu nabít.

Galvanické články suchý článek alkalický článek voltův sloup (několik sériově zapojených článků) olověný akumulátor (autobaterie)

Obrázky, animace a videa použité v prezentacích E-učitel jsou buď originálním dílem autora, nebo byly převzaty z volně dostupných internetových stránek.
 Vypínač 6 značka
Vypínač 6 značka Staen
Staen Staen
Staen Střídavý proud prezentace
Střídavý proud prezentace Střídavý proud prezentace
Střídavý proud prezentace Střídavý proud prezentace
Střídavý proud prezentace I am rarely wrong what kind of statement
I am rarely wrong what kind of statement I am proud to be an american
I am proud to be an american Kde vzniká golfský proud
Kde vzniká golfský proud Abstract noun of shy
Abstract noun of shy Prefix for pleased
Prefix for pleased Severoatlantský proud
Severoatlantský proud Honest open proud
Honest open proud Demokratický proud
Demokratický proud Cvrsto agregatno stanje
Cvrsto agregatno stanje John donne carpe diem
John donne carpe diem Boastful and proud
Boastful and proud Trojfázový proud
Trojfázový proud Imagery figure of speech
Imagery figure of speech Imaginativní proud
Imaginativní proud Elektrický proud schématické značky
Elektrický proud schématické značky Elektromagnetické jevy test
Elektromagnetické jevy test Imaginativní proud
Imaginativní proud Elektrický proud v elektrolytech
Elektrický proud v elektrolytech He was treated like a ____ and cast out from his community
He was treated like a ____ and cast out from his community Am i proud
Am i proud A proud taste for scarlet and miniver
A proud taste for scarlet and miniver Types of imagery in poetry
Types of imagery in poetry Asimilacni proud
Asimilacni proud Flexumility
Flexumility The geats proud prince is a kenning for
The geats proud prince is a kenning for Severoatlantský proud
Severoatlantský proud Elektricky proud v kovech
Elektricky proud v kovech Jak nazýváme proud který nemění svůj směr a velikost
Jak nazýváme proud který nemění svůj směr a velikost Death be not proud tone
Death be not proud tone Spirituální proud
Spirituální proud Dannielle glaros
Dannielle glaros Why do you feel proud of mt everest and gautam buddha
Why do you feel proud of mt everest and gautam buddha Pride vs proud
Pride vs proud Katolický proud
Katolický proud Listový mezofyl
Listový mezofyl Which of the following is wrong about metaphysical poets
Which of the following is wrong about metaphysical poets Proud old soldier
Proud old soldier Pride vs proud
Pride vs proud Arrogant connotation
Arrogant connotation Dioda semikonduktor
Dioda semikonduktor