Electroforesis SDSPAGE Sodium Dodecyl Sulphate Poly Acrylamide Gel









- Slides: 30

Electroforesis SDS-PAGE Sodium Dodecyl Sulphate. Poly. Acrylamide Gel Electrophoresis

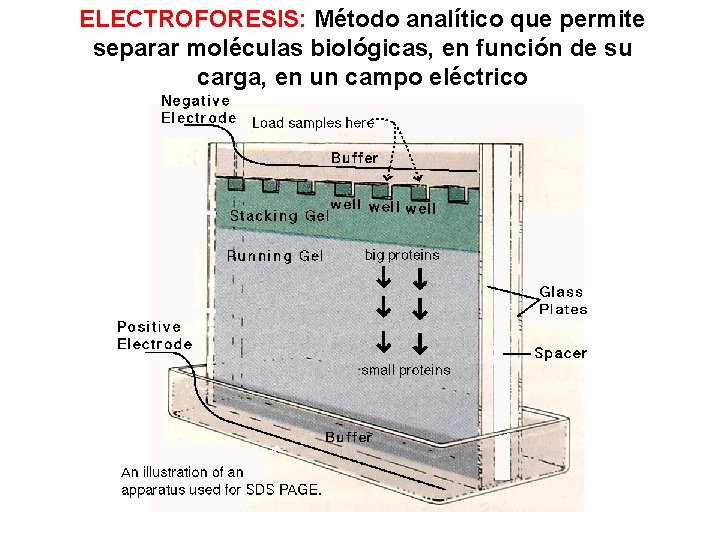
ELECTROFORESIS: Método analítico que permite separar moléculas biológicas, en función de su carga, en un campo eléctrico

APLICACIONES DE LA ELECTROFORESIS SDS-PAGE Grado de pureza de una proteína. · Determinación de masa molecular. · Verificación de la concentración de proteínas. · Detección de proteólisis. · Identificación de proteínas inmunoprecipitadas. · Separación de proteínas marcadas con isótopos radioactivos.

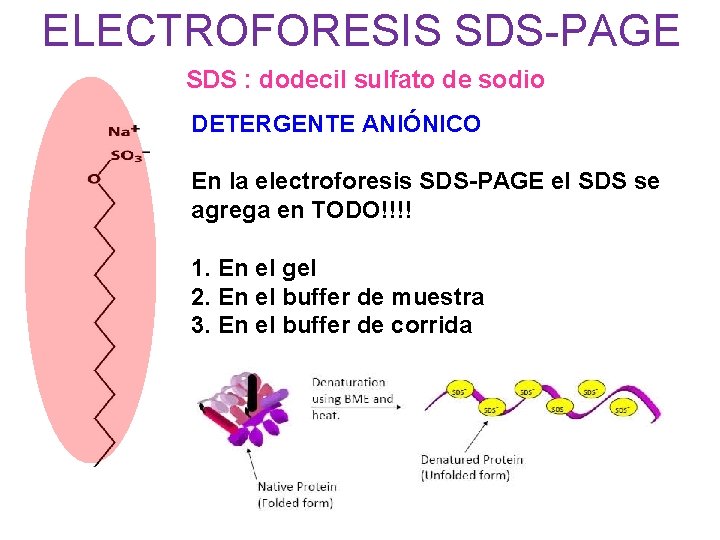
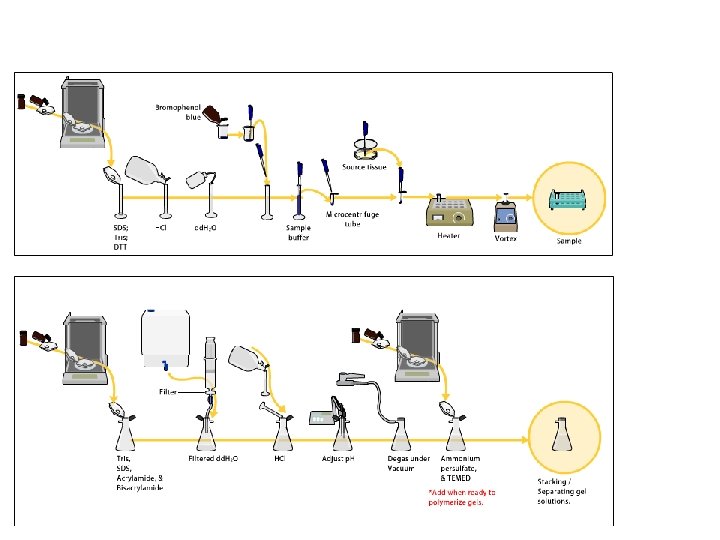
ELECTROFORESIS SDS-PAGE SDS : dodecil sulfato de sodio DETERGENTE ANIÓNICO En la electroforesis SDS-PAGE el SDS se agrega en TODO!!!! 1. En el gel 2. En el buffer de muestra 3. En el buffer de corrida

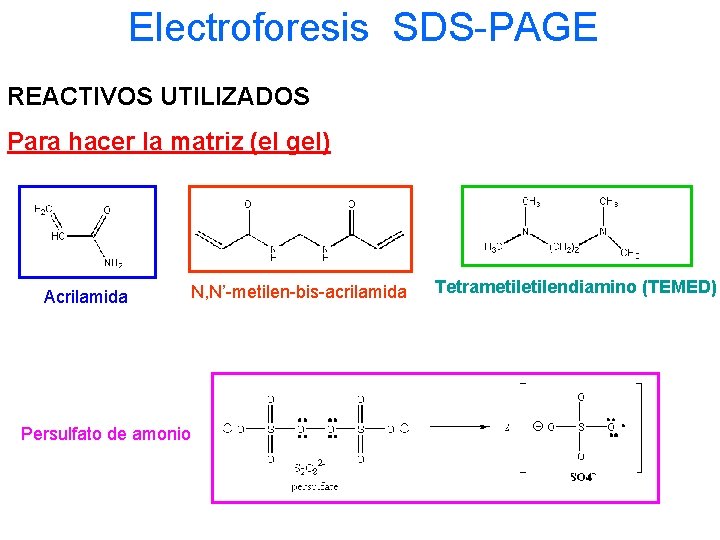
Electroforesis SDS-PAGE REACTIVOS UTILIZADOS Para hacer la matriz (el gel) Acrilamida Persulfato de amonio N, Nʼ-metilen-bis-acrilamida Tetrametilendiamino (TEMED)

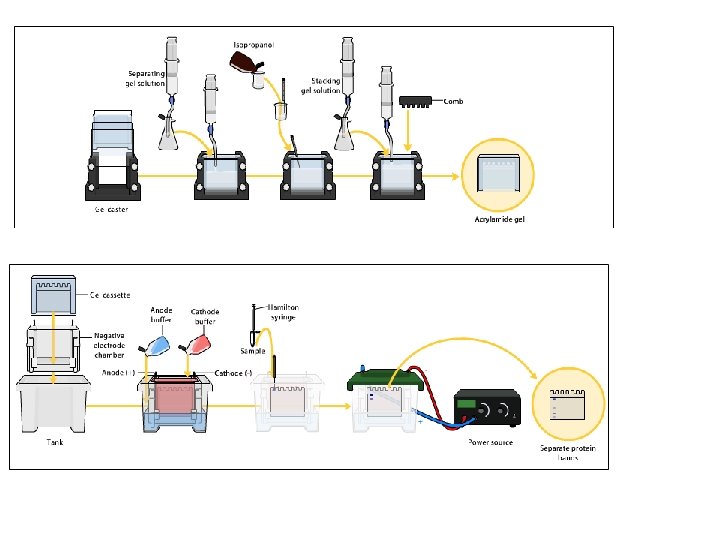
¿Cómo se forma la matriz (el gel)?

MATRIZ DE POLIACRILAMIDA Fase líquida o un gel muy poroso Gel de poliacrilamida

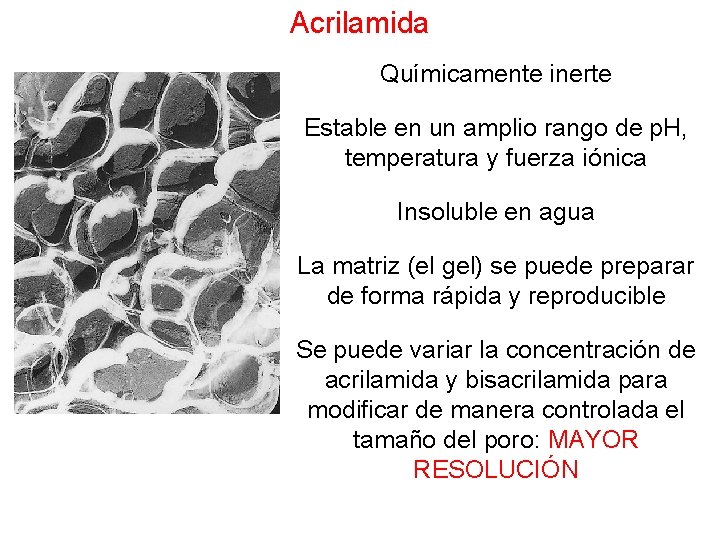
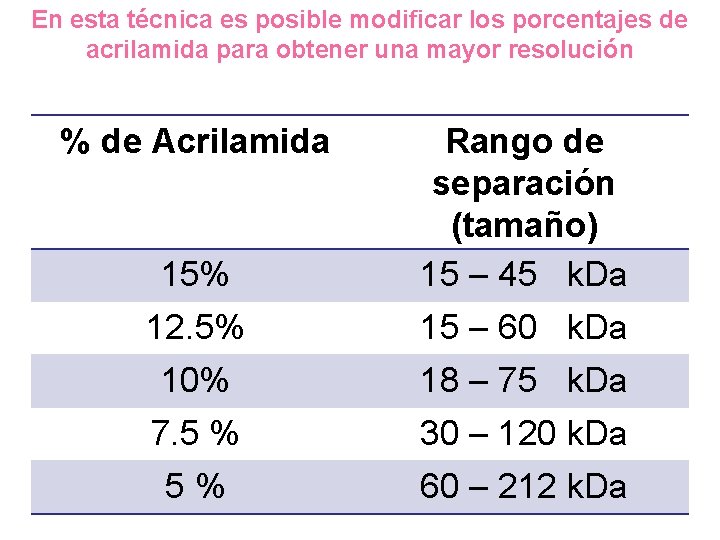
Acrilamida Químicamente inerte Estable en un amplio rango de p. H, temperatura y fuerza iónica Insoluble en agua La matriz (el gel) se puede preparar de forma rápida y reproducible Se puede variar la concentración de acrilamida y bisacrilamida para modificar de manera controlada el tamaño del poro: MAYOR RESOLUCIÓN

En esta técnica es posible modificar los porcentajes de acrilamida para obtener una mayor resolución % de Acrilamida 15% Rango de separación (tamaño) 15 – 45 k. Da 12. 5% 10% 15 – 60 k. Da 18 – 75 k. Da 7. 5 % 30 – 120 k. Da 5% 60 – 212 k. Da

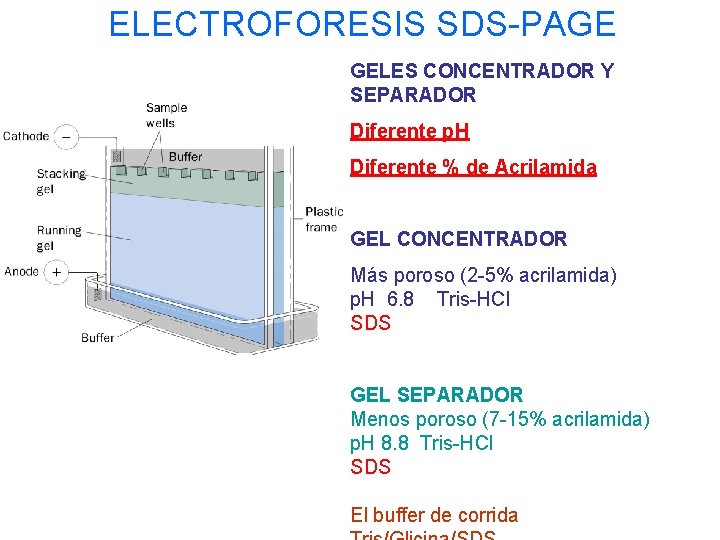
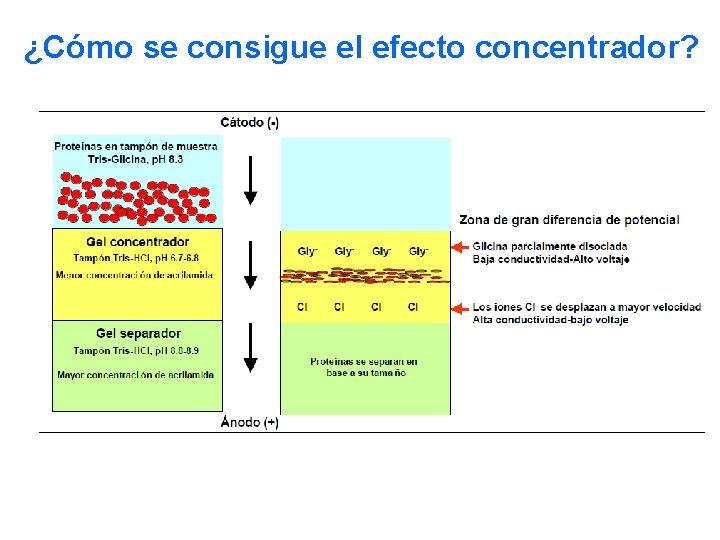
ELECTROFORESIS SDS-PAGE GELES CONCENTRADOR Y SEPARADOR Diferente p. H Diferente % de Acrilamida GEL CONCENTRADOR Más poroso (2 -5% acrilamida) p. H 6. 8 Tris-HCl SDS GEL SEPARADOR Menos poroso (7 -15% acrilamida) p. H 8. 8 Tris-HCl SDS El buffer de corrida


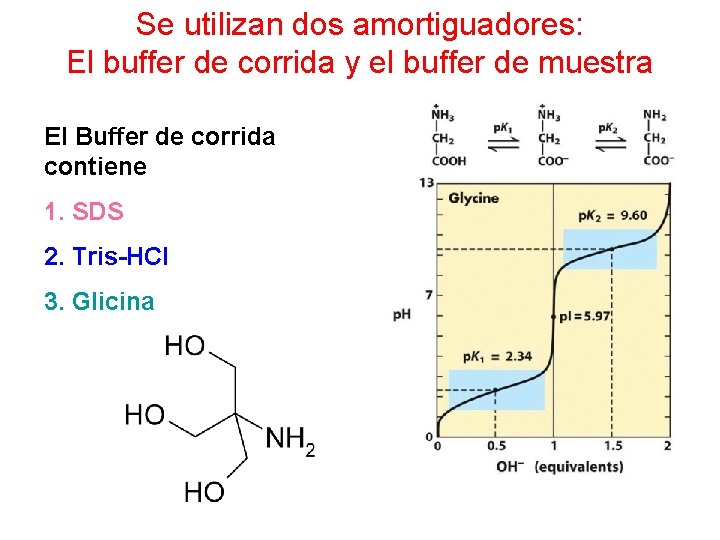
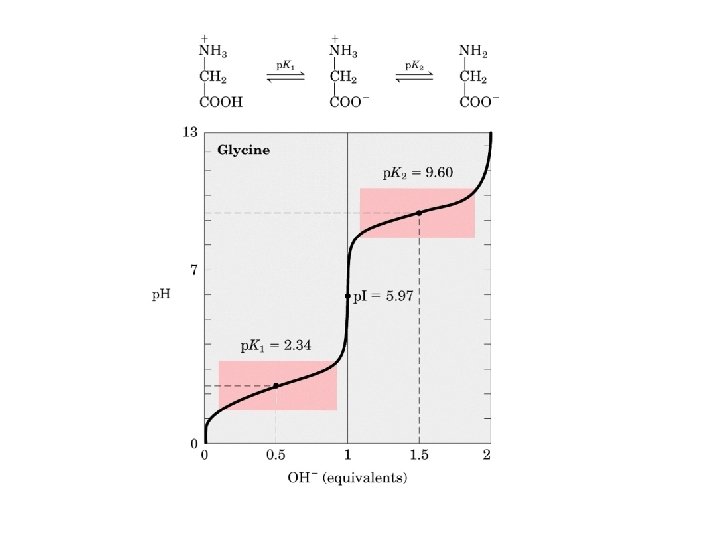
Se utilizan dos amortiguadores: El buffer de corrida y el buffer de muestra El Buffer de corrida contiene 1. SDS 2. Tris-HCl 3. Glicina

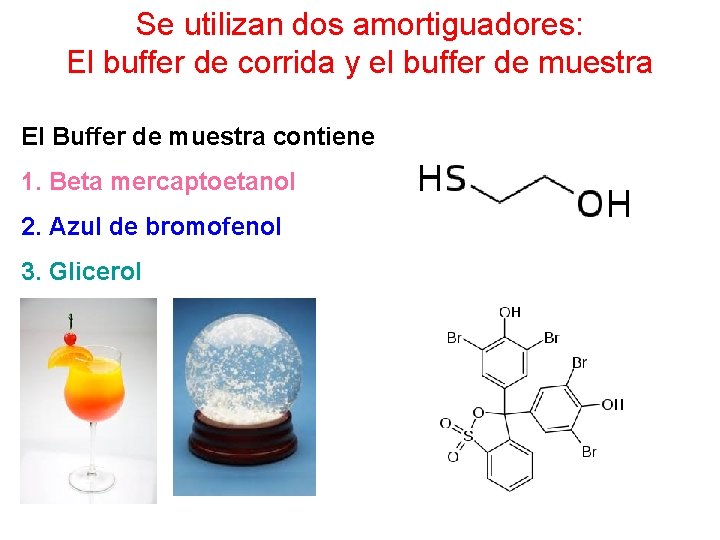
Se utilizan dos amortiguadores: El buffer de corrida y el buffer de muestra El Buffer de muestra contiene 1. Beta mercaptoetanol 2. Azul de bromofenol 3. Glicerol

¿Cómo se consigue el efecto concentrador?




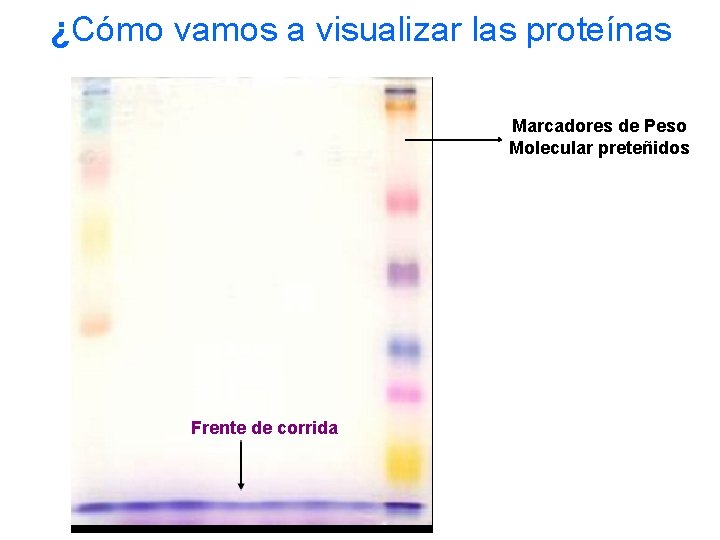
¿Cómo vamos a visualizar las proteínas Marcadores de Peso Molecular preteñidos Frente de corrida

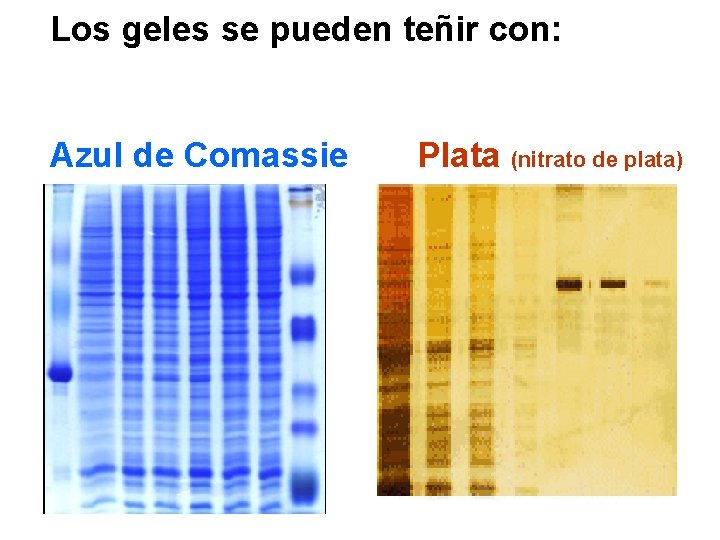
Los geles se pueden teñir con: Azul de Comassie Plata (nitrato de plata)

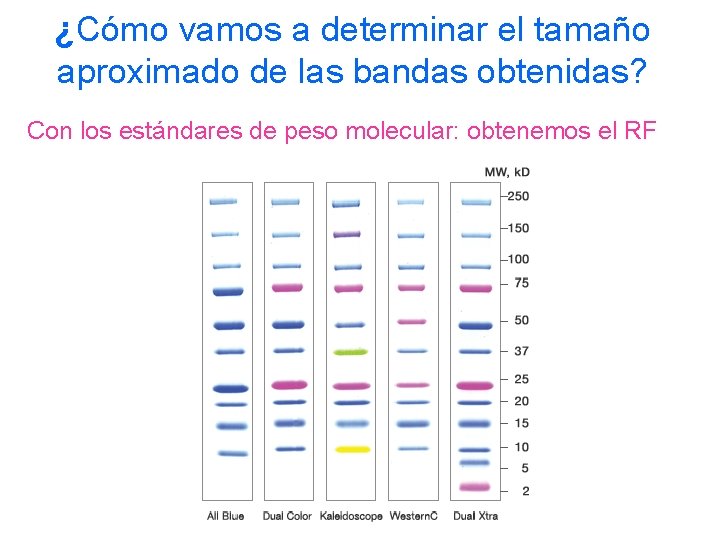
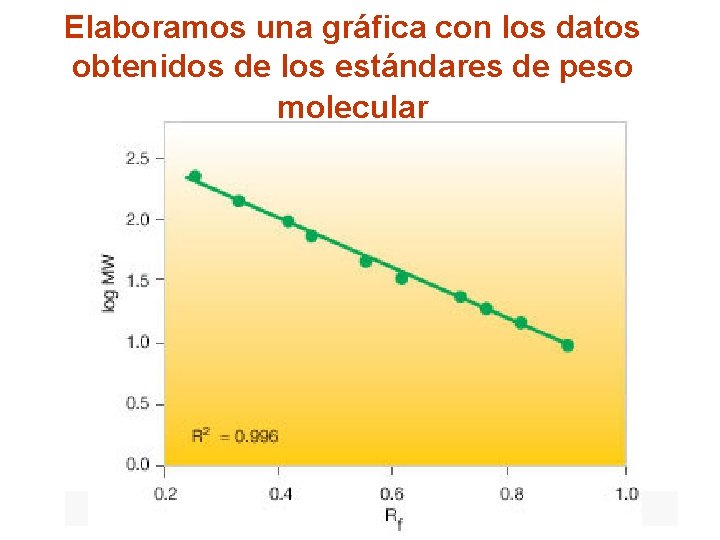
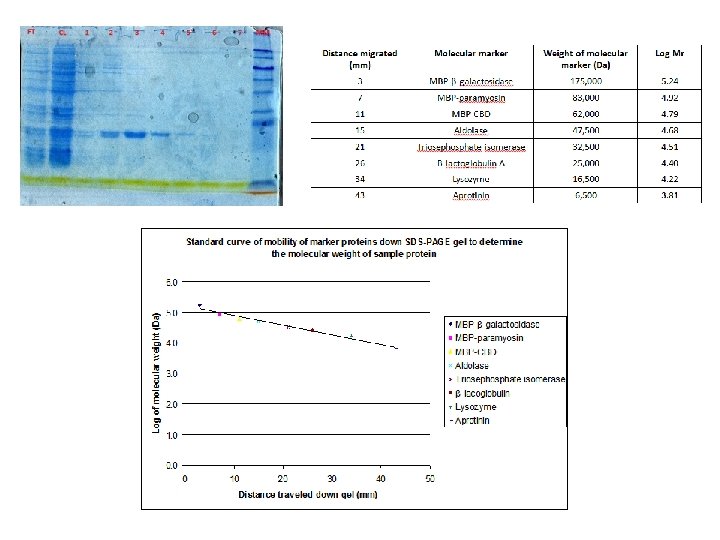
¿Cómo vamos a determinar el tamaño aproximado de las bandas obtenidas? Con los estándares de peso molecular: obtenemos el RF

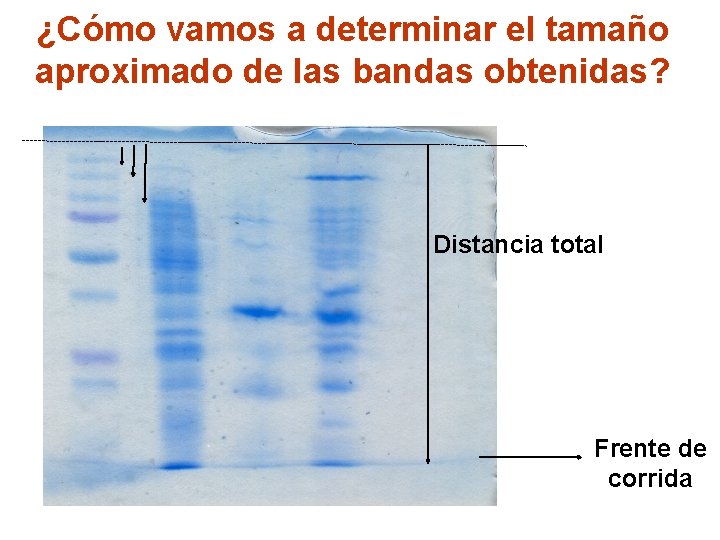
¿Cómo vamos a determinar el tamaño aproximado de las bandas obtenidas? Distancia total Frente de corrida

Elaboramos una gráfica con los datos obtenidos de los estándares de peso molecular

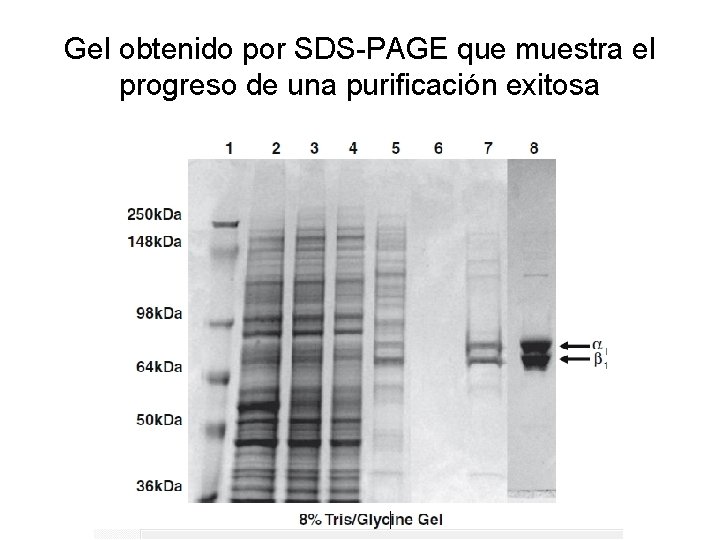
Gel obtenido por SDS-PAGE que muestra el progreso de una purificación exitosa


Procedimiento de proteína recombinante • Tomar 2. 5 m. L de precultivo de E. coli transformado con vector, añadir a 15 m. L de LB • Incubar con agitación a 37 C hasta OD 600 0. 6 -0. 8 • Tomar T 0 (1 m. L) e inducir con IPTG 1 m. M (final) • Seguir incubando y tomar alícuotas (1 m. L) cada 30 min por 2 h. • Tomar 15 µL y mezclar con 10 µL de BC, desnaturalizar y correr en SDS-PAGE.

Peculiaridades de la construcción: • En el vector p. ET-TEM se insertaron los genes que codifican para dos proteínas: • 1) β-lactamasa • 2) Omp. A Proteína de tránsito que se inserta en la membrana externa de las bacterias. (Pag. 43 del manual) • Por lo tanto: no se requiere la extracción de la βlactamasa, esta será secretada al medio tras su síntesis

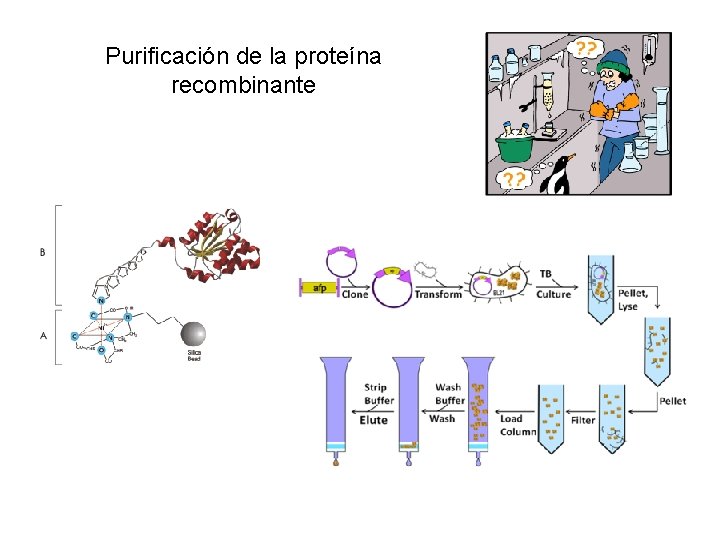
Purificación de la proteína recombinante

Proteina GFP

Purificación de la proteína recombinante

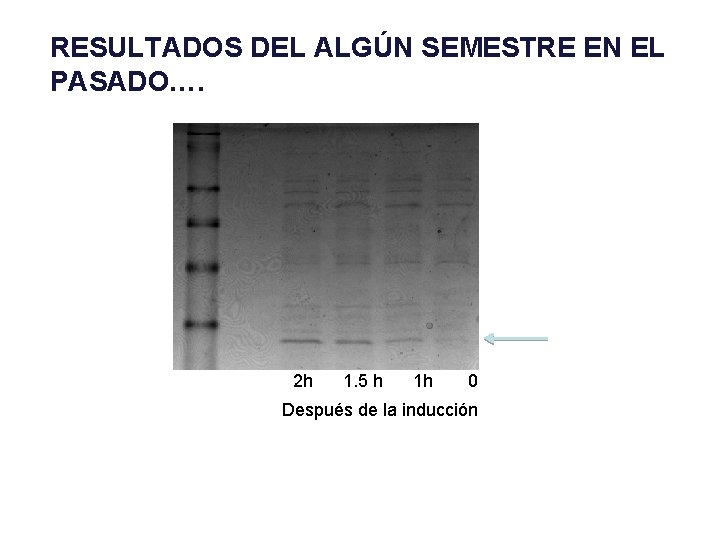
RESULTADOS DEL ALGÚN SEMESTRE EN EL PASADO…. 2 h 1. 5 h 1 h 0 Después de la inducción