El calor Unidad 16 1 2 Contenidos 1


























- Slides: 34

El calor. Unidad 16 1

2 Contenidos (1) 1. - Temperatura. Escalas termométricas. 2. - Calor. 3. - La transmisión del calor. 3. 1. Con cambio de temperatura. 3. 2. Con cambio de estado. 3. 3. Equilibrio térmico. 4. - La dilatación de los cuerpos Índice

3 Contenidos (2) 5. -. Equivalencia entre calor y trabajo. 6. - Energía interna 7. - Primer principio de la termodinámica. 8. - Segundo principio de la termodinámica. 9. - Máquinas térmicas. Índice

4 Temperatura (T). • Es una medida de la energía cinética media que tienen las moléculas. A mayor temperatura mayor agitación térmica (mayor energía cinética media). • Es una magnitud “intensiva”, intensiva es decir, no depende de la masa del sistema. • Dos cuerpos con diferentes temperaturas evolucionan siempre de forma que traten de igualar sus temperaturas (equilibrio térmico). • Para medir T se utilizan los termómetros que se basan en la dilatación de los líquidos (normalmente mercurio). Índice

5 Escalas termométricas. • Centígrada (Celsius). (ºC) • Es la que usamos normalmente. • Usa el “ 0” el punto de fusión del agua y “ 100” el punto de ebullición de la misma. • Farenheit (ºF). • Utilizada en el mundo anglosajón. • Usa el “ 32” el punto de fusión del agua y “ 212” el punto de ebullición de la misma. • 100 ºC equivalen a 180 ºF Índice

6 Escalas termométricas (cont. ). • Absoluta (Kelvin). (K) • Se usa en Química. • Usa el “ 273” el punto de fusión del agua y “ 373” el punto de ebullición dela misma. • Cada ºC equivale a 1 K. Simplemente, la escala está desplazada. • 0 K (– 273 ºC) es la temperatura más baja posible. Índice


Ejemplo: Un inglés te dice que tiene fiebre porque tiene 104ºF. ¿Cuántos grados centígrados son) ¿Cuántos kelvins? F – 32 C 5·(F – 32) 5·(104 – 32) ——— = — C = ————— 9 5 9 9 C = 40ºC T (abs) = C + 273 = 40 + 273 = 313 K Índice 8

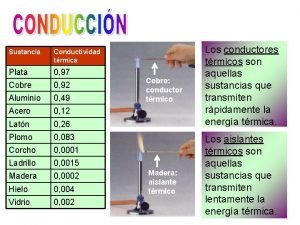
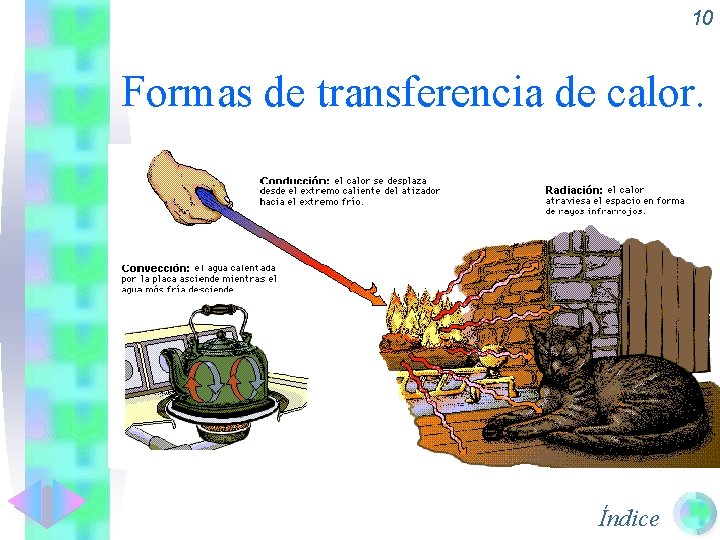
9 Formas de transferencia de calor. • Conducción: Se da fundamentalmente en sólidos. Al calentar un extremo. Las moléculas adquieren más energía y vibran sin desplazarse, pero comunicando esta energía a las moléculas vecinas. • Convección: Se da fundamentalmente en fluidos (líquidos y gases). Las moléculas calientes adquieren un mayor volumen y por tanto una menor densidad con lo que ascienden dejando hueco que ocupan las moléculas de más arriba. • Radiación: Se produce a través de ondas electromagnéticas que llegan sin necesidad de soporte material. De esta manera nos calienta un Índice radiador o nos llega el calor del sol.

10 Formas de transferencia de calor. Índice

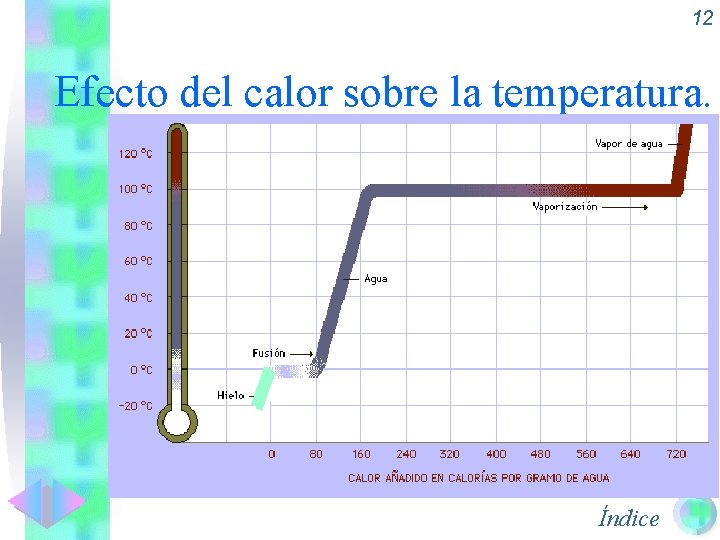
11 Calor y temperatura. • Cuando un cuerpo recibe calor puede: • Aumentar su temperatura En este caso, el calor recibido dependerá de: • Lo que se quiera aumentar T ( T) • De la masa a calentar (m) • Del tipo de sustancia (ce = calor específico) • Cambiar de estado físico. En este caso la temperatura no varía, y el calor recibido dependerá de: • De la masa a cambiar de estado (m) • Del tipo de sustancia (Lf o Lv = calor latente de fusión o vaporización) Índice • Ambas cosas

12 Efecto del calor sobre la temperatura. Índice

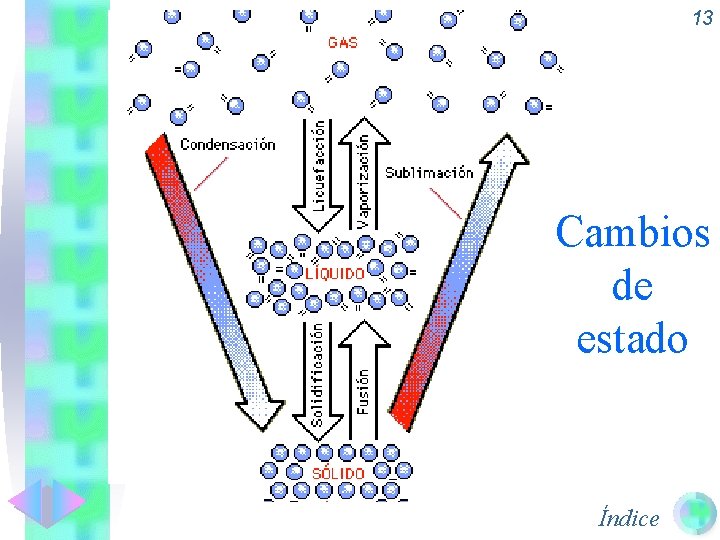
13 Cambios de estado Índice

14 Fórmulas del calor • Si se produce: • Aumento su temperatura: temperatura • • Q = m· ce · T • Cambio de estado físico: físico • QF = L F · m QV = L V · m Índice

15 Equilibrio térmico. • Obviamente, si un cuerpo adquiere calor , es porque otro lo cede, de forma que: • Qabsorbido = – Qcedido • Sea A el cuerpo de menor temperatura (absorberá calor) y el B de mayor temperatura (cederá calor). Al final, ambos adquirirán la misma temperatura de equilibrio (Teq): m. A· ce. A· (Teq– T 0 A) = – m. B· ce. B· (Teq– T 0 B) • O también: m. A· ce. A· (Teq– T 0 A) = m. B· ce. B· (T 0 B –Teq) Índice

Ejemplo: Se introduce una bolita de 200 g de 16 hierro a 120ºC en un recipiente con ½ litro de agua a 18ºC. Calcular: a) la temperatura de equilibrio; b) el calor cedido por la bola de hierro. a) m. A· ce. A· (Teq– T 0 A) = – m. B· ce. B· (Teq– T 0 B) J J 0, 5 kg · 4180 —— (Teq– 18ºC) = 0, 2 kg · 460 —— (120ºC–Teq) K·kg Resolviendo la ecuación obtenemos que la temperatura de equilibrio es: Teq= 22, 3ºC b) Qcedido = m. A· ce. A· (Teq– T 0 A) = J = 0, 2 kg · 460 —— ·(22, 3ºC – 120ºC) = – 8990 J K·kg El signo (–) indica que es cedido. 8990 J Índice

Ejemplo: Calcula el calor necesario para transformar 17 1 kg de hielo a – 10ºC en vapor de agua a 110ºC a presión atmosférica. (LF = 3, 34 · 105 J/kg; LV = 2, 26 · 106 J/kg) El calor total será la suma del necesario para pasar de hielo a – 10ºC a hielo a 0ºC (Q 1), de fundir el hielo (Q 2), de pasar el agua líquida a 0ºC a agua líquida a 100ºC (Q 3), de vaporizar el agua (Q 4) y de aumentar la temperatura del vapor hasta los 110ºC (Q 5): Q 1=m · ce· (T– T 0) = 1 kg ·(2, 05 k. J/kg·K)· 10 K = 20, 5 k. J Q 2=m · LF = 1 kg ·(3, 34 · 105 J/kg) = 334 k. J Q 3=m· ce·(T– T 0) = 1 kg·(4, 18 k. J/kg·K)· 100 K = 418 k. J Q 4=m · LV = 1 kg ·(2, 26 · 106 J/kg) = 2260 k. J Q 5=m · ce· (T– T 0) = 1 kg ·(1, 96 k. J/kg·K)· 10 K = 19, 6 k. J QTOTAL= Q 1 + Q 2 + Q 3 + Q 4 + Q 5 = 20, 5 k. J + 334 k. J + 418 k. J + 2260 k. J + 19, 6 k. J Índice QTOTAL = 3052, 1 k. J TOTAL

18 Dilatación Lineal: l = l 0·(1 + · T) Superficial: S = S 0·(1 + · T) Cúbica: V = V 0·(1 + · T) “ ”, “ ” y “ ” son los coeficientes de dilatación, lineal, superficial y cúbica respectivamente, y dependen del tipo de material. Se miden en K– 1. • Para un mismo material = 2 ; = 3 . • • Índice

Ejemplo: Una barra de aluminio mide 45 cm a 20 ºC. ¿Qué longitud en centímetros tendrá si la calentamos hasta 180ºC? . El coeficiente de dilatación lineal del aluminio es 2, 5 · 10– 5 ºC– 1. l = l 0·(1 + · T) = 0, 45 m·[1 + 2, 5 · 10– 5 ºC– 1·(180ºC – 20ºC)] = l = 0, 450675 m = 45, 0675 cm Índice 19

20 Dilatación en los gases. • Para todos los gases el coeficiente de dilatación cúbica se denomina “ ” y vale “ 1/273 K– 1. • Sea T 0 = 0 ºC = 273 K • V= V 0·[1 + (1/273 K– 1) ·(T – T 0)] = V 0 ·[1 + (T /273) K– 1 – 1] • V · 273 K = V 0 ·T • Ley de Chales Gay-Lussac: • V V 0 —— = —— T T 0 Índice

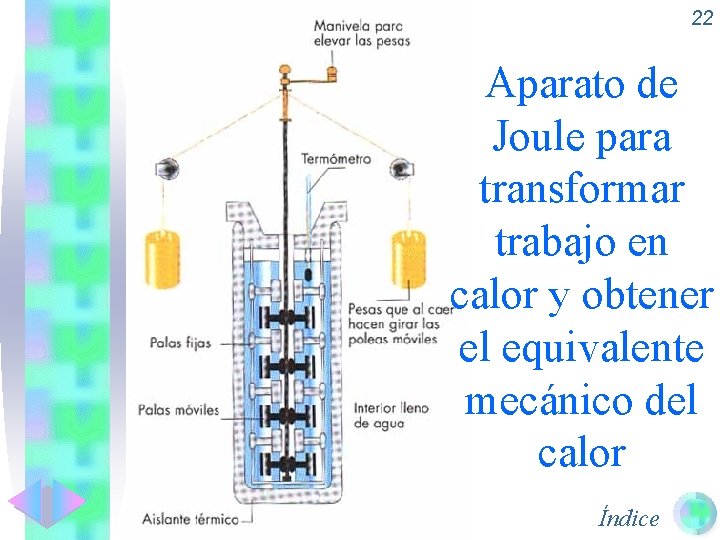
21 Equivalencia calor-trabajo. • A principios del siglo XIX se pensaba que el calor era una sustancia fluida material que pasaba de unos cuerpos a otros (teoría del “calórico”). • Joule demostró que el calor era una forma de energía y calculó la equivalencia entre la caloría (unidad de calor) y el julio (unidad de trabajo-energía). 1 J = 0’ 24 cal ; 1 cal = 4’ 18 J Índice

22 Aparato de Joule para transformar trabajo en calor y obtener el equivalente mecánico del calor Índice

23 Energía interna (U) • Es la energía total de las partículas que constituyen un sistema. • Es igual a la suma de todas las energías de rotación, traslación, vibración y enlace entre los átomos que constituyen las moléculas. • Es una magnitud “extensiva”, extensiva es decir, depende de la masa del sistema. • Es muy difícil de medir. En cambio es fácil determinar la variación de ésta ( U). Índice

Nota. ¡CUIDADO! En muchos libros aún se considera positivo el trabajo realizado por el sistema, con lo que éstos aún podréis ver U definido como Q – W. Primer principio de la Termodinámica CALOR 24 CALOR Q>0 Q<0 TRABAJO W< 0 W>0 • Un sistema pierde energía interna ( U < 0) si cede calor o realiza un trabajo y gana energía interna ( U > 0) si absorbe calor o el exterior ejerce un trabajo sobre él (compresión). Cuidado: No debe • U=Q+W escribirse Q Índice

25 • Trabajo en sistemas gaseosos. W = F · dr = p · S · dr = – p · d. V • En el caso de que la presión sea constante (sistemas isobáricos), la integral es inmediata: • W = – p · V • El signo menos se debe al actual criterio de signos que decide que sea negativa toda la energía que salga de un sistema. Si un sistema realiza un trabajo hacia el exterior es porque ha perdido energía. Índice

26 Tipos de procesos. • Adiabáticos: Adiabáticos (Q = 0) • No tiene lugar intercambio de calor con el exterior (por ejemplo, un termo) U = W • Isócoros: (V = constante) • Tienen lugar en un recipiente cerrado. • Como V = 0 W = 0 Qv = U • Isobáricos: (p = constante) • U = Qp – p· V ; U 2 – U 1 = Qp – (p·V 2 – p·V 1) • U 2 + p·V 2 = Qp + U 1 + p·V 1 • Si llamamos H = U + p·V Qp = H 2 – H 1 = H • Isotérmicos: (T = constante) Índice

Ejemplo: Una masa de 18 g de agua es transformada 27 en vapor a 101300 Pa y 100ºC convirtiéndose en 30, 6 litros de vapor a esta misma presión. Si LV (agua) es 2, 26 · 106 J/kg, calcula: a) la energía suministrada en forma de calor; b) el trabajo realizado por el sistema; c) la variación de energía interna. a) Q = m · LV = 0, 018 kg ·(2, 26 · 106 J/kg) Q = 40, 68 k. J b) El volumen del agua líquida se puede despreciar frente al del gas: 1, 8 · 10– 2 L << 30, 6 L W = – p · V = = – 101300 N·m – 2·(30, 6 · 10– 3 m 3) = – 3, 1 k. J c) U = Q + W = 40, 68 k. J – 3, 1 k. J = 37, 58 k. J Índice

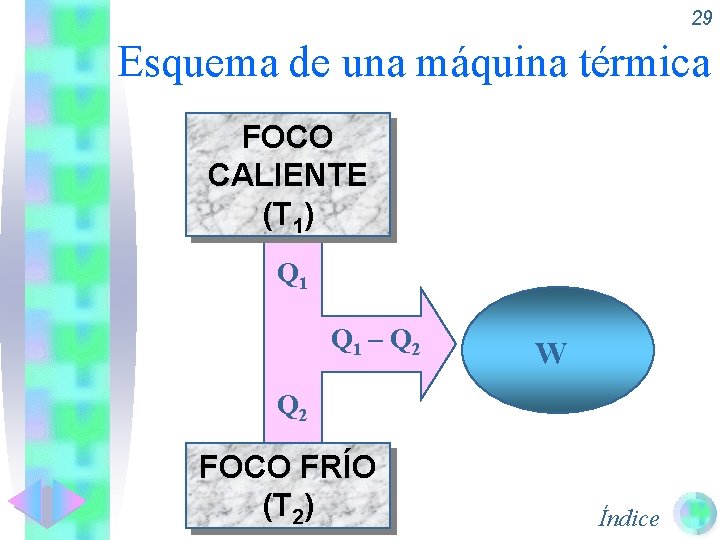
Segundo principio de la Termodinámica. 28 • Todo el trabajo que se suministra a un sistema puede almacenarse como calor. • Sin embargo, el proceso contrario no es posible: “No todo el calor suministrado o absorbido por el sistema y que hace aumentar U del mismo, puede recuperarse en forma de trabajo” trabajo ya que parte del calor se emplea en calentar un foco frío. • |W| |Qabsorbido| – |Qcedido al foco frío| = ————— =——————— |Qabsorbido| • También puede darse en tanto por 100. Índice

29 Esquema de una máquina térmica FOCO CALIENTE (T 1) Q 1 – Q 2 W Q 2 FOCO FRÍO (T 2) Índice

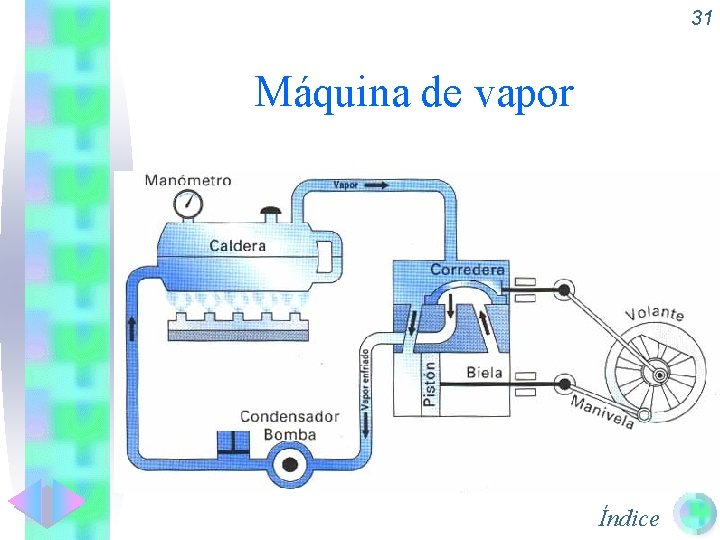
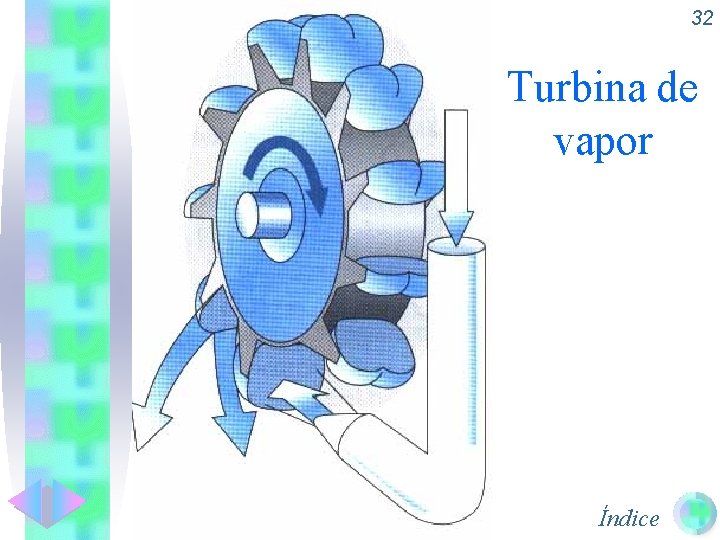
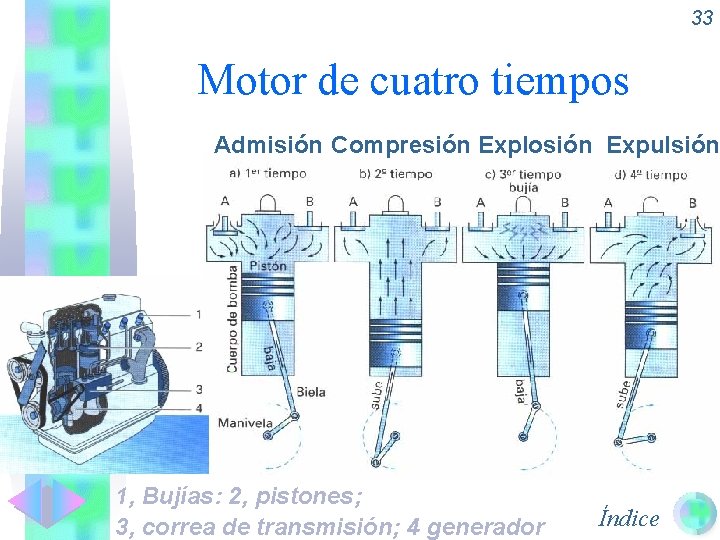
30 Máquinas térmicas • Las máquinas térmicas son las encargadas de transformar Q en W y tienen un rendimiento inferior al 100 %. • Máquina de vapor. • Turbina de vapor. • Motor de cuatro tiempos. • Aspiración o admisión • Compresión • Explosión. • Expulsión. • Motor Diesel. Índice

31 Máquina de vapor Índice

32 Turbina de vapor Índice

33 Motor de cuatro tiempos Admisión Compresión Explosión Expulsión 1, Bujías: 2, pistones; 3, correa de transmisión; 4 generador Índice

Ejemplo: Una máquina térmica extrae en cada ciclo 34 30 k. J del foco caliente y suministra 8 k. J al foco frío. Calcula: a) el trabajo que realiza; b) el rendimiento de la máquina. a) |W| = |Qabsorbido| – |Qcedido al foco frío| = 30 k. J – 8 k. J Trabajo realizado = 22 k. J b) |W| |Qabsorbido| – |Qcedido al foco frío| = ————— =——————— |Qabsorbido| |W| 22 k. J = ————— = 0, 73 ; |Qabsorbido| 30 k. J = 73 % Índice
 Que es sencible
Que es sencible Calor especifico hierro
Calor especifico hierro Unidad decena centena millar
Unidad decena centena millar Contenidos interdisciplinares
Contenidos interdisciplinares Saber hacer saber conocer y saber ser
Saber hacer saber conocer y saber ser Secuenciación de contenidos
Secuenciación de contenidos Procedimental conceptual y actitudinal
Procedimental conceptual y actitudinal Textos divulgativos
Textos divulgativos Enfoque pedagogico de conocimiento del medio primaria
Enfoque pedagogico de conocimiento del medio primaria Objetivos de repaso
Objetivos de repaso Contenidos factuales ejemplos
Contenidos factuales ejemplos Objetivos actitudinales ejemplos
Objetivos actitudinales ejemplos Contenidos desarrollados
Contenidos desarrollados Introduccion de un trabajo
Introduccion de un trabajo Los contenidos
Los contenidos Integración y reelaboración de contenidos digitales
Integración y reelaboración de contenidos digitales Calor
Calor Ex equao
Ex equao Transferencia de calor por convección
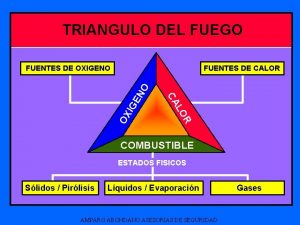
Transferencia de calor por convección Triangulo de fuego
Triangulo de fuego Calor específico molar
Calor específico molar Transferência de calor
Transferência de calor Que es el coeficiente global de transferencia de calor
Que es el coeficiente global de transferencia de calor Transmision de calor
Transmision de calor Heat transfer cengel
Heat transfer cengel Dónde hace calor y dónde hace frío líneas imaginarias
Dónde hace calor y dónde hace frío líneas imaginarias Fisica calor
Fisica calor Cantidad de calor
Cantidad de calor Tabela de calor específico
Tabela de calor específico Conductividad termica del cobre
Conductividad termica del cobre Desinfeccin
Desinfeccin Formas de propagação de calor 7 ano slide
Formas de propagação de calor 7 ano slide Calor y trabajo
Calor y trabajo Eliminacion de calor
Eliminacion de calor Da calorie a joule
Da calorie a joule