EJERCICIOS LEYES PONDERALES LEY DE LAS PROPORCIONES MULTIPLES






- Slides: 7

EJERCICIOS LEYES PONDERALES

LEY DE LAS PROPORCIONES MULTIPLES CARBONO + OXIGENO = DIOXIDO DE CARBONO 1, 00 g 2, 66 g CARBONO + OXIGENO = MONOXIDO DE CARBONO 1, 00 g 1, 33 g ¿Se cumple con la ley de Dalton? 2, 66 g = 2 Si, cumple con la ley de las proporciones múltiples. 1, 33 g 1 “Cuando dos elementos se combinan para formar más de un compuesto, la masa de uno de ellos, que se une a una masa fija del otro está en relación de números enteros y sencillos”

¿se cumple con la ley de Dalton? 0, 57 = 1 1, 14 2 0, 57= 1 1, 71 3 0, 57 = 1 2, 85 5 Si, cumple con la ley de las proporciones múltiples.

CROMO + OXIGENO = OXIDO DE CROMO (II) 76, 5 g 23, 5 g Óxidos de Cromo CROMO + OXIGENO = OXIDO DE CROMO (III) 61, 9 g 38, 1 g 76, 5 g Xg X= 47 g de oxigeno ¿se cumple con la ley de Dalton? R: A simple vista no, pero si hacemos una relación que nos permita fijar una cantidad de materia para el cromo podemos calcular la cantidad de oxigeno correspondiente y ver si cumple con esta ley. Obtenidos los nuevos datos podemos establecer la siguiente relación, que si cumple con la ley de Dalton. 23, 5 = 1 47 2

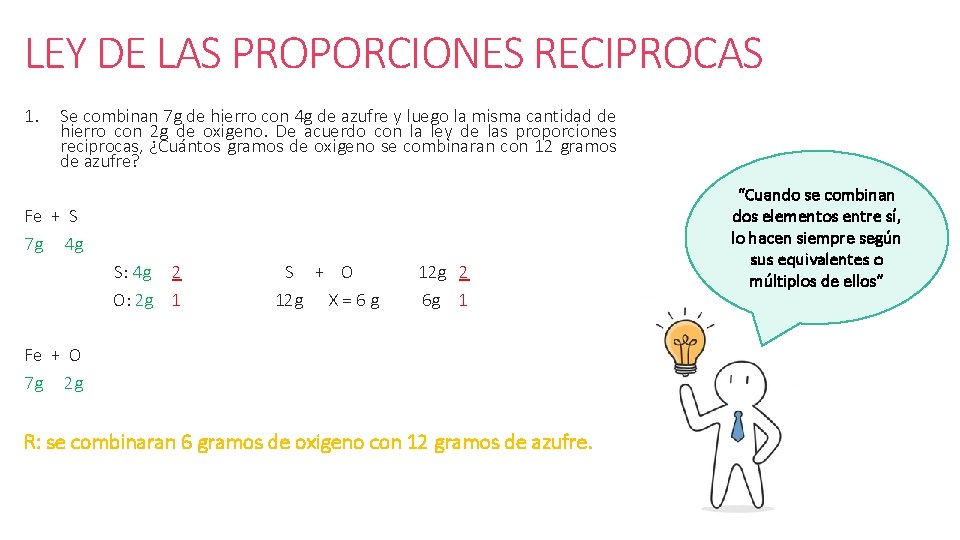
LEY DE LAS PROPORCIONES RECIPROCAS 1. Se combinan 7 g de hierro con 4 g de azufre y luego la misma cantidad de hierro con 2 g de oxigeno. De acuerdo con la ley de las proporciones reciprocas, ¿Cuántos gramos de oxigeno se combinaran con 12 gramos de azufre? Fe + S 7 g 4 g S: 4 g 2 O: 2 g 1 S + O 12 g X = 6 g 12 g 2 6 g 1 Fe + O 7 g 2 g R: se combinaran 6 gramos de oxigeno con 12 gramos de azufre. “Cuando se combinan dos elementos entre sí, lo hacen siempre según sus equivalentes o múltiplos de ellos”

LEY DE LOS VOLUMENES DE COMBINACION “Cuando reaccionan gases bajo condiciones de presión y temperatura equivalentes, lo hacen en relaciones de volúmenes de números enteros y sencillos”

b. ¿Qué ocurrirá si reaccionan 0, 24 L de nitrógeno y 3 litros de hidrogeno en condiciones normales de temperatura y presión. Tarea