Eigenschaften des Photons Das Photon ist das Energiequant















- Slides: 35

Eigenschaften des Photons Das Photon ist das Energiequant der elektromagnetischen Wellen, d. h. Licht hat wie von Einstein postuliert nicht nur Wellencharakter, sondern auch Teilchencharakter mit den oben angegebenen Eigenschaften (Einstein bekam den Nobelpreis für den photoelektrischen Effekt und nicht wie gemeinhin angenommen für die Relativitätstheorie). Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 1

Teilchencharakter des Photons aus: Photoeffekt Comptonstreuung Gravitation Plancksche Temperaturstrahlung Wellencharakter des Elektrons aus: Interferenz bei Beugung an Kristallen oder Doppelspalt Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 2

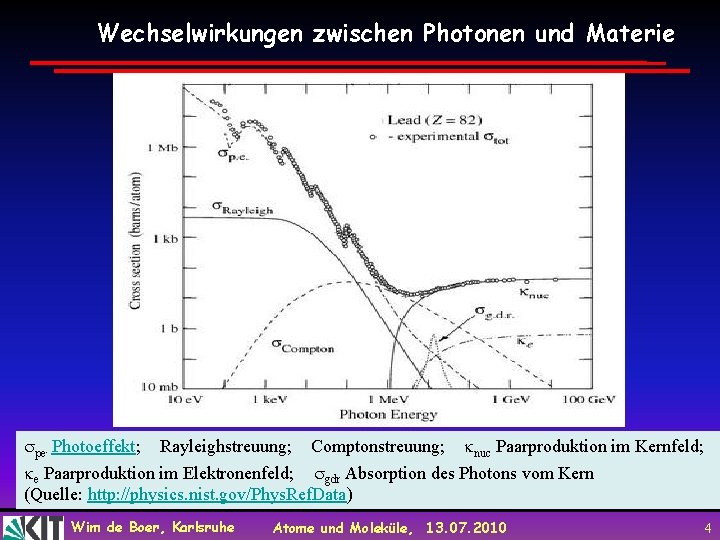
Wechselwirkung zwischen Photonen und Materie Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 3

Wechselwirkungen zwischen Photonen und Materie pe Photoeffekt; Rayleighstreuung; Comptonstreuung; nuc Paarproduktion im Kernfeld; e Paarproduktion im Elektronenfeld; gdr Absorption des Photons vom Kern (Quelle: http: //physics. nist. gov/Phys. Ref. Data) : : : Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 4

De-Broglie Beziehung Photon: E=hv=hc/ und E 2=p 2 c 2+m 2 c 4 Daher: für m=0 gilt: E=pc=hc/ oder p=h/ (de Broglie) Um Interferenzen der Elektronen zu erklären postulierte de Broglie das diese Beziehung auch für Teilchen gilt! Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 5

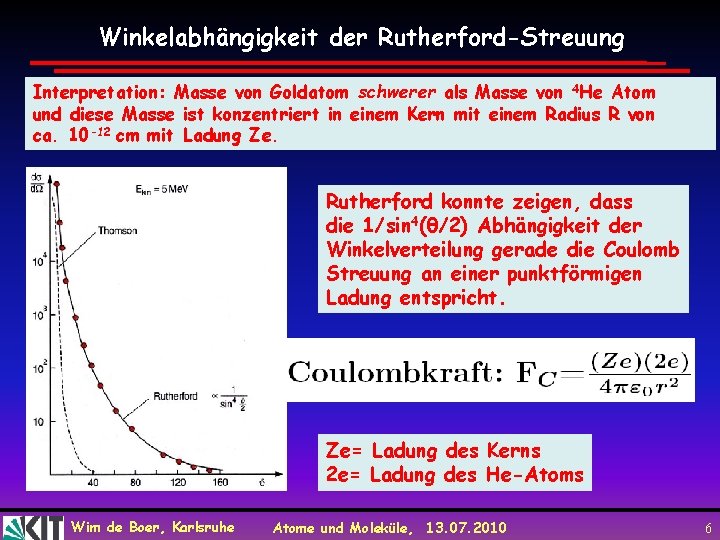
Winkelabhängigkeit der Rutherford-Streuung Interpretation: Masse von Goldatom schwerer als Masse von 4 He Atom und diese Masse ist konzentriert in einem Kern mit einem Radius R von ca. 10 -12 cm mit Ladung Ze. Rutherford konnte zeigen, dass die 1/sin 4(θ/2) Abhängigkeit der Winkelverteilung gerade die Coulomb Streuung an einer punktförmigen Ladung entspricht. Ze= Ladung des Kerns 2 e= Ladung des He-Atoms Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 6

Vollständiges Termschema des H-Atoms Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 7

Frank-Hertz Versuch beweist Energie Quantelung der Energieniveaus Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 8

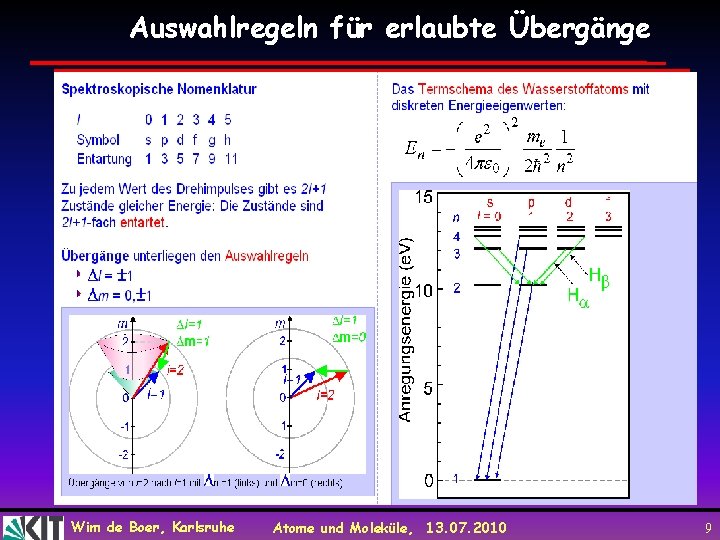
Auswahlregeln für erlaubte Übergänge Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 9

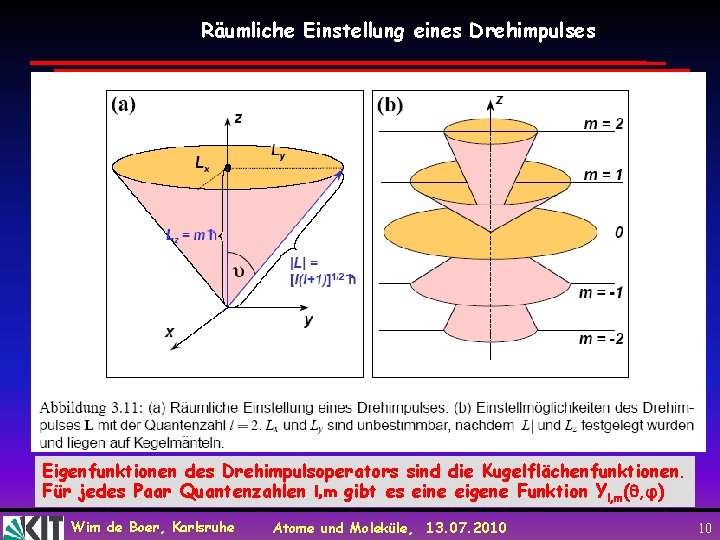
Räumliche Einstellung eines Drehimpulses Eigenfunktionen des Drehimpulsoperators sind die Kugelflächenfunktionen. Für jedes Paar Quantenzahlen l, m gibt es eine eigene Funktion Yl, m( , φ) Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 10

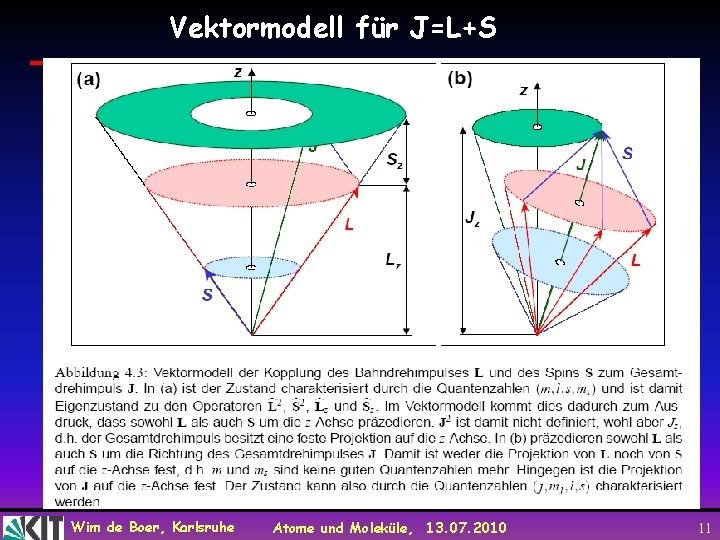
Vektormodell für J=L+S Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 11

Zusammenfassung Spin des Elektrons Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 12

Zusammenfassung Spin-Bahn-Kopplung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 13

Energieverschiebung durch Spin-Bahn-Kopplung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 14

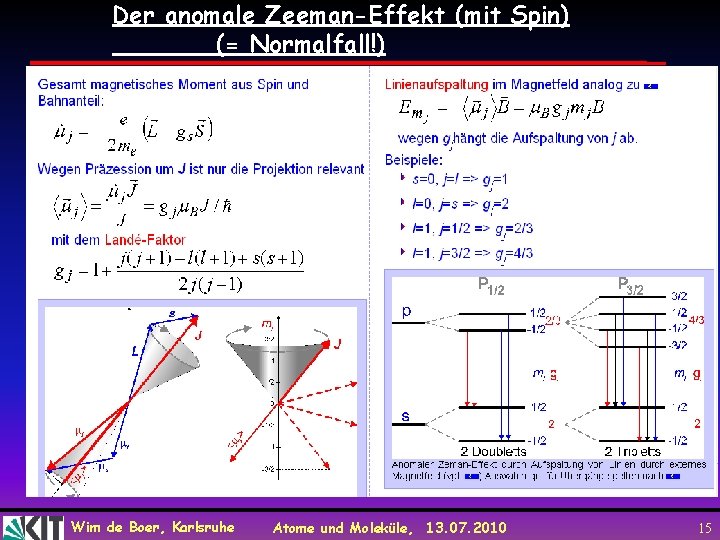
Der anomale Zeeman-Effekt (mit Spin) (= Normalfall!) Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 15

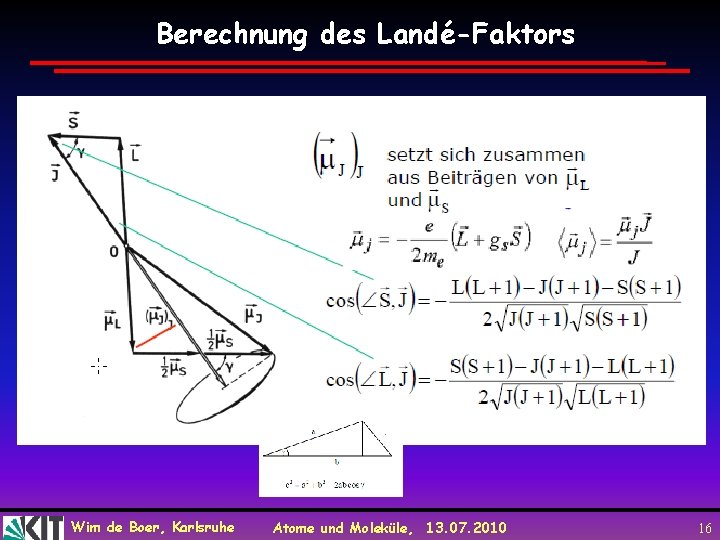
Berechnung des Landé-Faktors Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 16

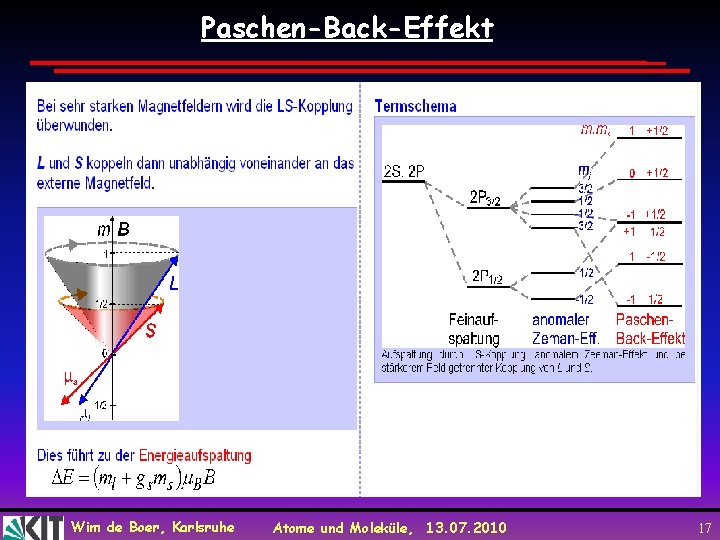
Paschen-Back-Effekt Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 17

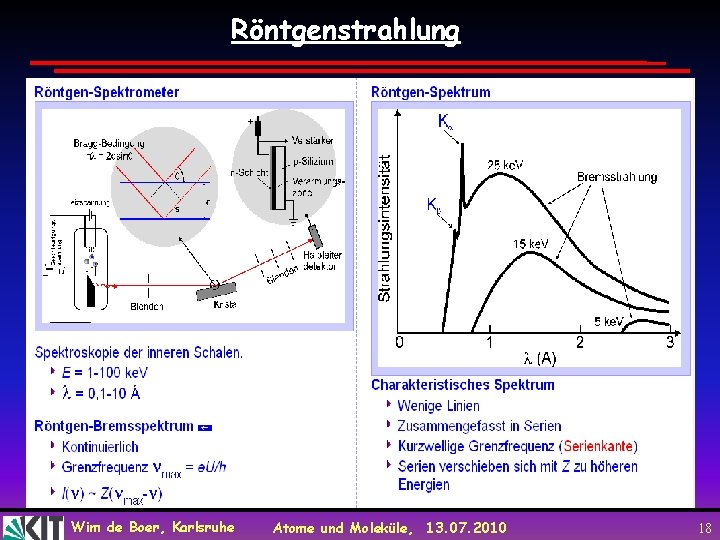
Röntgenstrahlung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 18

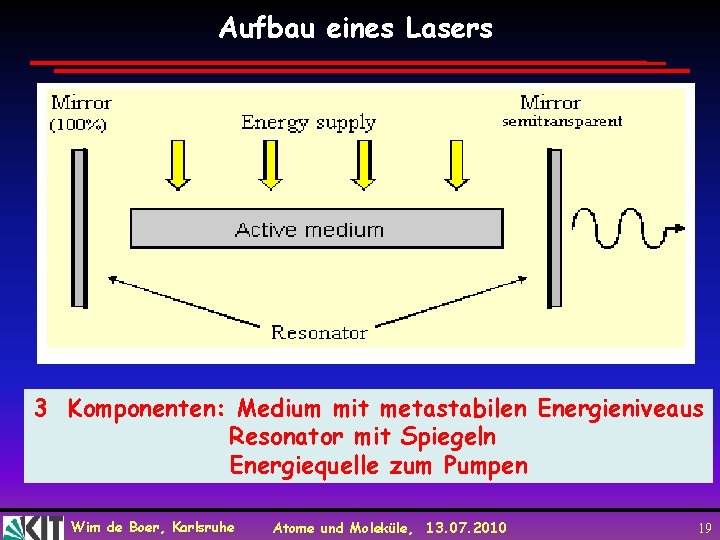
Aufbau eines Lasers 3 Komponenten: Medium mit metastabilen Energieniveaus Resonator mit Spiegeln Energiequelle zum Pumpen Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 19

Pumpen eines Lasers Um die Elektronen in einen angeregten Zustand zu bringen, muß der Laser "gepumpt" werden. Dies kann z. B. durch Gasentladung, Licht oder andere Laser geschehen. Bei einem 3 -Niveau-Laser wird dabei ein Elektron in ein noch höheres Energieniveau gebracht und fällt dann wieder auf das Energieniveau E 2 zurück (siehe Skizze). Die dabei entstehende Energie wird als Wärme abgegeben. Freq. des Lasers: Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 20

Periodensystem Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 21

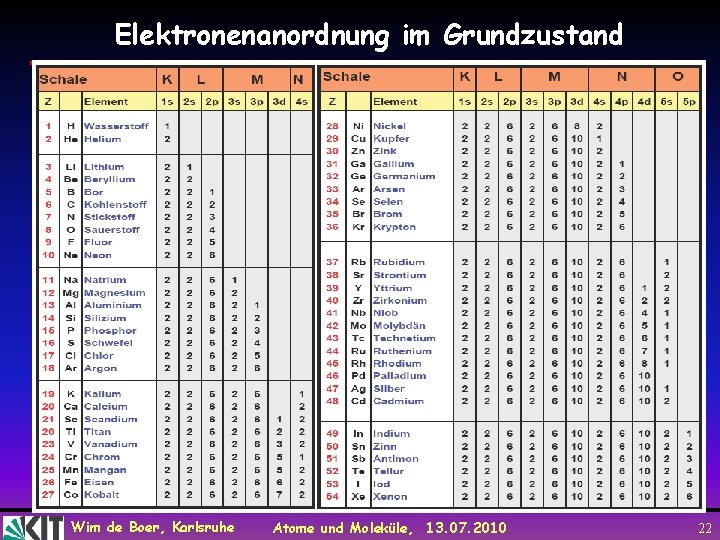
Elektronenanordnung im Grundzustand Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 22

Beispiel der QZ für die np 2 Konfiguration B S S A A S A S S A Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 23

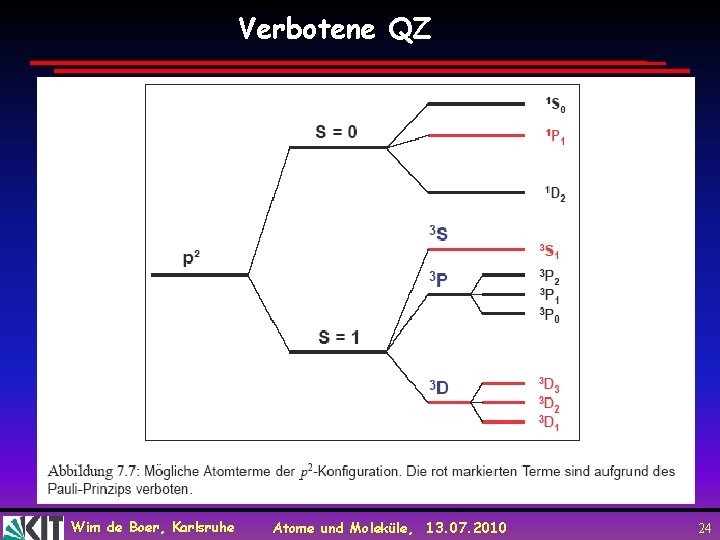
Verbotene QZ Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 24

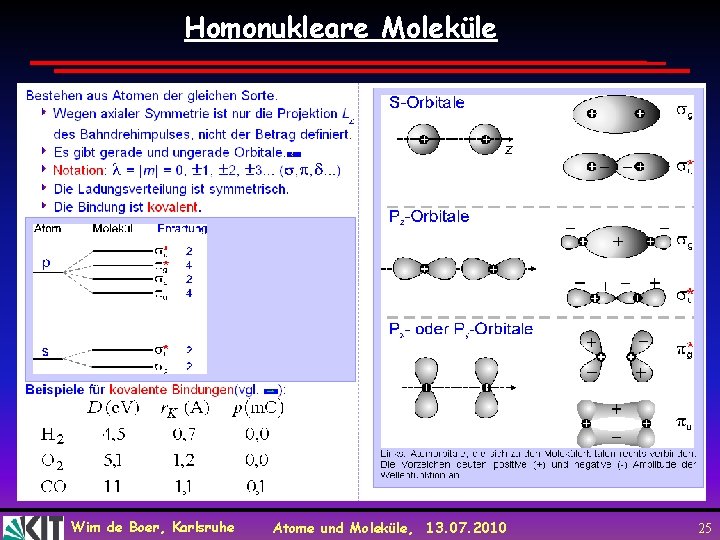
Homonukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 25

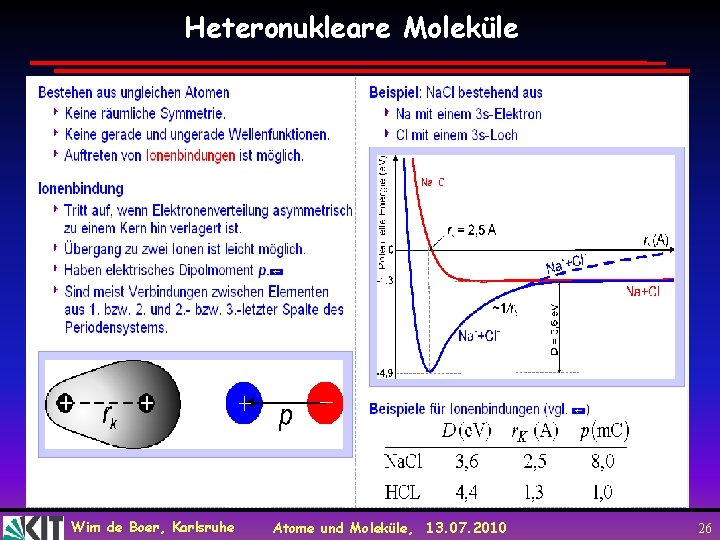
Heteronukleare Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 26

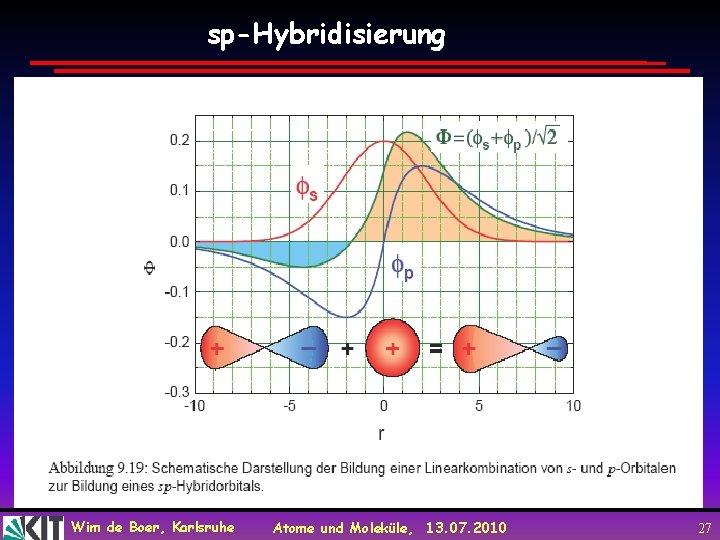
sp-Hybridisierung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 27

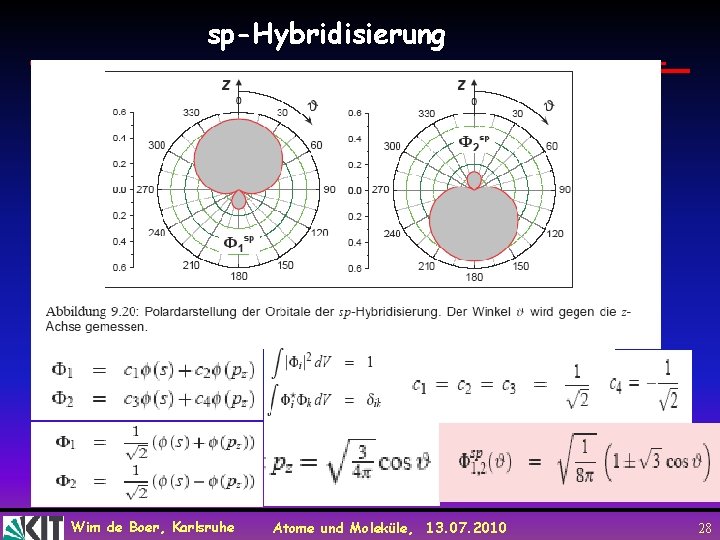
sp-Hybridisierung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 28

Vielatomige Moleküle Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 29

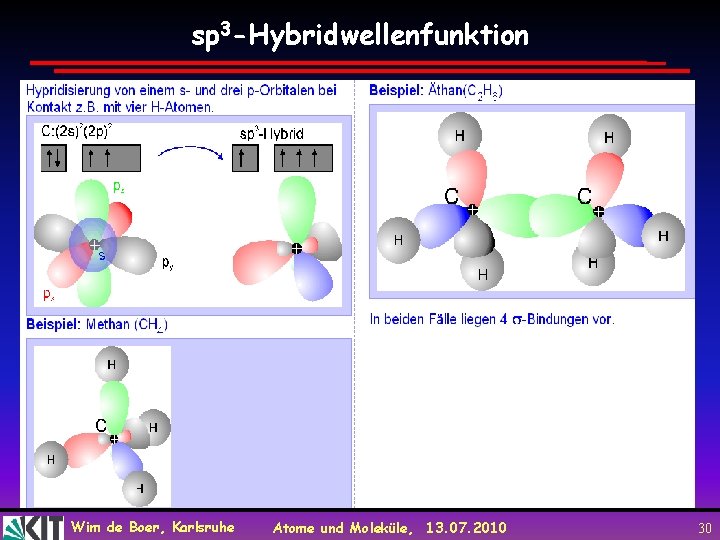
sp 3 -Hybridwellenfunktion Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 30

Zusammenfassung Schwingungen denn dann symmetrische Ladungsverteilung Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 31

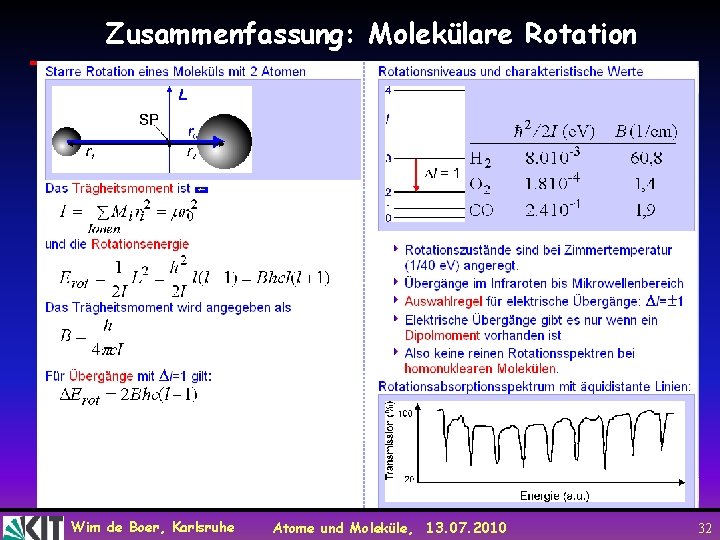
Zusammenfassung: Molekülare Rotation Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 32

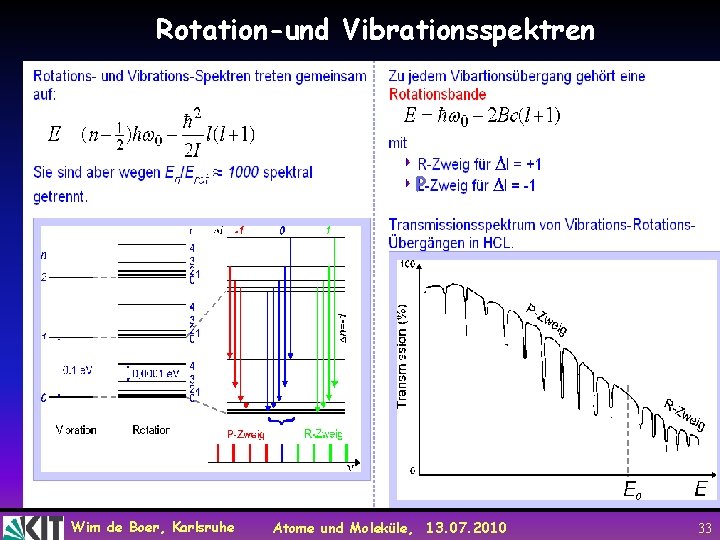
Rotation-und Vibrationsspektren P Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 33

Rotations-Schwingungspektroskopie Wichtigste Auswahlregeln bei der Rotations. Schwingungsspektroskopie: n= 1 für Schwingungen l= 1, 0 für Rotationen Wim de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 34

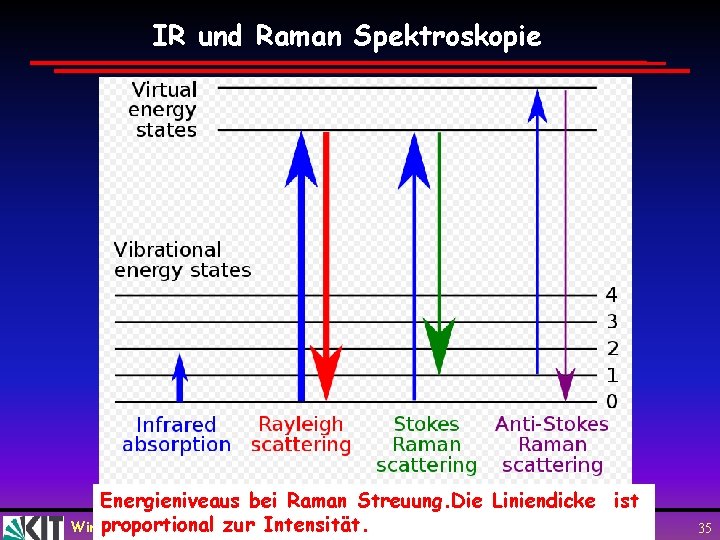
IR und Raman Spektroskopie Energieniveaus bei Raman Streuung. Die Liniendicke ist zur Intensität. Wimproportional de Boer, Karlsruhe Atome und Moleküle, 13. 07. 2010 35
 Der beste vierbeinige freund des menschen ist das bett
Der beste vierbeinige freund des menschen ist das bett Johannes 12 35-36
Johannes 12 35-36 Der zug des lebens original
Der zug des lebens original Quantum imaging with undetected photons
Quantum imaging with undetected photons Do photons have momentum
Do photons have momentum Energy planck's constant
Energy planck's constant Facts of light
Facts of light Photons
Photons Des des des
Des des des Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Heute mittwoch guten morgen mittwoch winter
Heute mittwoch guten morgen mittwoch winter Was ist deine lieblingsjahreszeit
Was ist deine lieblingsjahreszeit Ich habe heute klassendienst
Ich habe heute klassendienst Es ist herbst bunte blätter fliegen
Es ist herbst bunte blätter fliegen Zu glauben ist schwer. nichts zu glauben ist unmöglich
Zu glauben ist schwer. nichts zu glauben ist unmöglich Vorbilder und idole
Vorbilder und idole Fresnel koeffizienten
Fresnel koeffizienten Eigenschaften von erdmännchen
Eigenschaften von erdmännchen Eigenschaften von prisma
Eigenschaften von prisma Salzartige stoffe
Salzartige stoffe Haus der vierecke
Haus der vierecke Höhen inkreis dreieck
Höhen inkreis dreieck Regelmäßiges vieleck konstruieren
Regelmäßiges vieleck konstruieren Potenzfunktionen eigenschaften
Potenzfunktionen eigenschaften Halogenwasserstoffe
Halogenwasserstoffe übergangskinder eigenschaften
übergangskinder eigenschaften Wichtiges gebrauchsmetall
Wichtiges gebrauchsmetall Komplementäre matrix
Komplementäre matrix Magnetit magnetische eigenschaften
Magnetit magnetische eigenschaften Löcherquader
Löcherquader Schnelle fourier transformation
Schnelle fourier transformation Struktur alginat
Struktur alginat Eigenschaften von quantenobjekten
Eigenschaften von quantenobjekten Delbarestivale eigenschaften
Delbarestivale eigenschaften Leuven computer science
Leuven computer science