Dureza das guas 1 2 Definio Dureza de



























- Slides: 28

Dureza das Águas 1. 2. Definição: Dureza de uma amostra de água é a medida da sua capacidade de precipitar sabão, devido à presença de cátions como o cálcio e o magnésio, principalmente, além de outros como alumínio, zinco, ferro, hidrogênio, estrôncio, associados à ânions como carbonatos (e bicarbonatos) e sulfatos, além de outros como boratos, silicatos e fosfatos. Principais compostos: Bicarbonato de Cálcio Ca(HCO 3)2, Bicarbonato de Magnésio Mg(HCO 3)2, Sulfato de Cálcio, Ca. SO 4 e Sulfato de Magnésio, Mg. SO 4.

Dureza das Águas 2. Fonte Principal de Dureza nas Águas: Dissolução do calcáreo do solo pelo gás carbônico da água: Ca. CO 3 + H 2 O + CO 2 Ca(HCO 3)2 3. Graus de Dureza: mg Ca. CO 3 / 0 - 75 75 - 150 L 300 Grau de Brand Moderad Dura Dureza a a-mente dura > 300 Muito dura

Dureza das Águas 4. Importância nos Estudos de Controle de Qualidade das Águas: n Abastecimento Público de Água: Consumo excessivo de sabão, possibilidade de desenvolvimento de cálculo renal. n Abastecimento Industrial: Incrustações em sistemas de água quente como tubulações, caldeiras e trocadores de calor (precipitação de carbonatos).

Dureza das Águas 5. Classificação da Dureza: a) Quanto ao Cátion: - Dureza ao Cálcio - Dureza ao Magnésio - Dureza Total = Dureza ao Cálcio + Dureza ao Magnésio b) Quanto ao nion associado: - Dureza Temporária: Carbonato (e Bicarbonato) - Dureza Permanente: Sulfato - Dureza Total = Dureza Temporária + Dureza Permanente 6. Relação Alcalinidade e Dureza: A dureza temporária é correspondente à alcalinidade de bicarbonato.

Dureza das Águas 7. Determinação da Dureza: n Titulometria com EDTA (Complexometria) n Espectrofotometria de Absorção Atômica (medidas diretas de concentrações de cálcio e magnésio na amostra). 8. Remoção de Dureza (Abrandamento da Água) n Precipitação Química: Processo da Cal, Ca(OH)2 e Soda, Na 2 CO 3 n Troca Iônica: Minerais naturais (zeólitos), Resinas orgânicas sintéticas

Sulfato em Águas (SO 4)21. Fontes de Sulfatos nas Águas Naturais n Solo: A maioria dos sulfatos é bastante solúvel em água. n Efluentes Industriais: celulose e papel, químicas, etc. n Águas de drenagem de áreas agrícolas 2. Importância nos Estudos de Controle de Qualidade das Águas n Abastecimento Público de Água: Efeitos laxativos. Portaria 518 do MS: VMP = 250 mg/L n Corrosão em estruturas hidráulicas n Corrosão, toxicidade e maus odores em sistemas de esgotos sanitários n Inibição às metanobactérias e competição pelo substrato 1.

Sulfato em Águas Formação de acidez mineral em coletores de esgotos H 2 S + 2 O 2 H 2 0 (umidade) H 2 SO 4 O 2 O 2 H 2 S SO 4 S-2 Condições anaeróbias

Sulfato em Águas Turbidez (UNT) 3. Determinação Analítica n Método do Cloreto de Bário (Turbidimetria) n Ba. Cl 2 + SO 42 - + Solução condicionante Ba. SO 4 n Padrão: Na 2 SO 4 mg SO 4 / L

Sulfato em Águas 4. Remoção de Sulfato: Íon bastante solúvel em água, removível apenas por processos especiais de tratamento como: n Troca Iônica n Osmose Reversa

Cloreto (Cl-) em Águas 1. Fonte de Cloreto nas Águas Naturais n Esgoto Sanitário: 6 g. Cl-/pessoa/dia n Efluentes Industriais: Indústria Química, Petroquímica, Farmacêuticas, Curtumes, etc. n Regiões Litorâneas: Intrusão da Lingua Salina 2. Importância no Controle de Qualidade das Águas n Sabor salgado. Padrão de Potabilidade. Portaria 518 MS: 250 mg/L. n Corrosão em Estruturas Hidráulicas. n Inibição em processos anaeróbios de trat. de efluentes. n Interferência na análise de DQO. n Indicador da presença de esgotos nas águas naturais. 1.

Cloreto em Águas 3. Determinação Analítica n Titulação com Nitrato de Prata (Argentometria–Método de Mohr) Ag. NO 3 + Clprata) Ag. NO 3 + Cr. O 4 -2 Ag. Cl (Precipitação do cloreto de Ag 2 Cr. O 4 (Indicador: K 2 Cr. O 4) 4. Remoção de Cloreto (Dessalinização da Água) n Destilação (solar) n Troca Iônica n Osmose Reversa

Ferro em Águas 1. 1. Fontes de Ferro nas Águas Naturais n Solo: Solubilização do minério pelo gás carbônico da água: Feo + CO 2 + ½ O 2 Fe. CO 3 (águas subterrâneas) Águas superficiais: Chuvas, processos erosivos. n Efluentes industriais: Galvanoplastias (decapagem). 2. Estados de Oxidação: n Fe 2+ (mais solúvel) n Fe 3+ (menos solúvel) 3. Importância nos estudos de Controle de Qualidade das Águas n Desenvolvimento de sabor e cor nas águas. Padrão de Potabilidade. Portaria 518 MS: 0, 3 mg/L.

Ferro em Águas n n n Formação de incrustações (tubérculos) em canalizações. Ação indireta: Desenvolvimento de ferro-bactérias. Dificuldades na coagulação e floculação de águas. Padrão de emissão de esgotos na rede coletora (SP). Decreto 8468 Artigo 19 -A: Ferro solúvel: 15 mg/L. Tratamento de esgotos: Nutriente importante, estruturador de grânulos, flocos e biofilmes. 4. Determinação Analítica n Colorimetria: Método da 1, 10 Ortofenantrolina (reação com Fe 2+ na presença de acetato de amônia formando complexo avermelhado). Ferro Total: Redução Fe 3+ Fe 2+ com hidroxilamina em meio ácido seguida da colorimetria.

Ferro em Águas Fundamentos da Espectrofotometria: Lei de Beer – Lambert Transmitância (T) Absorbância (A): A = Log (1/T) Padrão: Sulfato Ferroso Amoniacal, Fe(NH 4)2(SO 4)2 Absorbância n mg Fe / L

Ferro em Águas 5. Remoção de Ferro n Oxidação Fe 2+ Fe 3+ seguida de Precipitação do n Agentes Oxidantes: O 2 (aeração – aeradores de tabuleiros, de cascata, bocais de aeração, difusores, etc. ) Cloro, Peróxido de Hidrogênio (H 2 O 2), Ozonização (O 3), etc.

Metais Pesados em Águas 1. Definição: Metais pesados são elementos químicos que apresentam número atômico superior a 22. Também podem ser definidos por sua singular propriedade de serem precipitados por sulfetos. Entretanto, a definição mais difundida é aquela relacionada com a saúde pública: metais pesados são aqueles que apresentam efeitos adversos à saúde humana. 2. Fontes de metais pesados nas águas naturais Efluentes Industriais: Indústrias extrativistas de metais, indústrias de tintas e pigmentos, galvanoplastias, indústrias químicas, indústrias de couros, peles e produtos similares, indústrias do ferro e do aço, lavanderias e indústria de petróleo.

Metais pesados em Águas 3. Importância nos estudos de controle de qualidade das águas Os metais pesados constituem contaminantes químicos nas águas, pois em pequenas concentrações trazem efeitos adversos à saúde. Desta forma, podem inviabilizar os sistemas públicos de água, uma vez que as estações de tratamento convencionais não os removem eficientemente e os tratamentos especiais necessários são muito caros. Os metais pesados constituem-se em padrões de potabilidade estabelecidos pela Portaria 518 do Ministério da Saúde. Devido aos prejuízos que, na qualidade de tóxicos, podem causar aos ecossistemas aquáticos naturais ou de sistemas de tratamento biológico de esgotos, são também padrões de classificação das águas naturais e de emissão de esgotos, tanto na legislação federal quanto no Estado de São Paulo.

Metais Pesados Nas águas naturais, os metais podem se apresentar na forma de íons hidratados de complexos estáveis (como os formados com ácido húmico e fúlvico), de partículas inorgânicas formando precipitados (como os precipitados de hidróxidos e sulfetos metálicos), podem ser absorvidos em partículas em suspensão que se mantêm na massa líquida, ou se misturam nos sedimentos do fundo. Podem também ser incorporados por organismos vivos. As águas que recebem efluentes contendo metais pesados apresentam concentrações elevadas destes no sedimento de fundo. Quando lamas insolúveis contendo metais são lançadas em grandes quantidades, estes podem sofrer transformações químicas inclusive sob ações biológicas, sendo lançados lentamente na corrente líquida.

Metais Pesados em Águas a) Chumbo em águas O chumbo está presente no ar, no tabaco, nas bebidas e nos alimentos, nestes últimos, naturalmente, por contaminação e na embalagem. Está presente na água devido às descargas de efluentes industriais como, por exemplo, os efluentes das indústrias de acumuladores (baterias), bem como devido ao uso indevido de tintas e tubulações e acessórios à base de chumbo. Constitui veneno cumulativo, provocando um envenenamento crônico chamado saturnismo, que consiste em efeito sobre o sistema nervoso central, com consequências bastante sérias. O chumbo é padrão de potabilidade, sendo fixado o valor máximo de 0, 01 mg/L pela Portaria 518 do Ministério da Saúde. É tóxico aos peixes, moluscos e crustáceos (0, 1 a 0, 4 mg/L).

Metais Pesados em Águas b) Bário Sais de bário são utilizados industrialmente na elaboração de cores, fogos de artifício, fabricação de vidro, inseticidas, etc. O bário pode ocorrer naturalmente na água, na forma de carbonatos em algumas fontes naturais. Decorre principalmente das atividades industriais e da extração da bauxita. Não possui efeito cumulativo, sendo que a dose fatal para o homem é considerada de 550 a 600 mg. Provoca efeitos no coração, constrição dos vasos sanguíneos elevando a pressão arterial e efeitos sobre o sistema nervoso. O padrão de potabilidade estabelecido pela Portaria 518 do Ministério da Saúde é 0, 7 mg/L.

Metais Pesados em Águas c) Cádmio O cádmio se apresenta nas águas naturais devido às descargas de efluentes industriais, principalmente as galvanoplastias. Apresenta efeito agudo, sendo que uma ínica dose de 9 g pode levar à morte e efeito crônico, concentrando-se nos rins, no fígado, no pâncreas e na tireóide. O padrão de potabilidade fixado pela Portaria 518 é de 0, 005 mg/L. No Japão, um aumento na concentração de cádmio de 0, 005 a 0, 18 mg/L provocado por uma mina de zinco, causou uma doença conhecida por “Itai-Itai”.

Metais pesados em Águas d) Arsênio Traços deste metalóide são encontrados em águas naturais e fontes termais. É usado como inseticida, herbicida, fungicida, na indústria da preservação da madeira e em atividades relacionadas com a mineração e com o uso industrial de certos tipos de vidros, tintas e corantes. É encontrado em verduras e frutas. Em moluscos, concentra-se até 100 mg/kg, sendo que a ingestão de 130 mg é fatal. Apresenta efeito cumulativo, sendo carcinogênico. O padrão de potabilidade é 0, 01 mg/L, estabelecido pela Portaria 518.

Metais Pesados em Águas e) Selênio Este não metal se apresenta nas águas devido às descargas de efluentes industriais. É tóxico tanto para os homens quanto para os animais. Provoca a chamada “Doença Alcalina” no gado, cujos efeitos são permanentes. Aumenta a incidência de cáries dentária e suspeita-se que seja potencialmente carcinogênico, de acordo com ensaios feitos em cobaias. O padrão de potabilidade é 0, 01 mg/L (Portaria 518)

Metais Pesados em Águas f) Cromo Hexavalente O cromo é largamente empregado nas indústrias, especialmente em galvanoplastias, onde a cromeação é um dos revestimentos de peças mais comuns. Pode ocorrer como contaminante de águas sujeitas a lançamento de efluentes de curtumes e de circulação de águas de refrigeração, onde é utilizado para controle da corrosão. A forma hexavalente é mais tóxica que a trivalente. Produz efeitos corrosivos no aparelho digestivo e nefrite. O padrão de potabilidade fixado pela Portaria 518 é 0, 05 mg/L.

Metais Pesados em Águas g) Mercúrio O mercúrio é largamente utilizado no Brasil nos garimpos, no processo de extração do ouro (amálgama). É também usado nas células eletrolíticas para a produção de cloro e soda e em certos praguicidas. Pode ser usado ainda em indústrias de produtos medicinais, desinfetantes e pigmentos. É altamente tóxico ao homem, sendo que doses de 3 a 30 gramas são fatais. Apresenta efeito cumulativo e provoca lesões cerebrais. Em Minamata no Japão, grande quantidade de metil mercúrio foi lançada na baía, contaminando peixes e habitantes da região, provocando graves lesões neurológicas e mortes. O padrão de potabilidade fixado pela portaria 518 é de 0, 001 mg/L.

Metais Pesados em Águas 4. Determinação Analítica O método mais usual para a determinação de metais pesados em amostras de água é a espectrofotometria de absorção atômica por chama, com pré-tratamento das amostras, que consiste em uma digestão química para a remoção de matéria orgânica. Nesta digestão são empregadas misturas de ácidos, como sulfúrico e nítrico, nítrico e clorídrico ou nítrico e perclórico. Recentemente, tem-se recomendado a pré-digestão das amostras com o emprego de microondas, uma vez que a digestão ácida não remove totalmente a matéria orgânica e provoca a perda de metais por volatilização. A absorção atômica com forno de grafite é, provavelmente, um dos mais sensíveis métodos capaz de determinar elementos na faixa de picogramas (10 -12 gramas). Em muitos casos, evitase o pré-tratamento da amostra, eliminando-se os problemas de contaminação provenientes dessa fase.

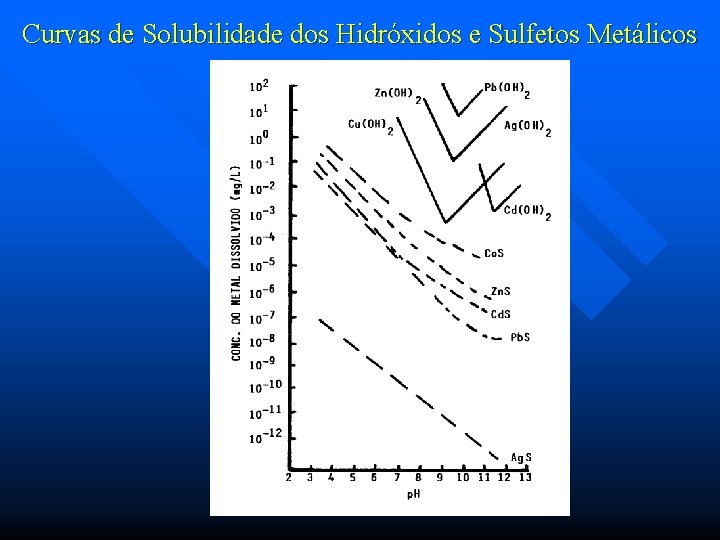
5. Remoção de metais pesados das águas n Troca - Iônica: O processo mais eficiente para a remoção de metais pesados é o que se baseia no fenômeno de troca iônica, empregando-se resinas catiônicas em sua forma primitiva de hidrogênio ou na forma sódica. Este processo permite uma remoção percentual bastante significativa dos metais presentes na água, viabilizando seu uso para finalidades industriais específicas e permitindo também o reuso de efluentes industriais. n No campo do tratamento de efluentes, o processo mais utilizado é o da precipitação química na forma de hidróxidos metálicos. Estes precipitam em faixas de p. H diferentes. O processo alternativo de precipitação de metais pesados na forma de sulfetos metálicos é mais eficiente, mas há o problema em se trabalhar com um produto tóxico.

Curvas de Solubilidade dos Hidróxidos e Sulfetos Metálicos
 Oxidos basicos
Oxidos basicos Cuáles son los materiales que no tienen forma ni dureza
Cuáles son los materiales que no tienen forma ni dureza Dureza total fórmula
Dureza total fórmula Tipos.de ensayo
Tipos.de ensayo Dureza brinell
Dureza brinell Dureza magnésica
Dureza magnésica Espero se encuentren bien al igual que su familia
Espero se encuentren bien al igual que su familia Dureza água por municípios
Dureza água por municípios Dureza rosiwal
Dureza rosiwal Propiedades extensivas
Propiedades extensivas 3mohs
3mohs Mosh escala
Mosh escala Dureza ortosa
Dureza ortosa Reflexões do poeta canto v
Reflexões do poeta canto v Das alte ist vergangen das neue angefangen
Das alte ist vergangen das neue angefangen Das alles ist deutschland das alles sind wir
Das alles ist deutschland das alles sind wir Eu vivo da pureza da resposta
Eu vivo da pureza da resposta Jesus ich bin das licht der welt
Jesus ich bin das licht der welt Revolução gloriosa resumo
Revolução gloriosa resumo Das göttliche interpretation
Das göttliche interpretation Mecanismo chave fechadura
Mecanismo chave fechadura Retrato físico e psicológico 4.o ano
Retrato físico e psicológico 4.o ano Qumica
Qumica Dias de la semana en ingles
Dias de la semana en ingles Chiavenato estilos de liderança
Chiavenato estilos de liderança Wer erfand 1887 das grammophon
Wer erfand 1887 das grammophon Apoenzima
Apoenzima Das ist der daumen der pflückt die pflaumen
Das ist der daumen der pflückt die pflaumen Das vorgangspassiv
Das vorgangspassiv