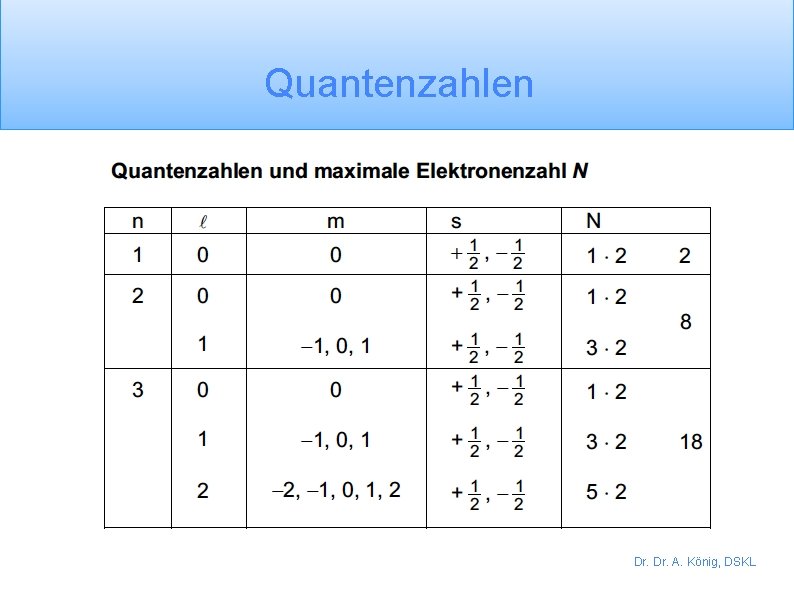
Dr A Knig DSKL Quantenzahlen Dr A Knig





- Slides: 21

Dr. A. König, DSKL

Quantenzahlen Dr. A. König, DSKL

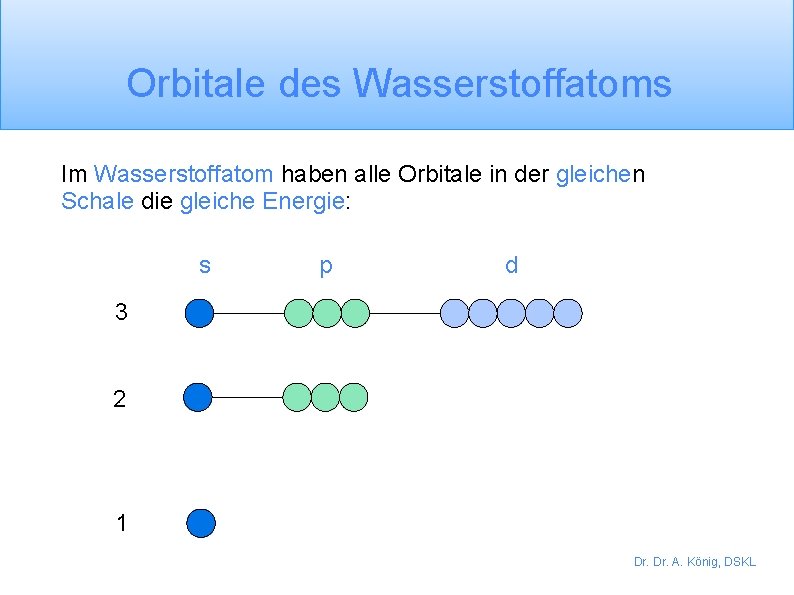
Orbitale des Wasserstoffatoms Im Wasserstoffatom haben alle Orbitale in der gleichen Schale die gleiche Energie: s p d 3 2 1 Dr. A. König, DSKL

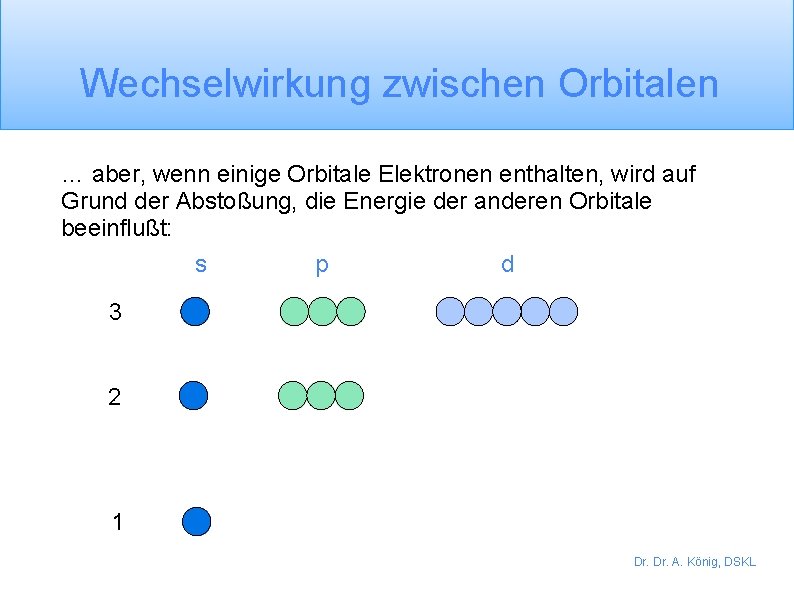
Wechselwirkung zwischen Orbitalen … aber, wenn einige Orbitale Elektronen enthalten, wird auf Grund der Abstoßung, die Energie der anderen Orbitale beeinflußt: p d s 3 2 1 Dr. A. König, DSKL

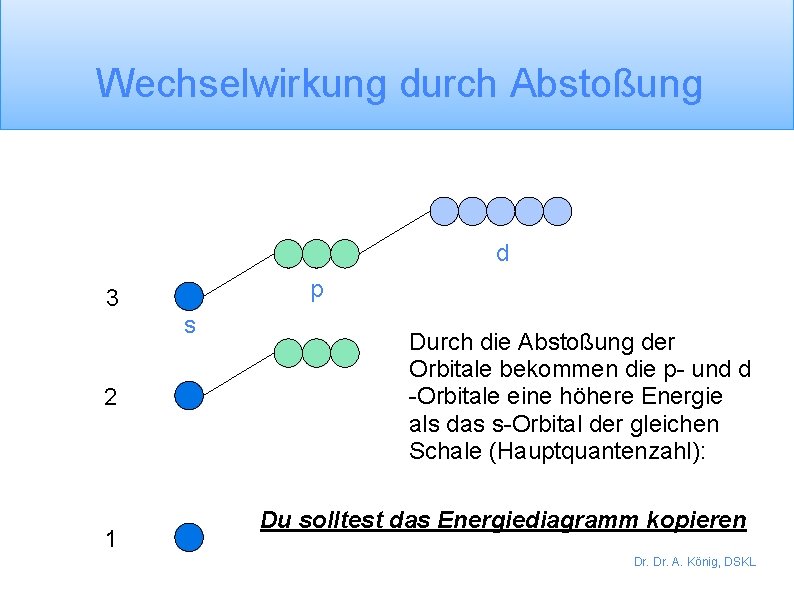
Wechselwirkung durch Abstoßung d p 3 s 2 1 Durch die Abstoßung der Orbitale bekommen die p- und d -Orbitale eine höhere Energie als das s-Orbital der gleichen Schale (Hauptquantenzahl): Du solltest das Energiediagramm kopieren Dr. A. König, DSKL

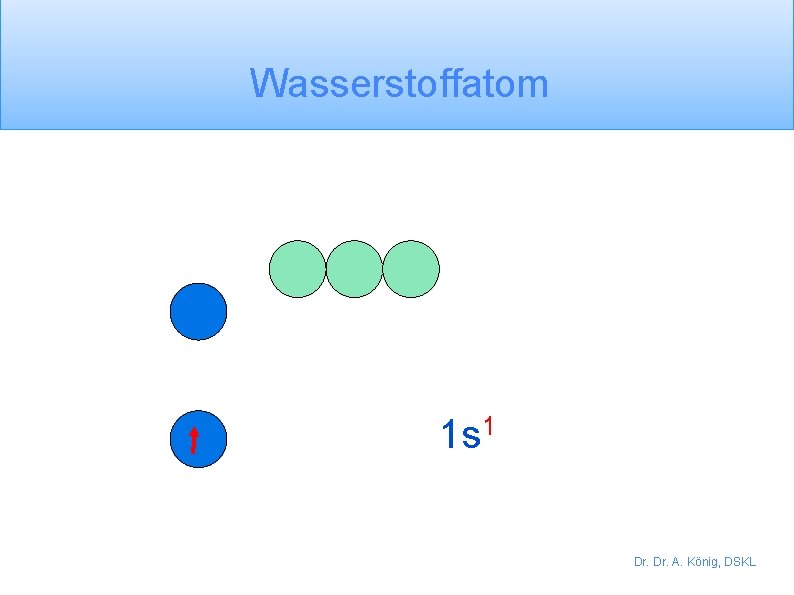
Wasserstoffatom 1 s 1 Dr. A. König, DSKL

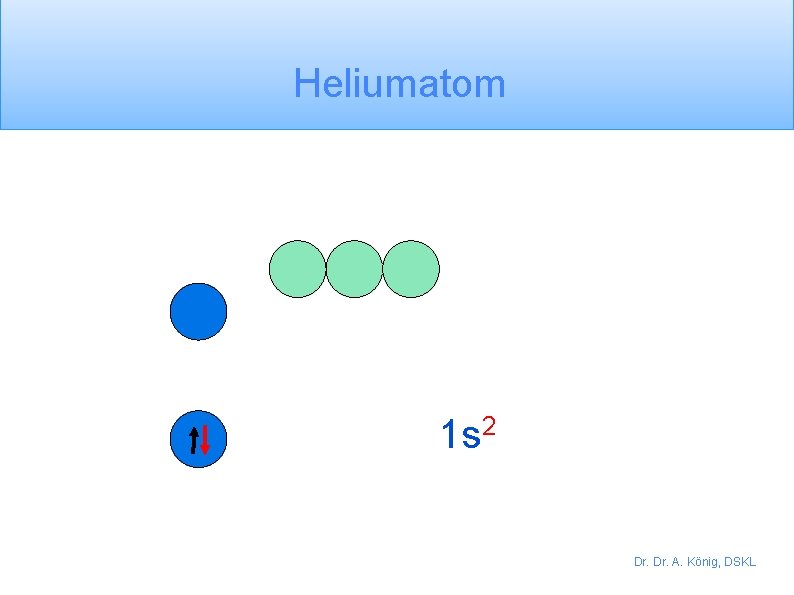
Heliumatom 1 s 2 Dr. A. König, DSKL

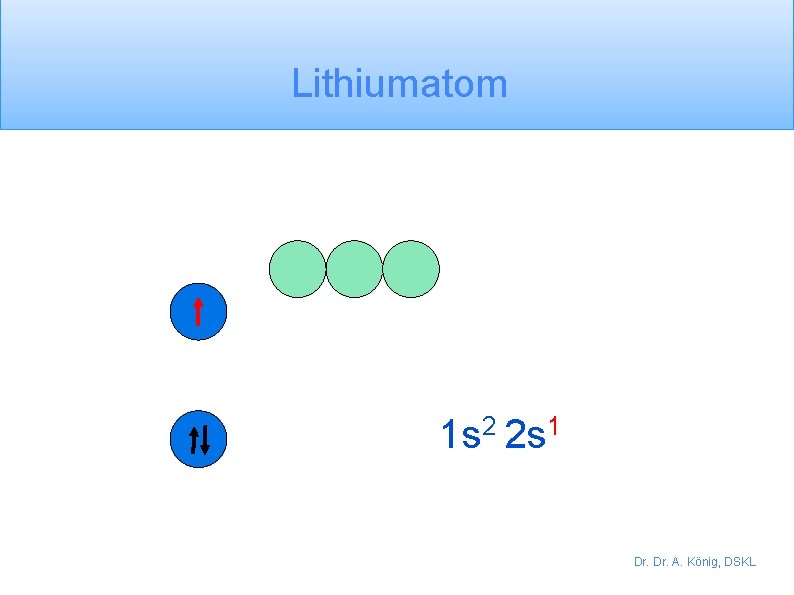
Lithiumatom 1 s 2 2 s 1 Dr. A. König, DSKL

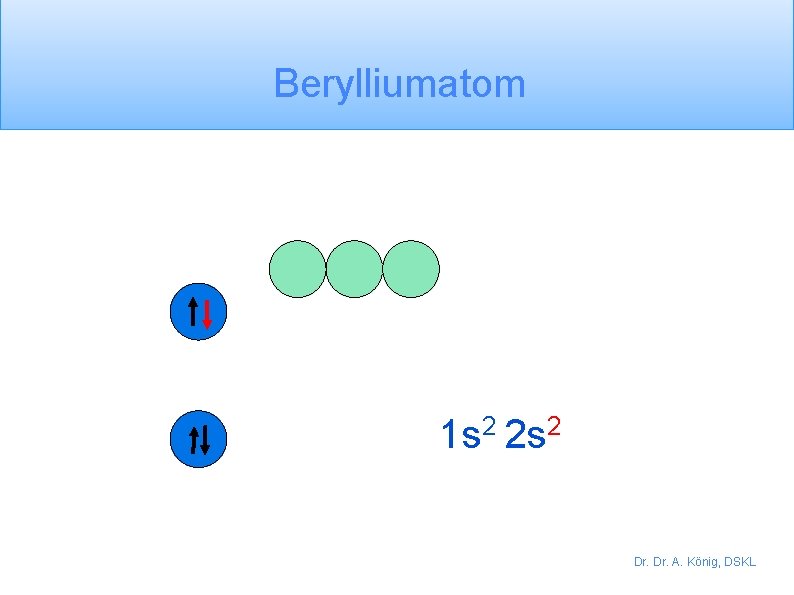
Berylliumatom 1 s 2 2 s 2 Dr. A. König, DSKL

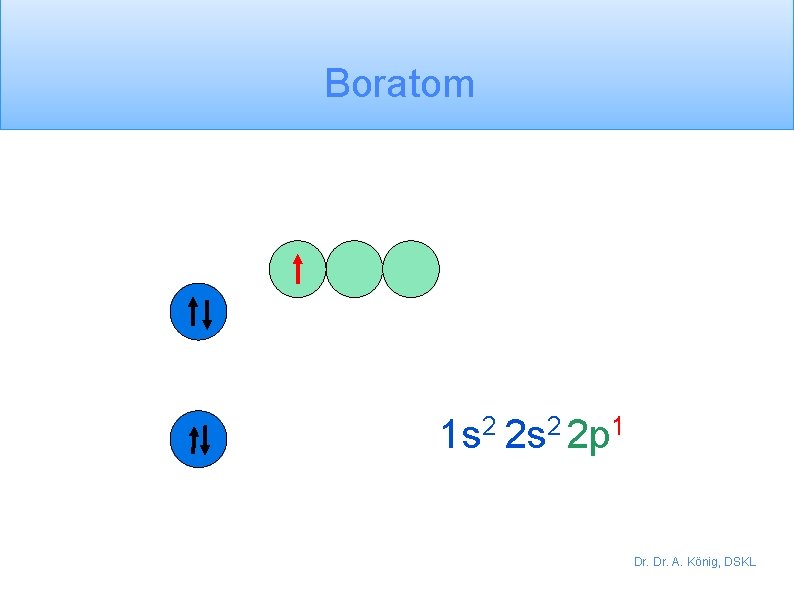
Boratom 1 s 2 2 p 1 Dr. A. König, DSKL

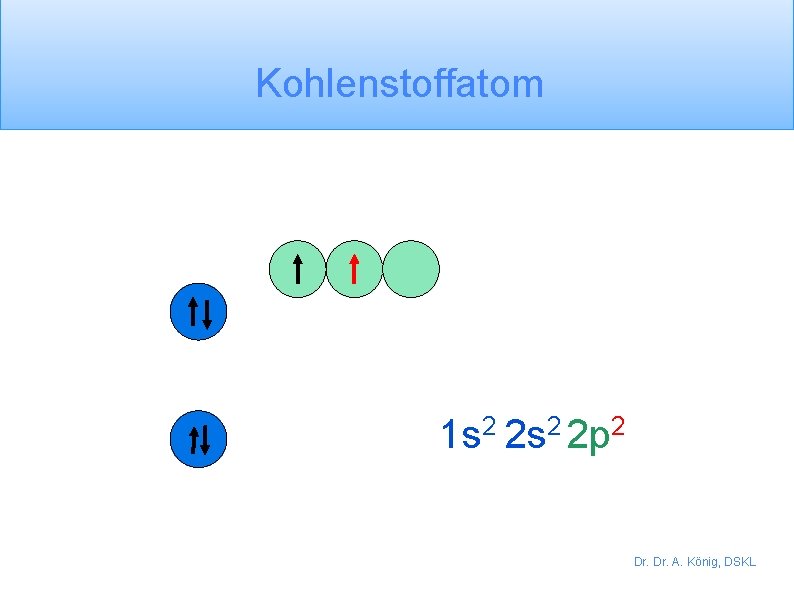
Kohlenstoffatom 1 s 2 2 p 2 Dr. A. König, DSKL

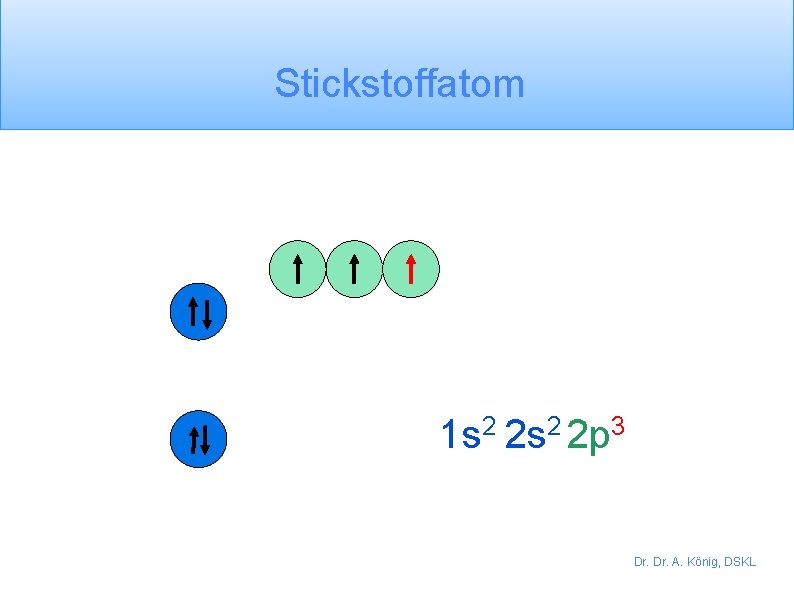
Stickstoffatom 1 s 2 2 p 3 Dr. A. König, DSKL

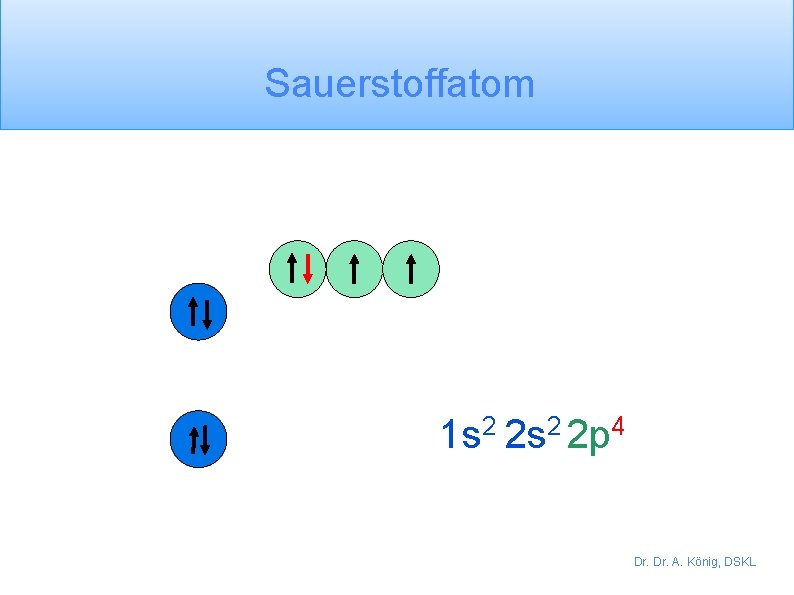
Sauerstoffatom 1 s 2 2 p 4 Dr. A. König, DSKL

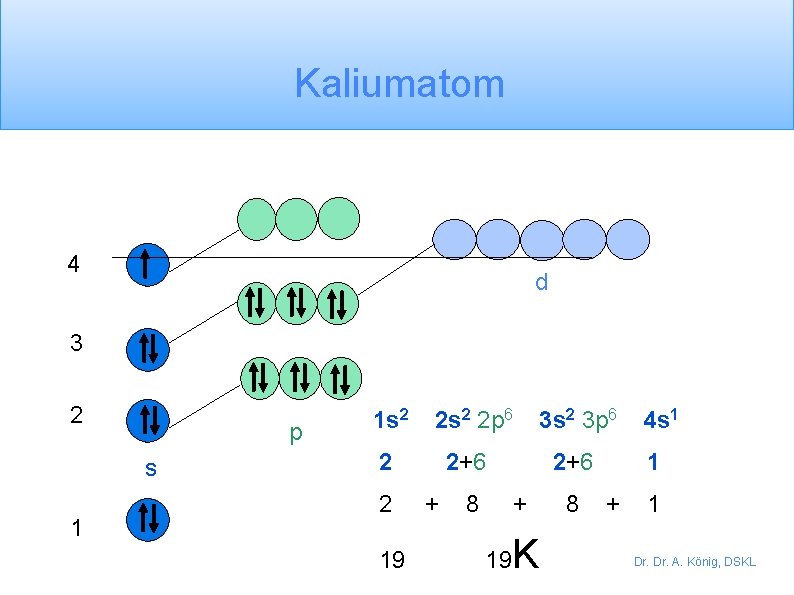
Übung zur Elektronenkonfiguration Schreibe die Elektronenkonfiguration der folgenden Elemente: Neonatom (z = 10) 1 s 2 2 p 6 Natriumatom (z = 11) 1 s 2 2 p 6 3 s 1 Siliziumatom (z = 14) 1 s 2 2 p 6 3 s 2 3 p 2 Kaliumatom (z = 19) 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 Dr. A. König, DSKL

Fehlerquellen - misconception Du hast möglicherweise das letzte Elektron des Kaliumatoms in das 3 d Orbital geschrieben 1 s 2 2 p 6 3 s 2 3 p 6 3 d 1 aber das Kaliumatom hat eine vergleichbare Elektronenanordnung wie das Natriumatom, so dass das letzte Elektron in einem s-Orbital ist Na K 1 s 2 2 p 6 3 s 1 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 Die Erklärung dafür ist, dass der Anstieg der Energie der 3 d-Orbitale das Elektron in das niedrigere Niveau 4 s leitet. Dr. A. König, DSKL

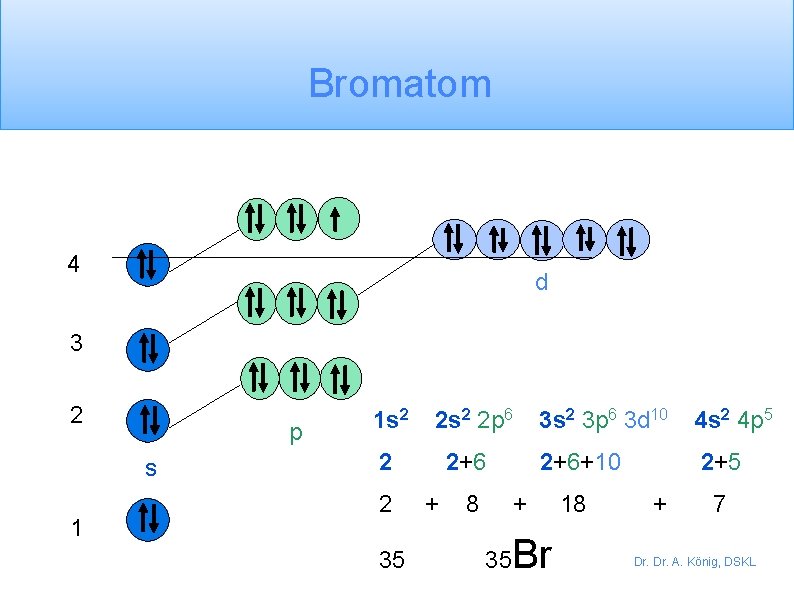
Dies erklärt die seltsame Serie von Längen der Perioden im Periodensystem: 2, 8, 8, 18 , wenn nach BOHR die maximale Anzahl von Elektronen pro Schale (2 n 2) 2, 8, 18, 36 ist. Brom ist z. B. das 35. Element im Periodensystem (PSE) und hat nur 7 Aussenelektronen. Wie kommt das? Dr. A. König, DSKL

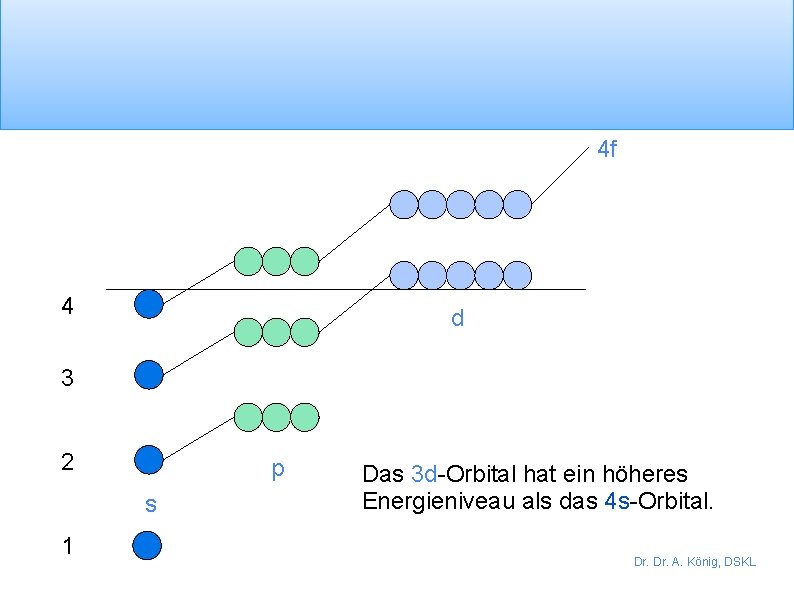
4 f 4 d 3 2 p s 1 Das 3 d-Orbital hat ein höheres Energieniveau als das 4 s-Orbital. Dr. A. König, DSKL

Kaliumatom 4 d 3 2 p s 1 1 s 2 2 p 6 2 2 19 2+6 + 8 2+6 + 19 3 s 2 3 p 6 K 8 4 s 1 1 + 1 Dr. A. König, DSKL

Bromatom 4 d 3 2 p s 1 1 s 2 2 p 6 2 2 35 2+6 + 8 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5 2+6+10 2+5 + 35 Br 18 + 7 Dr. A. König, DSKL

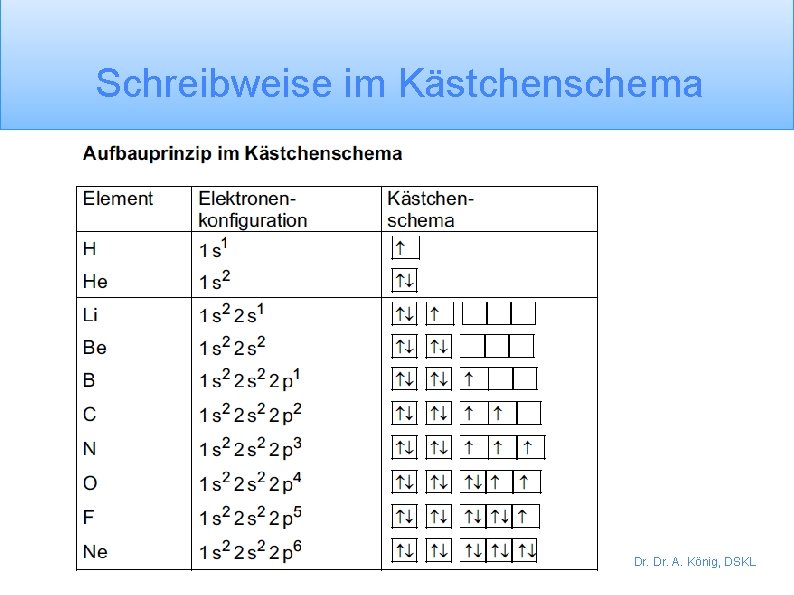
Schreibweise im Kästchenschema Dr. A. König, DSKL

Ende Dr. A. König, DSKL