Dissolution I Dfinitions Une solution est obtenue par
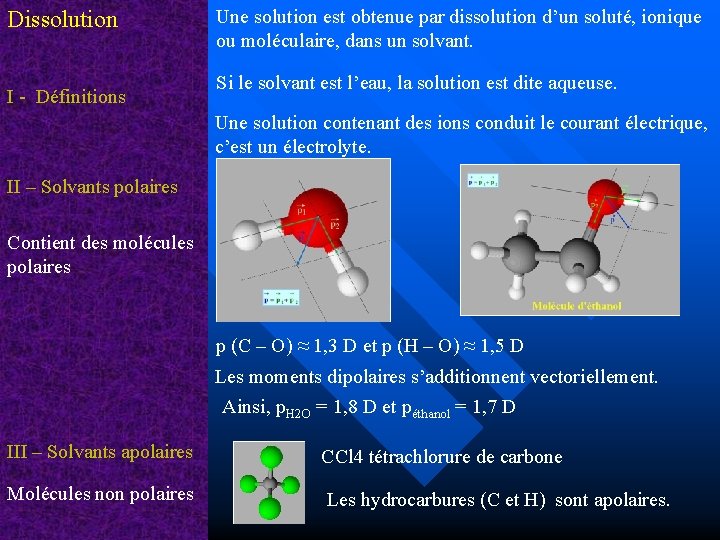
Dissolution I - Définitions Une solution est obtenue par dissolution d’un soluté, ionique ou moléculaire, dans un solvant. Si le solvant est l’eau, la solution est dite aqueuse. Une solution contenant des ions conduit le courant électrique, c’est un électrolyte. II – Solvants polaires Contient des molécules polaires p (C – O) ≈ 1, 3 D et p (H – O) ≈ 1, 5 D Les moments dipolaires s’additionnent vectoriellement. Ainsi, p. H 2 O = 1, 8 D et péthanol = 1, 7 D III – Solvants apolaires CCl 4 tétrachlorure de carbone Molécules non polaires Les hydrocarbures (C et H) sont apolaires.

Dissolution IV – Mécanisme de la dissolution 1 - Dissociation du solide ionique (forces opposées sur cations et anions) 2 - Hydratation des ions, on dit que les ions sont solvatés: 3 - Dispersion des ions. Les composés ioniques se dissolvent relativement bien dans des solvants polaires (Na. Cl dans H 2 O). Les composés polaires sont très solubles dans les solvants polaires (interaction dipôle-dipôle de Van der Waals). La solubilité augmente si des liaisons hydrogène peuvent se former (ex: l’éthanol dans l’eau). Les composés apolaires se dissolvent généralement dans des solvants apolaires (cyclohexane dans tétrachlorure de carbone).

Dissolution V – Equations chimiques et concentrations L’équation doit être équilibrée, c’est-à-dire respecter la conservation des éléments chimiques et de la charge électrique. Na. Cl (s) Co. Cl 2(s) eau → Na+(aq) + Cl-(aq) eau → Co 2+(aq) + 2 Cl-(aq) Concentration molaire en soluté apporté: Unités? Concentration molaire des ions: il faut voir l’équation de dissolution, par exemple: Fe. Cl 3(s) → Fe 3+(aq) + 3 Cl-(aq) [Fe 3+] = C(S) et [Cl-] = 3 C(S)

- Slides: 4