DISEO E IMPLEMENTACION DE UN PROCESO SEGURO DE




















- Slides: 29

DISEÑO E IMPLEMENTACION DE UN PROCESO SEGURO DE TRAZABILIDAD EN EL REUSO DE PRODUCTOS MEDICOS

Farm. María Gabriela Fraschetti Jefa de Farmacia – Área de Internación HOSPITALIANO DE BUENOS AIRES ACREDITADO POR JOINT COMMISSION INTERNATIONAL

INTRODUCCION • En la Argentina el Uso y Re-Uso de dispositivos médicos de uso único se encuentra reglamentado por la resolución Ministerial 255/94. • El Hospital Italiano desarrollo un proceso seguro de trazabilidad en el Re-Uso de Productos Médicos definidos como factibles de reutilizar. • Esto surge de la necesidad de cumplimentar con dicha resolución y ante las faltas frecuentes de disponibilidad de dichos productos en el mercado. • Este proceso es un método estandarizado y controlado, con criterios específicos que permite ofrecer seguridad al paciente y reducir el riesgo de eventos adversos infecciosos y no infecciosos asociados al re-uso.

OBJETIVO Describir el desarrollo del proceso de re uso de productos médicos estériles, de uso único, en el Servicio de Hemodinamia perteneciente a un hospital de alta complejidad, mediante la implementación de un sistema de trazabilidad y el control de los proceso involucrados, dentro del marco del la legislación local.

EQUIPO MULTIDISCIPLINARIO • Comité en Control de Infecciones • Servicio de Esterilización • Servicio Farmacia Internación • Departamento de Informática en Salud • Gerencia de Planeamiento y Control de Gestión

INSTANCIAS DEL PROYECTO • Se creo un Comité de Re Uso • Se utilizo un diseño centrado en el usuario participativo entre los Servicios involucrados • Se realizo el relevamiento a nivel macro de todo el circuito del Producto Medico • Se genero un software • Se elaboraro una Norma/Politica y un Procedimiento de Re uso de Productos Medicos de un solo Uso • Para la implementación se capacitó a los usuarios de cada sector

CRITERIOS DE ACEPTACION 1. El Servicio solicita al Comité de Re Uso la incorporación del Producto Médico al Proceso de Re Uso. 2. El Comité de Re Uso evalúa la factibilidad y número de re usos. 3. Se evalúa: ü que sean productos contemplados en la Ley 255/94 o similares estructuralmente. ü El proceso de esterilización no altere la funcionalidad del producto. ü Su estructura permita un adecuado lavado y limpieza luego de su uso. ü Análisis costo beneficio ü Disponibilidad en el mercado 4. Una vez aprobado, se incorpora a la Matriz de Productos Médicos de Re Uso del Área involucrada (imagen 1).

MATRIZ DE RE USO (imagen 1)

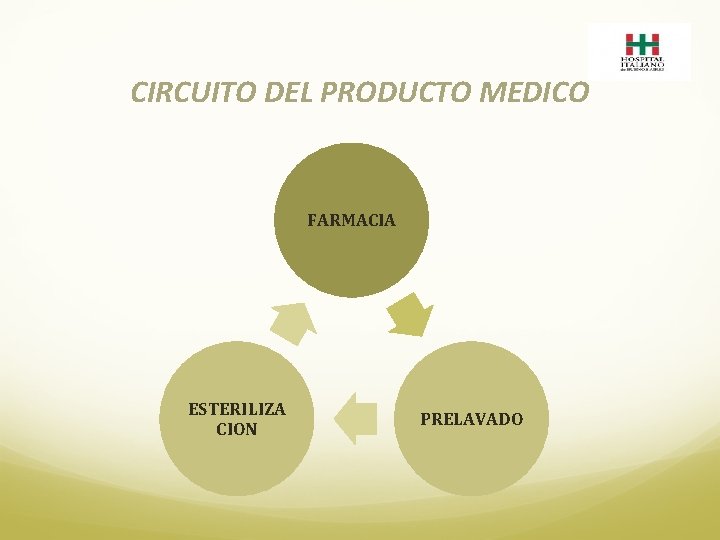
CIRCUITO DEL PRODUCTO MEDICO FARMACIA ESTERILIZA CION PRELAVADO

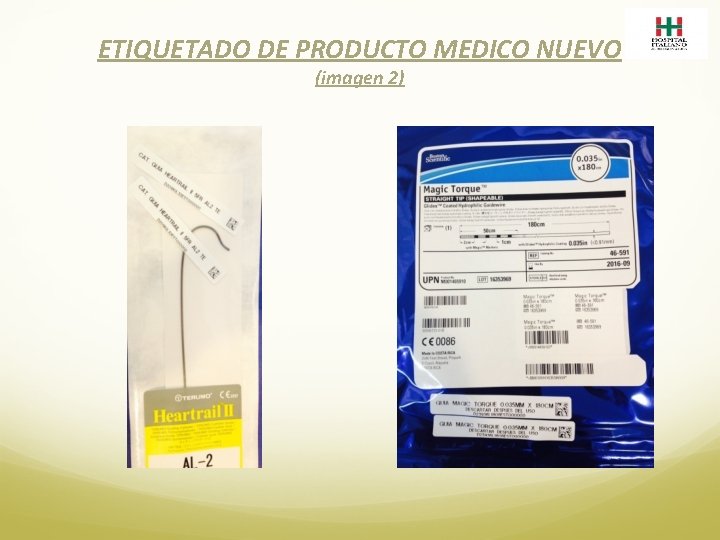
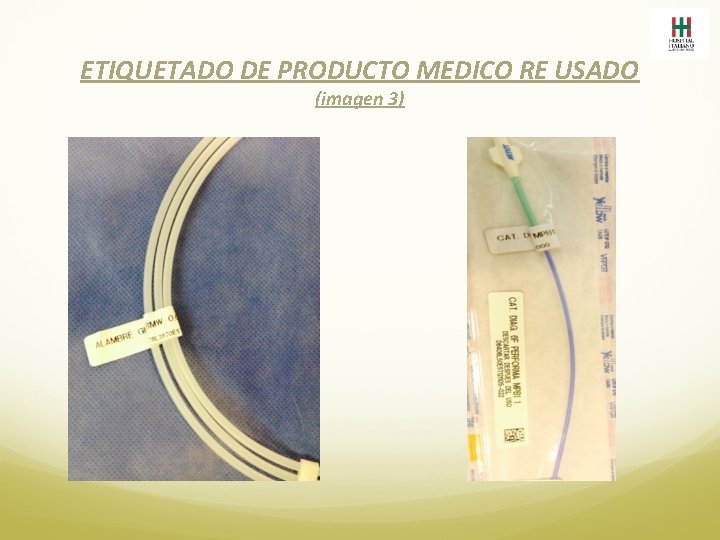
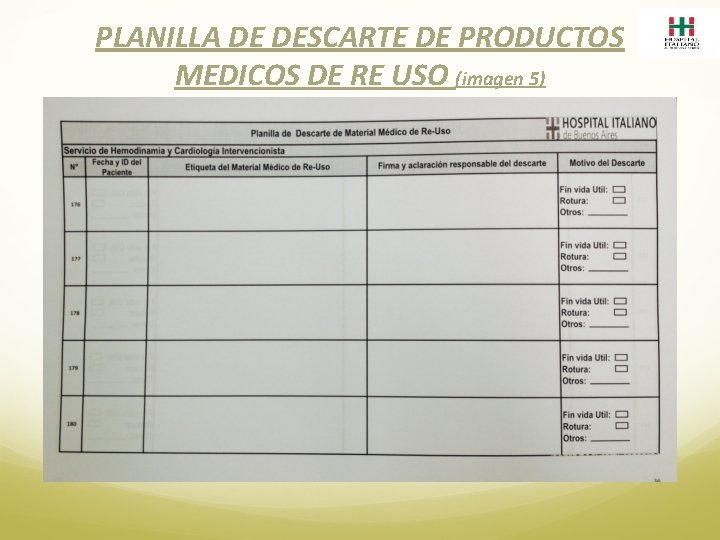
FARMACIA 1. El Producto Medico ingresa a la Farmacia Satélite del Servicio involucrado: o desde el Centro de Distribución por Reposición y/o transferencia (producto nuevo) o desde Esterilización (producto re usado) 2. Verifica lo recepcionado y lo ejecuta en el sistema SAF o de Esterilización según corresponda. 3. El producto llega a Farmacia identificado con dos etiquetas idénticas con un número de lote único (imagen 2 y 3). 4. Se dispensa junto a una Planilla de Etiquetas de Productos Médicos de Re Uso. (imagen 4). 5. Se debita a paciente frente a la presentación de la Planilla de Etiquetas. 6. En caso de no conformidad se registra en Planilla de Descarte de Productos Médicos (imagen 5) y se da de baja en el sistema como tal.

ETIQUETADO DE PRODUCTO MEDICO NUEVO (imagen 2)

ETIQUETADO DE PRODUCTO MEDICO RE USADO (imagen 3)

PLANILLA DE ETIQUETAS DE PRODUCTOS MEDICOS DE REUSO(imagen 4)

PLANILLA DE DESCARTE DE PRODUCTOS MEDICOS DE RE USO (imagen 5)

PRELAVADO 1. Recibe el material usado segregado por paciente con el pouch y etiqueta. 2. Se realiza el Prelavado del material. 3. Se hace un control de calidad de los materiales. 4. Si existe la necesidad de descarte por mal estado del producto o porque cumplió la cantidad de usos permitidos, se informa a la Farmacia del Sector para que lo realice. 5. Etiqueta el material si este lo permite, cuando se trata del primer uso (imagen 3). 6. Genera una solicitud a Esterilización con el código y lote del material, tomando los datos con una lectora de datos. 7. Envía el materia junto a la solicitud a Esterilización.

ESTERILIZACION 1. Recibe los Productos Médicos usados, prelavados e identificados. 2. Verifica contra la planilla electrónica si esta correcto y se ingresa para su proceso de esterilización. 3. Si existiera la necesidad de descarte, lo realiza directamente en el sistema y se llena la planilla de Descarte de Producto Médico (imagen 5) 4. Realiza el proceso de lavado y secado. 5. Verifica el estado de la etiqueta pegada en el material. 6. Realiza el empaque del Producto Médico y fija dos etiquetas nuevas sobre el mismo. 7. Esteriliza el Producto Médico. 8. Registra la entrega del Producto Medico en el Sistema de Esterilización y realiza el envío a la Farmacia del Servicio solicitante.

ESTERILIZACION CONTROL DE INTEGRIDAD Y FUNCIONALIDAD Independientemente de la cantidad de re usos que posean, se deben descartar los dispositivos que presenten algunas de las siguientes características: Ø Ø Ø Ø Ø Alteraciones en su integridad. Cualquier tipo de deterioro: fisuras, fragilidad o puntos débiles. Alteraciones en su funcionalidad. Cambios en su forma. Oxidación (elementos metálicos). Pérdida de integridad en el empaque. Achatamiento. Decoloración. Cambios en la resistencia a la inserción de la cuerda o guía (catéteres). Cambios en la rigidez del cuerpo o flexibilidad de la punta (catéteres).

DEPARTAMENTO DE INFORMATICA EN SALUD 1. Desarrolla el software 1. Capacita a todos los involucrados en el manejo del Sitema en las distintas instancias del Proceso. 1. Brinda soporte técnico permanente las veces que sea necesario. 1. Otorga al comité de Re Uso las herramientas informáticas necesarias para el registro y trazabilidad del Producto Médico.

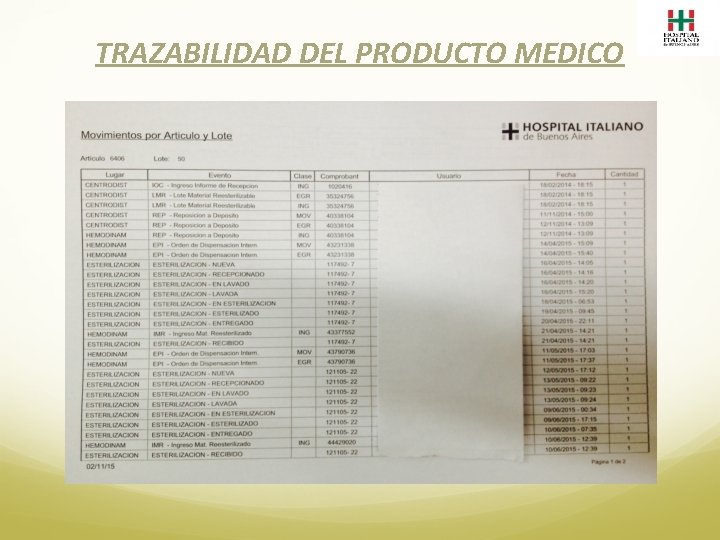
TRAZABILIDAD DEL PRODUCTO MEDICO

COMITÉ DE CONTROL DE INFECCIONES 1. Investiga todos los episodios de infecciones que puedan estar relacionados al Re Uso de Productos Médicos contemplados en el circuito. 2. Se hacen controles semanales: ü Se controlan los pacientes con infección en el sitio quirúrgico y los que tienen hemocultivos positivos. ü Hace una búsqueda en el sistema de Esterilización para ver si dichos pacientes usaron dispositivos de Re Uso. ü En caso de haber usado, se fija que producto fue y que lote. ü Busca la trazabilidad de este Producto para ver si se uso en otro paciente y si este también tuvo un cultivo positivo con el mismo germen. ü En caso de establecerse la asociación de un evento adverso, con el re uso de un Producto Médico de un solo uso en particular, se inicia un análisis, se informa a la Dirección Médica y al Comité de Re Uso para tomar las acciones correspondientes.

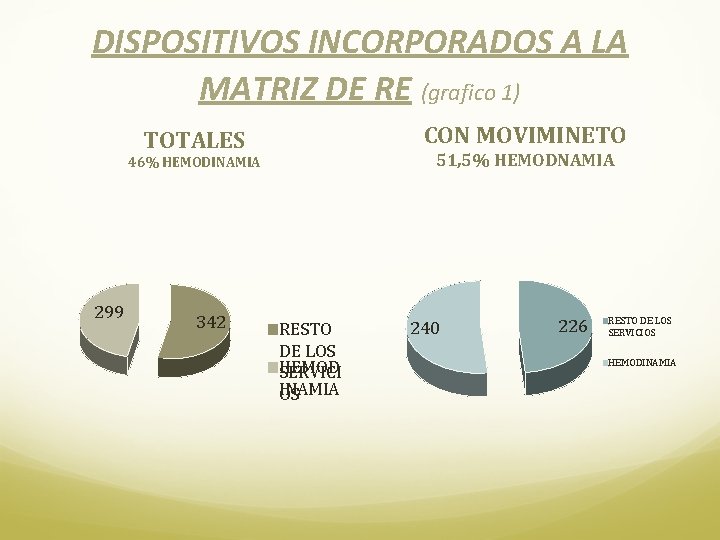
SERVICIO DE HEMODINAMIA • Se realiza una prueba piloto de Diciembre 2013 a Marzo del 2014 • Se conforma una Matriz con los dispositivos seleccionados y se asigna el lugar donde seran etiquetados. (imagen 1) • Se determina un número de re usos máximo permitido de 2. • En una primera etapa se seleccionan 180 dispositivos llegando a tener hoy en la matriz 299. Estos son el 46% de los dispositivos totales, pero solo el 80, 2% de los mismos tienen movimiento. (grafico 1) • Los dispositivos incluidos en el proceso de re uso estaban incluidos dentro de la siguiente clasificación: Ø Catéteres para coronariografia y arteriografía Ø Catéteres intervencionistas sobre arterias coronarias, viscerales, cerebrales o de miembros. Ø Guías metálicas

DISPOSITIVOS INCORPORADOS A LA MATRIZ DE RE (grafico 1) CON MOVIMINETO TOTALES 51, 5% HEMODNAMIA 46% HEMODINAMIA 299 342 RESTO DE LOS HEMOD SERVICI INAMIA OS 240 226 RESTO DE LOS SERVICIOS HEMODINAMIA

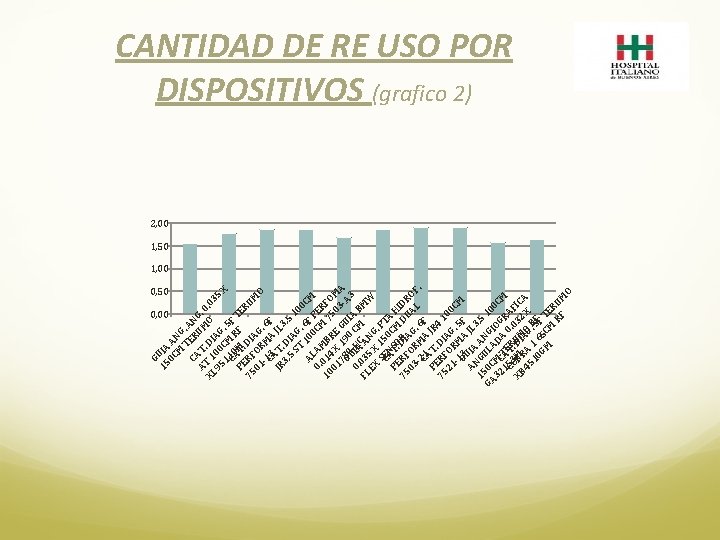
SEGUIMIENTO EN EL TIEMPO SEGUIMIENTO DURANTE DOS AÑOS: • El promedio en el número de re usos por dispositivo es de 1, 60, menor al establecido. Esto puede deberse a la ruptura del material, deterioro o baja por no conformidad (grafico 2). • Comparando el costo de usar 100% dispositivos nuevos con respecto a los re usados, el ahorro promedio mensual fue de $137. 725, considerando los 240 tipos de dispositivos de Hemodinamia que han tenido movimiento en el circuito de re uso.

G 15 UIA 0 C A M NG T. CA ER ANG A T UM. 0 XL T 1. DI O. 03 95 00 AG 5 X 11 CM. 5 CA 0 R F P TM F TER 75 ERF. DI UM 01 OR AG O. -1 M 6 CA 3 A F JR T. JL 3 3, D 5 IA , 5 1 ST G 00. CM AL 100 6 F 0. AM CM PER 10 014 B 7 F 01 X RE 50 OM 78 19 GU 3 - A A G 0 0 I 0. UI-AHC CM A B 3 M FL 035 AN W EX X G SCE 15. PT N 0 A PE AT. SO CM H 75 RF DIR DU IDR 03 OR AG A O -2 M. 6 L F. C 1 A F PE AT. JR 75 RF DI 4 1 21 OR AG 00 -1 M. 5 CM G 3 A F AN UIA JL 3 , 5 1 G A GA 50 C ULA NG 10 32 MC D IOG 0 C 1 C 5 ATTE A 0 RA M 3 R. XB OBMR. DUI M 032 FIC 45 A AGO X A 10 1 6. 5 RF GM 5 C F T M ER RF UM O CANTIDAD DE RE USO POR DISPOSITIVOS (grafico 2) 2, 00 1, 50 1, 00 0, 50 0, 00

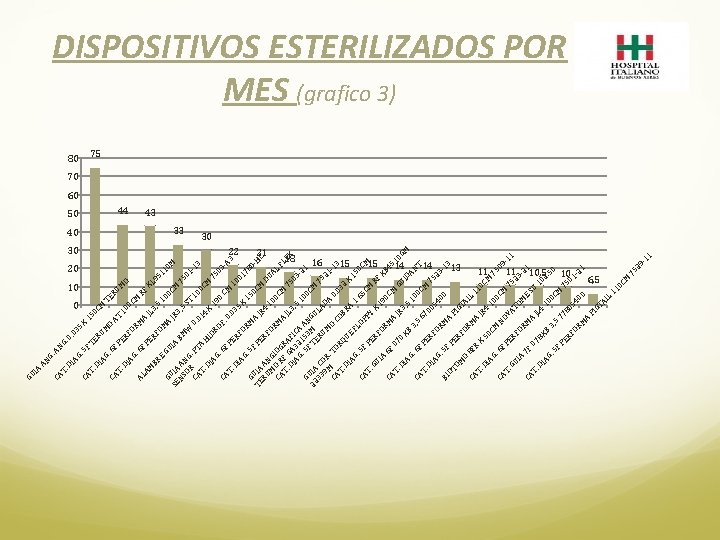
M O M RU TE 0 C 10 M 22 20 PE 44 BR RF JL XL RF 3, 95 5 OM E 11 1 0 GU GU 0 M A 0 C JR IA SE IA M 3, BM NS A 75 5 ST 01 OR NG W. P -1 0. 10 CA TA 3 0 0 C 14 T. HI M DI X D 75 AG 19 RO 03 0. 6 F. CA C -A F M 0. T. PE 3 03 10 DI RF 5 0 AG 17 X OR 15. 5 80 M G F 0 C A -H TE UIA PE JR M C RU AN RF 4 D 10 UA OR M GI 0 O L M CA R OG CM FL A T. F G RA EX JL 75 DI A FI 3 0 , 3 AG 2 CA 5 3 -2 10. 5 15 A 1 G 0 C F 3 M NG 22 UIA TE M UL 33 CO 7 RU AD 52 9 M R M 1 A. T O 0 13 CA OR CO. 0 T. 32 Q B DI UE RA X AG 15 FL 1. 5 0 C 65 O CA F P M C PY T. PE M GU RF RF X 19 IA OR XB 0 C 6 F M CA 45 M A 07 10 T. JR GU 0 DI GM 3 ID XB , 5 AG AN 10 3. 6 F , 5 CA 0 C T 67 T. PE M 00 DI RF 75 54 AG 23 OR 00. 5 -1 M BI F 3 A OT PE P IG OM RF T OR O AI 8 F L M CA 11 R A T. X J 0 C R DI 50 4 M AG 10 CM 75 0. 6 09 CA CM NO F -1 T. PE VA 7 1 GU 52 RF TO 3 IA OR -2 M 7 F 1 E M CA SU A 07 T. J L 1 8 DI 4 02 XB AG 10. 5 0 C 3, . 5 0 5 F M 77 PE 75 8 RF 05 01 OR 40 -2 1 0 M A PI GT AI L 11 0 C M 75 29 -1 1 M A AT 0 C 15 30 AM 6 F RF OR M O X 50 AL AG. DI PE 35 RU TE . 0 0 6 F 5 F G. 0 AN 10 T. AG. DI G. AN 80 CA T. CA IA GU DISPOSITIVOS ESTERILIZADOS POR MES (grafico 3) 75 70 60 43 40 33 30 21 18 16 15 15 14 14 13 11 11 10, 5 10 6, 5

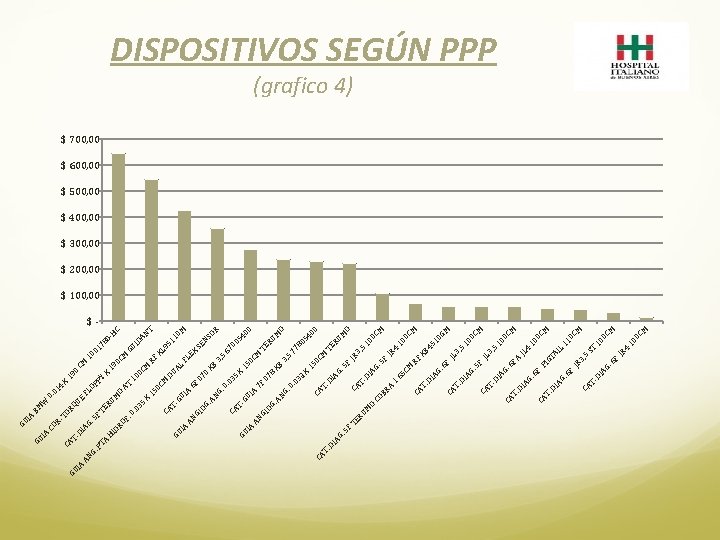
IA GU PT A 5 F 35 . 0 M O X AT M 01 10 0 C CM 19 0 C 10 X 0 19 PY OP FL 4 01 0. UE RU TE RQ BM W TO OF DR HI AG. DI R. CO IA HC 0 - 78 GU ID AN M X T 15 RF 0 C XL M 95 CA DU 11 T. GU AL 0 M GU IA FL I A AN E 6 F X GI SE 07 OG NS 0. A XB OR NG 3, 5. 0 6. 0 70 CA 35 05 T. X GU 40 15 GU 0 IA 0 I A CM AN 7 F T GI 07 ER OG 8 UM. A XB O NG 3, 5. 0 77. 0 32 80 54 X 15 00 0 C CA CA M T T. . D TE DI IA RU AG G. M. 5 5 F O F JR TE CA 3 RU T. , 5 DI 10 M O AG 0 C CO. 5 M BR F JR A 1 4 65 10 CM 0 C M R CA F XB T. DI 45 AG 10. 6 GM F CA J L T. 3, 5 DI 10 AG 0 C. 5 M F CA JL T. 3, 5 DI 10 AG 0 C CA. 6 M F T. A DI J L 4 AG 10. 6 F 0 C CA PI M T. GT DI AI AG L 11. 6 F 0 C JR M 3 , 5 CA S T. T DI 10 AG 0 C. 6 M F JR 4 10 0 C M G. AN T. CA IA GU GU DISPOSITIVOS SEGÚN PPP (grafico 4) $ 700, 00 $ 600, 00 $ 500, 00 $ 400, 00 $ 300, 00 $ 200, 00 $ 100, 00 $ -

CA T. IA F . 5 CA T. O CA T. F JR 4 4 JL IL M 0 C 10 M 03 75 -2 1 1 -2 01 75 -1 1 09 75 1 GM 10 45 3 -2 23 75 3 -1 21 75 O -A 03 M RU 75 XB 0 C 11 RF 0 C 10 M M 0 C 10 0 C 3 00 -1 23 75 TE M M 00 0 C 10 O EX 80 54 77 M 0 C 10 CM 65 F . 6. 6 DI AG 1 JR 4 GT A PI DI AG F . 6 BR A CO 5 ST 15 0 C 5 , 5 JL 3 3, 10 XB 5 X JL 3, F . 5 DI AG M RU TE F 5 32 JR 3, . 5 AG DI CA T. F . 6 AG DI 8 07 JR 3, . 0 NG. 0 F 7 F FL 00 54 67 AL RU M NT 0 M ID A TE DU 5 3, A M XB M M GU 11 HC 0 - 78 XL 95 M 0 C 0 C OR 0 RF 01 10 0 C 15 15 07 X M CM 19 X X 5 RF PE 6 F . 5 AG DI G. A GI O AN CA T. IA GU F . 6 IA GU AG DI CA T. 35 . 0 03 0. PY OP FL 0 C 0 19 10 X AT AN G. HI DR OF G. E QU GI O AN TA G. P AN DI AG IA GU GU O 4 01 0. M RU TE W BM OR R. T CO F . 5 IA GU DI AG IA GU CA T. CANTIDAD DE DISPOSITIVOS RE USADOS POR PPP (grafico 5) $ 250 000 $ 200 000 $ 150 000 $ 100 000 $ 50 000 A * PPP $ -

DISCUSION 1. Se implemento un proceso de reuso seguro y trazable. 2. La trazabilidad por lote permitió hacer un seguimiento por producto evitando el re-uso más de lo permitido e identificando los pacientes en quienes se usaron. 3. Disminuyo las tasas de infecciones, aunque no se puede evidenciar que porcentaje de este descenso se debe a la implementación de este proyecto, ya que estas tasas se ven afectadas por un conjunto multifactorial de acciones implementadas. 4. La identificación de cada Producto Médico es inequívoca, al individualizar la denominación de cada uno de ellos en el nuevo software de Esterilización.

MUCHAS GRACIAS Farm. María Gabriela Fraschetti gabriela. fraschetti@hiba. org. ar