Disciplina Cincia dos Materiais LOM 3013 2015 M










- Slides: 27

Disciplina : Ciência dos Materiais LOM 3013 – 2015 M 1 4 – Estruturas Cristalinas Prof. Carlos Angelo Nunes

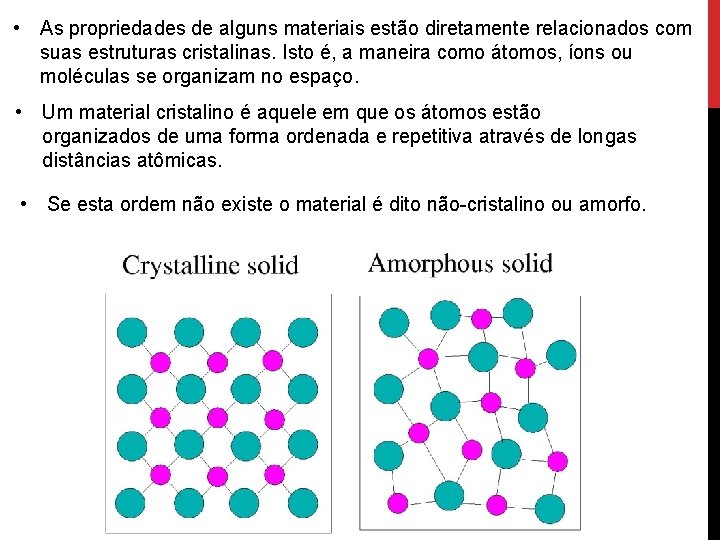
• As propriedades de alguns materiais estão diretamente relacionados com suas estruturas cristalinas. Isto é, a maneira como átomos, íons ou moléculas se organizam no espaço. • Um material cristalino é aquele em que os átomos estão organizados de uma forma ordenada e repetitiva através de longas distâncias atômicas. • Se esta ordem não existe o material é dito não-cristalino ou amorfo.

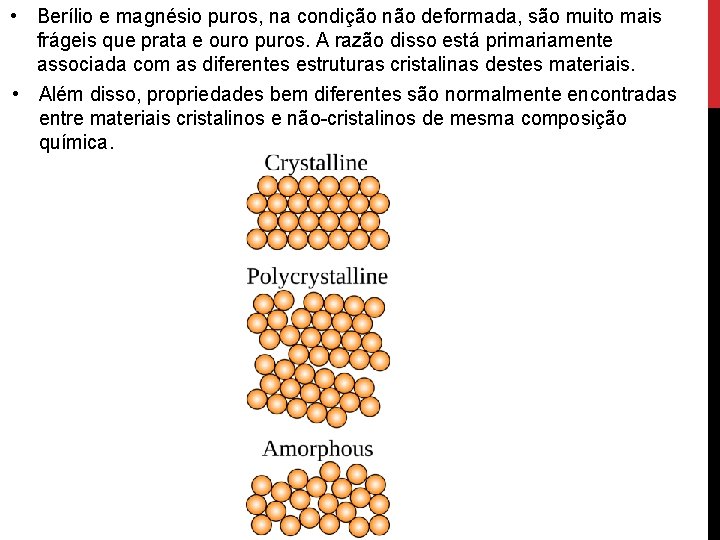
• Berílio e magnésio puros, na condição não deformada, são muito mais frágeis que prata e ouro puros. A razão disso está primariamente associada com as diferentes estruturas cristalinas destes materiais. • Além disso, propriedades bem diferentes são normalmente encontradas entre materiais cristalinos e não-cristalinos de mesma composição química.

Exemplo de Aplicação de Material Monocristalino: Paletas de superligas à base de níquel para turbina de alta-pressão em turbinas aeronáuticas. Paletas de superliga à base de níquel da turbina de alta pressão. Estrutura cristalina do níquel.

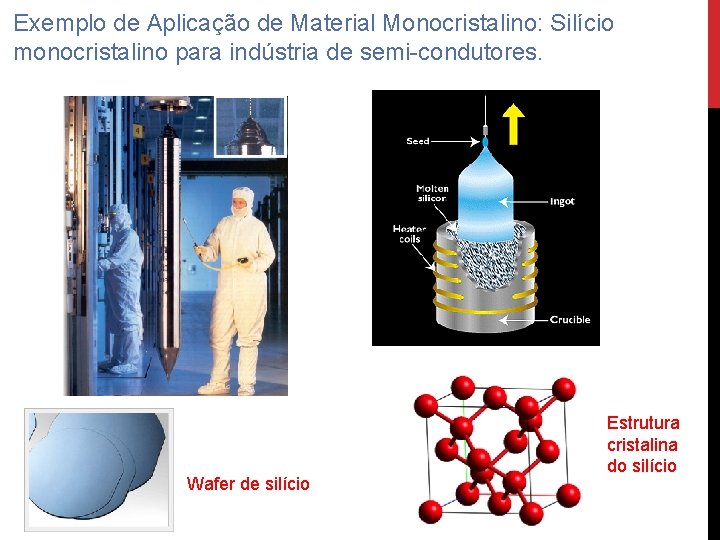
Exemplo de Aplicação de Material Monocristalino: Silício monocristalino para indústria de semi-condutores. Wafer de silício Estrutura cristalina do silício

Exemplo de Aplicação de Material Policristalino: Chapas laminadas de aço para indústria da linha branca – geladeira; fogão; micro-ondas.

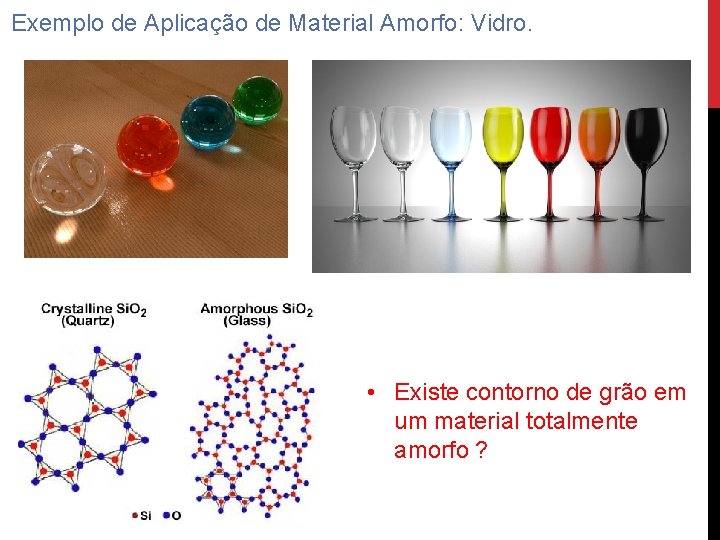
Exemplo de Aplicação de Material Amorfo: Vidro. • Existe contorno de grão em um material totalmente amorfo ?

Exemplo de Aplicação de Material Amorfo + Nanocristalino: Vitrocerâmicas Crystallization of Zr. O 2 -nucleated Mg. O/Al 2 O 3/Si. O 2 glasses

Célula Unitária • Como existem muitas estruturas cristalinas diferentes possíveis, algumas vezes é conveniente dividí-las em grupos de acordo com as configurações das células unitárias e/ou arranjos atômicos. • Célula unitária Paralelepípedo • Sistema de coordenadas xyz com origem em um dos vértices da célula unitária. • A geometria da célula unitária é completamente definida em termos de seis parâmetros: os comprimentos das três arestas, a, b e c, e os três ângulos entre os eixos: α, β e

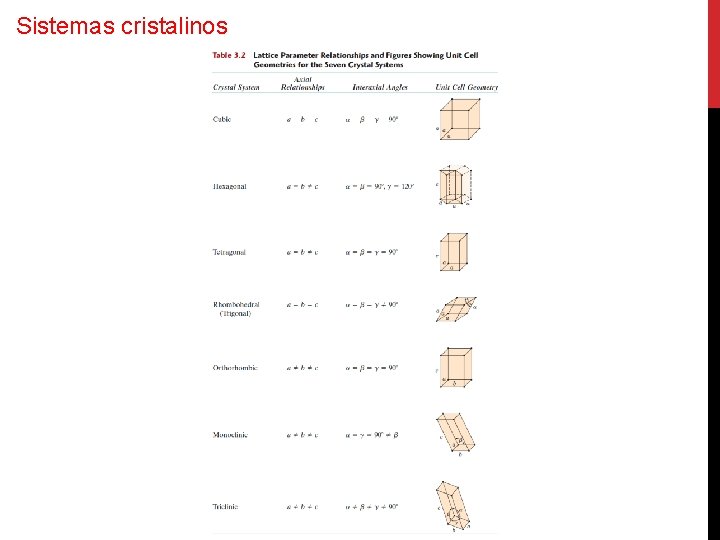
Sistemas cristalinos

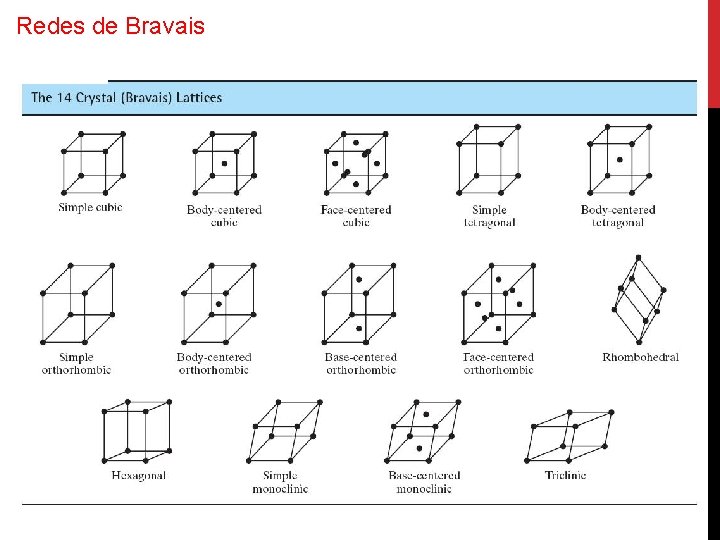
Redes de Bravais

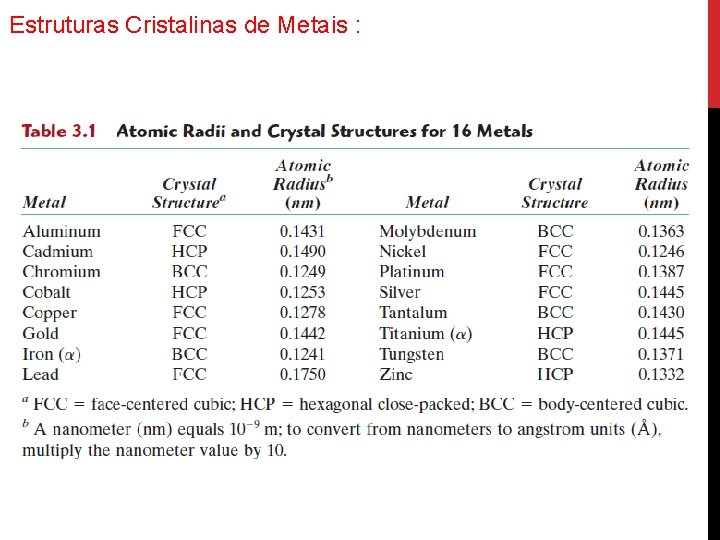
Estruturas Cristalinas de Metais :

Estruturas Cristalinas de Metais : Estrutura Cúbica de Face Centrada - CFC R a Ex. alumínio; cobre; prata; ouro a – parâmetro de rede; R – raio do átomo FE – Fator de empacotamento VACU – Volume ocupado pelos átomos no interior da célula unitária; VCU – Volume total da célula unitária.

Estruturas Cristalinas de Metais : Estrutura Cúbica de Face Centrada - CFC Direções compactas: comprimento = 4 R = 2 a Célula unitária contém: 6 x 1/2 + 8 x 1/8 = 4 atoms/célula 2 a a átomos célula FE = 4 4 3 p ( 2 a/4) 3 a 3 • Fator de empacotamento da CFC = 0, 74 (valor máximo de fator de empacotamento) volume átomo volume célula

Estruturas Cristalinas de Metais : Estrutura Cúbica de Face Centrada - CFC • Átomos se tocam ao longo das diagonais das faces. • Número de coordenação : 12. • Corner e faces são posições equivalentes.

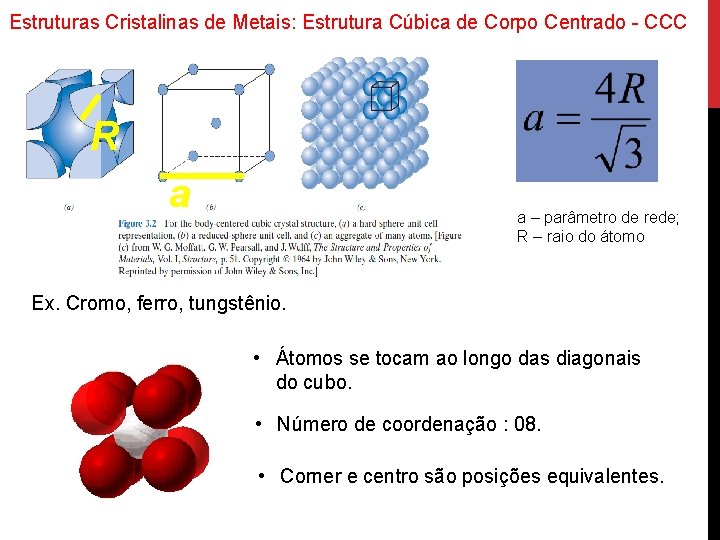
Estruturas Cristalinas de Metais: Estrutura Cúbica de Corpo Centrado - CCC R a a – parâmetro de rede; R – raio do átomo Ex. Cromo, ferro, tungstênio. • Átomos se tocam ao longo das diagonais do cubo. • Número de coordenação : 08. • Corner e centro são posições equivalentes.

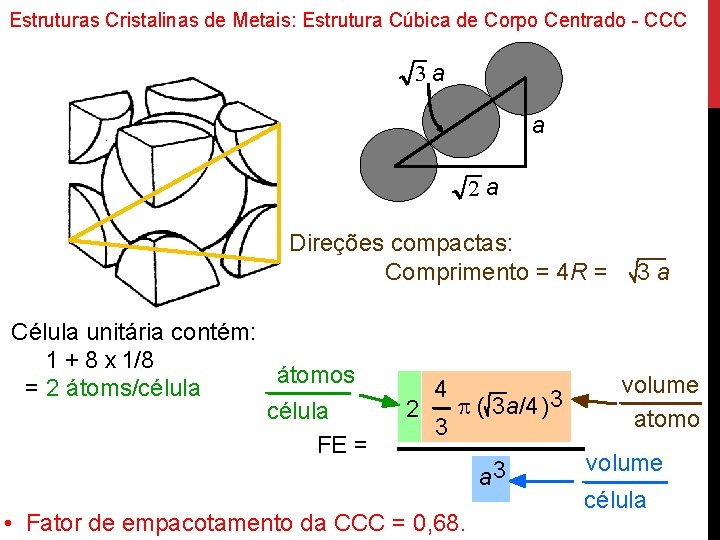
Estruturas Cristalinas de Metais: Estrutura Cúbica de Corpo Centrado - CCC 3 a a 2 a R a Direções compactas: Comprimento = 4 R = Célula unitária contém: 1 + 8 x 1/8 átomos = 2 átoms/célula FE = 2 4 3 p ( 3 a/4) 3 • Fator de empacotamento da CCC = 0, 68. a 3 3 a volume atomo volume célula

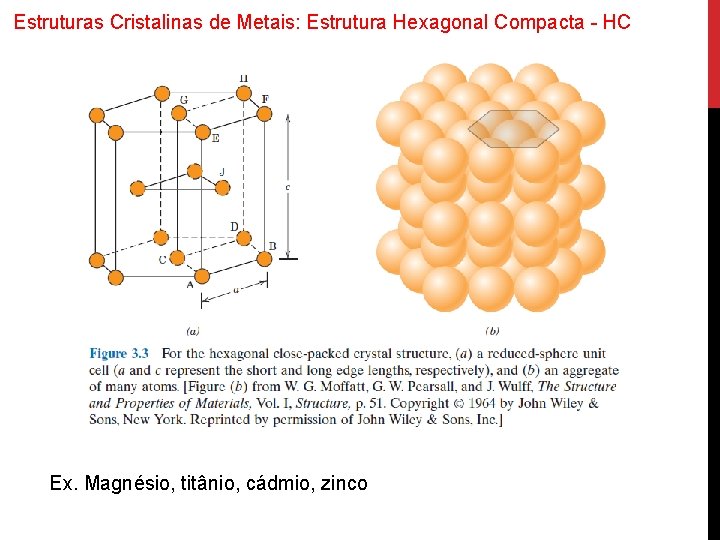
Estruturas Cristalinas de Metais: Estrutura Hexagonal Compacta - HC Ex. Magnésio, titânio, cádmio, zinco

Relação c/a ideal • Número de átomos por célula unitária: 6 • Número de coordenação: 12 • FE = 0, 74 • Corner e faces são posições equivalentes

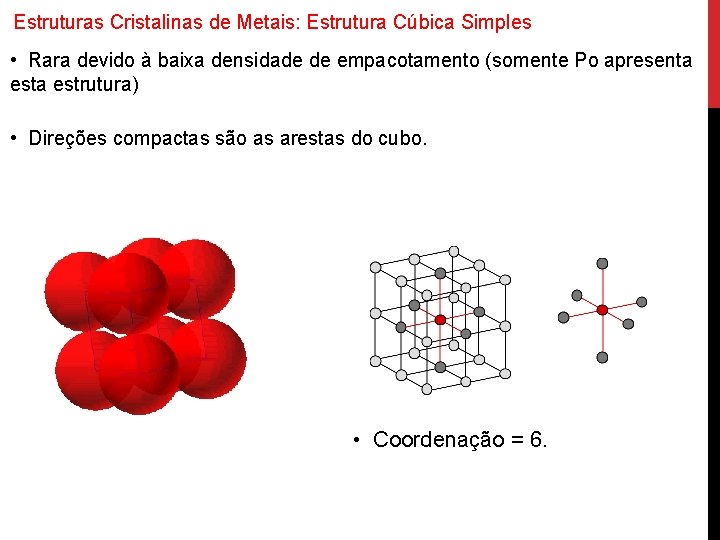
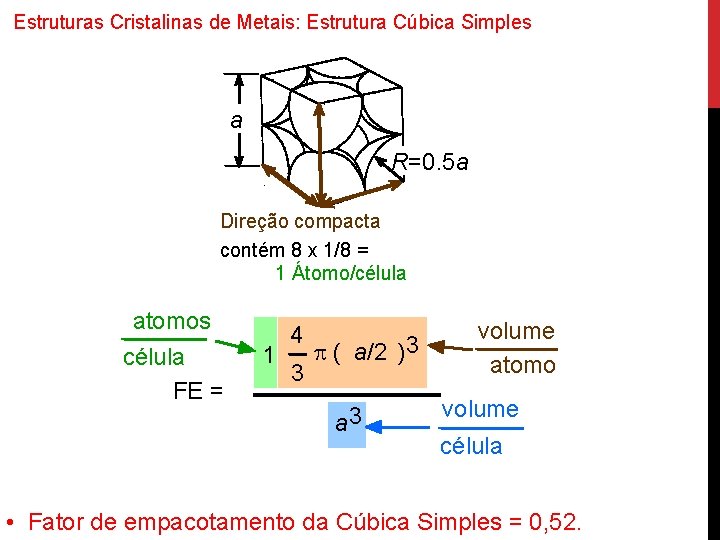
Estruturas Cristalinas de Metais: Estrutura Cúbica Simples • Rara devido à baixa densidade de empacotamento (somente Po apresenta estrutura) • Direções compactas são as arestas do cubo. • Coordenação = 6.

Estruturas Cristalinas de Metais: Estrutura Cúbica Simples a R=0. 5 a Direção compacta contém 8 x 1/8 = 1 Átomo/célula atomos célula FE = 1 4 3 p ( a/2 ) 3 a 3 volume atomo volume célula • Fator de empacotamento da Cúbica Simples = 0, 52.

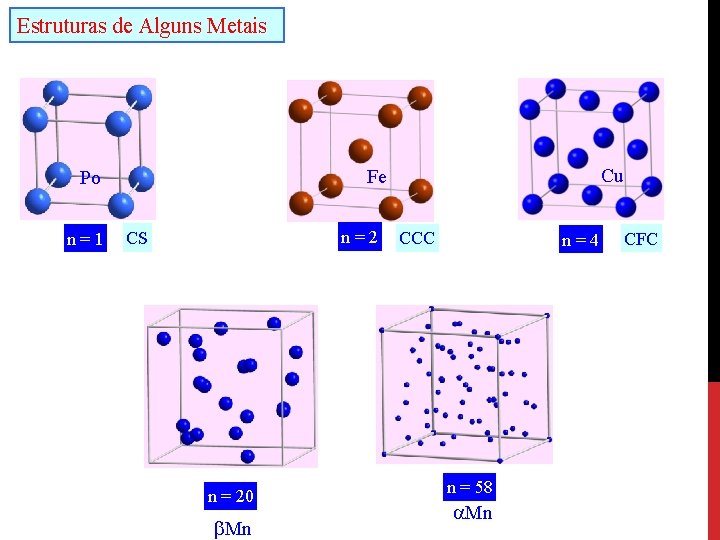
Estruturas de Alguns Metais n=1 Cu Fe Po n=2 CS n = 20 Mn CCC n=4 n = 58 Mn CFC

Cálculo de densidade teórica a partir da estrutura cristalina Onde: - densidade n- número de átomos associados a cada célula unitária A- massa atômica Vc- Volume da célula unitária NA- Número de avogrado (6, 02. 1023 átomos/mol)

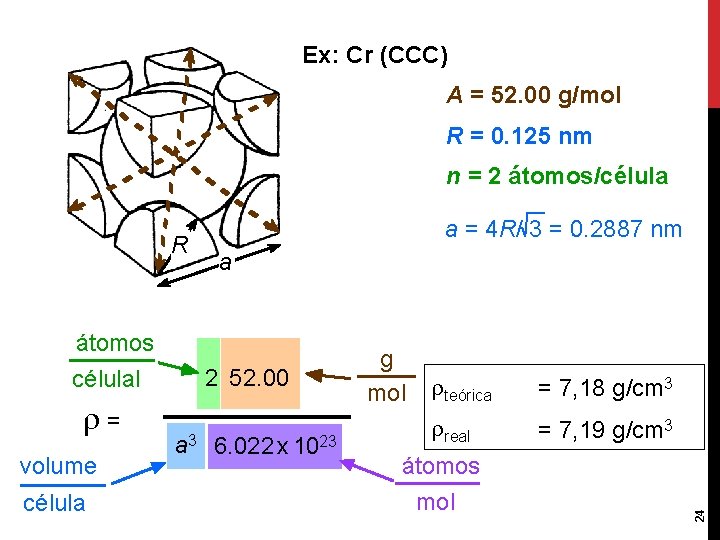
Ex: Cr (CCC) A = 52. 00 g/mol R = 0. 125 nm n = 2 átomos/célula átomos célulal = volume célula a 2 52. 00 a 3 6. 022 x 1023 g mol teórica = 7, 18 g/cm 3 real = 7, 19 g/cm 3 átomos mol 24 R a = 4 R/ 3 = 0. 2887 nm

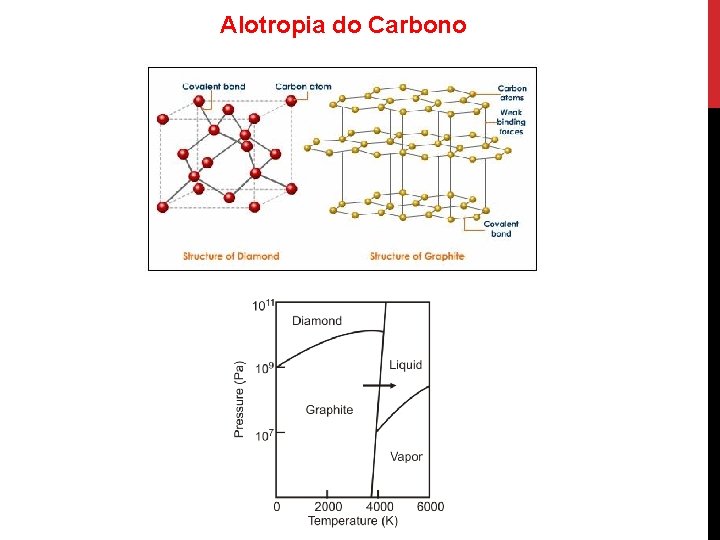
Alotropia do Carbono

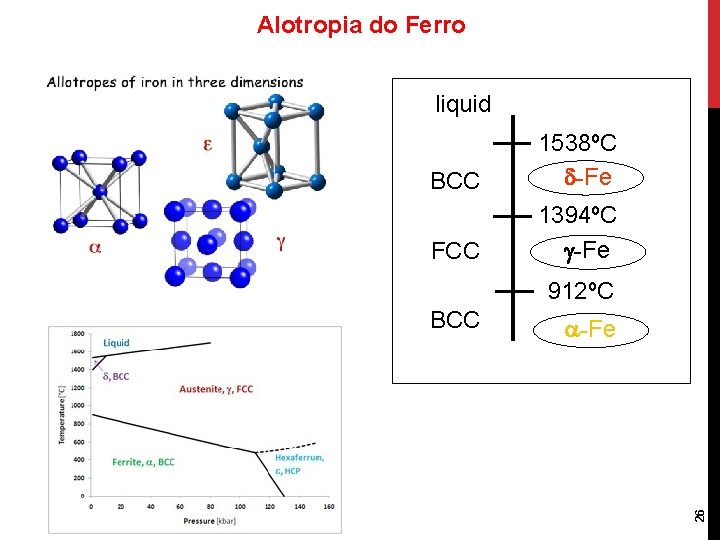
Alotropia do Ferro liquid BCC 1538ºC -Fe FCC 1394ºC -Fe 912ºC -Fe 26 BCC

Células-Unitárias Complexas • Proteína
 Oilaning barkamol shaxs tarbiyasidagi vazifalari
Oilaning barkamol shaxs tarbiyasidagi vazifalari A cincia
A cincia Cs 3013
Cs 3013 Cs 3013
Cs 3013 Rubrik pemarkahan
Rubrik pemarkahan Resistencia dos materiais
Resistencia dos materiais Fator de empacotamento ccc
Fator de empacotamento ccc Tecnologia dos materiais
Tecnologia dos materiais Resistência dos materiais
Resistência dos materiais Resistencia dos materiais
Resistencia dos materiais Resistência dos materiais
Resistência dos materiais Resistencia dos materiais
Resistencia dos materiais Classificação dos materiais na natureza
Classificação dos materiais na natureza Resistência dos materiais
Resistência dos materiais Tecnologia dos materiais
Tecnologia dos materiais Lom rapid prototyping
Lom rapid prototyping Lom ke kolmici
Lom ke kolmici Pulzatori
Pulzatori Ozodalik salomatlik garovi haqida maqollar
Ozodalik salomatlik garovi haqida maqollar Qon suyulib ketsa
Qon suyulib ketsa Konkavno zrcalo
Konkavno zrcalo Multiplayer matchmaking algorithm
Multiplayer matchmaking algorithm Lom světla příklady
Lom světla příklady Lom světla test
Lom světla test únavový lom
únavový lom Lom geofon
Lom geofon Krti lom
Krti lom Lom svjetlosti piramida
Lom svjetlosti piramida