Diamante Pedro Vega Martn Luque Martn Moreano Mateo






- Slides: 7

Diamante Pedro Vega| Martín Luque | Martín Moreano | Mateo Valencia

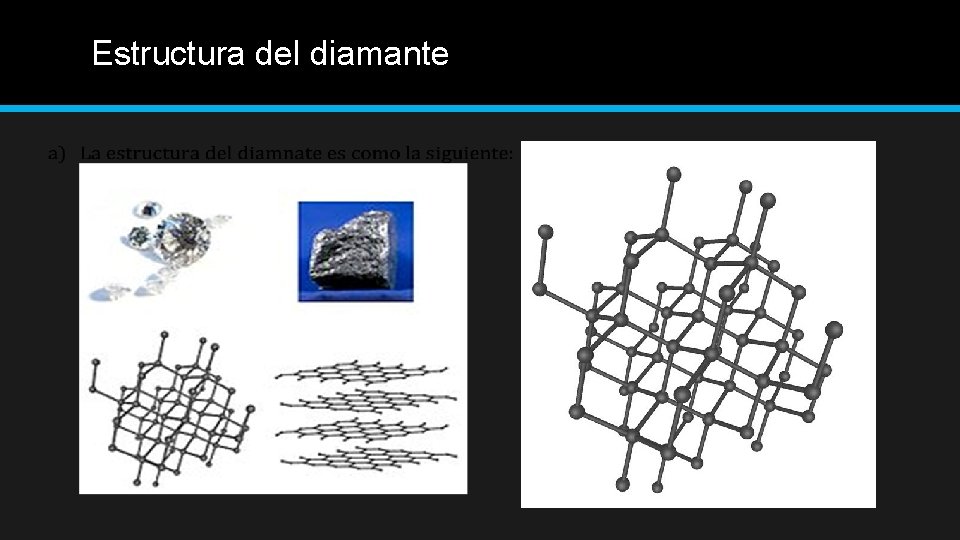
¿Alótropo de que elemento es? • El diamante es uno de los alótropos del carbono mejor conocidos, cuya dureza y alta dispersión de la luz lo hacen útil para aplicaciones industriales y joyería. • Características del alótropo: El cristal de diamante se forma por la repetición y el apilado en las 3 direcciones del espacio de átomos de carbono que se podrían comparar con tetraedros cúbicos cuyo centro concentraría la masa del átomo y en los que los 4 vértices tendrían un electrón. Los enlaces que unen los átomos son covalentes y cada centro de estos átomos está distanciado de su vecino solamente por una distancia del orden de 1, 54 ángstrom. Dado que los enlaces atómicos del diamante son muy cortos, esto explica en parte su gran dureza. • Fuerzas de Atracción: El diamante contiene enlaces covalentes, lo cual es una enrejado gigante de átomos de carbono, cada uno unido a cuatro vecinos por un enlace covalente.

Estructura del diamante

Propiedades Físicas • El diamante es carbono cristalino, de transparente a opaco, ópticamente isótropo. Es el material natural más duro conocido debido a su enlace covalente. • Se desconoce su resistencia a la tensión exacta. Sin embargo, se han observado resistencias de hasta 60 GPa, y la tensión máxima teórica podría situarse entre 90 y 225 GPa, dependiendo de la orientación del cristal. • Tiene un índice de refracción muy elevado (2, 417) y una dispersión moderada (0, 044), propiedades que son muy tenidas en cuenta durante el corte, y que le dan al diamante bien cortado su brillo • Las impurezas que sustituyen a los átomos de carbono en la red cristalina, y que en ocasiones dan lugar a defectos estructurales, son las responsables de la amplia gama de colores presentes en éstos. La mayoría de diamantes son dieléctricos pero muy buenos conductores del calor. • La gravedad específica del diamante monocristalino es de 3, 52, y es muy constante.

Propiedades Químicas • El diamante puede arder si es calentado con un soplete y se volverá externamente blanco. Bastará con volver a pulimentarlo para devolverle todo su brillo. • Si se calienta un diamante a 1. 400 grados durante 2 horas, arde rodeado de una llama muy viva. Si se añade oxígeno y se coloca en un vaso cerrado, arderá hacia los 800/850 grados. • El diamante es inatacable por los ácidos y los álcalis, excepto el nitrato potásico o la sosa fundida que logran disolverlo.

Aplicaciones del Diamante APLICACIONES EN LA INDUSTRIA • Con estos diamantes se fabrican troqueles y muelas para pulir herramientas. También se emplean para perforar pozos petroleros y para cortar todo tipo de piedras. • Es un semiconductor de alto rendimiento debido a que tiene características de conductividad tanto de calor como de electrones muy superiores a la del silicio (elemento mas común actualmente para estas aplicaciones). • El diamante artificial (producido al someter una sustancia carbonosa rica en grafito a temperaturas de hasta 2899 grados Celsius y una presión de más de 100000 atm. ) tiene aplicaciones de tipo industrial a pesar de ser fabricado como una joya, sin embargo su precio es menor que el de un diamante auténtico.

Aplicación sugerida del Diamante • Por su dureza se lo usa para realizar cortes, perforaciones, y lijado y pulido. • No se requiere de diamantes grandes para estas aplicaciones, es más la mayoría de diamantes que son de calidad de gema pueden encontrar un uso industrial. • En el presente se está desarrollando la aplicación del diamante en la construcción de microchips debido a su capacidad semiconductora.