Dfauts dans les cristaux Introduction Quest ce quun

























- Slides: 34

Défauts dans les cristaux

Introduction Qu'est ce qu'un défaut? Dans une structure cristalline idéale, même arrangement autour des atomes, périodicité non perturbée = pas de défauts Dans une structure cristalline réelle, toujours des défauts = imperfections, erreur d'empilement, nature de l'atome différent, localisation des atomes différente Les défauts = faible volume en dehors duquel les propriétés de symétrie et de structure sont celles du cristal idéal. Type de défaut et nombre dépendent du matériau: de son environnement, des traitements de déformation auquel il est soumis.

Les propriétés des cristaux Elles sont classées en deux catégories: 1)Les propriétés intrinsèques liées à la structure atomique du cristal et à sa symétrie: -piézoélectricité -biréfringence Ces propriétés sont modifiées par la présence de défauts: les conductibilités thermique et électrique des métaux, les phénomènes de croissance cristalline, la susceptibilité magnétique, etc…. Les propriétés extrinsèques: liées à la présence des défauts: -comportement sous l’effet de contraintes appliquées (prop. méca) -coloration/ centres colorés -propriétés de diffusion (propriétés thermiques) -réactions chimiques entre solides…

Les différents types de défauts 1) Les défauts à O-D Affectent la structure sur quelques atomes isolés (faible volume, dimensions de l’ordre des distances interatomiques) -les défauts ponctuels (lacunes, interstitiels, atomes d’impuretés, etc. ) -les défauts électroniques (électrons, trous positifs. . . ) ou leurs associations 2) Les défauts linéaires (1 -D) dont deux dimensions sont petites et la troisième grande Ils s'étendent suivant une ligne (une seule rangée d'atomes touchée à la fois) -dislocations coin ou vis

3) les défauts plans (2 D) Affectent un ou plusieurs plans du cristal: -fautes d’empilement -joint de grains - surface de mâcle -nucléation en surface 4) Les défauts volumiques (3 D) affectent des agrégats d'atomes: -contraintes élastiques d’origine externe ou interne -précipités -composés à plusieurs phases

Les défauts ponctuels 1) Les lacunes et les atomes en position interstitielle ou substitionnelle -lacune : absence d'ion dans un site normal du cristal La présence de lacunes induit des charges non compensées dans le cristal = augmentation de l'énergie du cristal.

-atome en position interstitielle: localisation d'un atome dans une position non conventionnelle dans le réseau du cristal parfait. Déplacement des atomes voisins faible mais mesurable. La présence d'atome en position interstitielle génère des distorsions locales qui vont induire une augmentation de l'énergie du cristal.

-énergie libre de Gibbs G = est minimum lorsque le cristal est en équilibre avec son environnement G = H - TS H = enthalpie ou énergie interne (forces électrostatiques + énergie liée aux vibrations des liaisons) S = entropie ou mesure du désordre T = température en kelvins La création d'un défaut ponctuel induit une augmentation de l'enthalpie du cristal H et une variation de l'entropie S G = H - T S pour une faible concentration en défauts à une température donnée, le terme - S reste le plus important et G reste négatif = le minéral sera plus stable avec une faible concentration en défauts

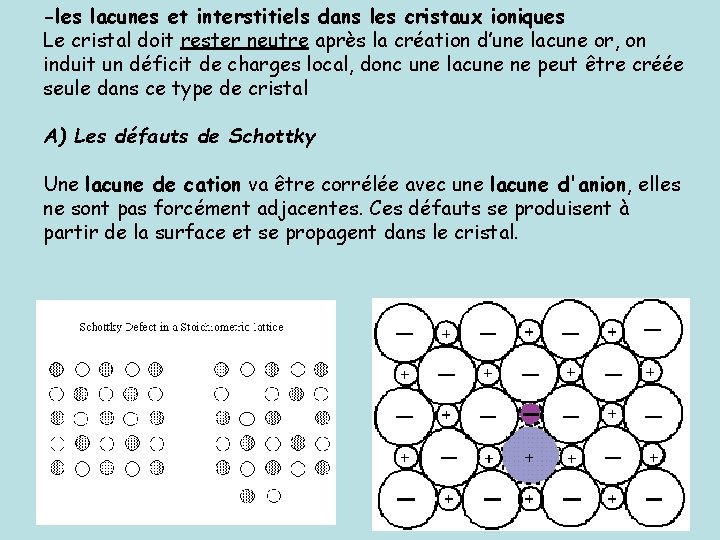
-les lacunes et interstitiels dans les cristaux ioniques Le cristal doit rester neutre après la création d’une lacune or, on induit un déficit de charges local, donc une lacune ne peut être créée seule dans ce type de cristal A) Les défauts de Schottky Une lacune de cation va être corrélée avec une lacune d'anion, elles ne sont pas forcément adjacentes. Ces défauts se produisent à partir de la surface et se propagent dans le cristal.

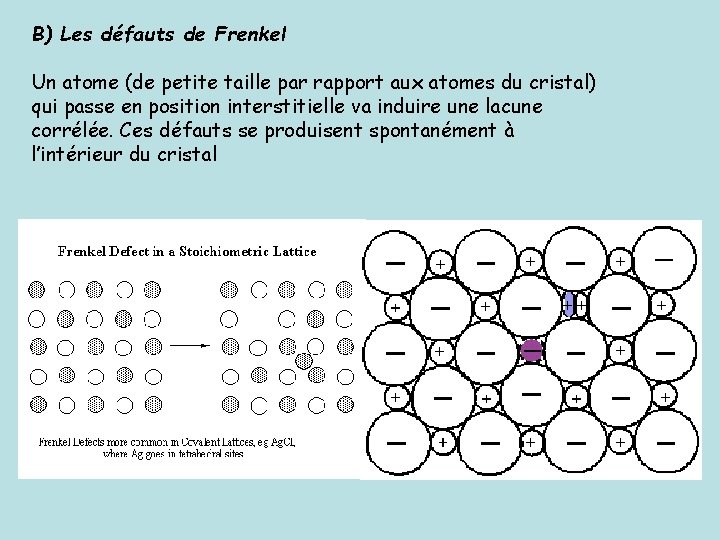
B) Les défauts de Frenkel Un atome (de petite taille par rapport aux atomes du cristal) qui passe en position interstitielle va induire une lacune corrélée. Ces défauts se produisent spontanément à l’intérieur du cristal

Exercice : quel est le défaut de Schottky le plus probable dans Zr. O 2?

Corrigé : Un défaut de Schottky soit une lacune de Zr 4+ associée à deux lacunes de O 2 -

C) Les impuretés dans les cristaux Un cristal n’est jamais totalement pur. Ce sont tous les atomes de natures différentes qui entrent dans la structure d'un cristal. On peut aussi doper les cristaux pour modifier les propriétés électriques ou la couleurs par ex. Il faut voir: - comment la structure peut accommoder l'impureté? -est ce qu'il y a distorsion de la structure? -quelle est la nature des liaisons entre l'élément et les atomes du cristal hôte? -quelle concentration peut entrer dans le cristal? -le cristal peut il rester neutre?

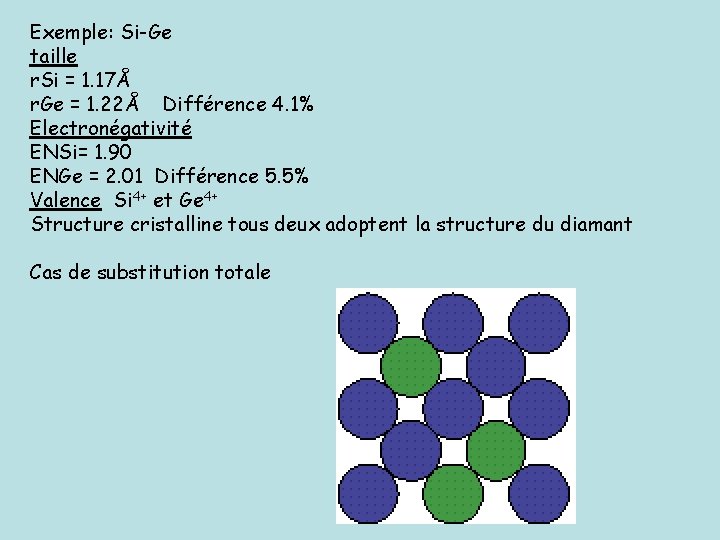
Une structure cristalline qui contient des impuretés peut former une solution solide. Solutions solides 1) Par substitution l'impureté occupe les mêmes sites que les atomes qu'elle remplace dans le cristal hôte On peut réaliser une substitution si: - la différence de taille entre l'atome impureté et les atomes du cristal hôte doit être inférieure ou égale à 15% - leur électronégativité est comparable - leur valence est la même - la structure dans laquelle cristallise l'impureté et les atomes hôtes est la même (pour les métaux essentiellement)

Exemple: Si-Ge taille r. Si = 1. 17Å r. Ge = 1. 22Å Différence 4. 1% Electronégativité ENSi= 1. 90 ENGe = 2. 01 Différence 5. 5% Valence Si 4+ et Ge 4+ Structure cristalline tous deux adoptent la structure du diamant Cas de substitution totale

Coloration de l ’olivine par incorporation d ’impuretés de Fe 2+ = Vert Coloration de l ’azurite par des impuretés de Cu 2+

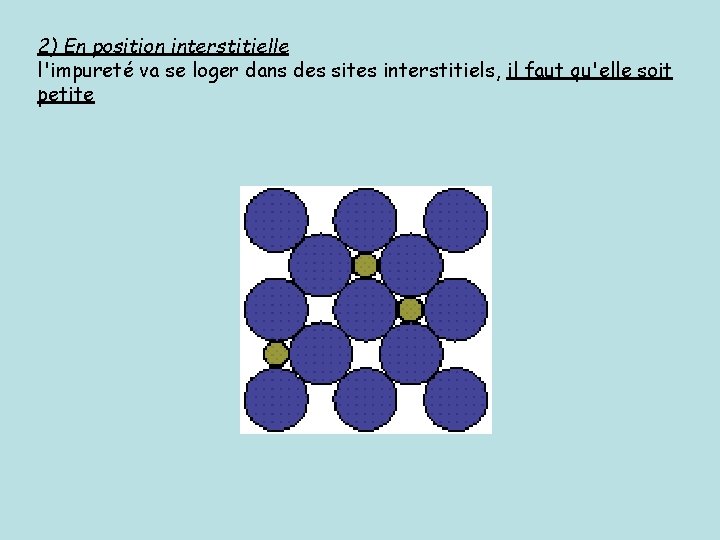
2) En position interstitielle l'impureté va se loger dans des sites interstitiels, il faut qu'elle soit petite

Déplacement des défauts dans les cristaux Le mouvement des défauts ponctuels permet le transport des charges dans les cristaux ioniques. cas des lacunes: un atome ou un ion voisin de la surface vient se placer en surface et laisse un site inoccupé (une lacune) qui se propage ensuite à l’intérieur du cristal : sous l’action de l’agitation thermique, un atome ou ion voisin « saute » dans la position restée vacante, laissant à son tour une lacune, etc… Cas des interstitiels: deux possibilités - saut direct d’une position interstitielle à une autre - saut par remplacement, l’interstitiel vient prendre la place d’un atome ou ion en position normale qui occupe à son tour une position interstitielle.

Les défauts électroniques Les centres colorés (liés à des défauts ponctuels) modification des propriétés optiques Coloration violette de la Fluorine Normalement incolore Coloration jaune verte de Na. Cl Une lacune d’ion négatif est chargée positivement et attire un e. Ce centre se comporte comme un atome d’H et l’e- peut réaliser des transitions entre un niveau fondamental et un niveau excité. Si pour réaliser cette transition un photon visible est absorbé, le centre va permettre la coloration du minéral = centre F dit centre coloré (F= Farbe)

modification des propriétés volumiques des cristaux La production de défauts ponctuels = variation de volume Contraction ou dilatation des mailles voisines et répercussion à travers tout le cristal Il s’ensuit une variation moyenne du volume de la maille cristalline qui peut être mesuré par diffraction des RX

Conclusion Les défauts ponctuels sont en général de même type pour un cristal donné. Ils dépendent du type de liaison et du rayon ionique des cations par rapport aux anions. Les défauts de FRENKEL ne se forment pas si -Les forces de répulsion sont élevées -si les tailles des cations et des anions sont proches Les impuretés concernent toujours un nombre important d’atomes Pb lorsque l’on veut des composés ultra purs Si Par ex.

Les défauts linéaires les dislocations Comment expliquer le phénomène de glissement atomique observé lors de la déformation plastique des matériaux cristallins? Le glissement simultané de toute les rangées atomiques sous l’effet de la contrainte est très improbable. Si on casse toutes liaisons en même temps, on crée une zone de clivage du cristal

-les dislocations - coins Visualisation du mouvement réel des atomes Lors de la déformation pour une dislocation - coin

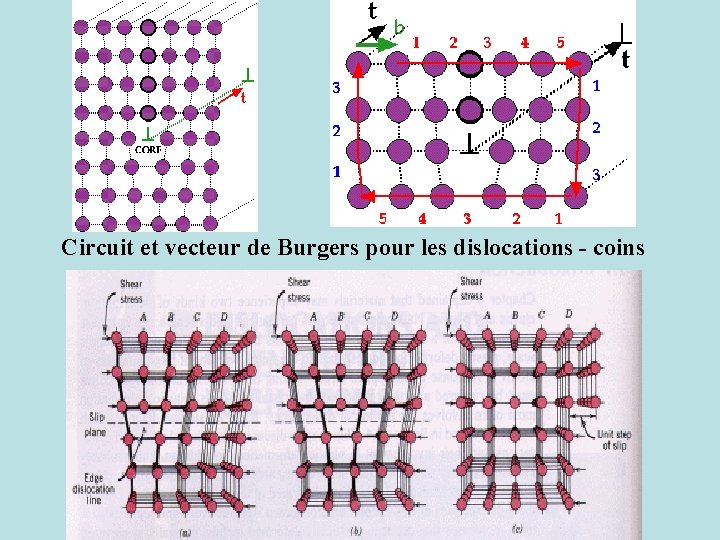
La région qui entoure une dislocation est perturbée par rapport à l'ensemble du cristal. Un 1/2 plan supplémentaire est incorporé dans le cristal. La rangée terminale des atomes de ce plan est la dislocation coin. Au dessus de la dislocation coin on a un effet de compression, au dessous un effet de tension Pour représenter une dislocation coin on utilise les circuits et vecteurs de BURGERS On réalise un chemin dans le sens des aiguilles d'une montre autour du coeur de la dislocation partant d'une valeur du paramètre de maille à un autre suivant la direction empruntée. A la fin du circuit qui doit avoir le même nombre de pas de droite à gauche et de haut en bas on ne peut refermer le circuit. Il est nécessaire d'ajouter la valeur d'un vecteur b pour le fermer. b pointe toujours d'un paramètre de maille vers l'autre et pour une dislocation coin b est perpendiculaire à la ligne de dislocation.

Circuit et vecteur de Burgers pour les dislocations - coins

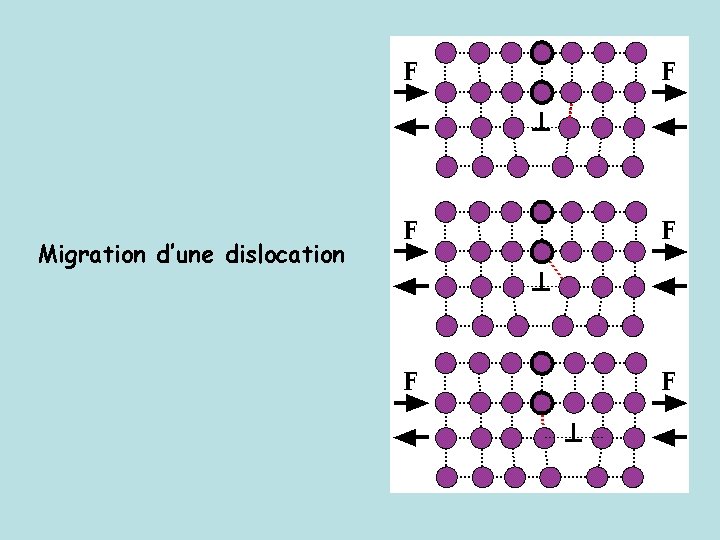
Migration d’une dislocation

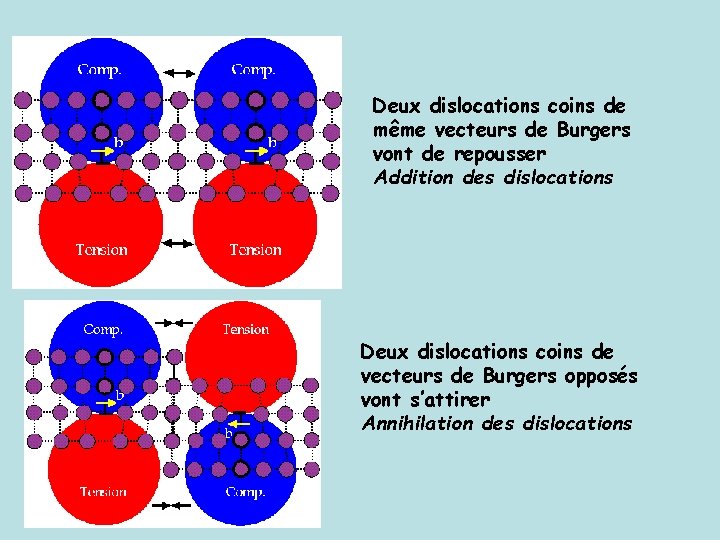
Deux dislocations coins de même vecteurs de Burgers vont de repousser Addition des dislocations Deux dislocations coins de vecteurs de Burgers opposés vont s’attirer Annihilation des dislocations

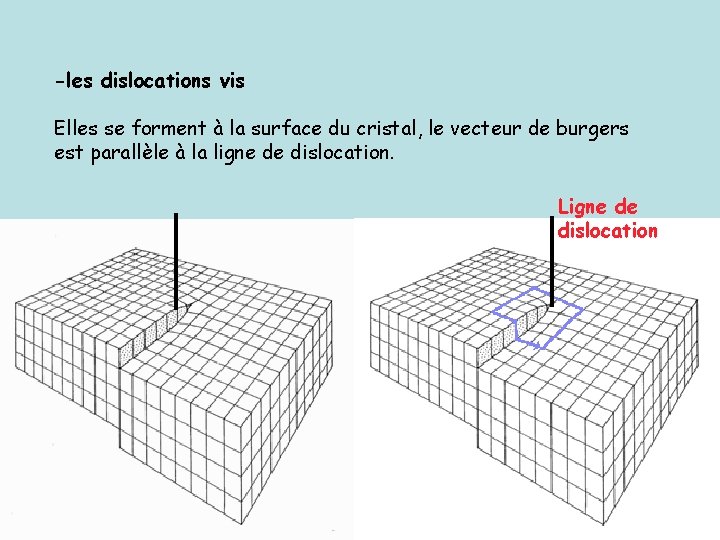
-les dislocations vis Elles se forment à la surface du cristal, le vecteur de burgers est parallèle à la ligne de dislocation. Ligne de dislocation

Photo MET d’une dislocation vis

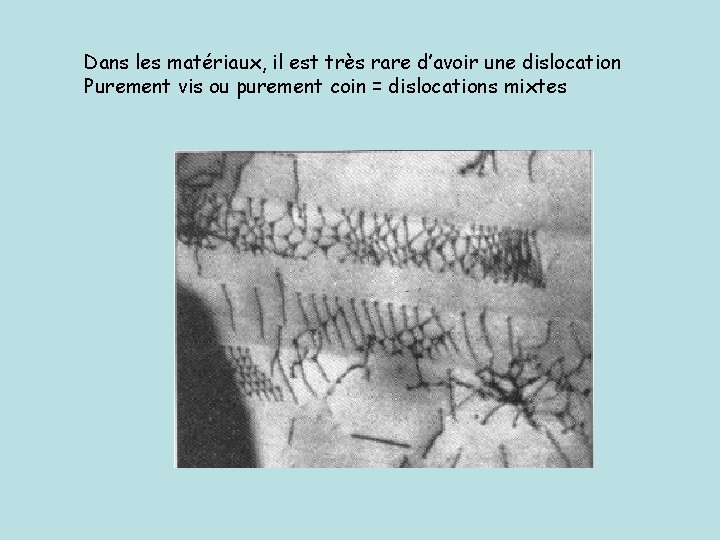
Dans les matériaux, il est très rare d’avoir une dislocation Purement vis ou purement coin = dislocations mixtes

- Intérêt de l’étude des dislocations dans les matériaux Les dislocations modifient les propriétés du cristal -déformabilité -conductibité… -durcissement (écrouissage des métaux) Les dislocations qui se déplacent sur des plans différents peuvent se rencontrer. Si elles sont de même signe, elles se bloquent Le cristal se durcit -Les dislocations -vis sont importantes lors de la croissance cristalline


-la non stoechiométrie La stoechiométrie (A=B dans AB) n’est pas une vertu des cristaux réels Exercice : Une pyrrhotite terrestre est moins dense qu’une troïlite de météorite et apparaît plus riche en soufre d’après l’analyse à la sonde Est ce possible? Densité 4. 85 Cas de Fe. S (S=troïlite (50%)/pyrrhotite terrestre(55%) 4. 5 Troïlite(météorite) 50 55 %d’atomes S

-corrigé Solution solide de soustraction Densité Fe(1 -x)S (S=troïlite (50%)/pyrrhotite(55%)) terrestre Troïlite(météorite) 50 55 %d’atomes S on a plus de soufre relativement que de fer d’après l’analyse Le soufre s’il est excédentaire devrait se placer en position interstitielle et la densité devrait augmenter. On a donc une erreur de mesure à la sonde liée à la présence de lacunes de Fe 2+ pour respecter les lois de Pauling = formation de Fe 3+ - changement de redox du fer possible lié à l’atmosphère oxydante
 Quest ce quun cluster
Quest ce quun cluster Site tetraedrique maille cc
Site tetraedrique maille cc Titre de l'oeuvre de la ficelle
Titre de l'oeuvre de la ficelle Cristal de sulfate de cuivre
Cristal de sulfate de cuivre Quand je suis frais je suis chaud qui suis-je
Quand je suis frais je suis chaud qui suis-je Macrocible d'entrée exemple
Macrocible d'entrée exemple Analyse du chapitre 49 le dernier jour d'un condamné
Analyse du chapitre 49 le dernier jour d'un condamné Le guide de la parfaite epouse
Le guide de la parfaite epouse Nous sommes les étoiles dans le ciel d'abraham paroles
Nous sommes les étoiles dans le ciel d'abraham paroles Zone chaude zone froide supermarché
Zone chaude zone froide supermarché Remerciements d'un rapport de stage
Remerciements d'un rapport de stage Dans les cieux et sur la terre
Dans les cieux et sur la terre Mécanisme intervenant dans les échanges cellulaires
Mécanisme intervenant dans les échanges cellulaires Groupe verbal
Groupe verbal Exemple texte d'opinion
Exemple texte d'opinion élément perturbateur dans un conte
élément perturbateur dans un conte Les instructions en classe
Les instructions en classe Les professeurs 1 of 1 dans la salle de classe.
Les professeurs 1 of 1 dans la salle de classe. Carte des enfers mythologie grecque
Carte des enfers mythologie grecque Haribo chiffre d'affaire
Haribo chiffre d'affaire Introduction quest
Introduction quest Eft quests
Eft quests Dissertation ses exemple
Dissertation ses exemple Comment faire une introduction dans une dissertation
Comment faire une introduction dans une dissertation Comment faire une introduction dans une dissertation
Comment faire une introduction dans une dissertation Parts de les flors
Parts de les flors Les lettres en français
Les lettres en français Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Les constellations les plus connues
Les constellations les plus connues Je moi tu toi
Je moi tu toi Parts d una planta
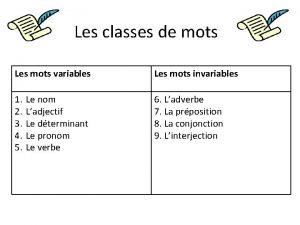
Parts d una planta Mots variables et invariables
Mots variables et invariables Classes de mots variables
Classes de mots variables Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Grand corp malade le train
Grand corp malade le train