Deuxime sance de regroupement PHR 101 n Leons


































- Slides: 37

Deuxième séance de regroupement PHR 101 n Leçons 4 - 6 n. Points importants n Commentaires sur les exercices n Questions / Réponses

La rotation, la vibration et l'énergie moléculaire

Quelques rappels de mécanique n Centre de masse : n Moment d’inertie : n Représente la mesure de l'opposition qu'offre un système à voir changer son état de mouvement de rotation autour d'un axe n Pour un système composé de n particules : n Vecteur moment cinétique : n Joue un rôle analogue à la quantité de mouvement en translation n Pour un système composé de n particules :

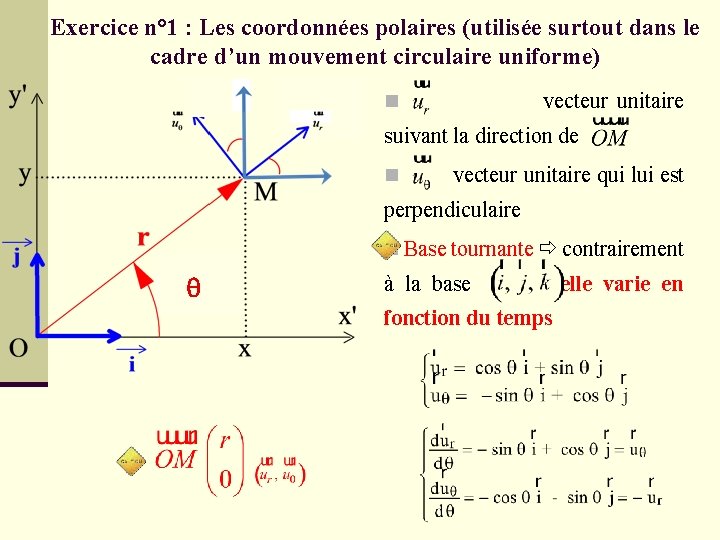
Exercice n° 1 : Les coordonnées polaires (utilisée surtout dans le cadre d’un mouvement circulaire uniforme) n vecteur unitaire suivant la direction de n vecteur unitaire qui lui est perpendiculaire n Base tournante contrairement q à la base elle varie en fonction du temps

Vecteur vitesse n Définition: n Expressions n Coordonnées cartésiennes : n Coordonnées polaires : Attention : Les vecteurs de la base polaire dépendent de l’angle q qui luimême dépend du temps. Pour dériver ces vecteurs par rapport au temps, il faut appliquer les règles de dérivation des fonctions composées.

Vecteur accélération n Définition: n Expressions n Coordonnées cartésiennes : n Coordonnées polaires : r, q et tous les vecteurs sont dépendants du temps

Le mouvement circulaire uniforme (MCU) n Une particule de masse m se déplaçant sur une trajectoire circulaire de rayon r constant avec une vitesse constante MCU Mouvement dans le plan Ep = 0 n L’énergie E est définie par : n Le vecteur moment cinétique par rapport au point O : n. Relation Energie / Moment cinétique m

La molécule diatomique en rotation autour de son centre de gravité rotateur rigide en MC n La position du centre de gravité est définie par : n Bilan des différentes relations : n Quand la molécule pivote autour de son centre de gravité, les atomes de masse m 1 et m 2 ont la même vitesse angulaire

Moment d’inertie – Masse réduite Le moment d’inertie I est défini par la relation : En substituant dans cette équation les expressions de r 1 et r 2, on trouve de point de vue mécanique, la molécule diatomique peut être étudiée comme un atome de masse unique µ tournant autour d’un point situé à une distance fixe r égale à la distance internucléaire.

Expression de l’énergie cinétique de rotation

De la mécanique classique à la mécanique quantique n En mécanique classique : l'énergie cinétique de rotation n En mécanique quantique, le moment cinétique d'un système microscopique (électron atome, molécule etc. . . ) est quantifié n La combinaison de ces 2 relations donne :

Spectre de rotation d'une molécule linéaire n Considérons une molécule linéaire ayant un moment dipolaire non nul, et un champ électrique oscillant associé à une radiation incidente. n La molécule et le champ peuvent s’influencer mutuellement et la molécule en rotation peut absorber ou céder de l'énergie. Il en résulte un spectre de rotation pure. n Les molécules non polaires telles que H 2, N 2 et CO 2 n'absorbent pas d'énergie qui pourrait être attribuée aux seuls changements d'énergie de rotation des molécules. Règle de sélection : D J = ± 1 n Remarque : les niveaux d'énergie de rotation sont assez rapprochés par rapport à la valeur de l'énergie thermique.

Ecart entre deux niveaux d’énergie rotationnelle permises En spectroscopie de rotation : Ecart entre deux raies : Les niveaux d’énergie s’écartent de plus en plus les uns des autres

Spectre de rotation n Le spectre de rotation pure de la plupart des molécules se trouve dans le domaine des micro-ondes de haute énergie à la limite de l'infrarouge lointain compte tenu de la faible valeur du moment d'inertie n La spectroscopie de rotation : n n’est pas utilisée en routine dans les labos de chimie n est limitée en pratique aux petites molécules n permet de faire des mesures très précises des moments d’inertie et d’avoir des renseignements sur la dimension des molécules

Approximation de l’oscillateur harmonique n Un système moléculaire diatomique peut se ramener au schéma d’un oscillateur harmonique. n Les deux atomes ne sont plus liés de façon rigide, mais peuvent osciller autour de leur position d’équilibre le long de l’axe inter nucléaire. n Dans le cas de l’approximation de l’oscillateur harmonique :

La vibration de la molécule n Les deux spectroscopies infrarouge (IR) et Raman étudient les vibrations des molécules lorsqu’elles sont irradiées par une onde électromagnétique de fréquence adéquate n L'énergie des niveaux de vibration : 0 = fréquence propre du système n Dans le cas d’une molécule diatomique (approximation de l’oscillateur harmonique) la fréquence propre de vibration est :

La vibration de la molécule n Ecart entre deux niveaux d'énergie de vibration n La valeur de l'énergie thermique est faible par rapport à l’énergie de vibration n Le couplage avec une radiation électromagnétique ne peut se produire que si la molécule en vibration présente un moment dipolaire oscillant qui pourra interagir avec le champ électrique de la radiation incidente. Il n'y aura donc pas d'interaction avec les molécules telles que H 2, N 2, O 2. n Comme pour la rotation il existe une règle de sélection qui limite les transitions résultant de l'absorption ou de l'émission d'un quantum d'une radiation par la relation : D v = ± 1 n Habituellement, les spectres de vibration sont étudiés en spectroscopie d'absorption et on a donc la règle de sélection : D v = + 1

Dipôle moléculaire n Dans une molécule diatomique homonucléaire (composée d'atomes de même type), le nuage électronique se répartit équitablement sur les deux atomes. n Dans une molécule diatomique hétéronucléaire, l'atome le plus électronégatif polarise le nuage électronique à son profit. n On rationalise ce déplacement du nuage électronique par la notion de charge partielle. L'atome qui s'enrichit d'une portion du nuage électronique porte alors une charge partielle -d ; l'atome qui s'appauvrit porte une charge partielle positive +d La géométrie de la molécule de CO 2 est linéaire et symétrique, les deux moments de liaison C=O se compensent. Le moment dipolaire résultant est donc nul. http: //www. uel-pcsm. education. fr/consultation/reference/chimie/effelec 1/apprendre/fa 2. 001/content/access. htm

L’électron dans l’atome : paramètres fondamentaux

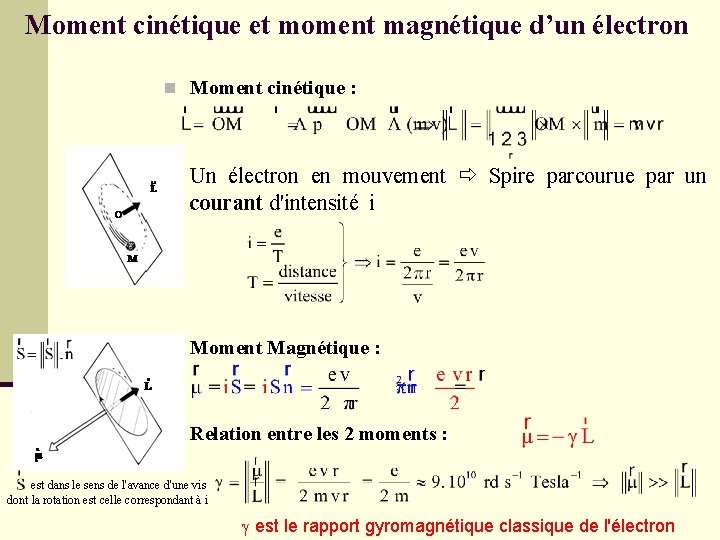
Moment cinétique et moment magnétique d’un électron n Moment cinétique : n Un électron en mouvement Spire parcourue par un courant d'intensité i n Moment Magnétique : n Relation entre les 2 moments : est dans le sens de l'avance d'une vis dont la rotation est celle correspondant à i g est le rapport gyromagnétique classique de l'électron

Les nombres quantiques n Le nombre quantique principal n n n Il définit donc la couche à laquelle appartient l'électron. Il fixe aussi, en première approximation, l'énergie de l'électron n 1 2 3 4 5 6 7 Niveau K L M N O P Q n Le nombre quantique orbital l : n n Il définit la sous-couche dans laquelle se trouve l'électron Il est lié à la quantification du moment cinétique n Le nombre quantique magnétique ml n Il est lié à la quantification de Lz (projection de sur l’axe de rotation z) : n ml = -l, -(l-1), . . . , 0, . . . , + (l-1), + l (2 l+1) orientations possibles du moment cinétique

Le nombre quantique magnétique ml n Choix de l’axe z ? ? n Il correspond au champ d'induction magnétique toujours présent dans l'atome. n Ce champ peut être dû au mouvement de l'électron luimême, à celui des autres électrons, au mouvement des protons du noyau etc. . . Il est souvent très faible, mais il existe.

Quantification du moment magnétique [ La norme du moment magnétique est également quantifiée [ La projection mz du moment magnétique sur l'axe z est également quantifiée :

L'atome (l'électron) dans un champ d'induction magnétique extérieur constant n Deux effets : un effet "dynamique" n un effet énergétique (effet Zeeman) n Electron dans un champ magnétique Effet dynamique n On obtient un mouvement de précession de Larmor qui provient du "couplage" entre le moment magnétique de l'électron et le champ n La fréquence angulaire du mouvement de rotation : = g B n Electron dans un champ magnétique Aspect énergétique n Une énergie potentielle E telle que : n n L'énergie totale d'un électron placé dans un champ magnétique extérieur : N’oublier pas d’ajouter E 0 dans l’expression de E E 0 est l'énergie quantifiée avant la mise en place du champ magnétique

Effet Zeeman n Il explique le dédoublement des niveaux d'énergie sous l'effet d'un champ d'induction magnétique. n Sous l'action de B apparition de raies supplémentaires n En spectroscopie atomique, les transitions électroniques dans un atome obéissent aux règles de sélection :

Spin de l'électron dans l'atome n L'électron possède un moment cinétique de rotation propre appelé "spin" n Le carré du moment cinétique de rotation propre de l'électron est quantifié : Avec : n La projection de sur l’axe des z (direction du champ magnétique) est également quantifiée : n Nombres quantiques de spin : n Le moment intrinsèque de rotation propre :

Couplage entre le champ d'induction magnétique et le moment magnétique de spin n Deux effets : un effet "dynamique" n un effet énergétique n Effet dynamique : n Comme dans le cas du mouvement orbital de l'électron, on obtient un mouvement de précession autour de la direction du champ n Aspect énergétique n Acquisition d’une énergie potentielle Ws telle que : n Apparition de deux niveaux d'énergie :

L’électron - Le rayonnement Interaction rayonnement électron

3 expériences qui ont mis à mal la MC L’effet Photoélectrique - Mis en évidence par HERTZ en 1888, c’est un phénomène de « libération » des électrons sous l’influence de la lumière (d’où son nom ). - En prêtant une nature ondulatoire à la lumière, on peut concevoir l’extraction d’électrons du métal (sous l’action de l’énergie de l’onde ). - On s’attend alors à ce qu’une augmentation de l’intensité lumineuse provoque une augmentation de l’énergie cinétique des électrons émis. Il n’en est rien ! - De nombreuses expériences ont montré que l’énergie de ces électrons émis est complètement indépendante de l’intensité de la lumière, que c’est le nombre de ces électrons qui augmente rigoureusement proportionnellement à l’intensité lumineuse. - Par contre, l’énergie cinétique des électrons éjectés augmente proportionnellement à la fréquence du rayonnement incident (et non pas en fonction de l’intensité) 1.

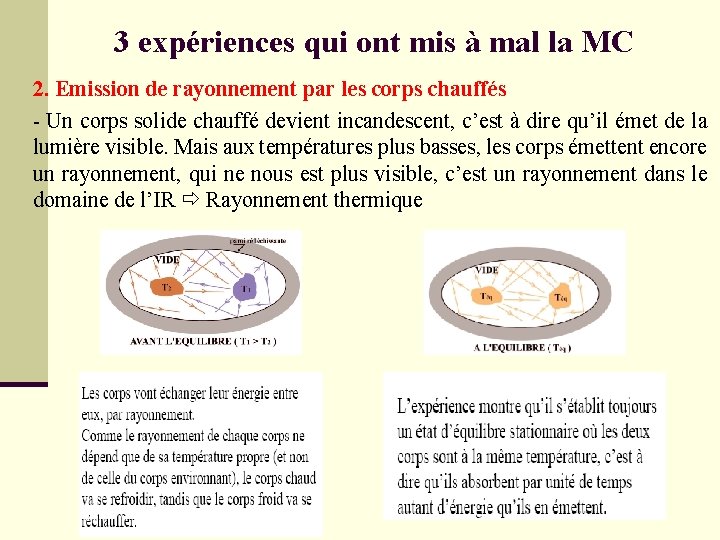
3 expériences qui ont mis à mal la MC 2. Emission de rayonnement par les corps chauffés - Un corps solide chauffé devient incandescent, c’est à dire qu’il émet de la lumière visible. Mais aux températures plus basses, les corps émettent encore un rayonnement, qui ne nous est plus visible, c’est un rayonnement dans le domaine de l’IR Rayonnement thermique


3 expériences qui ont mis à mal la MC 3. Emission de spectres de raies -Lorsque la lampe spectrale est chaude, les électrons émis par les électrodes entrent en collision avec les atomes de la vapeur, ces derniers vont alors passer dans des états excités, puis vont émettre du rayonnement lors de leur retour à l’état stable. - Là encore, la physique classique s’avère incapable de donner une interprétation correcte de la discontinuité observée : certaines raies sont permises, et non un ensemble continu de raies. Pourquoi les atomes n’émettent-ils que pour certaines longueurs d’onde ? Quelles raies sont émises par les différents atomes ? ………

Dualité onde corpuscule n La métaphore du cylindre est l'exemple d'un objet ayant des propriétés apparemment inconciliables. Il serait à première vue déroutant d'affirmer qu'un objet a à la fois les propriétés d'un cercle et d'un rectangle : sur un plan, un objet est soit un cercle, soit un rectangle. n Mais si l'on considère un cylindre : une projection dans l'axe du cylindre donne un cercle, et une projection perpendiculairement à cet axe donne un rectangle. n De la même manière, «onde» et «particule» sont des manières de voir les choses et non les choses en elles-mêmes.

Le Photon n Le photon est une particule élémentaire, de masse et de charge nulle n Un photon de fréquence (Hz) a pour énergie : n De Broglie avec sa loi sur la dualité onde-particule, réconcilie l'aspect corpusculaire de la lumière qu'incarne le photon et son aspect ondulatoire. Il a associé la quantité de mouvement d’une particule à une longueur d’onde (appelée longueur d’onde de de Broglie) : n Relation Energie/quantité de mouvement :

Les ondes sinusoïdales n Ce type d'onde a un grand intérêt car : beaucoup de phénomènes physiques simples engendrent des ondes sinusoïdales ; n on montre que toute onde périodique peut être représentée comme la superposition d'ondes sinusoïdales n Expression de l'élongation n

L'onde électromagnétique classique n Dans un référentiel cartésien, l'onde électromagnétique est caractérisée par un champ électrique , un champ d'induction magnétique et un vecteur d'onde n Equation d’ondes n Y représentent les composantes de ou n v est la norme de la vitesse de l'onde (v = c dans le vide) n Solution :

Onde électromagnétique plane n Une onde électromagnétique est qualifiée de plane lorsque ses coordonnées spatiales ne dépendent que d'un seul paramètre. n Les champs E et B sont fonction d'une seule coordonnée spatiale et d'une coordonnée temporelle. n Exemple : l'équation de propagation correspondant au champ électrique d’une onde plane se propageant suivant l’axe (oz) dans le vide est :
 Quelles sont les etapes du regroupement des armeniens
Quelles sont les etapes du regroupement des armeniens Phr v
Phr v Phr
Phr Hrci vs shrm certification
Hrci vs shrm certification Peer pressure meaning
Peer pressure meaning Benefits of phr
Benefits of phr Emr ehr phr
Emr ehr phr Sance 8
Sance 8 Construction de maison sancé
Construction de maison sancé Sance definition
Sance definition Sance 8
Sance 8 Introduction sur la gestion des stocks
Introduction sur la gestion des stocks Flash sance
Flash sance Sance 8
Sance 8 Sance definition
Sance definition Gas 101
Gas 101 Business etiquette 101: social skills for success download
Business etiquette 101: social skills for success download Municipal budgeting 101
Municipal budgeting 101 Forex 101
Forex 101 Seo 101 presentation
Seo 101 presentation Purpose of mechanical ventilation
Purpose of mechanical ventilation Rotary 101
Rotary 101 Purchasing 101 training
Purchasing 101 training Physics 101 final exam
Physics 101 final exam Hermeneutics 101
Hermeneutics 101 Undebit it
Undebit it Nurses touch socialization into professional nursing
Nurses touch socialization into professional nursing Uic disability resource center
Uic disability resource center Product management 101
Product management 101 Hugh thistlethwaite
Hugh thistlethwaite Prime numbers 101 to 200
Prime numbers 101 to 200 Lacl3
Lacl3 Dcs 101
Dcs 101 Ecg 101
Ecg 101 Hero 101 characters
Hero 101 characters Esc 101
Esc 101 Supercalifragilisticexpialidocious
Supercalifragilisticexpialidocious Stat 101
Stat 101





























































