Destylacja i Rektyfikacja Zastrzeenie Niektre materiay graficzne zamieszczone
















![Inżynieria Chemiczna i Procesowa Bilans materiałowy całej kolumny [mol/s]: Bilans składnika bardziej lotnego: Gdzie Inżynieria Chemiczna i Procesowa Bilans materiałowy całej kolumny [mol/s]: Bilans składnika bardziej lotnego: Gdzie](https://slidetodoc.com/presentation_image_h/f8f8ca8a135d37330b2c3d8573026abc/image-32.jpg)









- Slides: 72

Destylacja i Rektyfikacja Zastrzeżenie Niektóre materiały graficzne zamieszczone w tym dokumencie oraz w łączach zewnętrznych mogą być chronione prawem autorskim i jako takie są przeznaczone jedynie do użytku wewnętrznego na WIChi. P PW dla celów edukacyjnych Disclaimer Selected graphics in this document and external links can be copyright protected, and as such they are intended only for educational use at WIChi. P PW Materiały wykładowe opracowane w ramach projektu „Program Rozwojowy Politechniki Warszawskiej” współfinansowanego ze środków Unii Europejskiej

Inżynieria Chemiczna i Procesowa Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

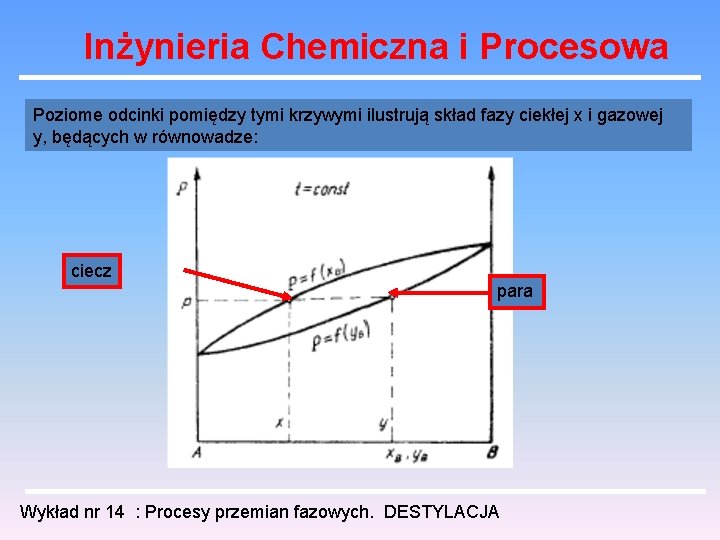
Inżynieria Chemiczna i Procesowa Poziome odcinki pomiędzy tymi krzywymi ilustrują skład fazy ciekłej x i gazowej y, będących w równowadze: ciecz para Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Dysponując pękiem takich izoterm, można skonstruować izobarę równowagi dla określonego ciśnienia: Wykres izobary podaje więc temperatury wrzenia t cieczy o składzie x, pod danym ciśnieniem P, oraz skład pary y będącej w równowadze z tą cieczą. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

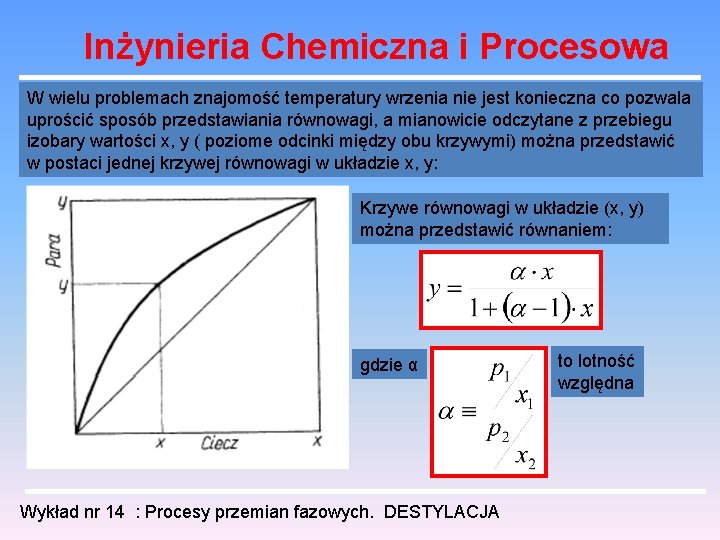
Inżynieria Chemiczna i Procesowa W wielu problemach znajomość temperatury wrzenia nie jest konieczna co pozwala uprościć sposób przedstawiania równowagi, a mianowicie odczytane z przebiegu izobary wartości x, y ( poziome odcinki między obu krzywymi) można przedstawić w postaci jednej krzywej równowagi w układzie x, y: Krzywe równowagi w układzie (x, y) można przedstawić równaniem: gdzie α Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA to lotność względna

Inżynieria Chemiczna i Procesowa Oprócz wykresów fazowych w obliczeniach destylacyjnych stosuje się wykresy entalpowe. Przebieg izoterm dla fazy ciekłej konstruuje się na wykresie entalpowym analogicznie jak przy krystalizacji w oparciu o dane ciepła rozpuszczania i rozcieńczania. Dysponując przebiegiem izoterm można określić ciepła mieszania izotermicznego qx lub też zmiany temperatury przy mieszaniu adiabatycznym: Wpływ ciśnienia na entalpie cieczy jest niewielki. W przybliżeniu można przyjąć wartość tych samych izoterm cieczy dla dużego zakresu ciśnień. W zakresie fazy parowej izotermy są liniami prostymi, gdyż przy mieszaniu gazów nie ma efektów cieplnych. Entalpia pary czystego składnika może być określone przez dodanie ciepła molowego parowania L do entalpii cieczy w tej samej temperaturze. Również dla fazy gazowej pomija się na ogół wpływ ciśnienia na entalpię. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

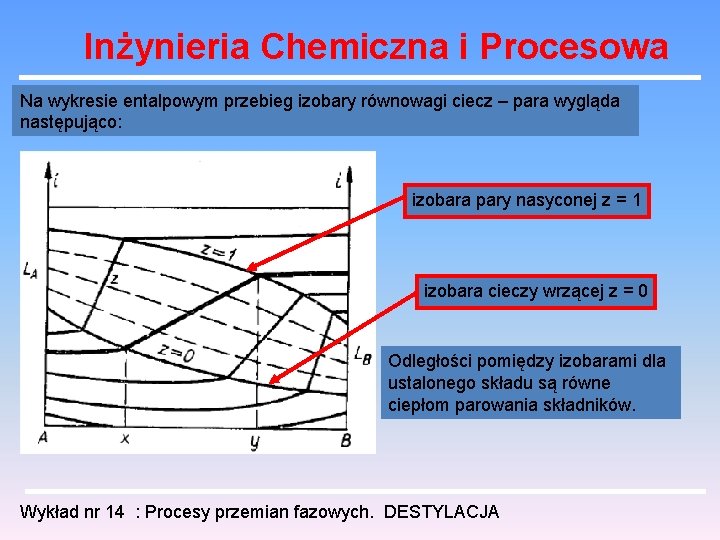
Inżynieria Chemiczna i Procesowa Na wykresie entalpowym przebieg izobary równowagi ciecz – para wygląda następująco: izobara pary nasyconej z = 1 izobara cieczy wrzącej z = 0 Odległości pomiędzy izobarami dla ustalonego składu są równe ciepłom parowania składników. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Destylacja równowagowa dwuskładnikowa Proces destylacji równowagowej polega na częściowym odparowaniu surówki S w ten sposób, aby powstałe opary D stykały się z cieczą pozostałą W. Zwykle odbywa się to podczas przepływu surówki przez ogrzewaną z zewnątrz rurę. W układzie takim w każdym przekroju rury panują warunki zbliżone do równowagowych. Przebieg tego procesu dla mieszaniny dwuskładnikowej można przedstawić na wykresie: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Znając ciśnienie procesu oraz temperaturę t 1 do której została zagrzana surówka S o stanie x 0 t 0 z wykresu odczytamy skład x cieczy wyczerpanej W o raz y Destylatu: Bilans masowy procesu opisują równania: stąd można wyznaczyć stopień destylacji Zd czyli stosunek ilości destylatu ( w molach) do ilości surówki: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

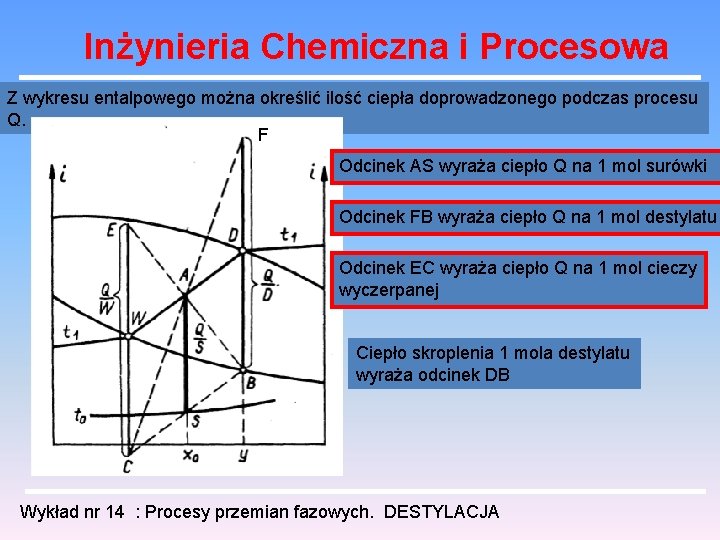
Inżynieria Chemiczna i Procesowa Z wykresu entalpowego można określić ilość ciepła doprowadzonego podczas procesu Q. F Odcinek AS wyraża ciepło Q na 1 mol surówki Odcinek FB wyraża ciepło Q na 1 mol destylatu Odcinek EC wyraża ciepło Q na 1 mol cieczy wyczerpanej Ciepło skroplenia 1 mola destylatu wyraża odcinek DB Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

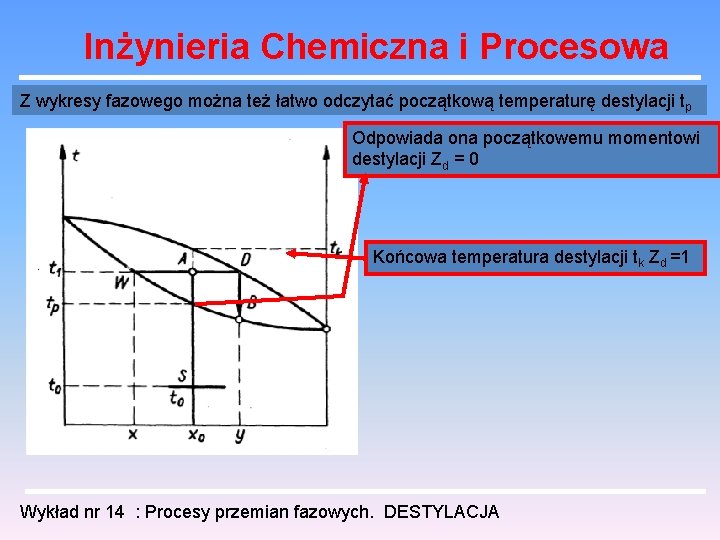
Inżynieria Chemiczna i Procesowa Z wykresy fazowego można też łatwo odczytać początkową temperaturę destylacji tp Odpowiada ona początkowemu momentowi destylacji Zd = 0 Końcowa temperatura destylacji tk Zd =1 Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Proces destylacji równowagowej można też interpretować na wykresie (x, y). Z równań bilansowych wynika zależność: stosunek W / D można przedstawić następująco: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Na wykresie (x, y) ostatniej zależności odpowiada linia AB y 0 Z punktu A o współrzędnych odpowiadających stanowi surówki S kreślimy linię o nachylaniu W / D obliczonym dla żądanego stopnia destylacji Zd. Przecięcie tej linii z krzywą równowagi daje skład odcieku x i oparów y ( punkt B ). Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

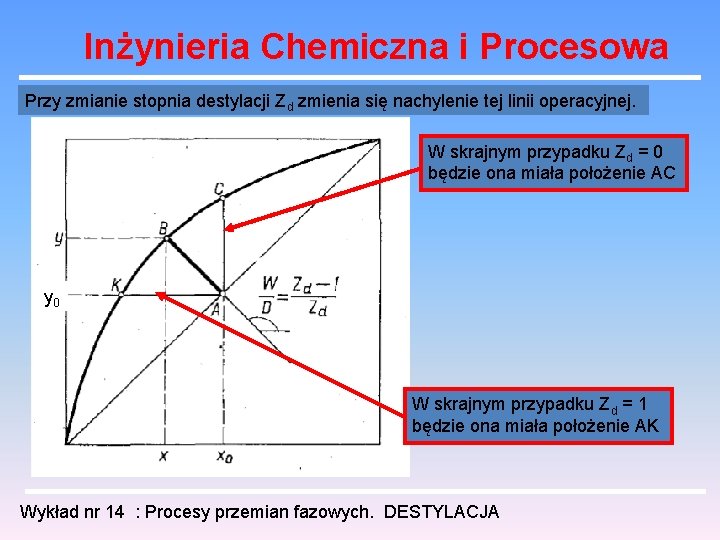
Inżynieria Chemiczna i Procesowa Przy zmianie stopnia destylacji Zd zmienia się nachylenie tej linii operacyjnej. W skrajnym przypadku Zd = 0 będzie ona miała położenie AC y 0 W skrajnym przypadku Zd = 1 będzie ona miała położenie AK Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Wartość stopnia destylacji można też odczytać z wykresu fazowego. Jeżeli jest określona temperatura końcowa procesu określona jest wtedy linia równowagi WD. Prowadzimy dwie linie pomocnicze 0 W i 1 D , które przecinają się w punkcie operacyjnym R. Linia RA wyznacza na osi układu odcinek 0 K równy stopniowi destylacji Zd Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Destylacja ekspansyjna (przez samoodparowanie) Ciśnienie, pod którym odbywa się destylacja, ma duży wpływ na równowagę. Dla różnych ciśnień inaczej uzyskuje się położenie izobary: Im wyższe ciśnienie tym wyżej leży na wykresie odpowiednia izobara. Im niższe ciśnienie tym dalej względem siebie leżą linia cieczy i linia pary. Oznacza to że pod niskimi ciśnieniami panują szczególnie korzystne warunki rozfrakcjonowania. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

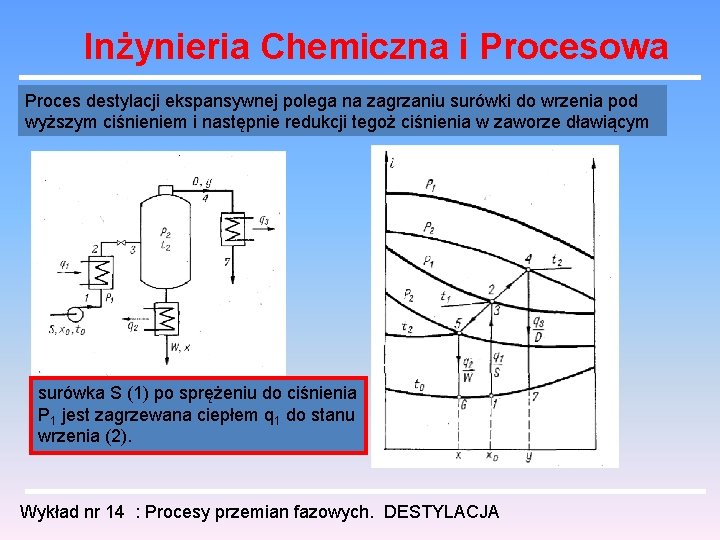
Inżynieria Chemiczna i Procesowa Proces destylacji ekspansywnej polega na zagrzaniu surówki do wrzenia pod wyższym ciśnieniem i następnie redukcji tegoż ciśnienia w zaworze dławiącym surówka S (1) po sprężeniu do ciśnienia P 1 jest zagrzewana ciepłem q 1 do stanu wrzenia (2). Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

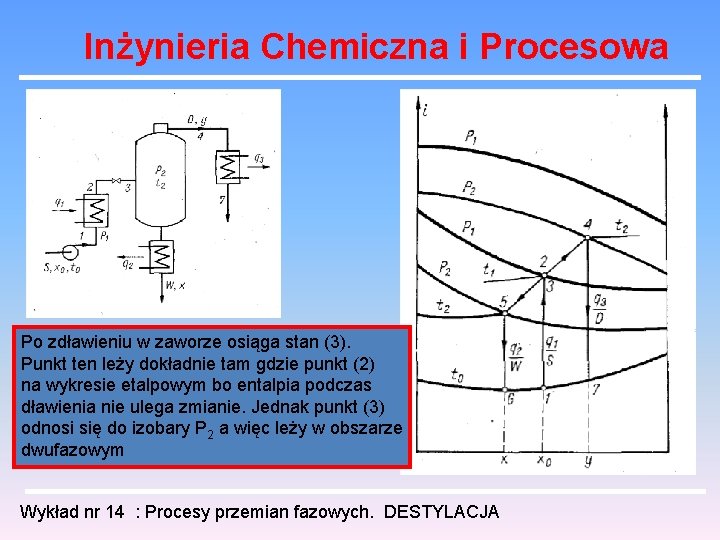
Inżynieria Chemiczna i Procesowa Po zdławieniu w zaworze osiąga stan (3). Punkt ten leży dokładnie tam gdzie punkt (2) na wykresie etalpowym bo entalpia podczas dławienia nie ulega zmianie. Jednak punkt (3) odnosi się do izobary P 2 a więc leży w obszarze dwufazowym Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

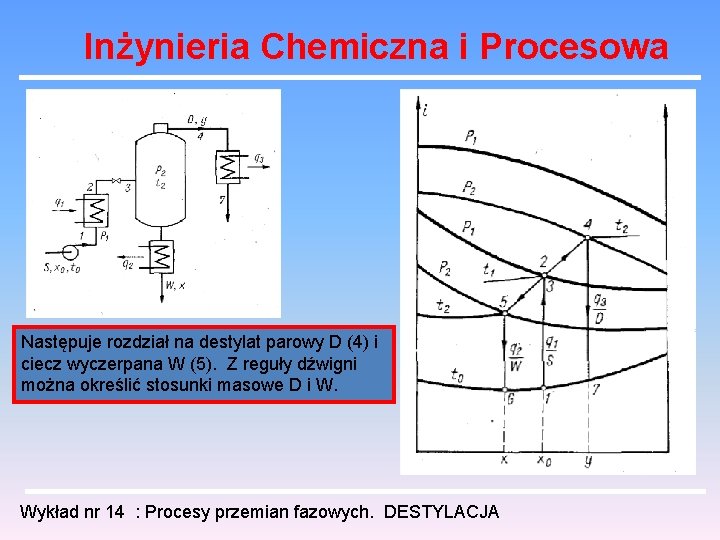
Inżynieria Chemiczna i Procesowa Następuje rozdział na destylat parowy D (4) i ciecz wyczerpana W (5). Z reguły dźwigni można określić stosunki masowe D i W. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

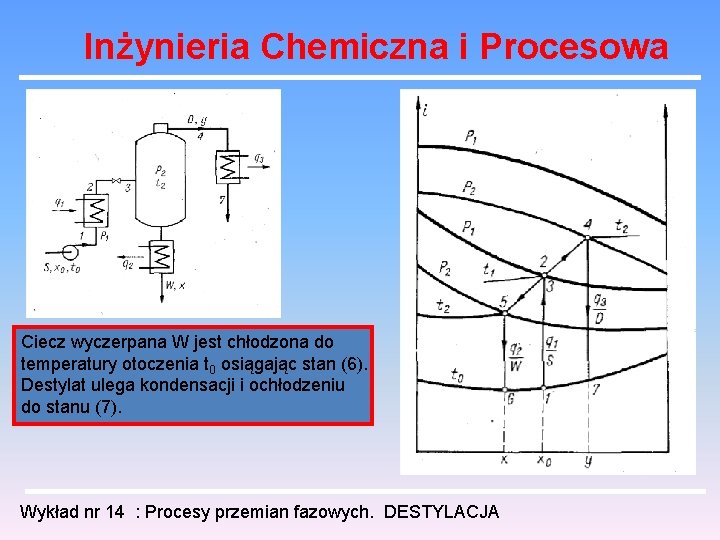
Inżynieria Chemiczna i Procesowa Ciecz wyczerpana W jest chłodzona do temperatury otoczenia t 0 osiągając stan (6). Destylat ulega kondensacji i ochłodzeniu do stanu (7). Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Z wykresu można wyznaczyć zużycie ciepła w zagrzewaczu na 1 mol surówki : (1) – (2) q 1 / S Odcinek (5)- (6) określa ilość ciepła oddanego przez ciecz wyczerpaną W na 1 mol cieczy wyczerpanej: q 2 / W Odcinek (4)- (7) określa ilość ciepła oddanego przez destylat D na 1 mol destylatu: wyczerpanej: q 3 / D Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Destylacja prosta różniczkowa Proces ten prowadzony jest w ten sposób że opary w miarę powstawania usuwane są z nad cieczy. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

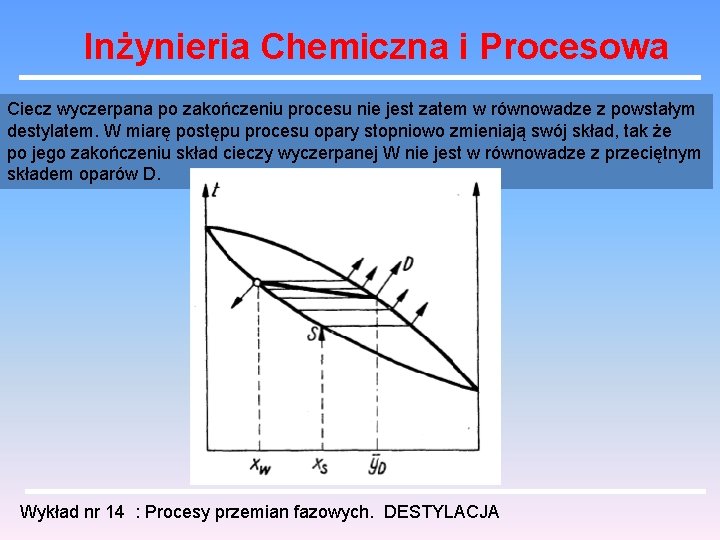
Inżynieria Chemiczna i Procesowa Ciecz wyczerpana po zakończeniu procesu nie jest zatem w równowadze z powstałym destylatem. W miarę postępu procesu opary stopniowo zmieniają swój skład, tak że po jego zakończeniu skład cieczy wyczerpanej W nie jest w równowadze z przeciętnym składem oparów D. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

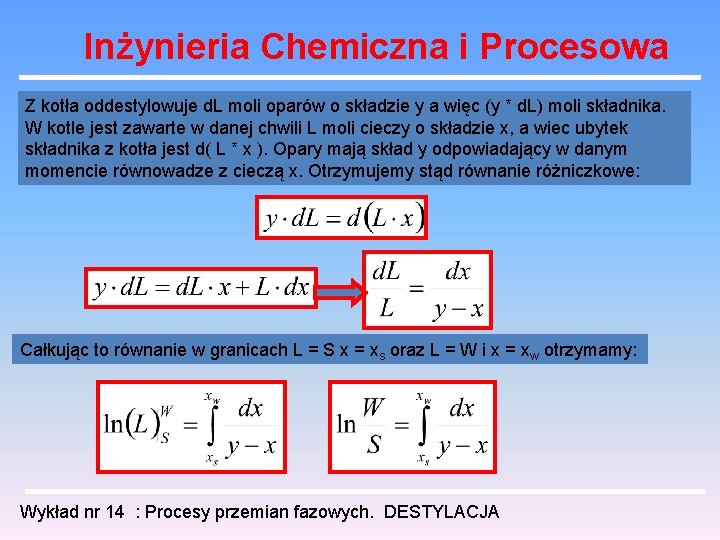
Inżynieria Chemiczna i Procesowa Z kotła oddestylowuje d. L moli oparów o składzie y a więc (y * d. L) moli składnika. W kotle jest zawarte w danej chwili L moli cieczy o składzie x, a wiec ubytek składnika z kotła jest d( L * x ). Opary mają skład y odpowiadający w danym momencie równowadze z cieczą x. Otrzymujemy stąd równanie różniczkowe: Całkując to równanie w granicach L = S x = xs oraz L = W i x = xw otrzymamy: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

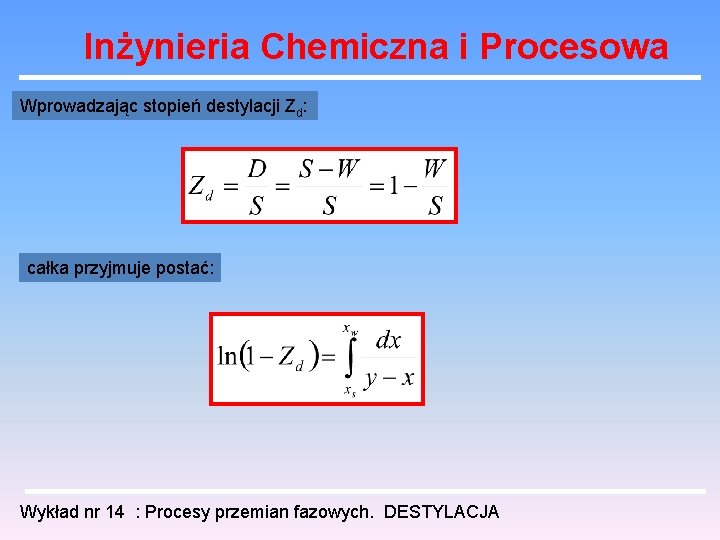
Inżynieria Chemiczna i Procesowa Wprowadzając stopień destylacji Zd: całka przyjmuje postać: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

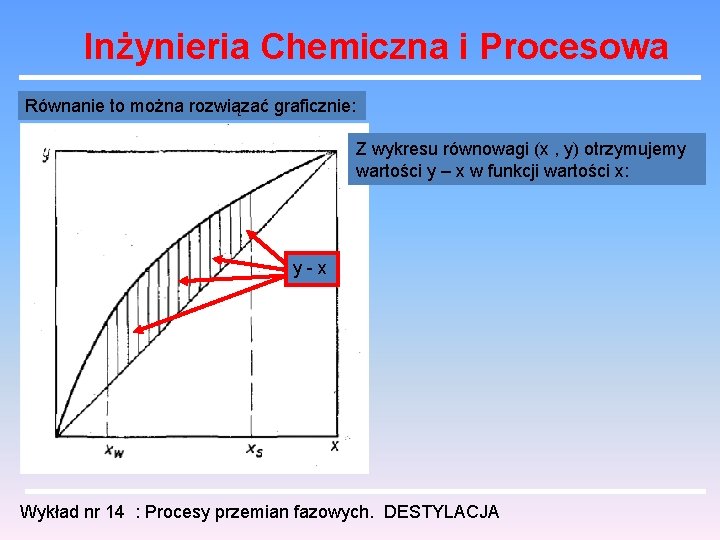
Inżynieria Chemiczna i Procesowa Równanie to można rozwiązać graficznie: Z wykresu równowagi (x , y) otrzymujemy wartości y – x w funkcji wartości x: y-x Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Następnie wykreślamy zależność wartości 1 / ( y – x ) w funkcji x Pole pod wykresem w granicach xw – ws równe jest wartości szukanej całki. Znając stopień destylacji Zd obliczamy ilość destylatu D. Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Jeżeli można przyjąć stałość lotności względnej wówczas równowagę opisuje równanie: Stąd wartość całki można wyznaczyć analitycznie: Przeciętny skład destylatu można określić z bilansu jednego składnika: Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

Inżynieria Chemiczna i Procesowa Znając temperaturę w kotle na początku procesu t 1 i na końcu procesu t 2 oraz przeciętny skład destylatu yd z wykresu entalpowego można odczytać ilość ciepła zużytą w tym procesie: zakładamy że przeciętne opary są w stanie pary nasyconej Wykład nr 14 : Procesy przemian fazowych. DESTYLACJA

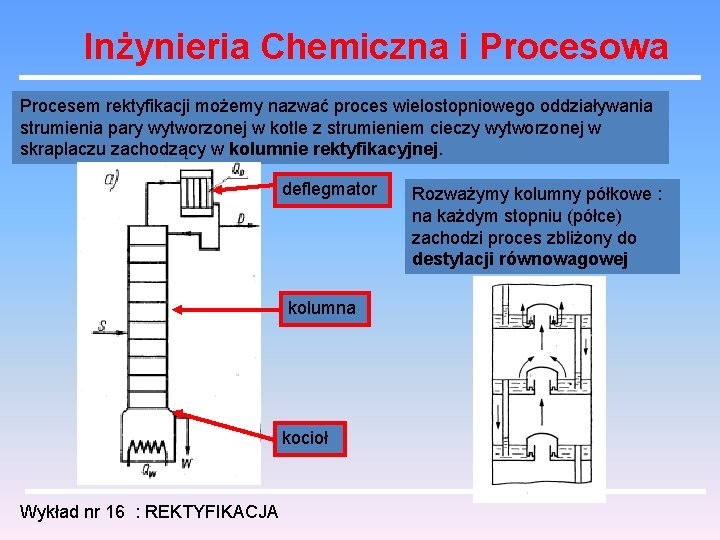
Inżynieria Chemiczna i Procesowa Procesem rektyfikacji możemy nazwać proces wielostopniowego oddziaływania strumienia pary wytworzonej w kotle z strumieniem cieczy wytworzonej w skraplaczu zachodzący w kolumnie rektyfikacyjnej. deflegmator kolumna kocioł Wykład nr 16 : REKTYFIKACJA Rozważymy kolumny półkowe : na każdym stopniu (półce) zachodzi proces zbliżony do destylacji równowagowej

Inżynieria Chemiczna i Procesowa W takim układzie zmiany składu faz zachodzą w sposób skokowy. Kolumna może być zaopatrzona w deflegmator całkowicie skraplający, w którym opary z kolumny ulegają całkowitemu skropleniu. Odpowiednia część skroplin jest zawracana do kolumny jako flegma resztę zaś stanowi ciekły destylat. Kolumna może posiadać deflegmator częściowo skraplający. Przez regulacje ilości wody chłodzącej tylko cześć oparów ulega kondensacji (flegma) a resztę stanowi parowy destylat ulegający kondensacji w osobnym skraplaczu. Wykład nr 16 : REKTYFIKACJA
![Inżynieria Chemiczna i Procesowa Bilans materiałowy całej kolumny mols Bilans składnika bardziej lotnego Gdzie Inżynieria Chemiczna i Procesowa Bilans materiałowy całej kolumny [mol/s]: Bilans składnika bardziej lotnego: Gdzie](https://slidetodoc.com/presentation_image_h/f8f8ca8a135d37330b2c3d8573026abc/image-32.jpg)
Inżynieria Chemiczna i Procesowa Bilans materiałowy całej kolumny [mol/s]: Bilans składnika bardziej lotnego: Gdzie xs , x. D , x. W to ułamki molowe składnika Wykład nr 16 : REKTYFIKACJA

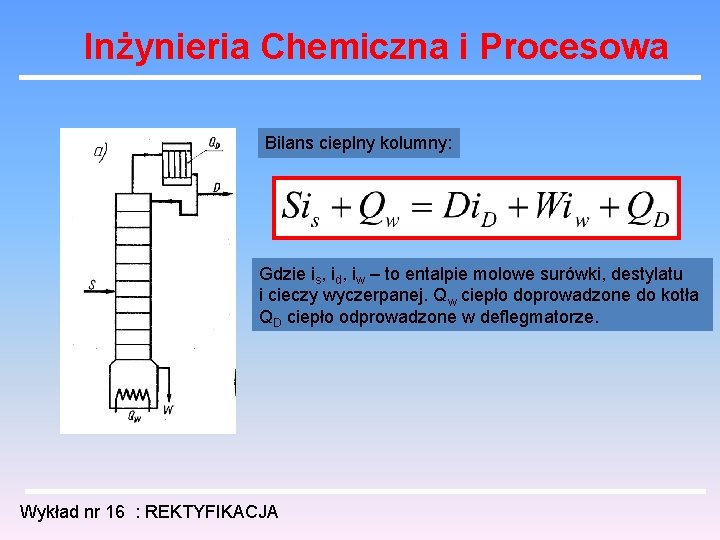
Inżynieria Chemiczna i Procesowa Bilans cieplny kolumny: Gdzie is, id, iw – to entalpie molowe surówki, destylatu i cieczy wyczerpanej. Qw ciepło doprowadzone do kotła QD ciepło odprowadzone w deflegmatorze. Wykład nr 16 : REKTYFIKACJA

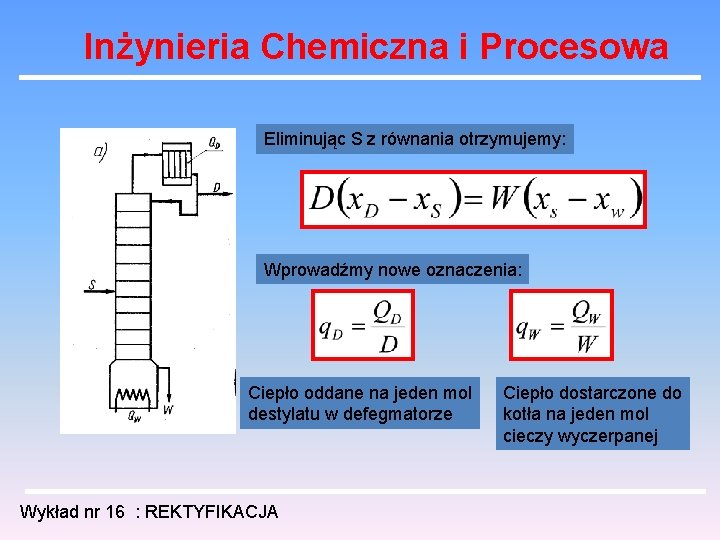
Inżynieria Chemiczna i Procesowa Eliminując S z równania otrzymujemy: Wprowadźmy nowe oznaczenia: Ciepło oddane na jeden mol destylatu w defegmatorze Wykład nr 16 : REKTYFIKACJA Ciepło dostarczone do kotła na jeden mol cieczy wyczerpanej

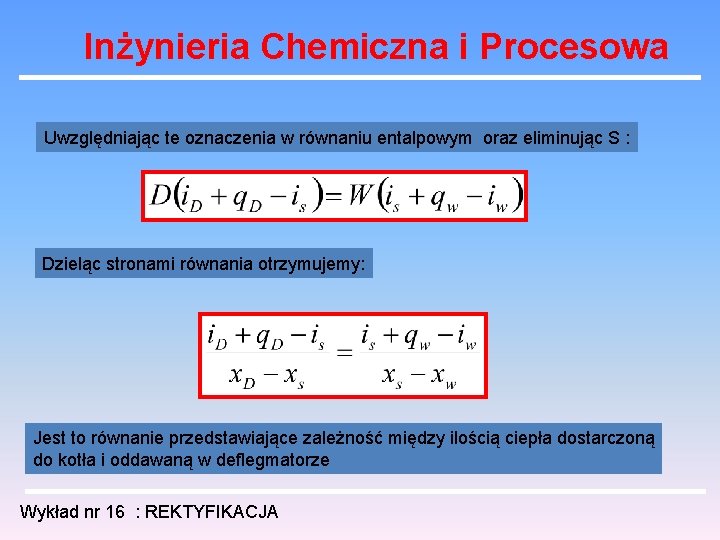
Inżynieria Chemiczna i Procesowa Uwzględniając te oznaczenia w równaniu entalpowym oraz eliminując S : Dzieląc stronami równania otrzymujemy: Jest to równanie przedstawiające zależność między ilością ciepła dostarczoną do kotła i oddawaną w deflegmatorze Wykład nr 16 : REKTYFIKACJA

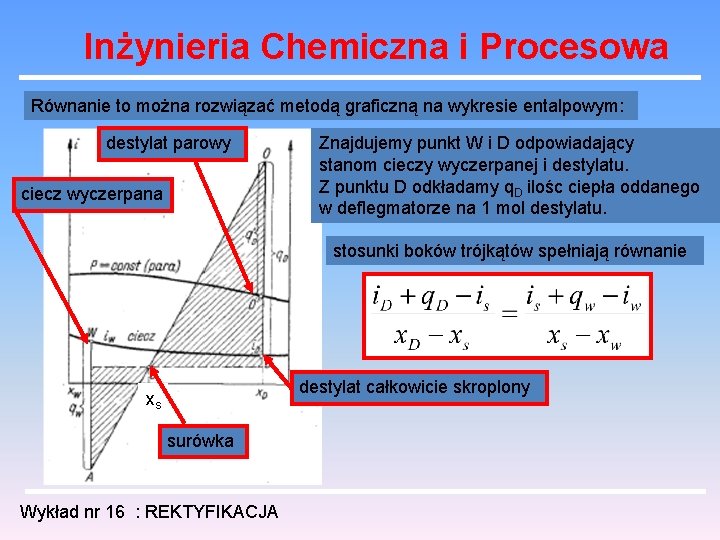
Inżynieria Chemiczna i Procesowa Równanie to można rozwiązać metodą graficzną na wykresie entalpowym: destylat parowy ciecz wyczerpana Znajdujemy punkt W i D odpowiadający stanom cieczy wyczerpanej i destylatu. Z punktu D odkładamy q. D ilośc ciepła oddanego w deflegmatorze na 1 mol destylatu. stosunki boków trójkątów spełniają równanie destylat całkowicie skroplony xs surówka Wykład nr 16 : REKTYFIKACJA

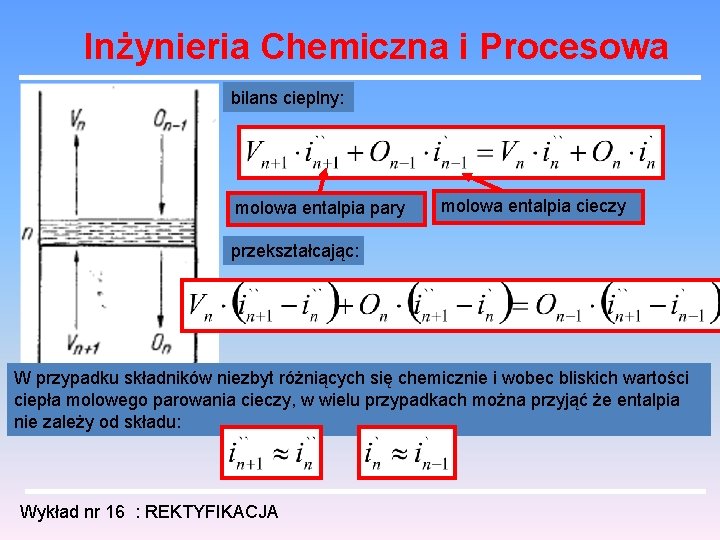
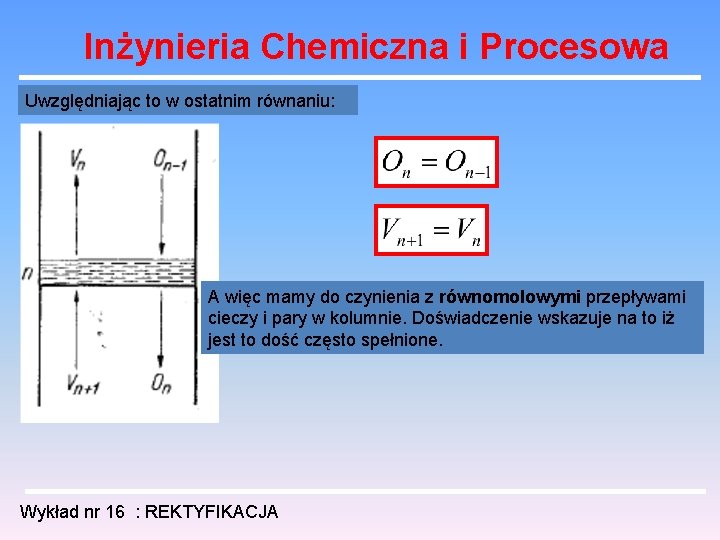
Inżynieria Chemiczna i Procesowa Analiza pracy kolumny rektyfikacyjnej Analizę pracy kolumny rozpoczniemy dla przypadku tzw. przepływów równomolowych liczba moli oparów dopływających na dana półkę - Vn+1 liczba moli oparów odpływających z danej półki - Vn liczba moli odcieku dopływającego do danej półki – On-1 liczba moli odcieku odpływającego z danej półki – On bilans masowy: Wykład nr 16 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa bilans cieplny: molowa entalpia pary molowa entalpia cieczy przekształcając: W przypadku składników niezbyt różniących się chemicznie i wobec bliskich wartości ciepła molowego parowania cieczy, w wielu przypadkach można przyjąć że entalpia nie zależy od składu: Wykład nr 16 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Uwzględniając to w ostatnim równaniu: A więc mamy do czynienia z równomolowymi przepływami cieczy i pary w kolumnie. Doświadczenie wskazuje na to iż jest to dość często spełnione. Wykład nr 16 : REKTYFIKACJA

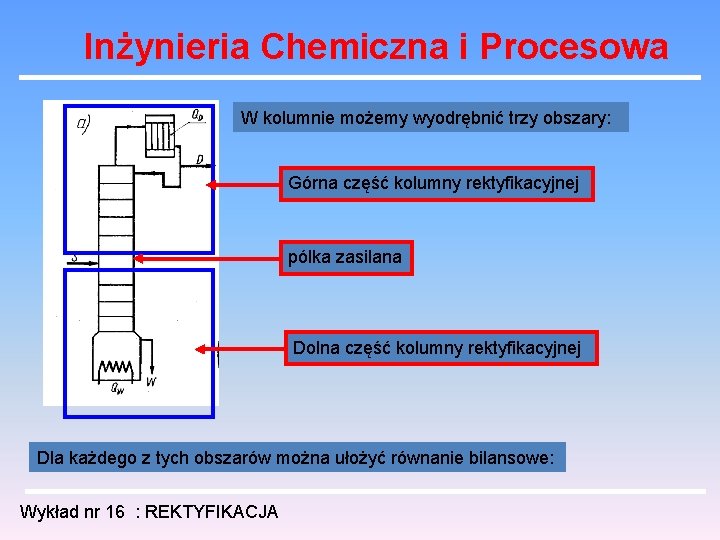
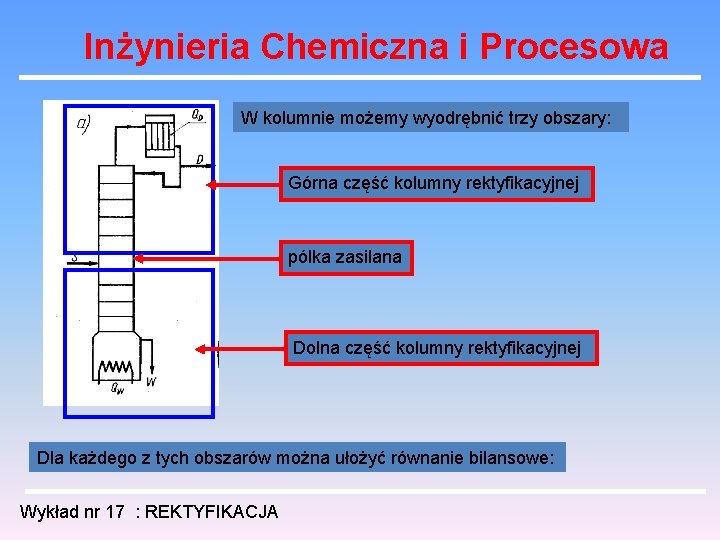
Inżynieria Chemiczna i Procesowa W kolumnie możemy wyodrębnić trzy obszary: Górna część kolumny rektyfikacyjnej pólka zasilana Dolna część kolumny rektyfikacyjnej Dla każdego z tych obszarów można ułożyć równanie bilansowe: Wykład nr 16 : REKTYFIKACJA

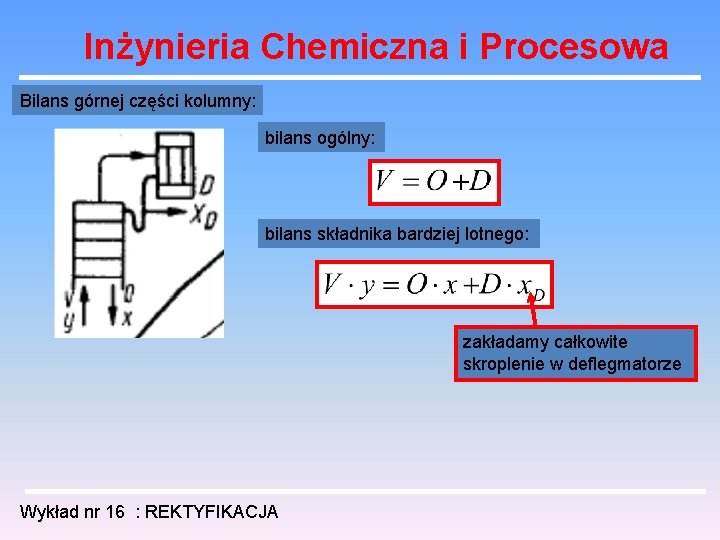
Inżynieria Chemiczna i Procesowa Bilans górnej części kolumny: bilans ogólny: bilans składnika bardziej lotnego: zakładamy całkowite skroplenie w deflegmatorze Wykład nr 16 : REKTYFIKACJA

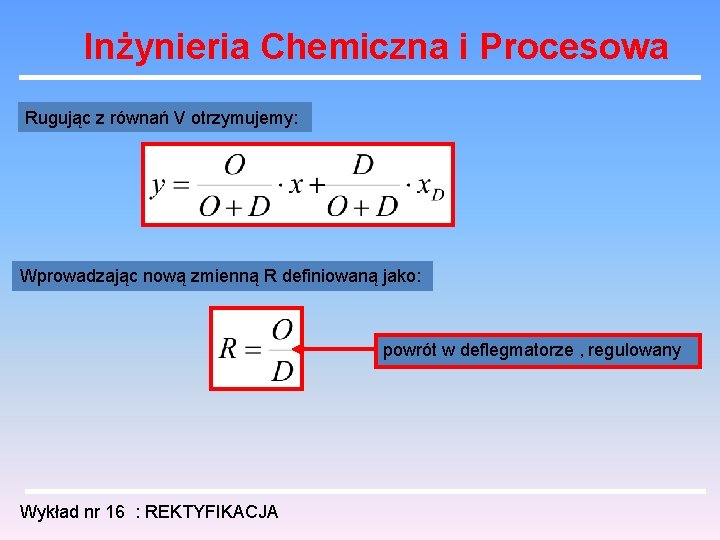
Inżynieria Chemiczna i Procesowa Rugując z równań V otrzymujemy: Wprowadzając nową zmienną R definiowaną jako: powrót w deflegmatorze , regulowany Wykład nr 16 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Otrzymujemy równanie „górnej linii operacyjnej”: na wykresie (x , y) jest to linia prosta przechodząca przez punkt określający skład destylatu x = x. D i o nachyleniu R / R+1 Równanie to podaje zależność między składem cieczy i pary w przekrojach pomiędzy półkami w górnej części kolumny Wykład nr 16 : REKTYFIKACJA

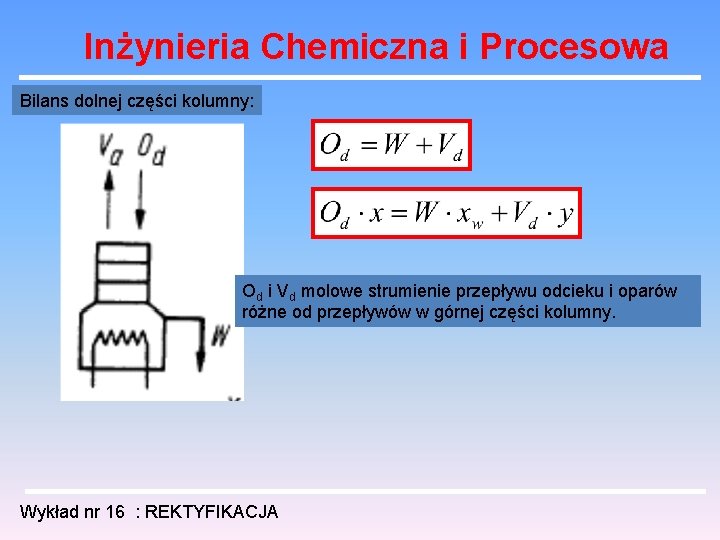
Inżynieria Chemiczna i Procesowa Bilans dolnej części kolumny: Od i Vd molowe strumienie przepływu odcieku i oparów różne od przepływów w górnej części kolumny. Wykład nr 16 : REKTYFIKACJA

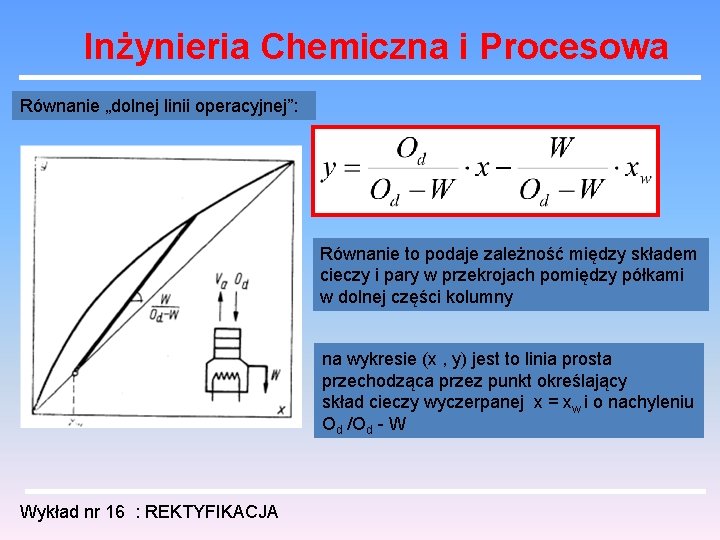
Inżynieria Chemiczna i Procesowa Równanie „dolnej linii operacyjnej”: Równanie to podaje zależność między składem cieczy i pary w przekrojach pomiędzy półkami w dolnej części kolumny na wykresie (x , y) jest to linia prosta przechodząca przez punkt określający skład cieczy wyczerpanej x = xw i o nachyleniu Od /Od - W Wykład nr 16 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa W kolumnie możemy wyodrębnić trzy obszary: Górna część kolumny rektyfikacyjnej pólka zasilana Dolna część kolumny rektyfikacyjnej Dla każdego z tych obszarów można ułożyć równanie bilansowe: Wykład nr 17 : REKTYFIKACJA

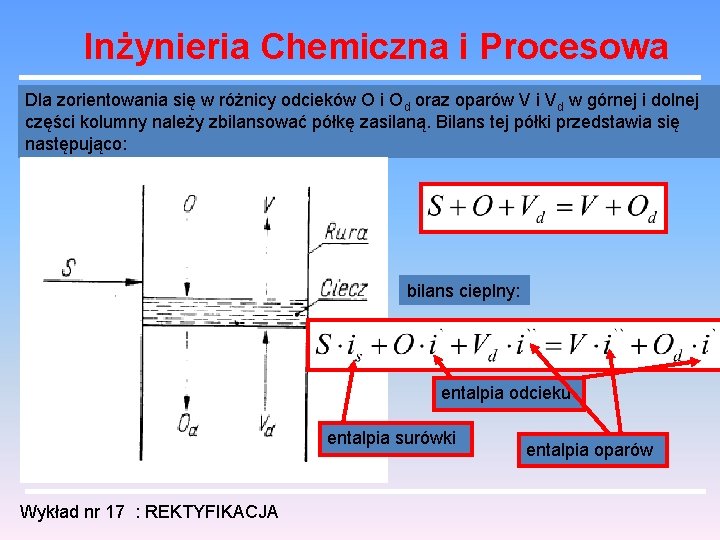
Inżynieria Chemiczna i Procesowa Dla zorientowania się w różnicy odcieków O i Od oraz oparów V i Vd w górnej i dolnej części kolumny należy zbilansować półkę zasilaną. Bilans tej półki przedstawia się następująco: bilans cieplny: entalpia odcieku entalpia surówki Wykład nr 17 : REKTYFIKACJA entalpia oparów

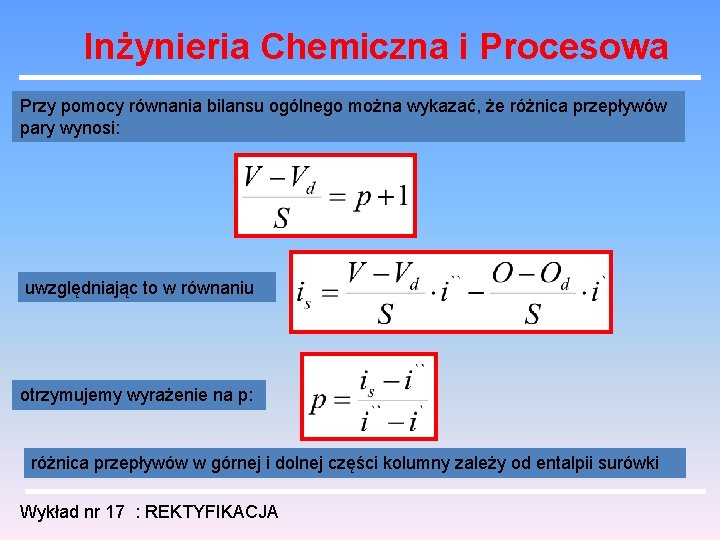
Inżynieria Chemiczna i Procesowa entalpie odcieku i oparów nie zmieniają się przy przejściu przez półkę, stąd po przekształceniu otrzymujemy równanie: oznaczmy względną różnicę odcieków w górnej i dolnej części kolumny przez p: Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Przy pomocy równania bilansu ogólnego można wykazać, że różnica przepływów pary wynosi: uwzględniając to w równaniu otrzymujemy wyrażenie na p: różnica przepływów w górnej i dolnej części kolumny zależy od entalpii surówki Wykład nr 17 : REKTYFIKACJA

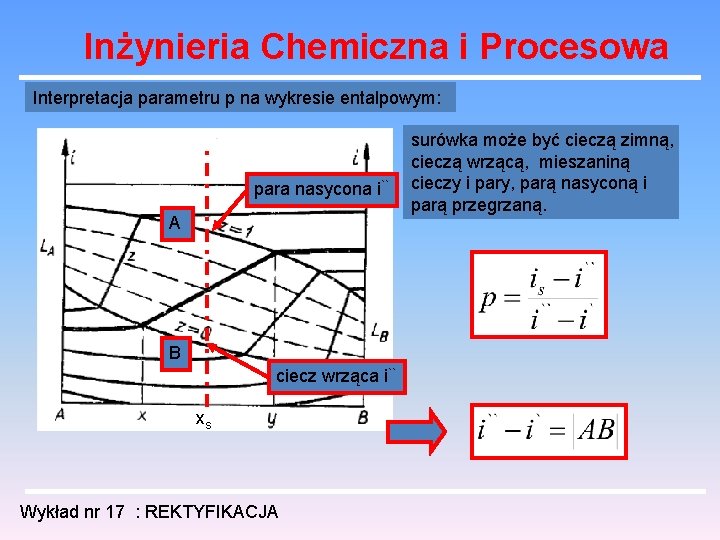
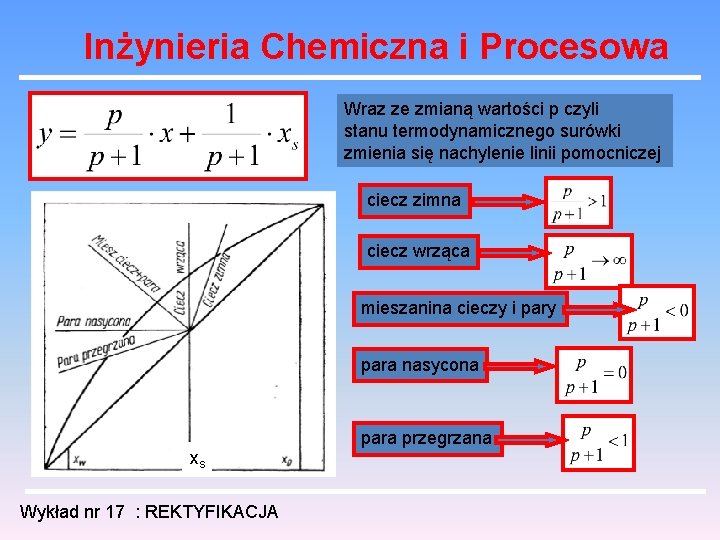
Inżynieria Chemiczna i Procesowa Interpretacja parametru p na wykresie entalpowym: para nasycona i`` A B ciecz wrząca i`` xs Wykład nr 17 : REKTYFIKACJA surówka może być cieczą zimną, cieczą wrzącą, mieszaniną cieczy i pary, parą nasyconą i parą przegrzaną.

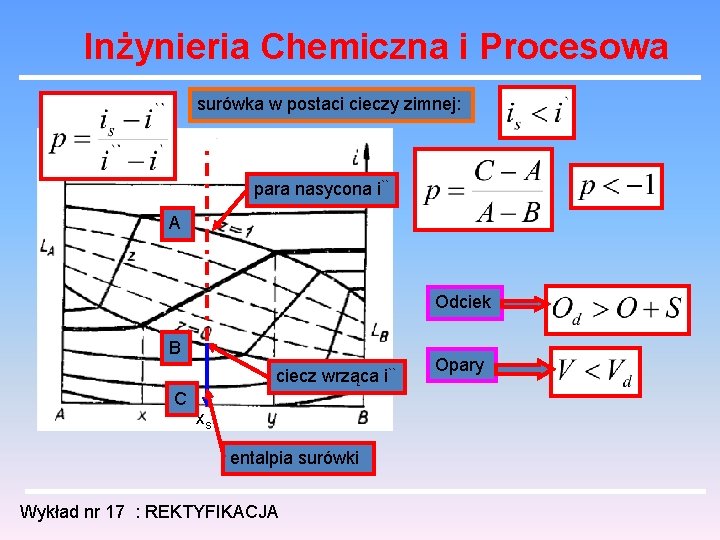
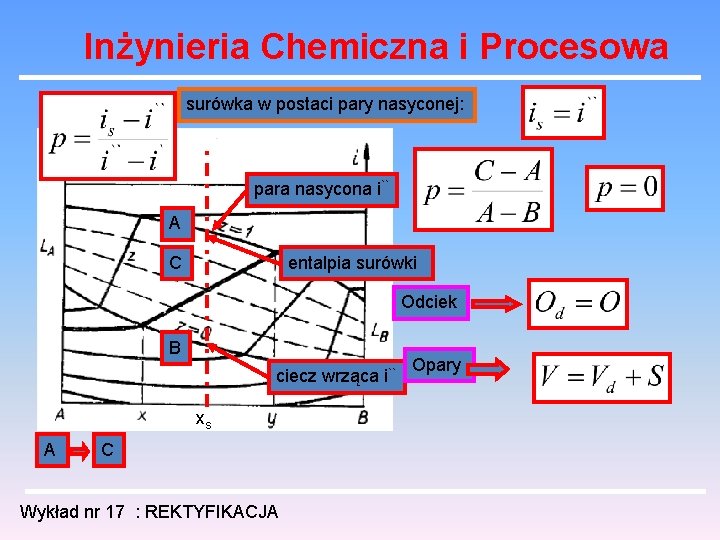
Inżynieria Chemiczna i Procesowa surówka w postaci cieczy zimnej: para nasycona i`` A Odciek B ciecz wrząca i`` C xs entalpia surówki Wykład nr 17 : REKTYFIKACJA Opary

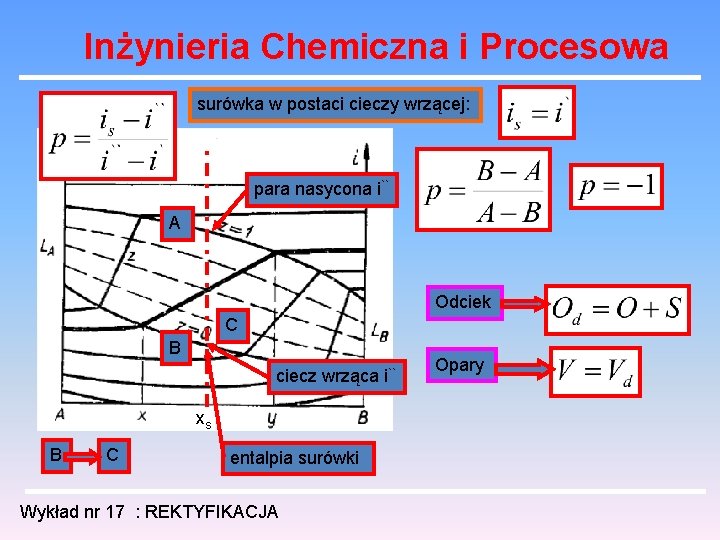
Inżynieria Chemiczna i Procesowa surówka w postaci cieczy wrzącej: para nasycona i`` A Odciek C B ciecz wrząca i`` xs B C entalpia surówki Wykład nr 17 : REKTYFIKACJA Opary

Inżynieria Chemiczna i Procesowa surówka w postaci mieszaniny cieczy i pary: para nasycona i`` A entalpia surówki C Odciek B ciecz wrząca i`` xs Wykład nr 17 : REKTYFIKACJA Opary

Inżynieria Chemiczna i Procesowa surówka w postaci pary nasyconej: para nasycona i`` A C entalpia surówki Odciek B ciecz wrząca i`` xs A C Wykład nr 17 : REKTYFIKACJA Opary

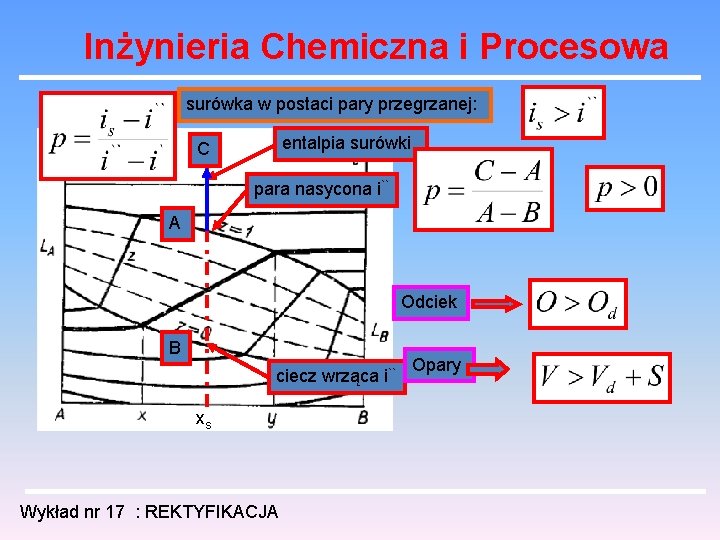
Inżynieria Chemiczna i Procesowa surówka w postaci pary przegrzanej: entalpia surówki C para nasycona i`` A Odciek B ciecz wrząca i`` xs Wykład nr 17 : REKTYFIKACJA Opary

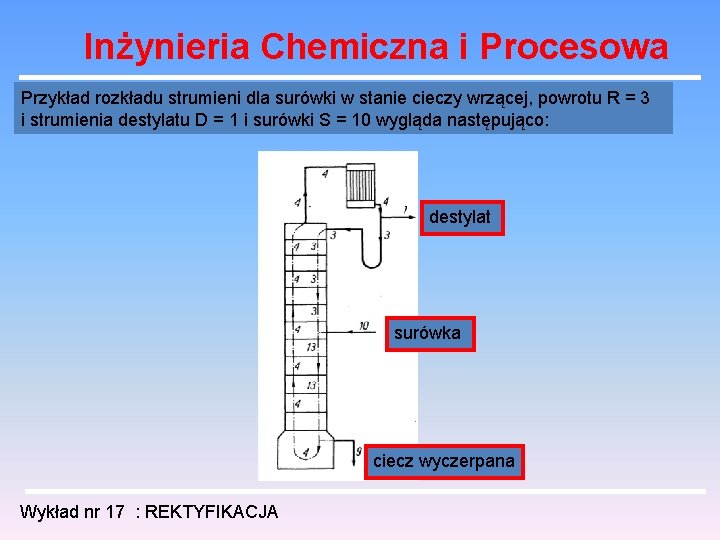
Inżynieria Chemiczna i Procesowa Przykład rozkładu strumieni dla surówki w stanie cieczy wrzącej, powrotu R = 3 i strumienia destylatu D = 1 i surówki S = 10 wygląda następująco: destylat surówka ciecz wyczerpana Wykład nr 17 : REKTYFIKACJA

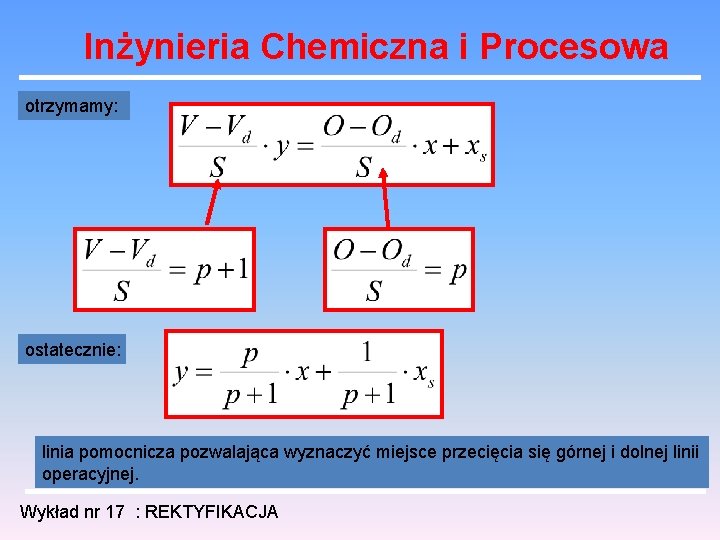
Inżynieria Chemiczna i Procesowa Znając entalpie surówki, a stąd parametr p mówiący o różnicy odcieków w górnej i dolnej części kolumny, można określić miejsce przecięcie się górnej i dolnej linii operacyjnej. Najwygodniej wypisać równania tych linii w postaci: Sumując je i uwzględniając równanie bilansu całej kolumny dla jednego składnika: Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa otrzymamy: ostatecznie: linia pomocnicza pozwalająca wyznaczyć miejsce przecięcia się górnej i dolnej linii operacyjnej. Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Wraz ze zmianą wartości p czyli stanu termodynamicznego surówki zmienia się nachylenie linii pomocniczej ciecz zimna ciecz wrząca mieszanina cieczy i pary para nasycona xs Wykład nr 17 : REKTYFIKACJA para przegrzana

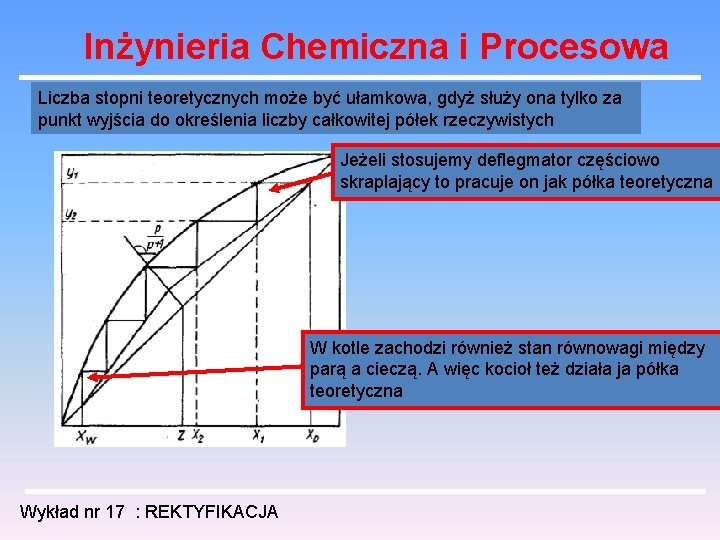
Inżynieria Chemiczna i Procesowa Aby otrzymywać rozwiązania typy granicznego wprowadzono koncepcję tzw. półki „teoretycznej”. Ciecz C opuszczająca taką półkę jest w stanie równowagi z parą D opuszczającą półkę. Obie fazy mają więc tę samą temperaturę i składy związane krzywą równowagi. Na półce zatem skład cieczy zmienia się B C zmienia się też skład pary A D. Zdolność frakcjonującą półki mierzy się różnicą składów C D W rzeczywistości równowaga na półce nie jest osiągana. Dochodzi się tylko do składów C` D`. Rozfrakcjonowanie na półce „rzeczywistej” jest mniejsze niż na teoretycznej C`D` < CD Wykład nr 17 : REKTYFIKACJA

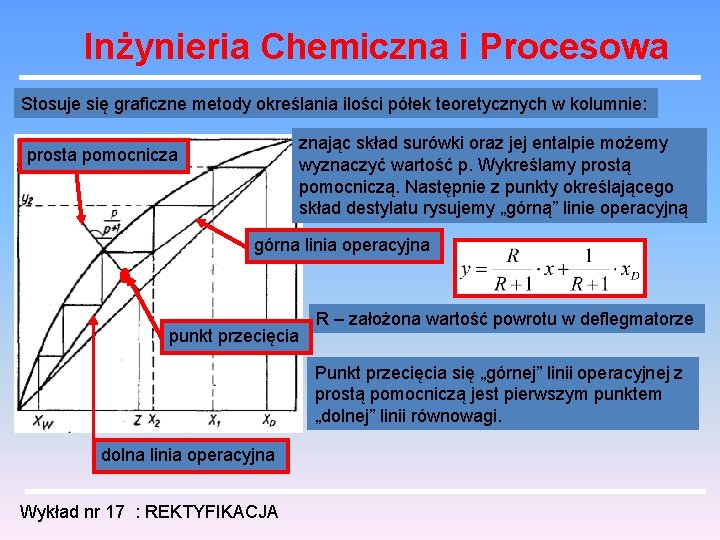
Inżynieria Chemiczna i Procesowa Stosuje się graficzne metody określania ilości półek teoretycznych w kolumnie: znając skład surówki oraz jej entalpie możemy wyznaczyć wartość p. Wykreślamy prostą pomocniczą. Następnie z punkty określającego skład destylatu rysujemy „górną” linie operacyjną prosta pomocnicza górna linia operacyjna punkt przecięcia R – założona wartość powrotu w deflegmatorze Punkt przecięcia się „górnej” linii operacyjnej z prostą pomocniczą jest pierwszym punktem „dolnej” linii równowagi. dolna linia operacyjna Wykład nr 17 : REKTYFIKACJA

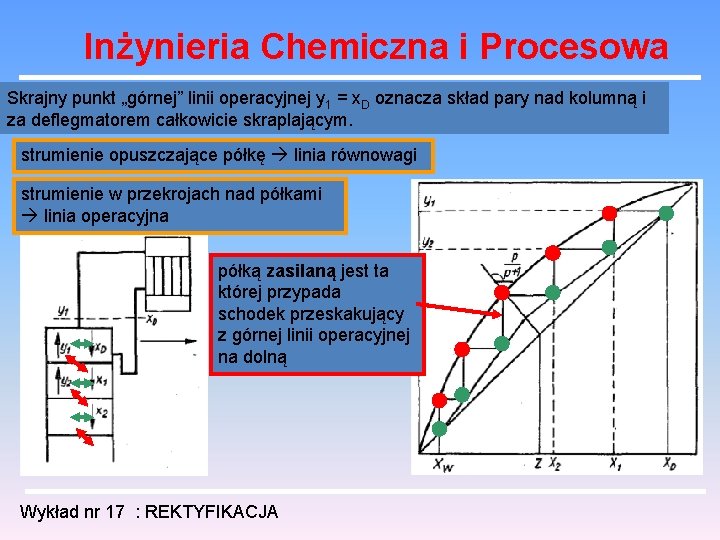
Inżynieria Chemiczna i Procesowa Skrajny punkt „górnej” linii operacyjnej y 1 = x. D oznacza skład pary nad kolumną i za deflegmatorem całkowicie skraplającym. strumienie opuszczające półkę linia równowagi strumienie w przekrojach nad półkami linia operacyjna półką zasilaną jest ta której przypada schodek przeskakujący z górnej linii operacyjnej na dolną Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Bilans cieplny deflegmatora: QD D O ciepło odebrane w deflegmatorze Wykład nr 17 : REKTYFIKACJA ciepło parowania

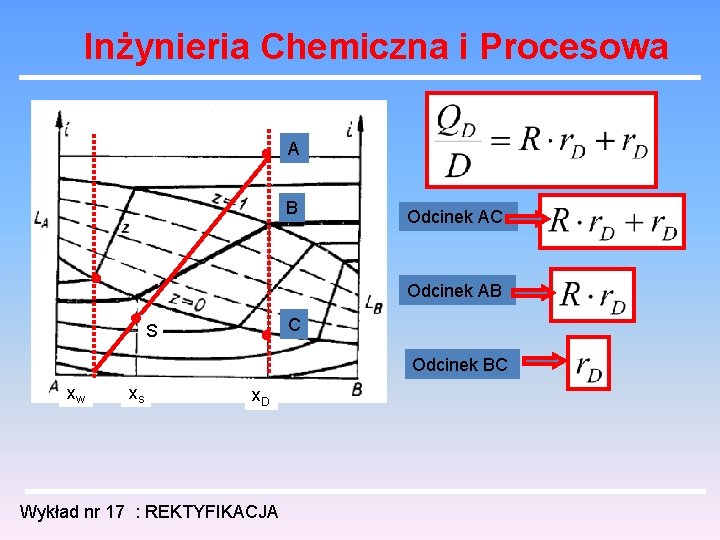
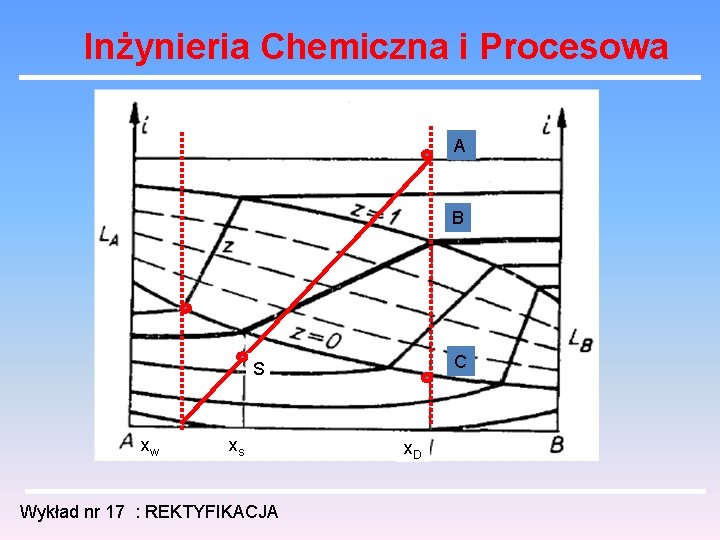
Inżynieria Chemiczna i Procesowa A B Odcinek AC Odcinek AB C S Odcinek BC xw xs x. D Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa A B C S xw xs Wykład nr 17 : REKTYFIKACJA x. D

Inżynieria Chemiczna i Procesowa Liczba stopni teoretycznych może być ułamkowa, gdyż służy ona tylko za punkt wyjścia do określenia liczby całkowitej półek rzeczywistych Jeżeli stosujemy deflegmator częściowo skraplający to pracuje on jak półka teoretyczna W kotle zachodzi również stan równowagi między parą a cieczą. A więc kocioł też działa ja półka teoretyczna Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa Ze zmniejszaniem powrotu w deflegmatorze maleje zużycie ciepła na 1 mol otrzymanego destylatu. Istnieje jednak minimum tego powrotu. Ze zmniejszaniem bowiem powrotu R nachylenie górnej linii operacyjnej maleje. W granicznym przypadku linia operacyjna „górna” przetnie się z linia pomocnicza na krzywej równowagi Liczba półek teoretycznych dla takiego przypadku jest nieskończenie wielka. xs Wykład nr 17 : REKTYFIKACJA

Inżynieria Chemiczna i Procesowa W przypadkach szczególnych minimalne nachylenie linii operacyjnej „górnej” a więc i powrót minimalny może wynikać ze styczności linii operacyjnej do linii równowagi. Wykład nr 17 : REKTYFIKACJA

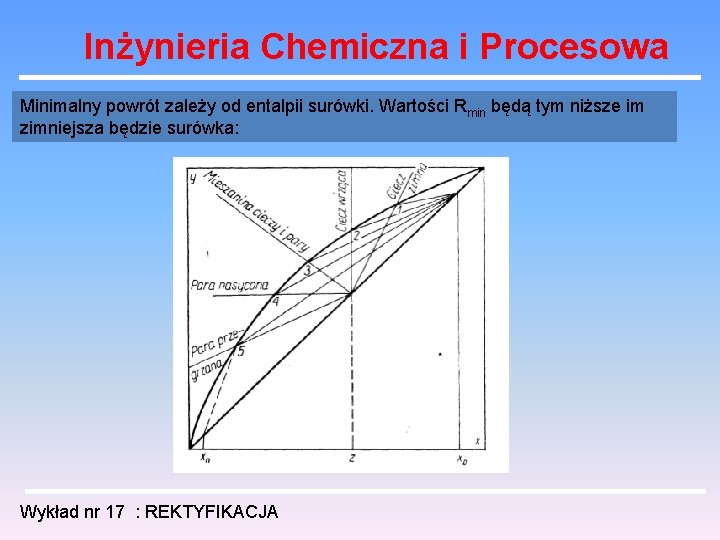
Inżynieria Chemiczna i Procesowa Minimalny powrót zależy od entalpii surówki. Wartości Rmin będą tym niższe im zimniejsza będzie surówka: Wykład nr 17 : REKTYFIKACJA

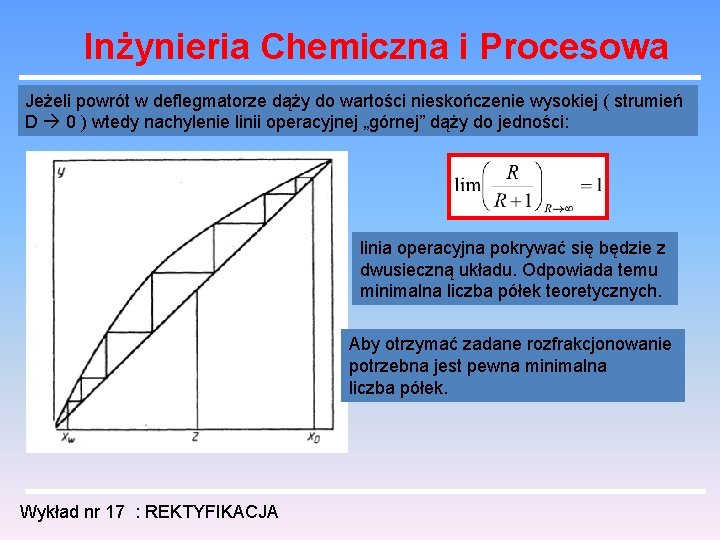
Inżynieria Chemiczna i Procesowa Jeżeli powrót w deflegmatorze dąży do wartości nieskończenie wysokiej ( strumień D 0 ) wtedy nachylenie linii operacyjnej „górnej” dąży do jedności: linia operacyjna pokrywać się będzie z dwusieczną układu. Odpowiada temu minimalna liczba półek teoretycznych. Aby otrzymać zadane rozfrakcjonowanie potrzebna jest pewna minimalna liczba półek. Wykład nr 17 : REKTYFIKACJA

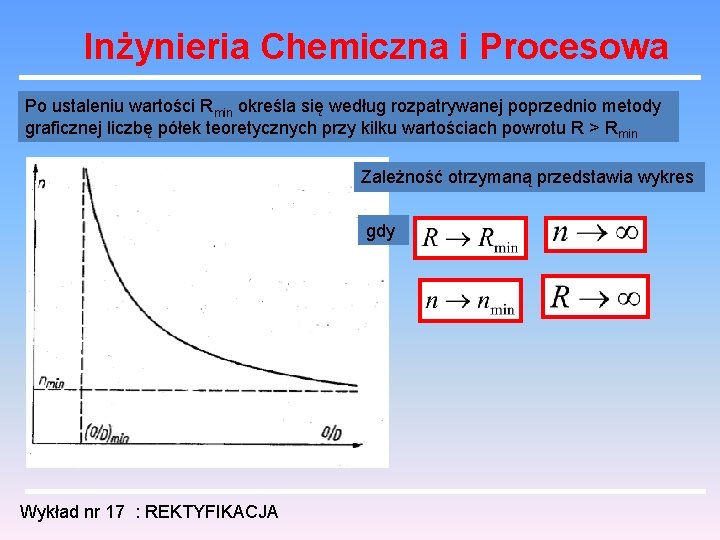
Inżynieria Chemiczna i Procesowa Po ustaleniu wartości Rmin określa się według rozpatrywanej poprzednio metody graficznej liczbę półek teoretycznych przy kilku wartościach powrotu R > Rmin Zależność otrzymaną przedstawia wykres gdy Wykład nr 17 : REKTYFIKACJA

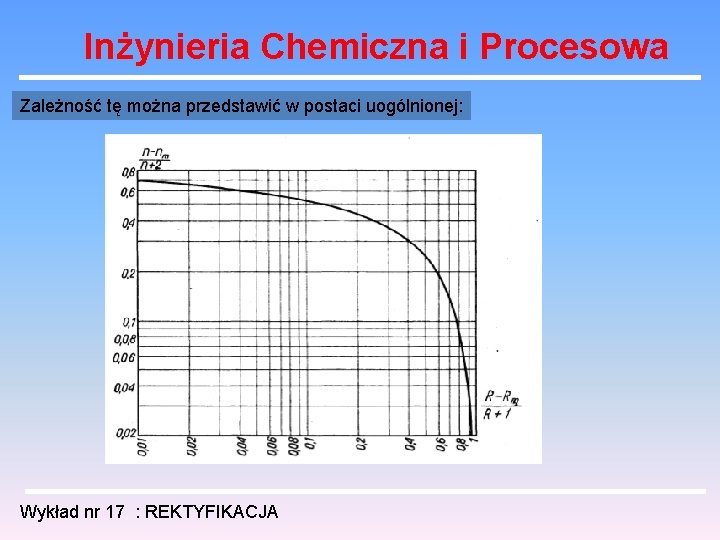
Inżynieria Chemiczna i Procesowa Zależność tę można przedstawić w postaci uogólnionej: Wykład nr 17 : REKTYFIKACJA





























