Design History File Device Master Record and Device










- Slides: 11

Design History File, Device Master Record and Device History Record C. Lamoureux 3. 11. 2005

Tietoisku 1. FDA: n määritelmät 2. Miten se on ollut meillä ennen QSP: tä 3. Mitä se meillä nyt ja tästä lähin tarkoittaa 4. Mihin niitä tarvitaan ja minkälaisia kysymyksiä saattaa esiintyä Page 2

Design History File - DHF Ø Design history file (DHF) means a compilation of records which describes the design history of a finished device [820. 3(e)]. Ø The purpose of the Design History File (DHF) is to demonstrate that the product was developed in accordance with the Quality Management System and design plans. DESIGN INPUT Mitä olet loppukäyttäjälle keksinyt, DESIGN OUTPUT miksi ja minkä mukaan. . . DESIGN VERIFICATION DESIGN VALIDATION RISK MANAGEMENT PLAN RISK ASSESSMENT OTHER (e. g. essential requirements checklist) DESIGN CHANGES Page 3

Device Master Record - DMR Ø Each manufacturer shall maintain device master records (DMR's). The DMR for each type of device shall include, or refer to the location of, the following information: • • • (a) DEVICE SPECIFICATIONS including appropriate drawings, composition, formulation, component specifications, and software specifications; (b) PRODUCTION PROCESS SPECIFICATIONS including the appropriate equipment specifications, production methods, production procedures, and production environment specifications; (c) QUALITY ASSURANCE PROCEDURES AND SPECIFICATIONS including acceptance criteria and the quality assurance equipment to be used; (d) PACKAGING AND LABELING SPECIFICATIONS, including methods and processes used; and (e) INSTALLATION, MAINTENANCE, AND SERVICING procedures and methods. Mitä valmistat ja miten, jotta se vastaisi asiakkaalle luvattua laatua. . . Page 4

Device Master Record = keittokirja Page 5

Device History Record - DHR Ø Each manufacturer shall maintain device history records (DHR's). Each manufacturer shall establish and maintain procedures to ensure that DHR's for each batch, lot, or unit are maintained to demonstrate that the device is manufactured in accordance with the DMR and the requirements of this part. The DHR shall include, or refer to the location of, the following information: • • • (a) The dates of manufacture; (b) The quantity manufactured; (c) The quantity released for distribution; (d) The acceptance records which demonstrate the device is manufactured in accordance with the DMR; (e) The primary identification label and labeling used for each production unit; and (f) Any device identification(s) and control number(s) used. Onko tuote valmistettu, kuljetettu ja installoitu kuten määritelty ja sovittu. . . Page 6

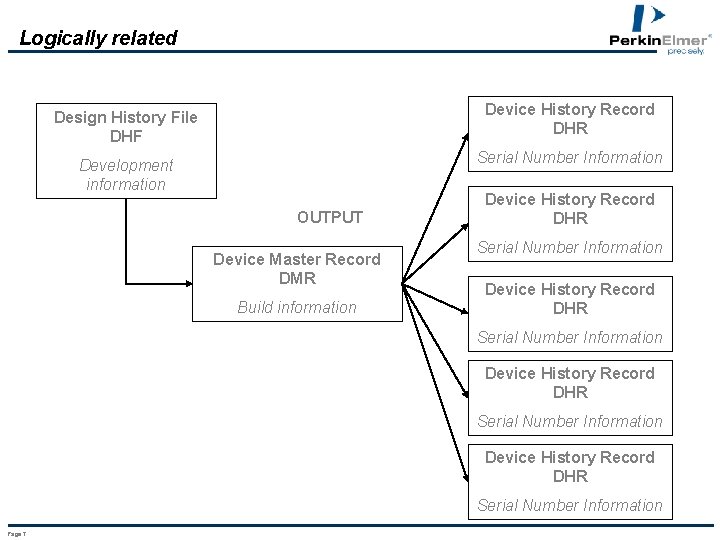
Logically related Design History File DHF Device History Record DHR Development information Serial Number Information OUTPUT Device Master Record DMR Build information Device History Record DHR Serial Number Information Page 7

Ennen QSP: tä Ø DHF, Design History File DRG -mapit jäädytyksien mukaan Projektimapit Ilman yhtenäistä, vakiintunutta tapaa varmistaa, että tuotteen historia dokumentoidaan ja tallennetaan nykyisiä vaatimuksia vastaavalla tavalla. Ø DMR, Device Master Record Tarvittavia dokumentteja ei lueteltu yhdeksi kokonaisuudeksi (listaksi). DMR -indeksiä ei tunnistettu tuotantosiirron vältämättömäksi työkaluksi. Ø DHR, Device History Record Jäljitettävyysaste vaihtelee, tietojen “niputtaminen” tuotteen elinkaaren aikana vaikeata. Page 8

Tästä lähin Ø DHF, Design History File Yhtenäinen tapa dokumentoida ja arkistoida tuotteen historiaa. Geneerinen DHF Master index file. Ø DMR, Device Master Record Vaadittava “ouptut” NPD: n prosessista. Yksi indeksi johtaa kaikkiin dokumentteihin (ja komponentteihin), jotka tarvitaan tuotteen valmistamiseksi. Ø DHR, Device History Record Tietojen niputtaminen ja niiden jäljitettävyys parannettavia eri prosessien myötä (CAPA, takaisinveto, logistiikka, QPR) sekä työkalujen myötä (SAP, Oracle, PDM). Page 9

Mihin niitä tarvitaan Ø DHF, Design History File Ongelmatilanteissa mahdollisuus jäljittää “mitä tuotteelle tehtiin ja miksi”. Sisältää tietoja, jotka eivät löydy DMR: stä, kuten verifinointi ja validointi. Jotta sama virhe ei toistuisi … Ø DMR, Device Master Record Mitä tarvitaan tuotteen valmistamiseksi ja mistä tietää, puuttuuko jotakin? Tuotantosiirtoprosessi, tuotantosiirtoprojektit. Tuotteen lopetukset. Ø DHR, Device History Record Mitä asiakkaalle lopun lopuksi meni? Missä olosuhteissa tuote on valmistettu, pakattu, kuljetettu ja asennettu? Huolto- ja upgrade -toimenpiteet. Asiakasvalituksien käsittely, takaisinveto. Page 10

Mahdollisia kysymyksiä Ø DHF, Design History File Show me the DHF to see the rationale for approving this device despite known problems… Ø DMR, Device Master Record How did you make sure that you had all the procedures required to manufacture this device prior to transfer? Do you have a procedure for testing this component and where is it? Ø DHR, Device History Record Show me that this batch was produced according to the DMR. Show me what happen to this device and why was the latest software upgrade not performed. Page 11