DESARROLLO DE NUEVOS PRODUCTOS Dr Armando Rivero Laverde






































- Slides: 39

DESARROLLO DE NUEVOS PRODUCTOS Dr. Armando Rivero Laverde Armando Rivero 2002

2 Sinonimos • • • INVESTIGACION Y DESARROLLO PREFORMULACION DESARROLLO GALENICO DESARROLLO FARMACEUTICO • DESGAL • I+D • R+D Armando Rivero 2002

3 ¿Por qué formular? Armando Rivero 2002

4 ¿Por qué preformular? *Mejorar características organolépticas. *Proteger de la degradación a través del tracto gastrointestinal. *Evitar la degradación por acción de agentes externos. *Facilitar la incorporación del fármaco. *Conseguir el acceso del fármaco a determinadas cavidades corporales. *Facilitar la correcta dosificación. *Controlar el proceso de liberación. Armando Rivero 2002

5 Preformulación Armando Rivero 2002

6 Conocimiento del principio activo *Propiedades físicas. *Características. *Protección. *Incorporación. *Propiedades químicas. *Degradación. Armando Rivero 2002

7 *Propiedades biofarmacéuticas. *Acceso. *Dosificación. *Distribución. *Liberación. Influencia de: * Excipientes. * Proceso de fabricación. Armando Rivero 2002

8 Se debe contar con el conocimiento de. . . Armando Rivero 2002

9 *Pureza. *Solubilidad. *Capacidad de absorción. *Estabilidad. *Compatibilidad con otros excipientes. *Otras propiedades específicas de la forma farmacéutica. Armando Rivero 2002

10 Pureza ¿Cuales son? *Impurezas inorgánicas (cloruros, sulfatos, metales pesados, etc). *Descritas en Farmacopea (%). *% de agua. *Residuos de disolventes (metanol en estreptomicina sulfato). *Productos relacionados: *Intermedios de síntesis. *Extracción no selectiva. *Productos de degradación. Armando Rivero 2002

11 Pureza (II) Importancia: *Pueden constituir hasta el 15%. *Problemas toxicológicos. Determinación: *Cromatografía. *Punto de fusión. Armando Rivero 2002

12 Solubilidad *Perfil p. H-solubilidad. *Morfología cristalina. *Estado de hidratación. *Tamaño de partícula. *Métodos para modificar la solubilidad. *Formación de sales. *Cosolvencia. *Complejación. *Tensoactivos. *Velocidad de disolución. Armando Rivero 2002

13 Capacidad de Absorción *Coeficiente de reparto. *Constante de ionización. *Permeabilidad a través de las membranas biológicas. Armando Rivero 2002

14 Estabilidad *Ajuste de p. H. *Control de temperatura. *Control de la polaridad del medio. *Protección frente a la luz. *Restricción de oxígeno. *Evitar la presencia de metales pesados. *Adición de antioxidantes. Armando Rivero 2002

15 Estabilidad (II) *Alteración de la estructura cristalina. *Alteración en la homogeneidad de distribución. *Alteraciones en la consistencia o estado de agregación. *Precipitación de fármacos en disolución. *Alteraciones en el estado de hidratación. Armando Rivero 2002

16 Compatibilidad con otros excipientes Armando Rivero 2002

17 Compatibilidad con otros excipientes (II) Armando Rivero 2002

18 Otras propiedades *Densidad *Segregación, flujo, llenado. *Capacidad de flujo *Crítico para polvos, cápsulas y comprimidos. *Angulo de reposo (25º a 45º). *Capacidad de compresión *Comportamiento plástico. *Capacidad de fragmentación. Armando Rivero 2002

19 Diseño de la fórmula Armando Rivero 2002

20 Diseño de la fórmula *Fórmula cuali-cuantitativa. *Especificaciones del producto. *Registro de fabricación. *Método de fabricación. *Selección de equipos. *Condiciones de fabricación. *Controles durante el proceso de fabricación. Armando Rivero 2002

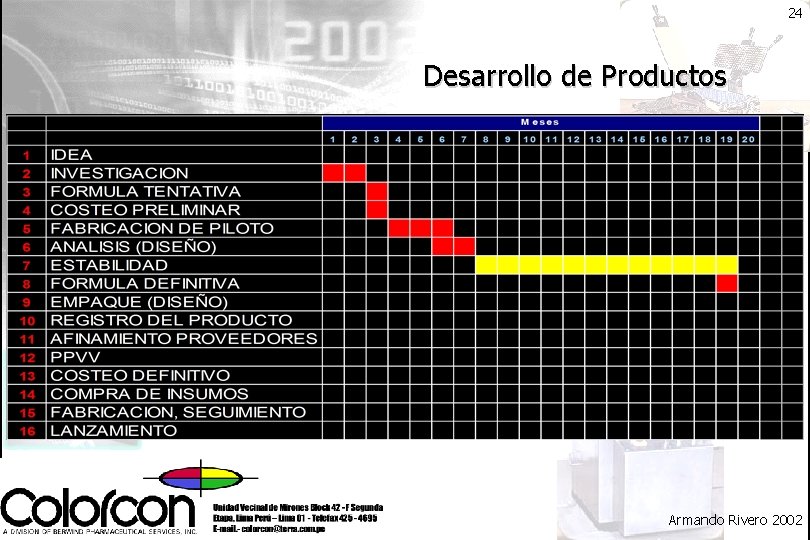
21 Desarrollo de Productos Armando Rivero 2002

Pasos claves en el Desarrollo de Productos y Procesos Estado de Desarrollo 22 Fase de Escalamiento Diseño del Producto. 1 X Caracterización del Producto. Selección del Producto. Diseño del Proceso. Optimización del Producto. Caracterización del Proceso. Optimización del Proceso. Calificación del Proceso. 10 X Calificación del Proceso. 100 X Validación del Proceso. Certificación del Producto. Armando Rivero 2002

23 Desarrollo de Productos • Desarrollo del proceso: – Que sea económico. – Que el producto cumpla con las especificaciones. – Que cumpla con BPM. – Identificar las variables críticas del proceso que puedan afectar las especificaciones. – Establecer las especificaciones del proceso y sus métodos de análisis. – Seleccionar equipos e instalaciones. – Escalonamiento. – Caracterización. – Verificación. Armando Rivero 2002

24 Desarrollo de Productos Armando Rivero 2002

25 Desarrollo de Productos Naturales BIBLIOGRAFIA TRADICIONES / FOLKLORE TOXICIDAD FITOQUIMICOS FARMACOLOGICOS CLINICOS ESTACIONALIDAD PERIODICIDAD COSECHAS CULTIVOS ECOLOGICOS UNIFORMIDAD TAXONOMICA DESCONTAMINACION ESTABILIZACION TRANSPORTE DESCONTAMINACION FINAL PROCESAMIENTO INDUSTRIAL DOSIFICACION APROPIADA FORMA FARMACEUTICA APROPIADA PROCESO FABRICACION ESTABILIDAD EMPAQUE ALMACENAMIENTO DISTRIBUCION MATERIAL NATURAL PRODUCTO PROCESADO PRODUCTO NATURAL NUTRACEUTICO DE USO EN SALUD ALIMENTO FUNCIONAL MEDICAMENTO Armando Rivero 2002

26 Calificación del Proceso Comprende todas las actividades encaminadas a demostrar que: • Todos los sistemas, sub-sistemas y operaciones unitarias del proceso funcionan y se ejecutan como se había planeado. • Todos los parámetros críticos se encuentran bajo control. • Pruebas de capacidad del diseño son comprobables y se pueden certificar. Armando Rivero 2002

Documentación Armando Rivero 2002

Desarrollo de Productos Documentación 28 v. Especificaciones. v. Características de los materiales. v. Lista de equipos. v. Características del Proceso. No hay una lista estrictamente definida. Mantener todos los documentos básicos para la toma de decisiones Armando Rivero 2002

29 Documentos v Deben ser diseñados, revisados y distribuidos cuidadosamente. v Ser aprobados, firmados y fechados por personas autorizadas. v Expresar claramente el título, la naturaleza y el propósito. v Redactarse en forma ordenada. v Deben revisarse regularmente y mantenerse actualizados. v Diseñados de tal manera que el ingreso de datos se haga en forma clara, legible e indeleble. Armando Rivero 2002

30 La documentación correcta es: 1. Permanente: La información no puede cambiarse, borrarse o lavarse. 2. Legible: La información se puede leer fácilmente. 3. Exacta: Los cálculos son correctos, la otra información es precisa y puede registrarse fácilmente. 4. Puntual: La información se registra a tiempo, inmediatamente después de la acción. Nunca antes. 5. Clara: Todo el que lee el documento lo entiende igual. 6. Consistente: Toda información, como fechas, abreviaturas, unidades de medida, etc. Está normalizada para que no haya confusión. 7. Completa: Se incluye toda la información requerida. 8. Directa: Toda la información se registra inmediatamente en el formulario correcto, libreta de laboratorio o sistema computarizado. 9. Cierta: Toda información y conclusiones incluidas son, según el conocimiento y la habilidad del escritor, lo que realmente sucedió. Armando Rivero 2002

Estudios de Estabilidad Armando Rivero 2002

32 Estudio de Estabilidad del Medicamento Consideraciones. . Etico, científico, asistencial, legal y económico. . . para mantener la. . . Máxima seguridad, eficacia y calidad durante el período de su existencia hasta su administración. . Condujo al desarrollo de métodos para efectuar. . Predicciones de la estabilidad de los medicamentos. . . Estableciendo de esta manera un. Plazo de Validez Considerando. . . . Zona Climática Utilizando. . . . . Diseños optimizados de experimentos Conferencia: Estudios de Estabilidad del Medicamento Eduardo L. Mariño Unidad de Farmacia Clínica y Farmacoterapia, Departamento de Farmacia, Facultad de Farmacia, Universidad de Barcelona, España III Congreso Nacional de Ciencias Farmacéuticas y Bioquímica. Lima - Perú. 1992 Armando Rivero 2002

33 Motivos para realizar un estudio de estabilidad • Realizar estudios de pre-formulación. • Aportar información sobre la vida media y las condiciones de almacenamiento de productos a granel. • Aportar información sobre la vida media y las condiciones de almacenamiento de productos terminados ya comercializados. • Aportar información sobre la vida media y las condiciones de almacenamiento de nuevos productos. • Aportar información sobre la vida media y las condiciones de almacenamiento cuando se cambia la fórmula del producto. • Aportar información sobre la vida media y las condiciones de almacenamiento cuando hay un cambio significativo en los materiales de partida. • Aportar información sobre la vida media y las condiciones de almacenamiento cuando hay un cambio significativo del material de acondicionamiento primario del producto intermedio o terminado. • Por cumplimiento de normativas para registro. • A requerimiento de las autoridades sanitarias. • Estudio para una ampliación de caducidad. • Cambio en el procedimiento, en el sistema o en el equipo de Producción. • Otras razones. Armando Rivero 2002

34 Procedimiento Protocolo básico • • Tipo y tamaño del envase Número de lotes Condiciones de almacenamiento Periodicidad de los análisis Cantidad de muestra Análisis a realizar Métodos analíticos Documentación, presentación de resultados, interpretación, discusión y conclusiones Armando Rivero 2002

35 Tipos de Ensayos Condiciones de Almacenamiento Estudios a Tiempo Real Estudios específicos: Se estudian los efectos de los siguientes factores: Físicos Temperatura (*) Luz Radiaciones Aire Humedad Posición del envase Químicos p. H Agentes o solventes químicos Reactivos oxidantes Interacciones con los materiales de acondicionamiento primario: cesión o adsorción de componentes Armando Rivero 2002

36 Selección de Lotes La información de la estabilidad a largo plazo y acelerada proviene de tres lotes de la misma formulación y la misma forma de dosaje en los contenedores (envases primarios) propuestos por marketing. Dos de los tres lotes deberán corresponder a lotes piloto pequeños. El tercero puede ser mayor. Datos de lotes a escala laboratorio no son aceptables como información primaria de estabilidad. Los primeros tres lotes fabricados luego de la aprobación, si no fueron considerados en la Solicitud de Registro original, deberán ser colocados bajo estudios de estabilidad acelerada y a largo plazo usando el mismo protocolo de estabilidad que el de la solicitud aprobada. Condiciones Prueba a Largo Plazo (TIEMPO REAL) • 25°C ± 2°C / 60% HR ± 5% • Período mínimo de la prueba: 12 meses Prueba Acelerada • 40°C ± 2°C / 75% HR ± 5% • Período mínimo de la prueba: 06 meses Si ocurre algún cambio significativo durante la prueba acelerada, puede realizarse una prueba adicional en condiciones intermedias, p. e. , 30°C ± 2°C / 60% HR ± 5%. En este caso, la Solicitud de Registro puede incluir un mínimo de datos correspondientes a 06 meses para un estudio a 30°C / 60% HR de un año. La prueba a Largo Plazo deberá continuarse por el tiempo suficiente más allá de 12 meses posteriores a su tiempo de vida media, con periodos apropiados de análisis. La información adicional acumulada deberá ser remitida a las autoridades durante el periodo de revisión de la Solicitud de Registro. Stability Testing of New Drug Substances and Products ICH Harmonised Tripartite Guideline International Conference on Harmonization of Technical Requirements for the Registration of Pharmaceuticals for Human Use Armando Rivero 2002

37 WHO Guidelines on Stability Testing of Pharmaceutical Products Containing Well-Established Drugs Substance in Conventional Dosage Forms WHO/PHARM/94. 565 Armando Rivero 2002

38 Estudio de Estabilidad Antes: Tiempo Real • 25°C / 90% HR • A fecha de vencimiento ó Ahora: Tiempo Real • 25°C / 95% HR • Hasta 12 meses adicionales a la fecha de vencimiento. • Periodo mínimo: 12 meses y Acelerada • 40°C / 75% HR • 50°C / 75% HR • Ambas a 12 meses, datos para registro en 06 meses, decisión de continuar en 03 meses. Acelerada • 40°C / 75% HR • 30°C / 60% HR • Ambas a 12 meses, datos para registro en 06 meses, decisión de continuar en 06 meses. • Periodo mínimo: 06 meses. Armando Rivero 2002

39 “Diseña y fabrica tu producto como si el consumidor final fueras tú mismo” Armando Rivero 2002
 Etapas de desarrollo de nuevos productos
Etapas de desarrollo de nuevos productos Dr armando rivero
Dr armando rivero Dr rivero armando
Dr rivero armando Natalia laverde
Natalia laverde Estrategias de empaque
Estrategias de empaque Matriz de expansion de productos y mercado
Matriz de expansion de productos y mercado Karen tatiana valencia rivero
Karen tatiana valencia rivero Standard & poor's
Standard & poor's Lorena rivero
Lorena rivero Jose miguel alonso rivero digestivo
Jose miguel alonso rivero digestivo Signe de harzer
Signe de harzer Lorena rivero del paso
Lorena rivero del paso Logo de utea
Logo de utea Bernardo rivero
Bernardo rivero Nuevos inhibidores de betalactamasas
Nuevos inhibidores de betalactamasas Las tic y los nuevos paradigmas educativos
Las tic y los nuevos paradigmas educativos Nuevos paradigmas educativos
Nuevos paradigmas educativos Nuevos ambientes de aprendizaje
Nuevos ambientes de aprendizaje Nuevos comienzos en la biblia
Nuevos comienzos en la biblia Nuevos grados
Nuevos grados Cuentos nuevos
Cuentos nuevos Aprendizaje enactivo
Aprendizaje enactivo Ella necesita ir de compras para comprar calcetines nuevos.
Ella necesita ir de compras para comprar calcetines nuevos. Vino nuevo en odres nuevos
Vino nuevo en odres nuevos Veo de ver
Veo de ver Nuevos anticonvulsivantes
Nuevos anticonvulsivantes Texto descriptivo
Texto descriptivo Nuevos inhibidores de betalactamasas
Nuevos inhibidores de betalactamasas Edad de cobre bronce y hierro
Edad de cobre bronce y hierro Cambios culturales
Cambios culturales Paradigma conductista
Paradigma conductista Nuevos retos nuevas oportunidades
Nuevos retos nuevas oportunidades Yucef merhi
Yucef merhi Armando iturralde
Armando iturralde Armando solar-lezama
Armando solar-lezama Armando bought 45 baseball cards
Armando bought 45 baseball cards Define armando
Define armando Armando cosentino
Armando cosentino Pass
Pass Armando iacovantuono
Armando iacovantuono