derivati degli acidi carbossilici Formazione di sali per

derivati degli acidi carbossilici
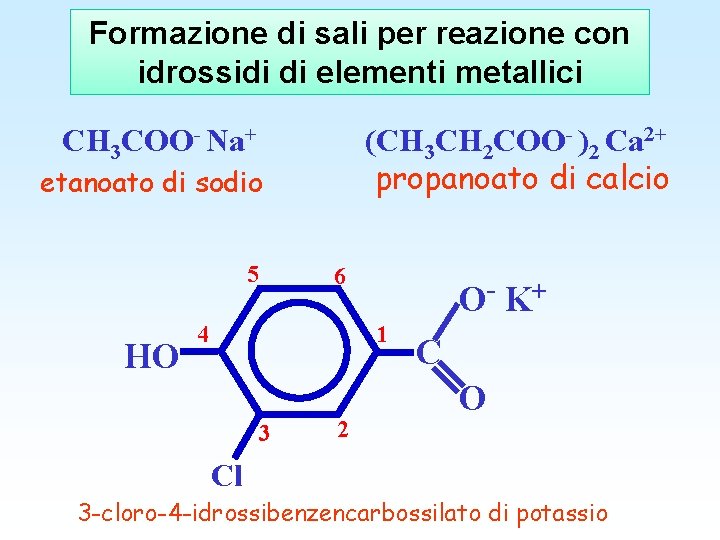
Formazione di sali per reazione con idrossidi di elementi metallici (CH 3 CH 2 COO- )2 Ca 2+ propanoato di calcio CH 3 COO- Na+ etanoato di sodio 5 6 4 O- K+ 1 OH 3 2 C O Cl 3 -cloro-4 -idrossibenzencarbossilato di potassio
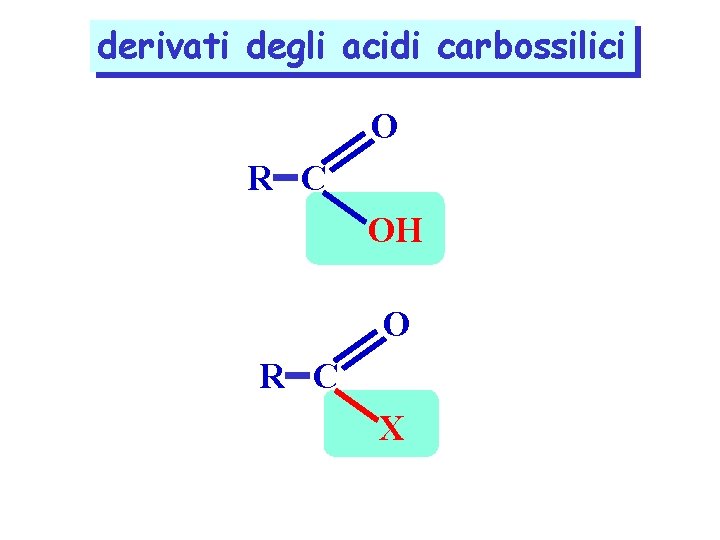
derivati degli acidi carbossilici O R C OH O R C X
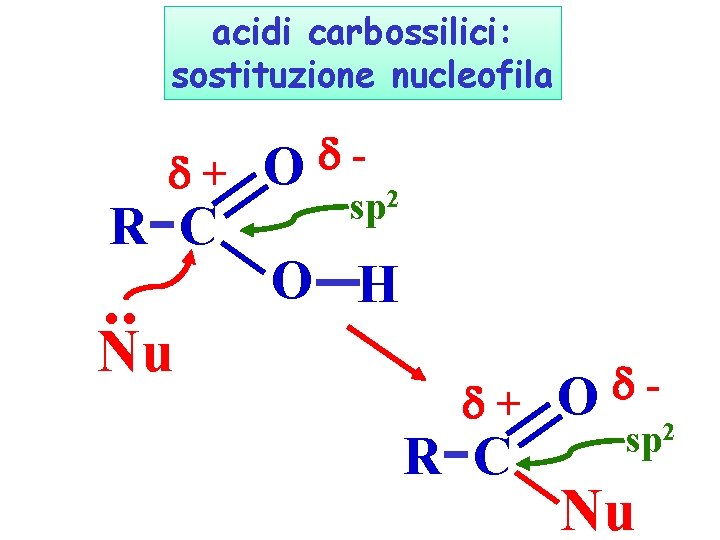
acidi carbossilici: sostituzione nucleofila + R C . . Nu O sp 2 O H + R C O sp 2 Nu
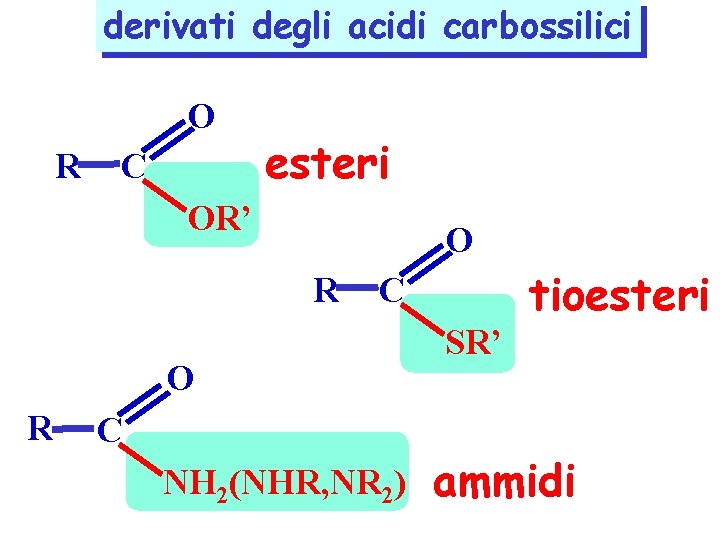
derivati degli acidi carbossilici O R C esteri OR’ O R C NH 2(NHR, NR 2) SR’ tioesteri ammidi
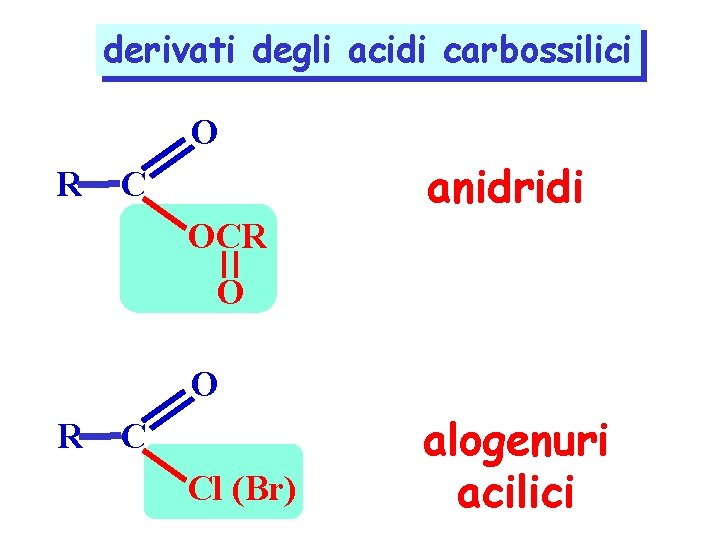
derivati degli acidi carbossilici O R anidridi C OCR O O R C Cl (Br) alogenuri acilici
ESTERI
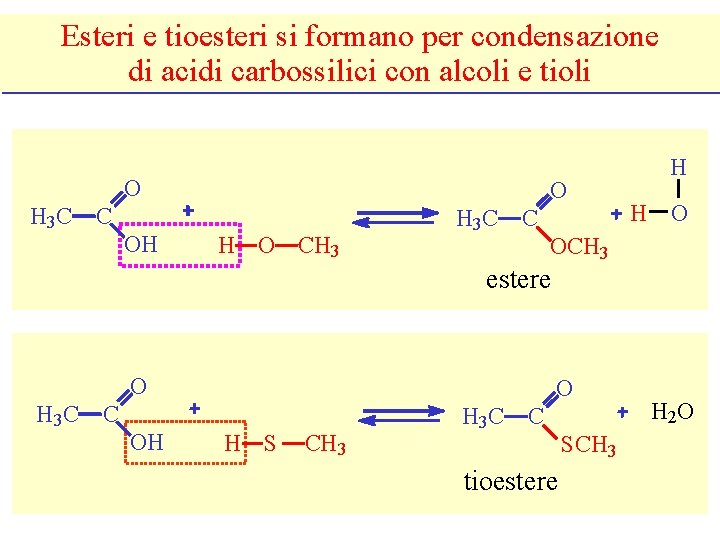
Esteri e tioesteri si formano per condensazione di acidi carbossilici con alcoli e tioli O H 3 C O C OH H O CH 3 H 3 C C H H O OCH 3 estere O H 3 C O C OH H S CH 3 H 3 C C tioestere SCH 3 H 2 O
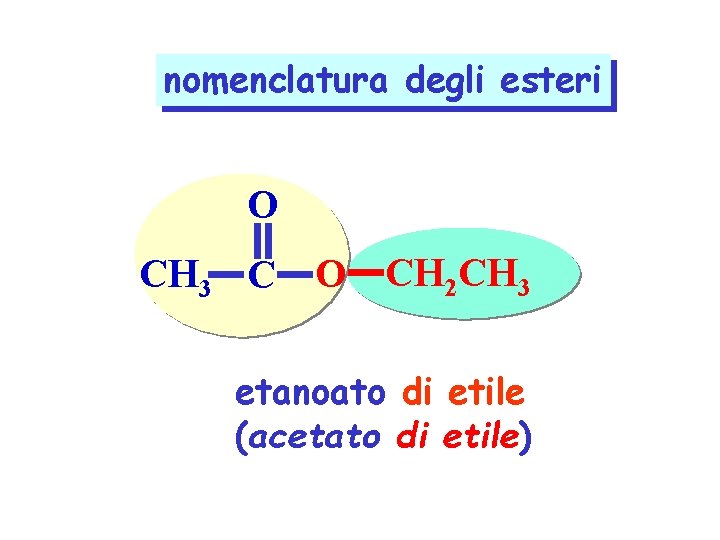
nomenclatura degli esteri O CH 3 C O CH 2 CH 3 etanoato di etile (acetato di etile)
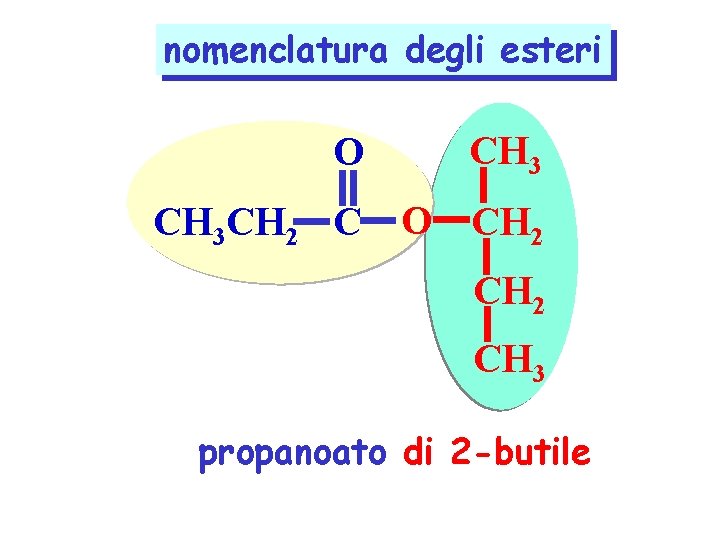
nomenclatura degli esteri O CH 3 CH 2 C O CH 2 CH 3 propanoato di 2 -butile
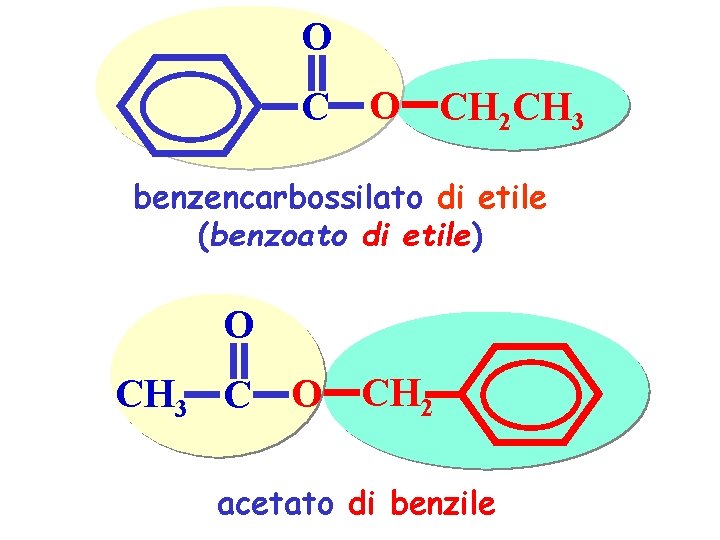
O C O CH 2 CH 3 benzencarbossilato di etile (benzoato di etile) O CH 3 C O CH 2 acetato di benzile
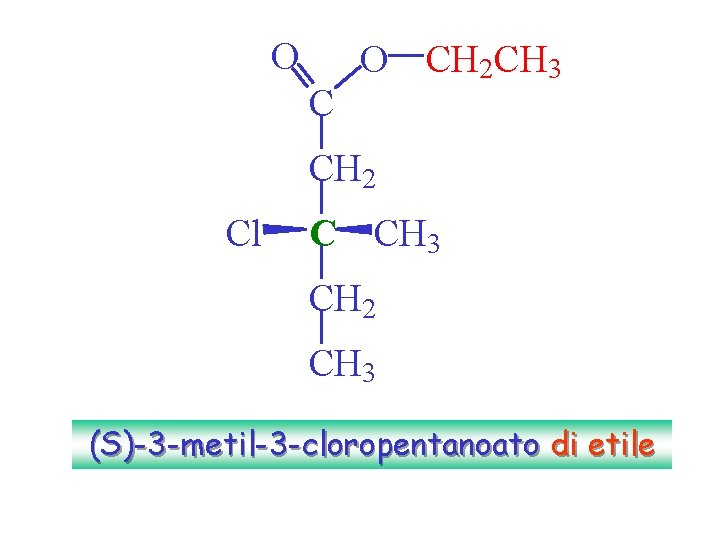
O C O CH 2 CH 3 CH 2 Cl C CH 3 CH 2 CH 3 (S)-3 -metil-3 -cloropentanoato di etile
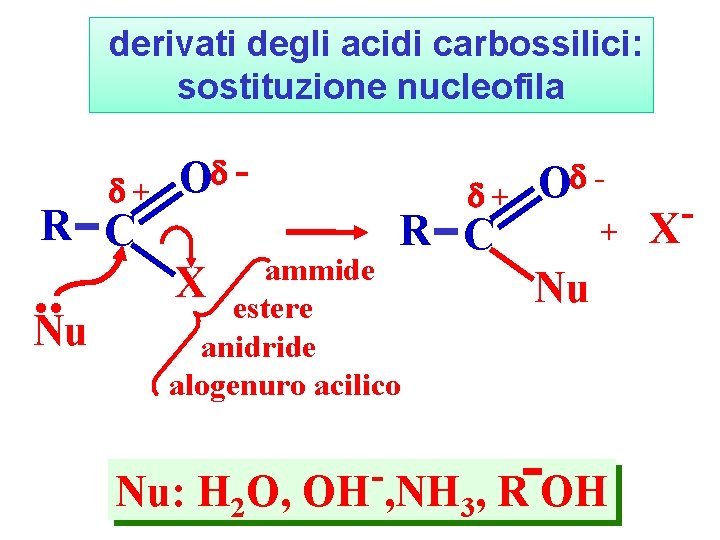
derivati degli acidi carbossilici: sostituzione nucleofila + R C . . Nu O - + R C ammide X estere anidride alogenuro acilico O - + X Nu Nu: H 2 O, OH , NH 3, R OH

formazione degli esteri meccanismo della reazione di sostituzione nucleofila (SN 2)
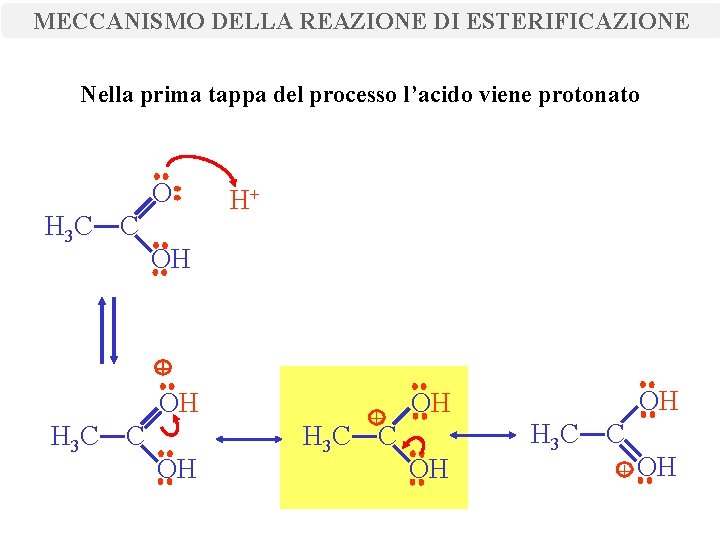
MECCANISMO DELLA REAZIONE DI ESTERIFICAZIONE Nella prima tappa del processo l’acido viene protonato O H 3 C C H+ OH H 3 C C OH + H 3 C C OH OH OH H 3 C C + OH
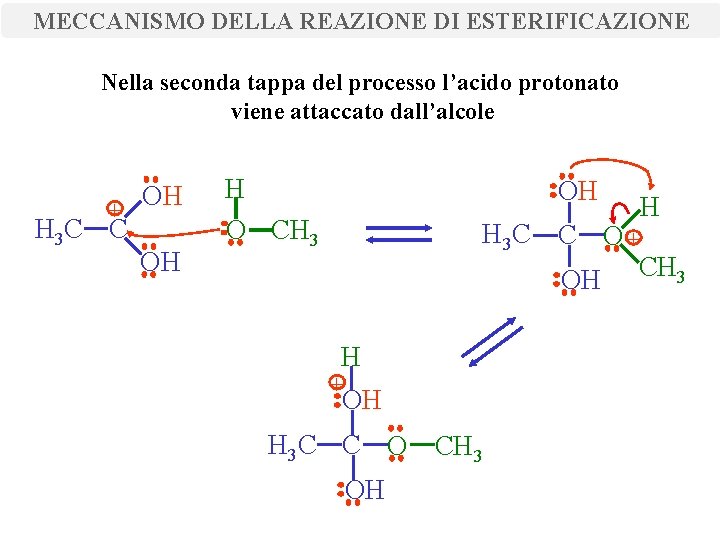
MECCANISMO DELLA REAZIONE DI ESTERIFICAZIONE Nella seconda tappa del processo l’acido protonato viene attaccato dall’alcole + H 3 C C OH OH H O CH 3 OH H H 3 C C O + OH CH 3 H + OH H 3 C C O CH 3 OH
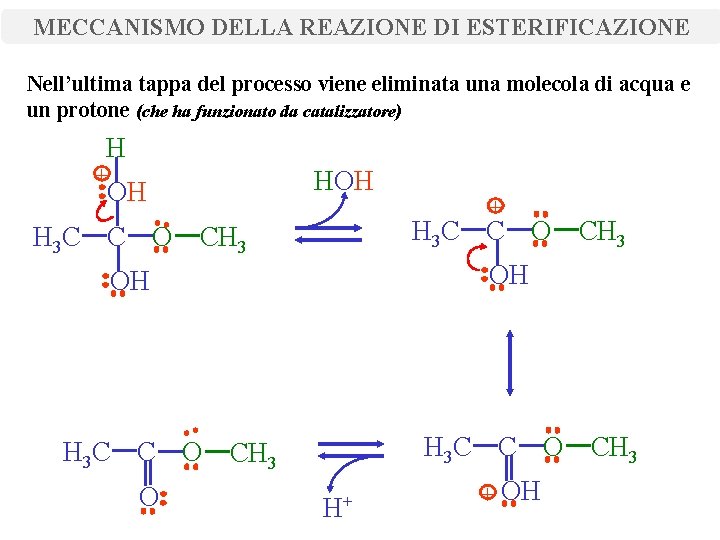
MECCANISMO DELLA REAZIONE DI ESTERIFICAZIONE Nell’ultima tappa del processo viene eliminata una molecola di acqua e un protone (che ha funzionato da catalizzatore) H + OH H 3 C C O CH 3 OH OH H 3 C C O CH 3 O + H+ + OH
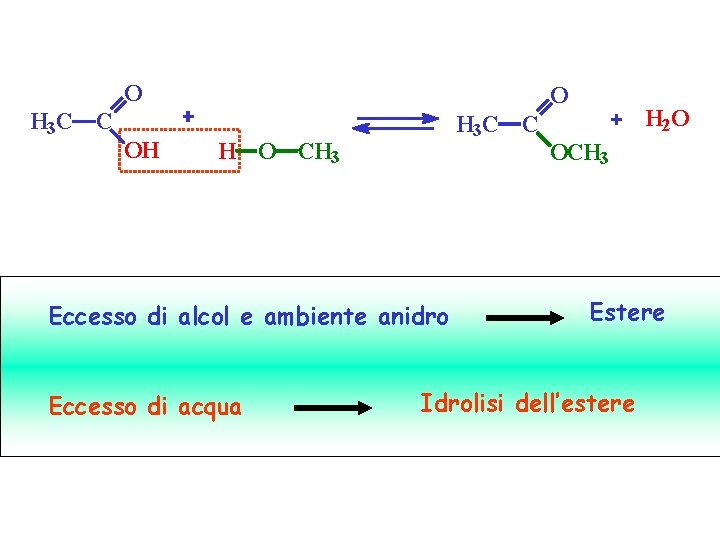
O H 3 C C OH O H 3 C C H O CH 3 Eccesso di alcol e ambiente anidro Eccesso di acqua H 2 O OCH 3 Estere Idrolisi dell’estere
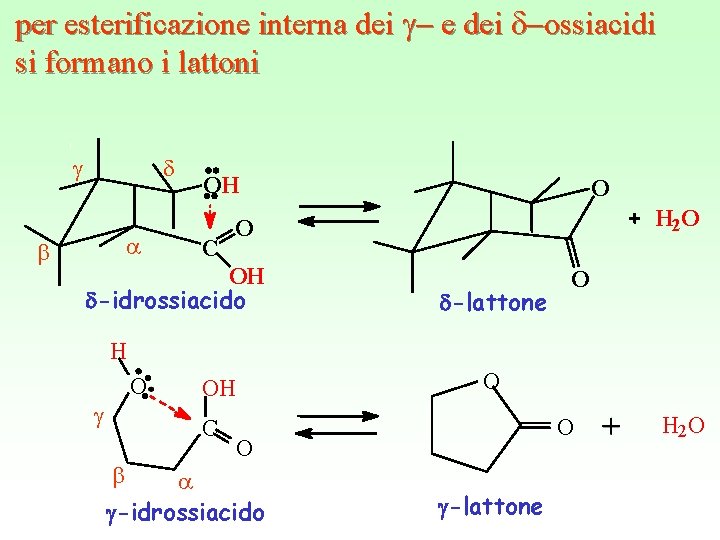
per esterificazione interna dei g- e dei d-ossiacidi si formano i lattoni g b d a OH C O H 2 O O OH -idrossiacido -lattone O H O g C b O OH O O a -idrossiacido -lattone H 2 O
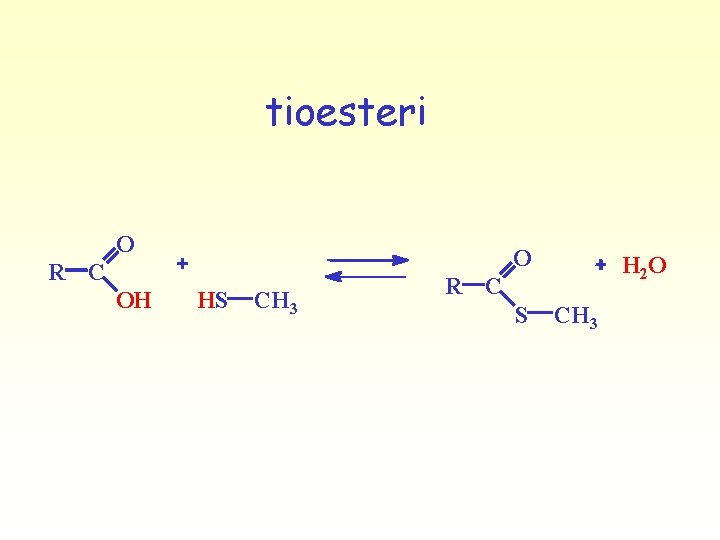
tioesteri O O R C OH HS CH 3 H 2 O R C S CH 3
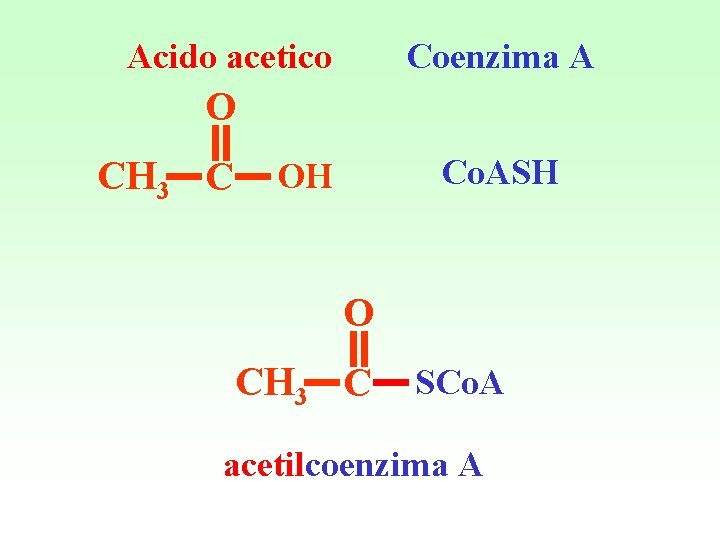
Acido acetico Coenzima A O CH 3 C Co. ASH OH O CH 3 C SCo. A acetilcoenzima A
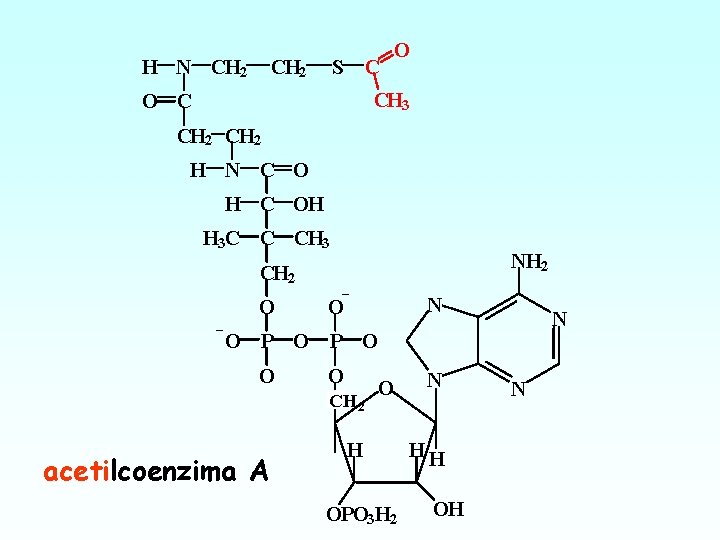
H N CH 2 S C O CH 3 O C CH 2 H N C O H C OH H 3 C C CH 3 NH 2 CH 2 O N O P O O O CH 2 acetilcoenzima A O H OPO 3 H 2 N HH OH N
Reazioni degli ESTERI SN 2

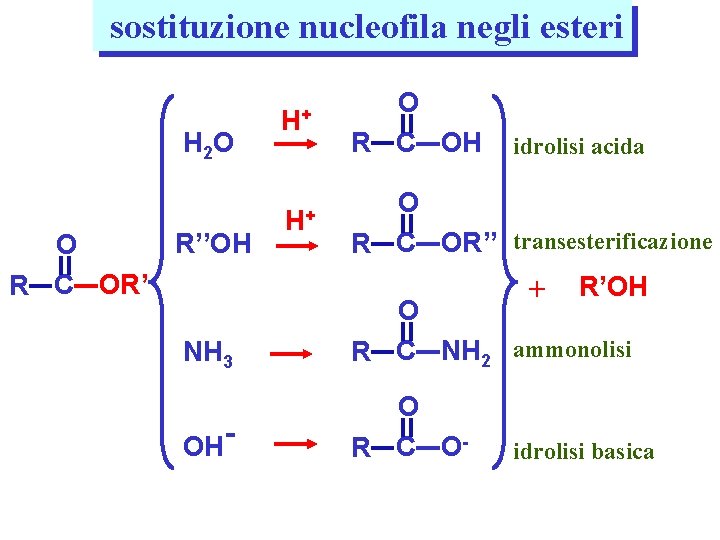
sostituzione nucleofila negli esteri H 2 O R’’OH O R C OR’ H+ O R C OH H+ O R C OR’’ transesterificazione idrolisi acida + R’OH NH 3 O R C NH 2 ammonolisi OH O R C O- idrolisi basica
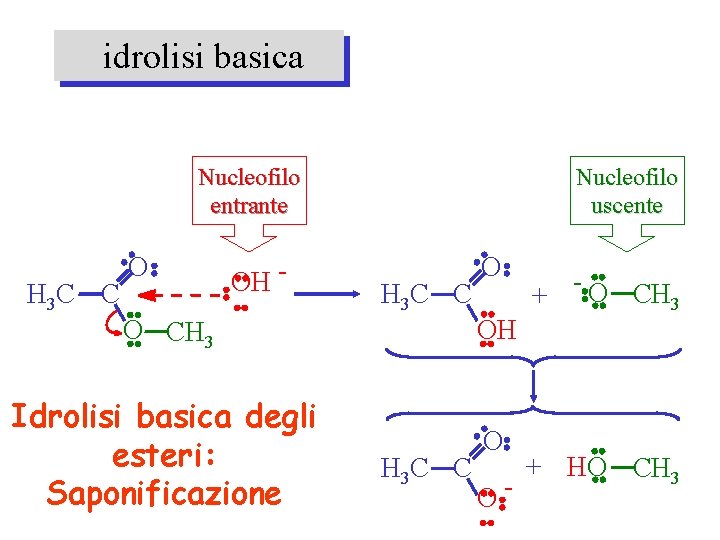
idrolisi basica Nucleofilo entrante H 3 C C O OH - Nucleofilo uscente H 3 C C O O CH 3 OH Idrolisi basica degli esteri: Saponificazione O H 3 C C O- + -O CH 3 + HO CH 3
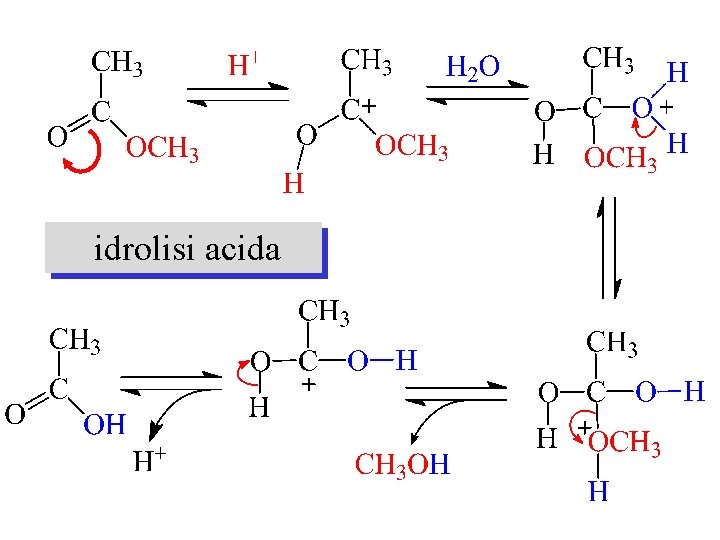
idrolisi acida
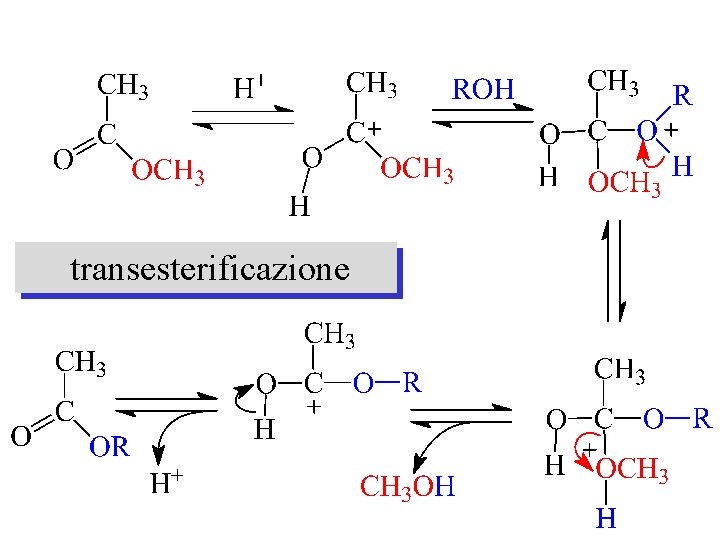
transesterificazione

Meccanismo della Condensazione di Claisen tra due molecole di acetato di etile (formazione dei β-cheto esteri)
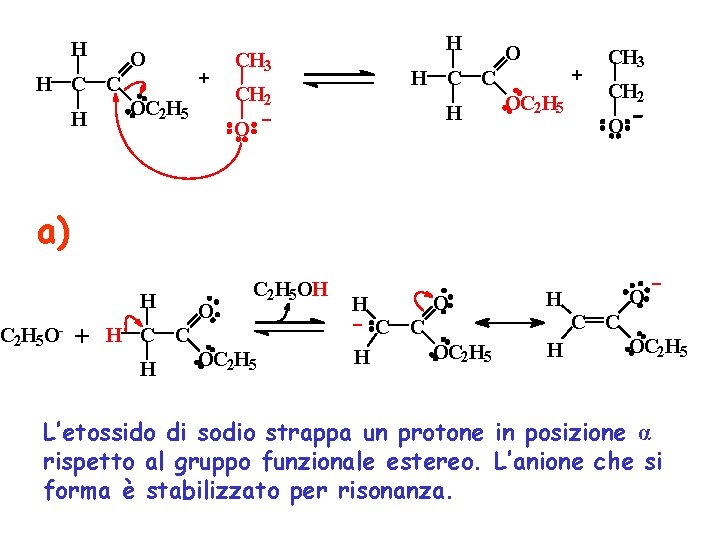
H O CH 3 H C C H H CH 3 H C C CH 2 OC 2 H 5 O H O OC 2 H 5 CH 2 O a) H C 2 H 5 O- + H C C H O C 2 H 5 OH OC 2 H 5 H C C H O C C OC 2 H 5 L’etossido di sodio strappa un protone in posizione α rispetto al gruppo funzionale estereo. L’anione che si forma è stabilizzato per risonanza.
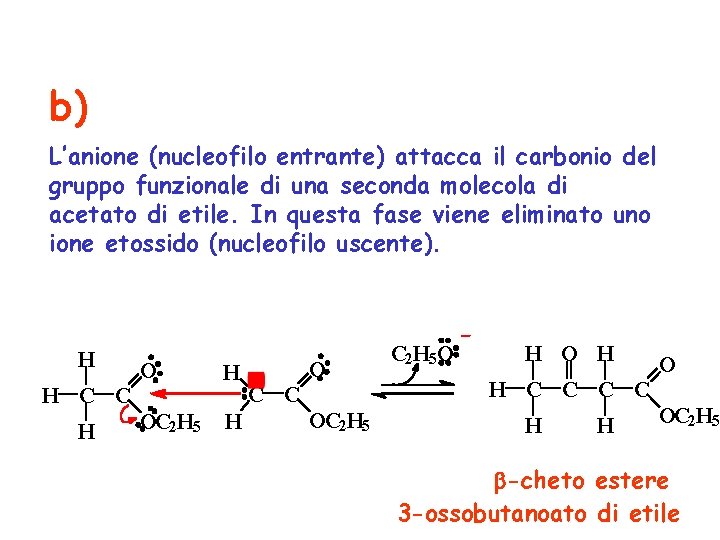
b) L’anione (nucleofilo entrante) attacca il carbonio del gruppo funzionale di una seconda molecola di acetato di etile. In questa fase viene eliminato uno ione etossido (nucleofilo uscente). H O H C C H OC 2 H 5 H H O C C OC 2 H 5 O H O H C C H H OC 2 H 5 -cheto estere 3 -ossobutanoato di etile
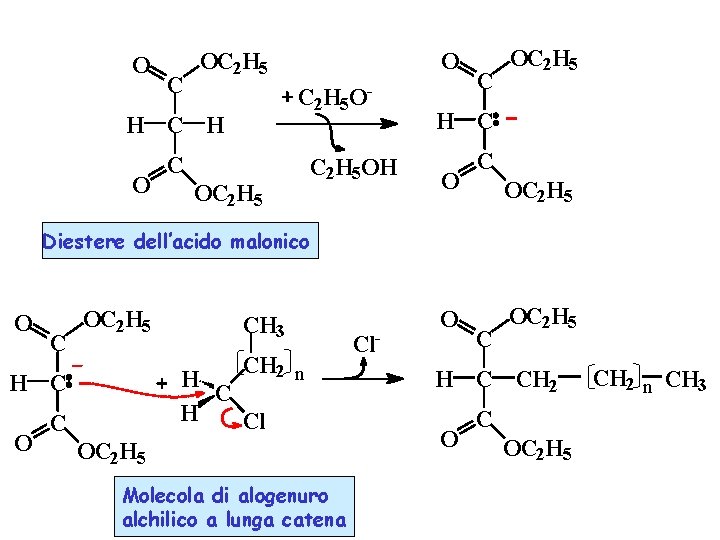
O C OC 2 H 5 - C 2 H 5 O H C H O O C OC 2 H 5 OH C OC 2 H 5 Diestere dell’acido malonico O C OC 2 H 5 CH 2 n H Cl H C O CH 3 C OC 2 H 5 Molecola di alogenuro alchilico a lunga catena Cl- O C OC 2 H 5 H C CH 2 O C OC 2 H 5 CH 2 n CH 3
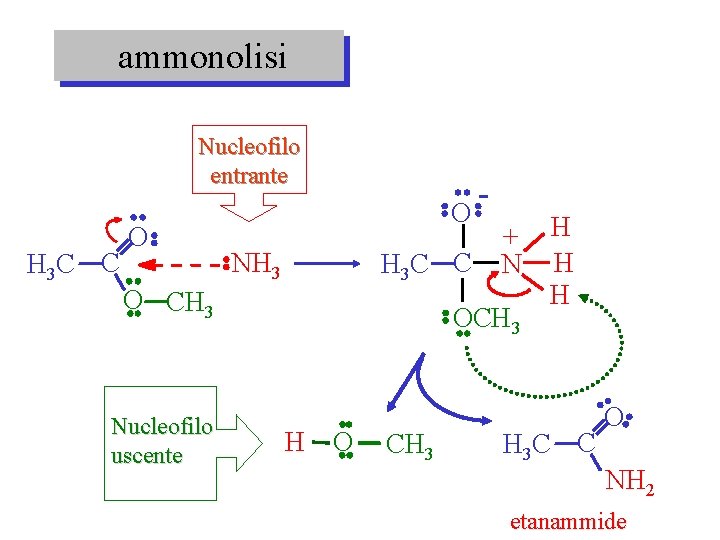
ammonolisi Nucleofilo entrante H 3 C C O O H 3 C C NH 3 O CH 3 Nucleofilo uscente + N OCH 3 H O CH 3 H H 3 C C O NH 2 etanammide
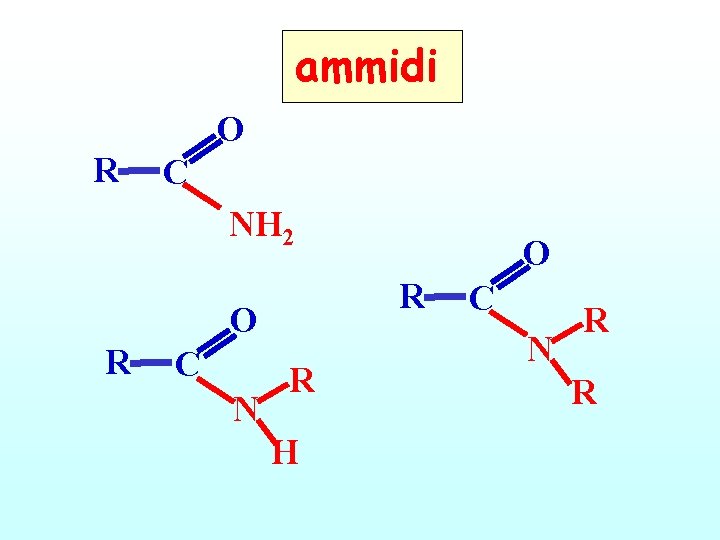
ammidi O R C NH 2 R O R C N O R H C N R R
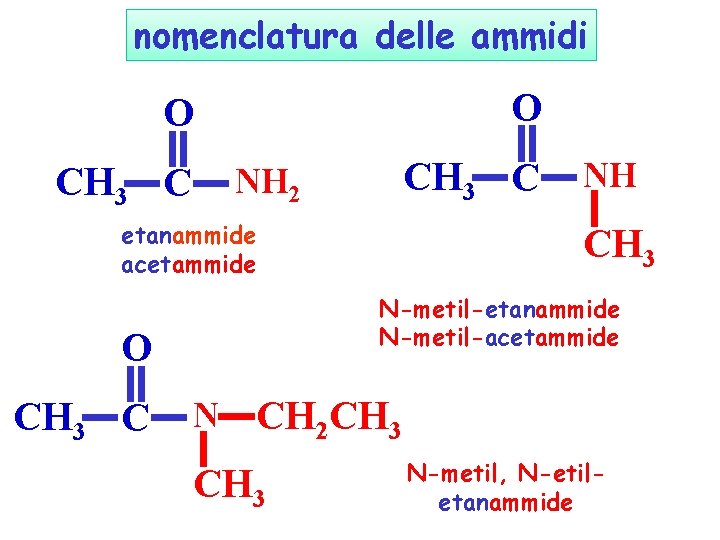
nomenclatura delle ammidi O O CH 3 C NH 2 etanammide acetammide CH 3 N-metil-etanammide N-metil-acetammide O CH 3 C NH N CH 2 CH 3 N-metil, N-etiletanammide
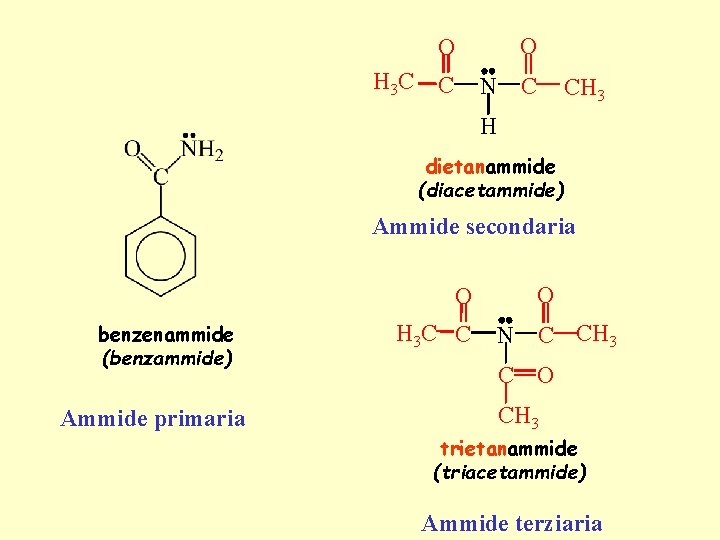
H 3 C O O C N C CH 3 H dietanammide (diacetammide) Ammide secondaria O benzenammide (benzammide) Ammide primaria H 3 C C O N C CH 3 C O CH 3 trietanammide (triacetammide) Ammide terziaria
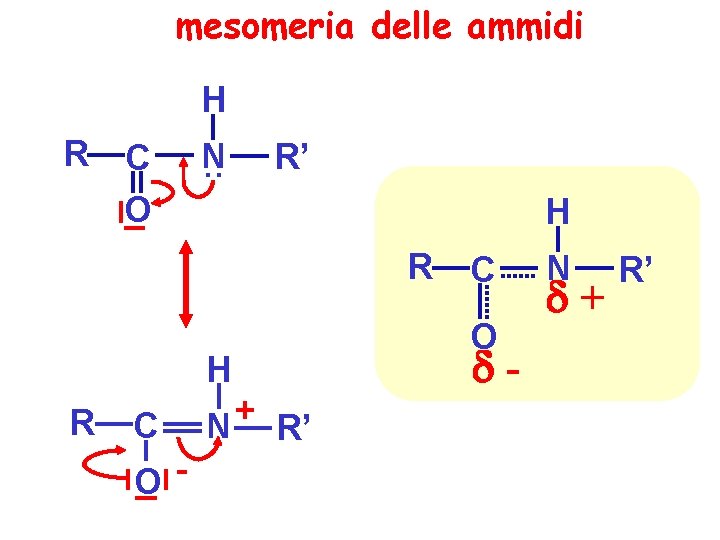
mesomeria delle ammidi H R C O N. . R’ H R C O- + N R’ C O - N + R’
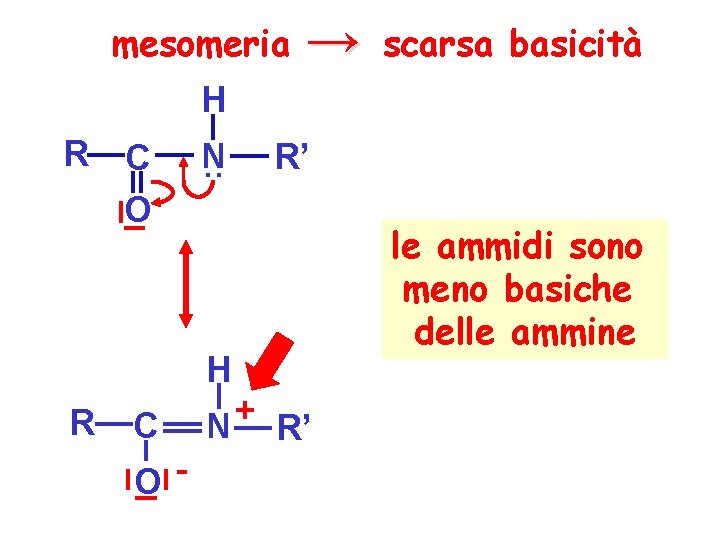
mesomeria → scarsa basicità H R C O N. . R’ H R C O- + N R’ le ammidi sono meno basiche delle ammine
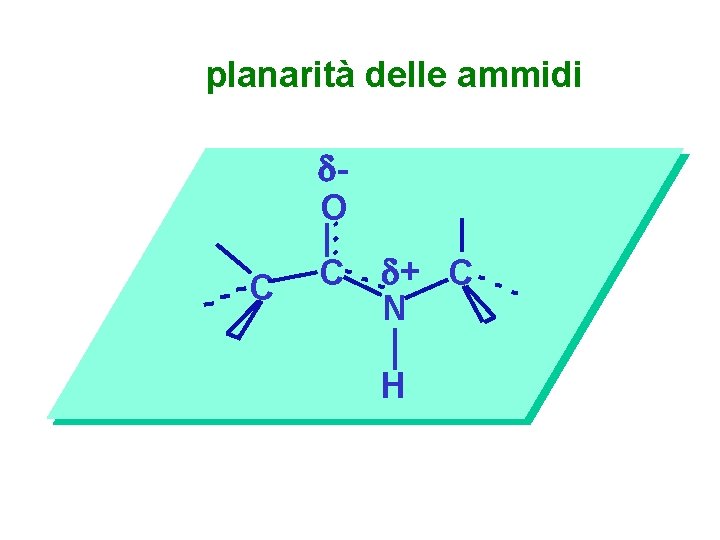
planarità delle ammidi O C C + C N H
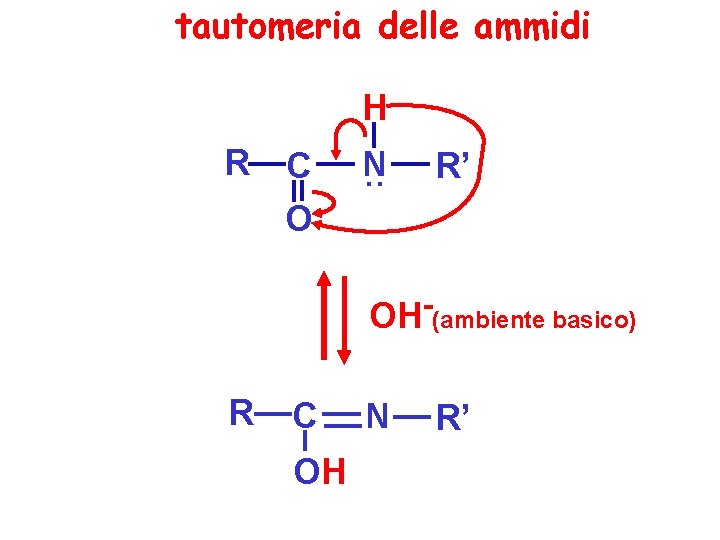
tautomeria delle ammidi H R C O N. . R’ OH-(ambiente basico) R C OH N R’
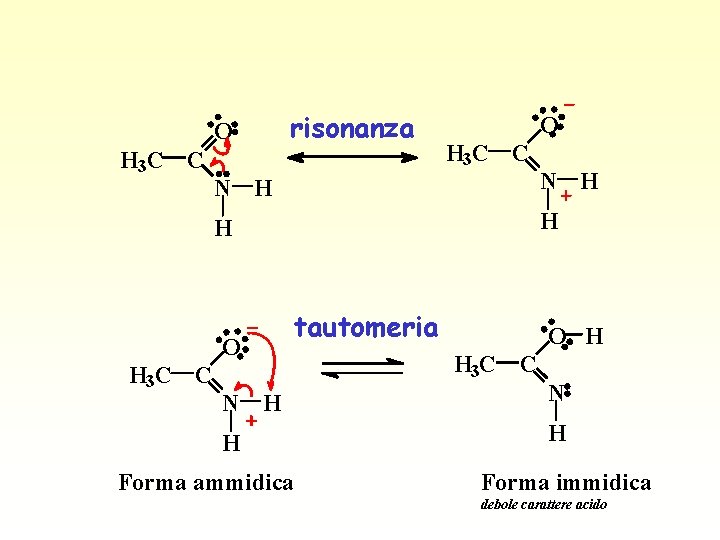
O H 3 C C N H H H O H 3 C C risonanza tautomeria O H H 3 C C N H H Forma ammidica Forma immidica debole carattere acido
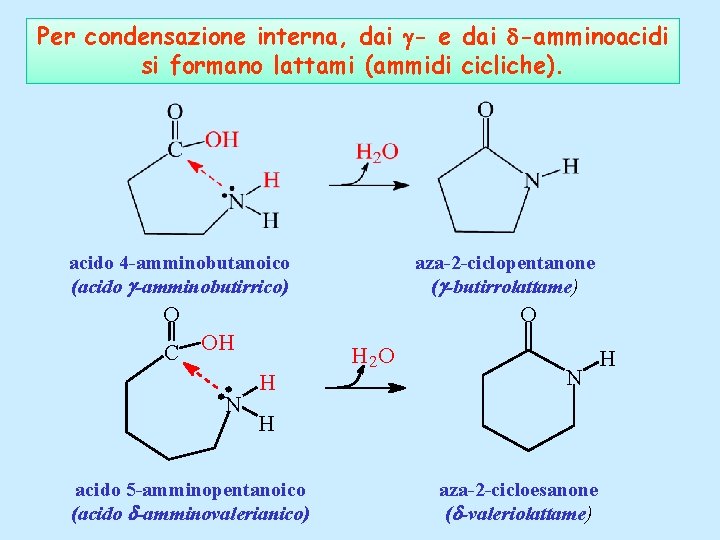
Per condensazione interna, dai - e dai -amminoacidi si formano lattami (ammidi cicliche). acido 4 -amminobutanoico (acido g-amminobutirrico) aza-2 -ciclopentanone (g-butirrolattame) O O C OH N H H 2 O N H acido 5 -amminopentanoico (acido d-amminovalerianico) aza-2 -cicloesanone (d-valeriolattame) H
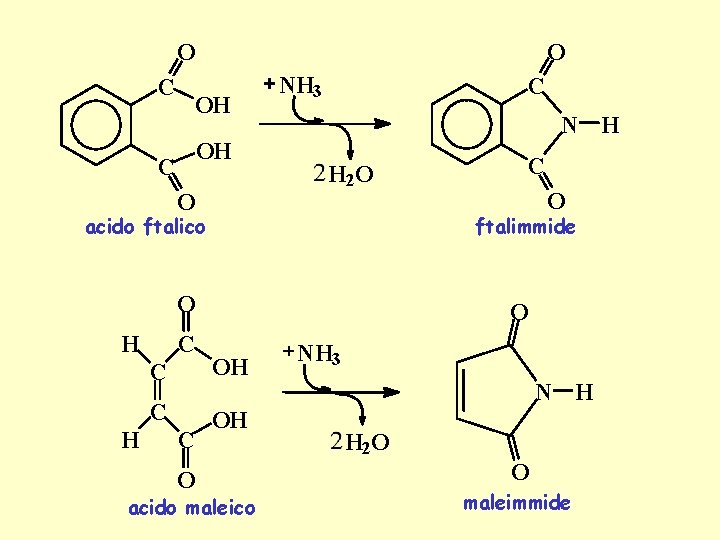
O O C OH OH C O NH 3 C N H H 2 O acido ftalico H C OH C O O ftalimmide O H C acido maleico NH 3 N H H 2 O O maleimmide
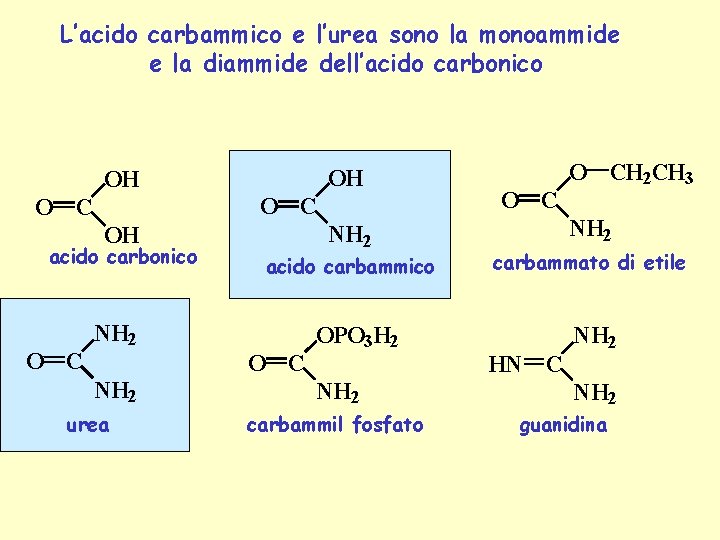
L’acido carbammico e l’urea sono la monoammide e la diammide dell’acido carbonico OH OH O C NH 2 OH acido carbonico O C acido carbammico NH 2 O C NH 2 urea OPO 3 H 2 NH 2 carbammil fosfato O CH 2 CH 3 NH 2 carbammato di etile HN C NH 2 guanidina
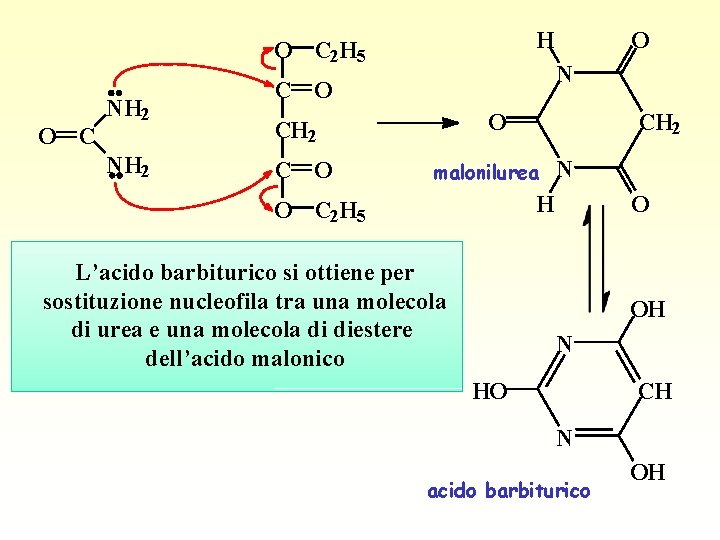
H O C 2 H 5 O C NH 2 N C O O CH 2 malonilurea N H O C 2 H 5 L’acido barbiturico si ottiene per sostituzione nucleofila tra una molecola di urea e una molecola di diestere dell’acido malonico O OH N HO CH N acido barbiturico OH
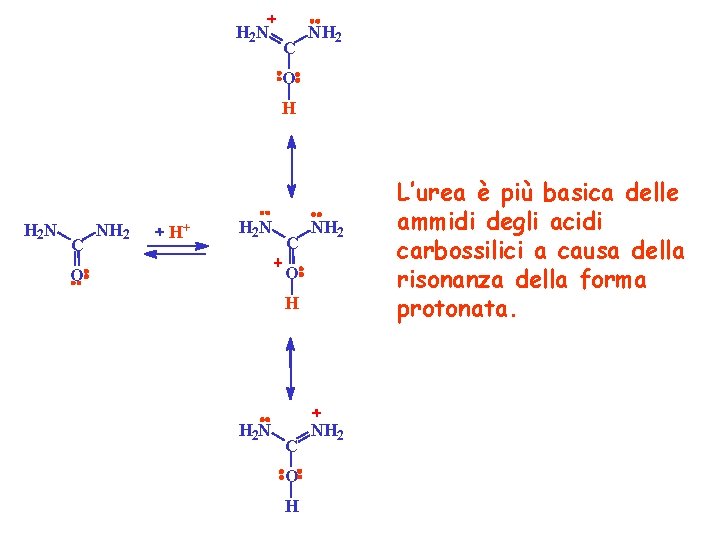
H 2 N C NH 2 O H H 2 N C NH 2 H+ H 2 N C NH 2 O O H H 2 N C O H NH 2 L’urea è più basica delle ammidi degli acidi carbossilici a causa della risonanza della forma protonata.
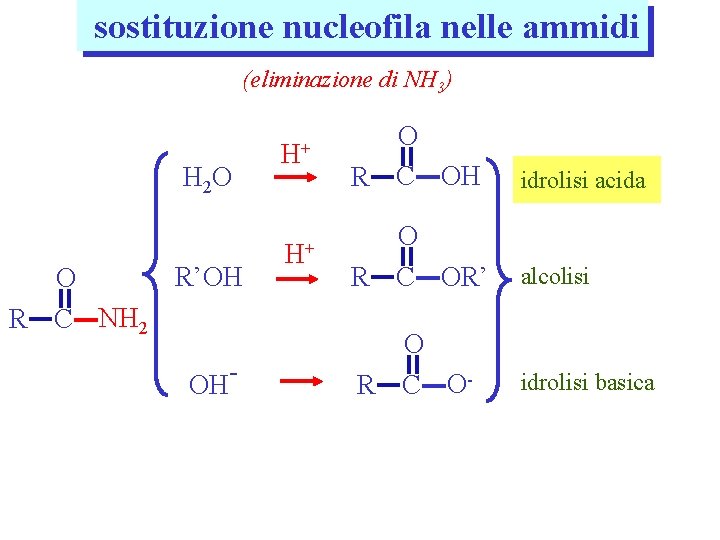
sostituzione nucleofila nelle ammidi (eliminazione di NH 3) H 2 O R’OH O R C NH 2 OH- H+ O R C OH idrolisi acida H+ O R C OR’ alcolisi O R C O- idrolisi basica

Idrolisi di un ammide monoalchilsostituita in ambiente acido
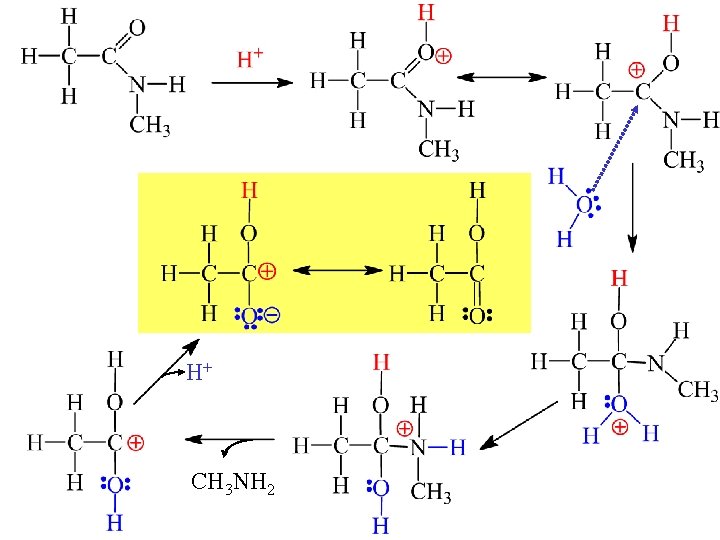
H+ CH 3 NH 2

Meccanismo di idrolisi di un’ammide monoalchil sostituita in ambiente basico
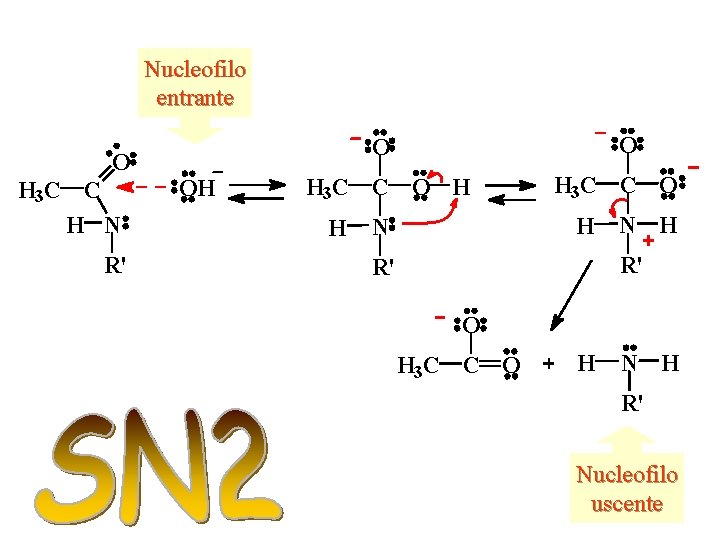
Nucleofilo entrante O H 3 C C H N R' O O OH H 3 C C O H N N H R' R' O H 3 C C O H N H R' Nucleofilo uscente

Alogenuri Acilici e Anidridi
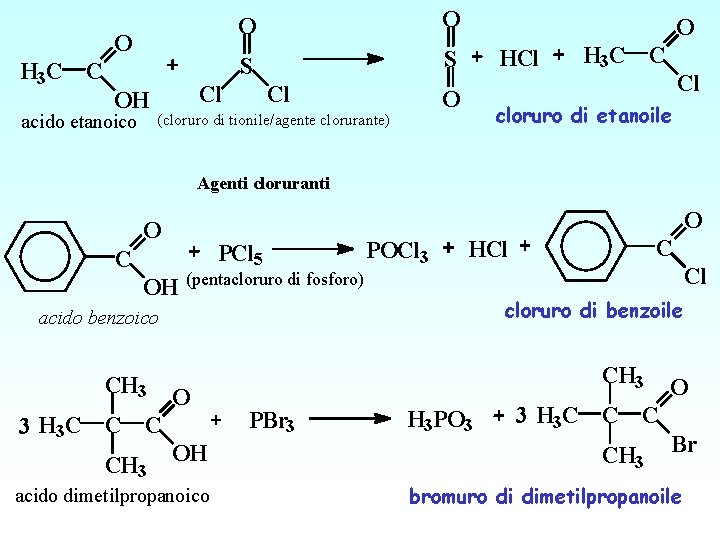
O H 3 C C OH acido etanoico O O S S Cl Cl O HCl O (cloruro di tionile/agente clorurante) H 3 C C Cl cloruro di etanoile Agenti cloruranti O O C PCl 5 POCl 3 OH (pentacloruro di fosforo) 3 H 3 C C C CH 3 O OH acido dimetilpropanoico Cl cloruro di benzoile acido benzoico CH 3 C HCl CH 3 PBr 3 H 3 PO 3 3 H 3 C C C CH 3 O Br bromuro di dimetilpropanoile
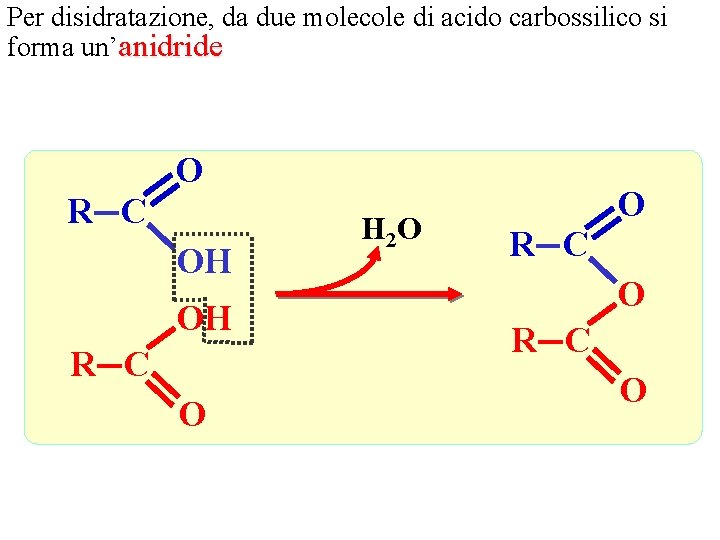
Per disidratazione, da due molecole di acido carbossilico si forma un’anidride O R C OH OH R C O H 2 O O R C O
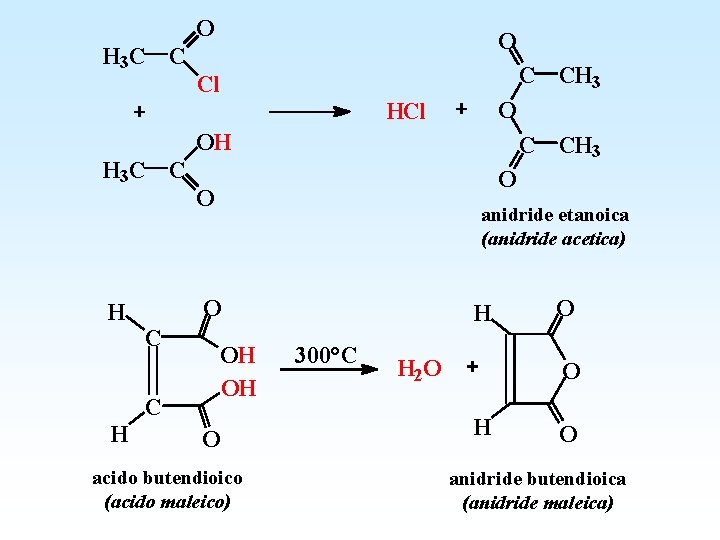
O H 3 C C O C CH 3 Cl O HCl OH H 3 C C H O O anidride etanoica (anidride acetica) O C C H C CH 3 OH OH O acido butendioico (acido maleico) H 300°C H 2 O O O H O anidride butendioica (anidride maleica)
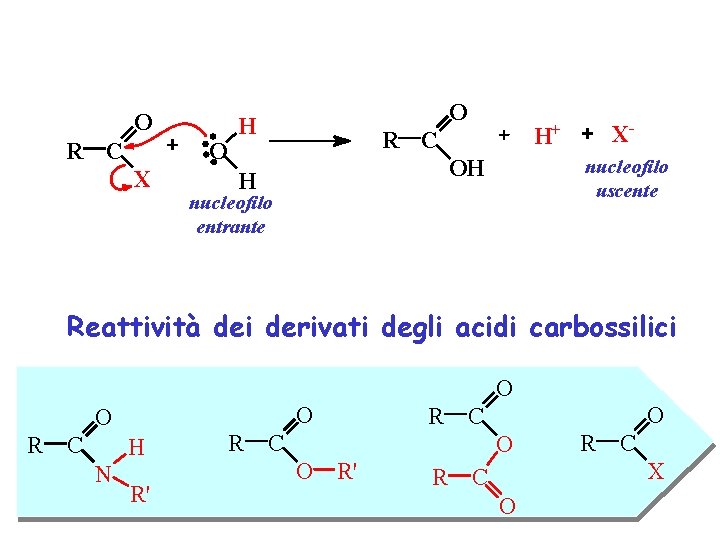
O R C O X O H R C OH H X- H+ nucleofilo uscente nucleofilo entrante Reattività dei derivati degli acidi carbossilici O O O R C H N R' R O R C C O O R' R R C X C O

L’alcolisi di un alogenuro acilico porta alla formazione di un estere e un acido alogenidrico
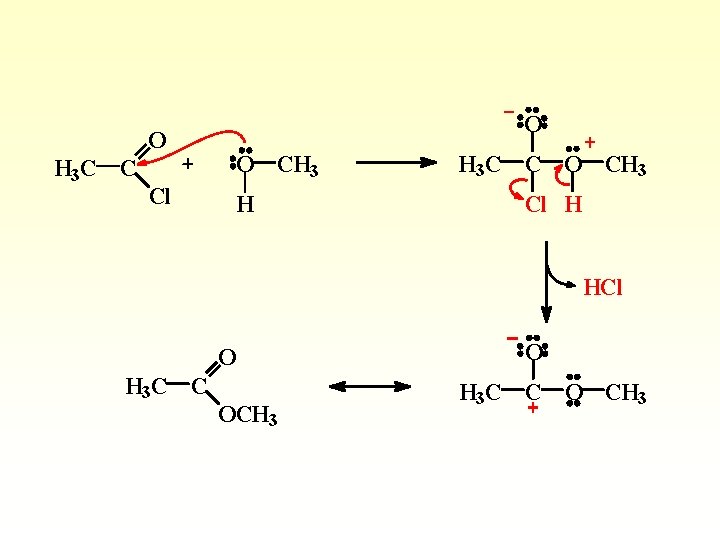
O H 3 C C Cl O O CH 3 H H 3 C C O CH 3 Cl H HCl O H 3 C C OCH 3 O H 3 C C O CH 3

Dall’alcolisi di una anidride si ottengono un acido carbossilico e l’estere
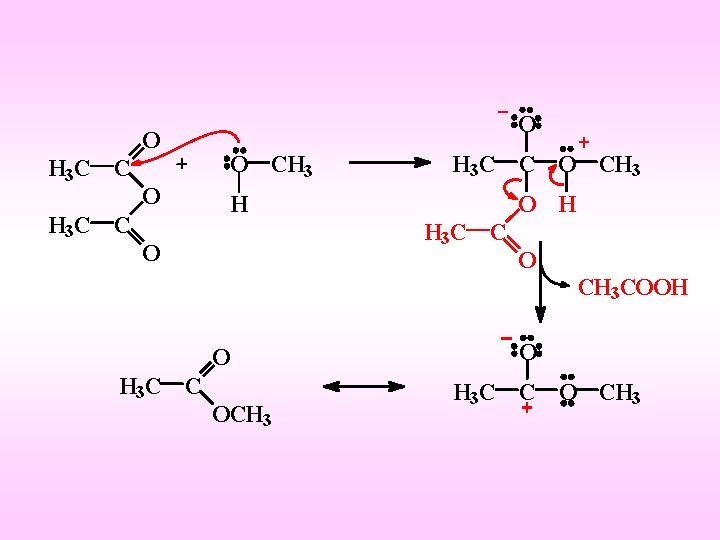
O H 3 C C O O O CH 3 O H H H 3 C C O O H 3 C C O CH 3 COOH O H 3 C C O CH 3
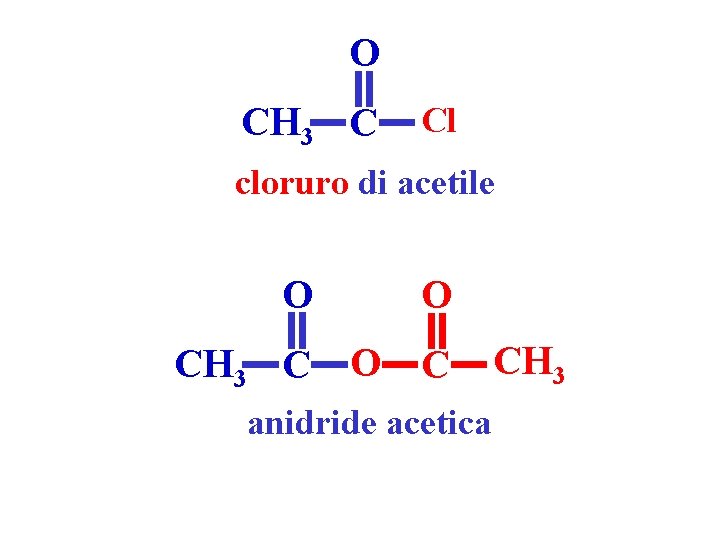
O CH 3 C Cl cloruro di acetile O CH 3 C O O C anidride acetica CH 3
- Slides: 61