Der EPORezeptor und seine Funktionen Das JanusGesicht der














- Slides: 29

Der EPO-Rezeptor und seine Funktionen

Das ‘Janus-Gesicht’ der Tumorhypoxie Hypoxie Verringerte Proliferation Differenzierung Apoptose Nekrose Adaptive Prozesse Aggressiver Phänotyp Tumorprogression Erworbene Therapieresistenz Schlüsselbotschaft Die überwiegende Mehrzahl hypoxischer Tumorzellen leiden unter diesen Folgen. Ein kleiner Teil (< 5%? ) der Zellen zeigt jedoch ein ganz anderes Verhalten, sie bestimmen das Schicksal des Krebspatienten.

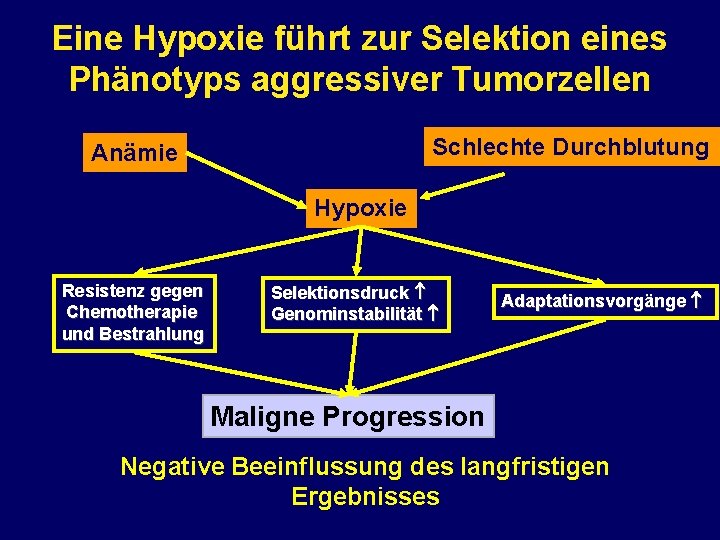
Eine Hypoxie führt zur Selektion eines Phänotyps aggressiver Tumorzellen Schlechte Durchblutung Anämie Hypoxie Resistenz gegen Chemotherapie und Bestrahlung Selektionsdruck Genominstabilität Adaptationsvorgänge Maligne Progression Negative Beeinflussung des langfristigen Ergebnisses

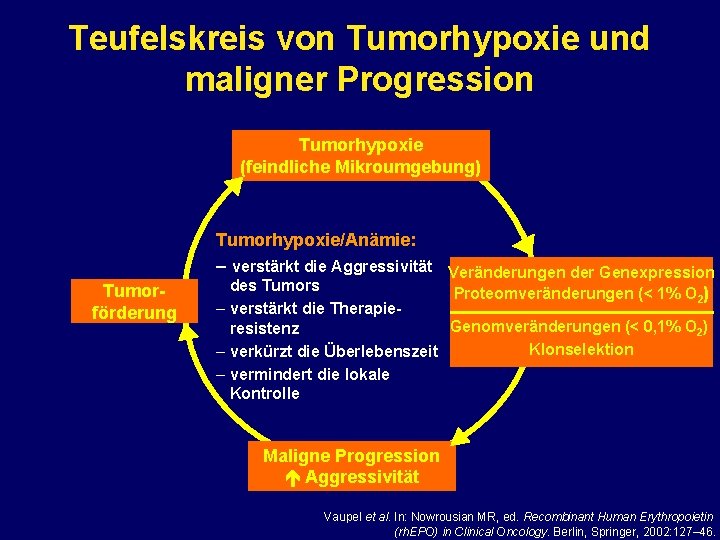
Teufelskreis von Tumorhypoxie und maligner Progression Tumorhypoxie (feindliche Mikroumgebung) Tumorförderung Tumorhypoxie/Anämie: – verstärkt die Aggressivität Veränderungen der Genexpression des Tumors Proteomveränderungen (< 1% O 2) – verstärkt die Therapie. Genomveränderungen (< 0, 1% O 2) resistenz Klonselektion – verkürzt die Überlebenszeit – vermindert die lokale Kontrolle Maligne Progression Aggressivität Vaupel et al. In: Nowrousian MR, ed. Recombinant Human Erythropoietin (rh. EPO) in Clinical Oncology. Berlin, Springer, 2002: 127– 46.

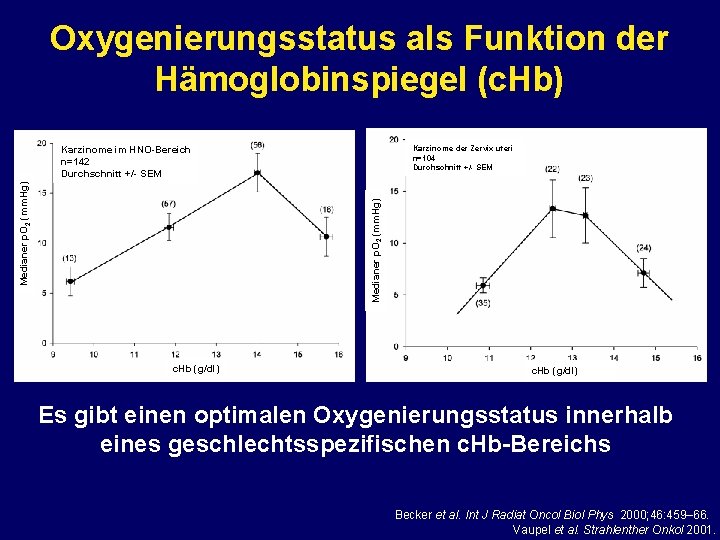
Oxygenierungsstatus als Funktion der Hämoglobinspiegel (c. Hb) Karzinome der Zervix uteri n=104 Durchschnitt +/- SEM Medianer p. O 2 (mm. Hg) Karzinome im HNO-Bereich n=142 Durchschnitt +/- SEM c. Hb (g/dl) Es gibt einen optimalen Oxygenierungsstatus innerhalb eines geschlechtsspezifischen c. Hb-Bereichs Becker et al. Int J Radiat Oncol Biol Phys 2000; 46: 459– 66. Vaupel et al. Strahlenther Onkol 2001.

Medianer p. O 2 (mm. Hg) Oxygenierungsstatus als Funktion des Hämoglobinspiegels 100 80 60 50 40 30 (3) (5) (3) (8) Normale Mamma 20 10 8 6 5 4 3 (9) (3) Mammakarzinome 2 1 (9) (7) 8 10 12 Hb (g/dl) 14 Vaupel et al. Cancer Res 2003; 63: 7634– 7.

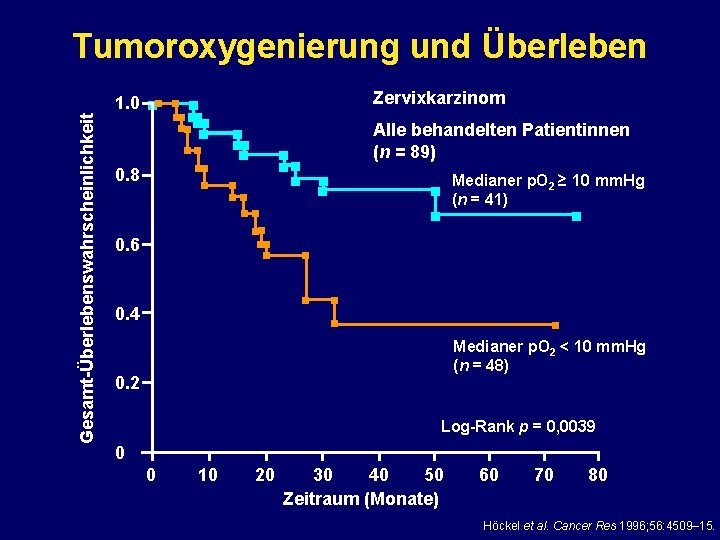
Tumoroxygenierung und Überleben Gesamt-Überlebenswahrscheinlichkeit 1. 0 nn n n nn nn nn 0. 8 n Zervixkarzinom n nn n Alle behandelten Patientinnen (n = 89) n nn n n n nn n 0. 6 n n 0. 4 Medianer p. O 2 ≥ 10 mm. Hg (n = 41) n n n Medianer p. O 2 < 10 mm. Hg (n = 48) 0. 2 Log-Rank p = 0, 0039 0 0 10 20 30 40 50 Zeitraum (Monate) 60 70 80 Höckel et al. Cancer Res 1996; 56: 4509– 15.

Oxygenierung von normalem Gewebe und Tumoren im HNO-Bereich Normalgewebe kann eine leichte Anämie kompensieren; Tumoren können dies nicht Tumoren im HNO-Bereich Gewebe-p. O 2 (mm Hg) p < 0, 0001 50 Normalgewebe (M. sternocleidom. ) Tumor 0 Mäßige/starke Anämie (Hb <11 g/dl) Leichte Anämie Normaler Hb F: 11, 0– 11, 9 g/d. L Hb-Wert M: 11, 0– 12, 9 g/d. L Becker et al. Int J Radiat Oncol Biol Phys 2000; 46: 459– 66.

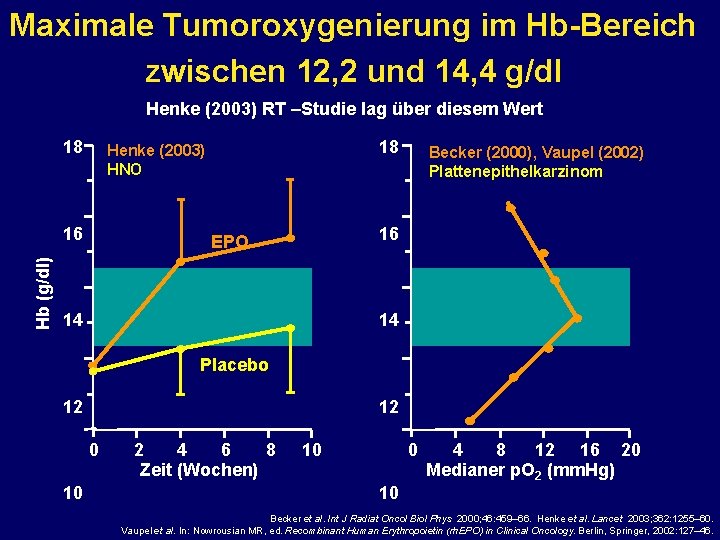
Maximale Tumoroxygenierung im Hb-Bereich zwischen 12, 2 und 14, 4 g/dl Henke (2003) RT –Studie lag über diesem Wert 18 16 Hb (g/dl) 18 Henke (2003) HNO Becker (2000), Vaupel (2002) Plattenepithelkarzinom 16 EPO 14 14 Placebo 12 12 0 10 2 4 6 8 Zeit (Wochen) 10 0 4 8 12 16 20 Medianer p. O 2 (mm. Hg) 10 Becker et al. Int J Radiat Oncol Biol Phys 2000; 46: 459– 66. Henke et al. Lancet 2003; 362: 1255– 60. Vaupel et al. In: Nowrousian MR, ed. Recombinant Human Erythropoietin (rh. EPO) in Clinical Oncology. Berlin, Springer, 2002: 127– 46.

Anämie, Hypoxie und Ergebnis einer Bestrahlung • Die Entwicklung einer Tumorhypoxie steht mit einer Anämie im Zusammenhang (Hb <13 g/dl)1, 2 • Hypoxische Regionen sind bei soliden Tumoren aufgrund einer unzureichenden Blutversorgung und hohem intratumoralem Sauerstoffverbrauch häufig. • Molekularer Sauerstoff scheint hoch reaktive Hydroxylradikale, die eine DNA-Schädigung vermitteln, zu stabilisieren • Zum Abtöten von Zellen ist unter hypoxischen Bedingungen im Vergleich zu Normalbedingungen das 2, 5 - bis 3, 5 -Fache der Standard-Bestrahlungsdosis erforderlich. 1. Brizel et al. Radiother Oncol 1999; 53: 113– 17. 2. Becker et al. Int J Radiat Oncol Biol Phys 2000; 46: 459– 66.

Zusammenfassung zur Tumoroxygenierung • Nur für Anstiege der Hb-Werte, die zu einer Verbesserung der Tumoroxygenierung führen, ist eine günstige Auswirkung auf die Prognose zu erwarten. • Bei höheren Hb-Werten (Hb >14 g/dl) ist ein erheblicher Anstieg der viskösen Resistenz innerhalb der chaotischen Mikrogefäße zu erwarten, was zu einer Nettoreduktion der Sauerstoffzufuhr führt (schlechte Tumoroxygenierung) • Nur Anstiege bis zu den gegenwärtig empfohlenen Hb-Werten führen zu Verbesserungen der Tumoroxygenierung, was die Prognose verbessern kann.

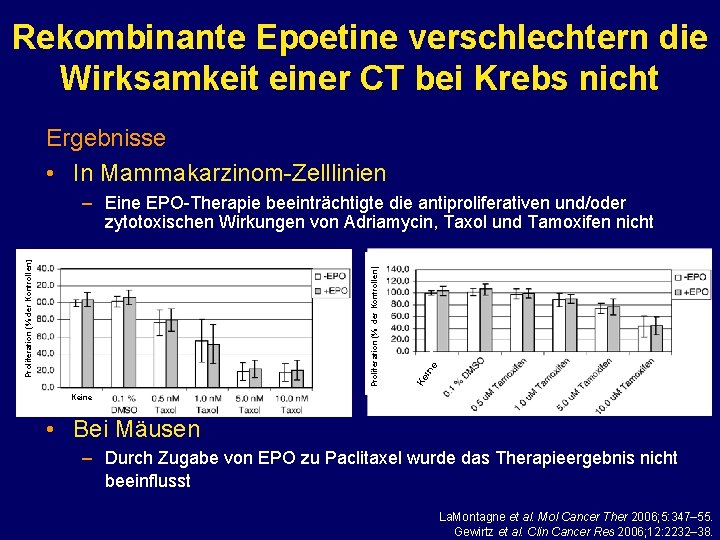
Rekombinante Epoetine verschlechtern die Wirksamkeit einer CT bei Krebs nicht Ergebnisse • In Mammakarzinom-Zelllinien e Ke in Proliferation (% der Kontrollen) – Eine EPO-Therapie beeinträchtigte die antiproliferativen und/oder zytotoxischen Wirkungen von Adriamycin, Taxol und Tamoxifen nicht Keine • Bei Mäusen – Durch Zugabe von EPO zu Paclitaxel wurde das Therapieergebnis nicht beeinflusst La. Montagne et al. Mol Cancer Ther 2006; 5: 347– 55. Gewirtz et al. Clin Cancer Res 2006; 12: 2232– 38.

Kenntnisse über den EPO-Rezeptor • Offene Fragen – Gibt es auf Tumorzellen EPO-Rezeptoren? – Ist der EPO-Rezeptor auf Tumorzellen funktionsfähig? – Können ESA in vivo den EPO-Rezeptor auf Tumorzellen stimulieren?

EPO-Rezeptoren (EPO-R) auf menschlichen Tumoren? • Indirekte Belege 1, 2 – Elimination von IHC-Färbung des Tumors bei vorheriger Resorption von EPO-R – In klinischen Studien lassen sich eine Verringerung des lokoregionalen PFS oder des Gesamtüberlebens in der mit ESA behandelten Gruppe beobachten • Direkte Belege 3 – Demonstration eines EPO-R-Effekts in Tumorzelllinien oder Tumorproben mit polyklonalen Antiseren von Kaninchen (IHC) – Förderung des Tumorzellwachstums und/oder Therapieresistenz in vitro IHC = Immunhistochemie. 1. Osterborg et al. Eur J Cancer 2007; 43: 510– 9. 2. Lai et al. J Clin Oncol 2006; 24: 4675– 6. 3. Sinclair et al. Cancer 2007; 110: 477– 88.

Rekombinantes Epoetin ist nicht mit einem Tumorwachstum assoziiert Präklinische Studien • Untersuchung der EPO-Rezeptor-Expression und Auswirkung einer Therapie mit rekombinanten Epoetinen auf das Tumorwachstum Ergebnisse • In Mammakarzinom-Zelllinien – Es wurde eine EPO-Rezeptor-Expression nachgewiesen – Es war keine spezifische Bindung von Epoetin an den Rezeptor zu beobachten, was darauf hinweist, dass der EPO-Rezeptor nicht funktionsfähig ist – Eine Epoetin-Therapie führte nicht zu Tumorwachstum • Epoetin löste keine physiologische Reaktion des Tumors aus (Proliferation, Migration, Signaltransduktion) La. Montagne et al. Mol Cancer Ther 2006; 5: 347– 55. Gewirtz et al. Clin Cancer Res 2006; 12: 2232– 38.

Präklinische Studien zur Auswirkung von ESA auf menschliche Tumoren • Die Mehrzahl der in-vitro- und in-vivo-Studien zeigte eine neutrale Auswirkung • In einigen wenigen in-vitro- Studien zeigte sich eine gewisse Auswirkung auf die Proliferation und/oder Apoptoseresistenz – – Suprapharmakologische Konzentration von ESA Nicht statistisch signifikant; synchronisierte Zellen Nicht konsistent, was positive/negative Kontrollen betrifft Keine eindeutigen Belege für intrazelluläre Signalgebung Osterborg et al. Eur J Cancer 2007; 43: 510– 9.

Präklinische Daten deuten nicht auf eine Bedeutung von EPO-R für die Tumorprogression hin • Das EPO-R-Gen ist kein Onkogen, und eine Überexpression dieses Gens bringt für Tumoren keinen Selektionsvorteil • EPO-R-m. RNA-Spiegel sind in Tumorzelllinien nachweisbar, im Vergleich zu nicht tumorösen Geweben aber nicht erhöht • Tumorzelllinien zeigen eine schwache oder nicht nachweisbare EPOBindung • Eine Oberflächenexpression von EPO-R auf Tumoren wurde nicht zweifelsfrei gezeigt • In den meisten klinischen Modellen zeigen sich verbesserte Ergebnisse (keine Tumorprogression in 23 unabhängigen Studien) Sinclair et al. Cancer 2007; 110: 477– 88.

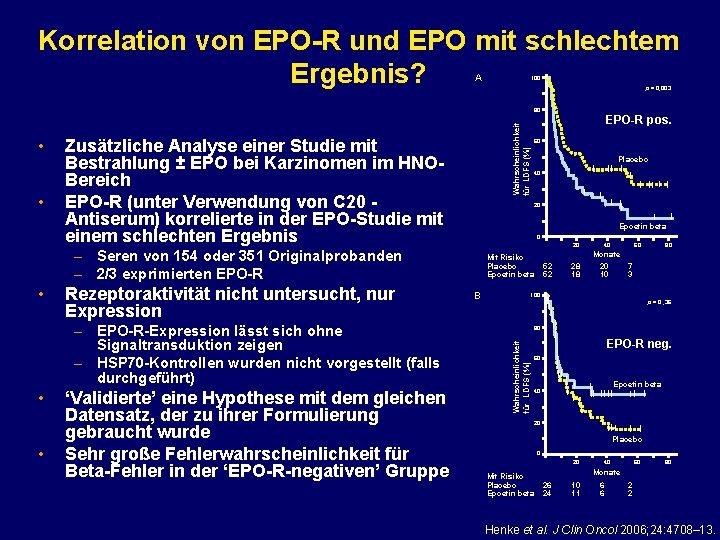
Korrelation von EPO-R und EPO mit schlechtem Ergebnis? A 100 p = 0, 003 • Zusätzliche Analyse einer Studie mit Bestrahlung ± EPO bei Karzinomen im HNOBereich EPO-R (unter Verwendung von C 20 Antiserum) korrelierte in der EPO-Studie mit einem schlechten Ergebnis Rezeptoraktivität nicht untersucht, nur Expression – EPO-R-Expression lässt sich ohne Signaltransduktion zeigen – HSP 70 -Kontrollen wurden nicht vorgestellt (falls durchgeführt) • • ‘Validierte’ eine Hypothese mit dem gleichen Datensatz, der zu ihrer Formulierung gebraucht wurde Sehr große Fehlerwahrscheinlichkeit für Beta-Fehler in der ‘EPO-R-negativen’ Gruppe 60 Placebo 40 Epoetin beta 0 20 – Seren von 154 oder 351 Originalprobanden – 2/3 exprimierten EPO-R • EPO-R pos. 20 Mit Risiko Placebo Epoetin beta B 52 52 28 18 40 60 80 Monate 20 7 10 3 100 p = 0 , 36 80 Wahrscheinlichkeit für LDFS (%) • Wahrscheinlichkeit für LDFS (%) 80 EPO-R neg. 60 Epoetin beta 40 20 Placebo 0 20 Mit Risiko Placebo Epoetin beta 40 60 80 Monate 26 24 10 11 6 6 2 2 Henke et al. J Clin Oncol 2006; 24: 4708– 13.

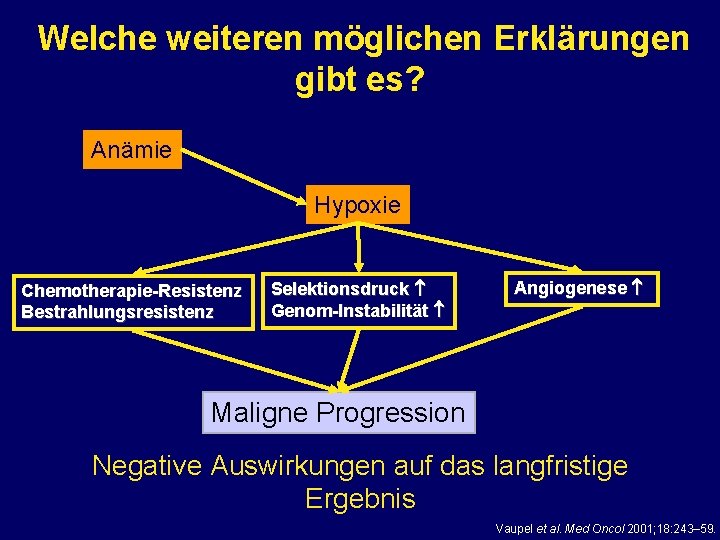
Welche weiteren möglichen Erklärungen gibt es? Anämie Hypoxie Chemotherapie-Resistenz Bestrahlungsresistenz Selektionsdruck Genom-Instabilität Angiogenese Maligne Progression Negative Auswirkungen auf das langfristige Ergebnis Vaupel et al. Med Oncol 2001; 18: 243– 59.

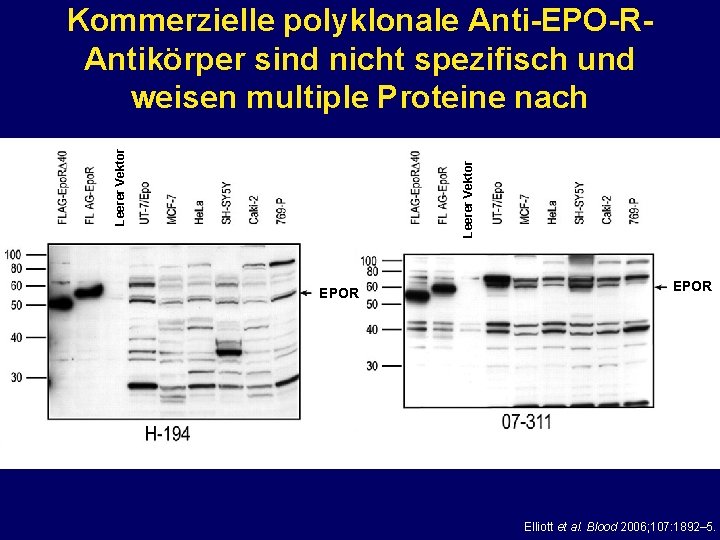
Leerer Vektor Kommerzielle polyklonale Anti-EPO-RAntikörper sind nicht spezifisch und weisen multiple Proteine nach EPOR Elliott et al. Blood 2006; 107: 1892– 5.

Hitzeschockprotein 70 (HSP 70) • Sehr gut erhaltene Familie von Chaperon-Proteinen, die in normalen Zellen durch Stress induziert werden und wichtige Funktionen für das Überleben der Zelle und die Apoptoseresistenz haben • Die Expression wird bei vielen menschlichen Tumoren verstärkt – Die Expression korreliert bei vielen Tumorarten (Bronchien, Mamma, HNO, Prostata, Darm, Magen, Blase) mit einem kürzeren Überleben und einer Therapieresistenz – Die Expression wird unter hypoxischen Bedingungen verstärkt – Eine Hinunterregulierung (z. B. Antisense) induziert den Tod von Tumorzellen • Homologe Sequenz mit Antigen, das zur Bildung von polyklonalen Antikörpern C 20 verwendet wird (insbesondere HSP 70 -2 und HSP 705) Viele der ‘EPO-R’, die mit C 20 nachgewiesen werden, könnten auch HSP 70 -2 oder HSP 70 -5 sein Schmitt et al. J Leukoc Biol 2007; 81: 15– 27.

Zusammenfassung der Datenlage: ESA sind nicht mit Tumorwachstum/Proliferation assoziiert • Präklinische und klinische Daten sprechen nicht für die Hypothese, eine ESA-Therapie führe zu Tumorwachstum/-proliferation • Der Antikörper, der zum Nachweis des EPO-Rezeptors verwendet wird, ist unspezifisch und weist auch das Hitzeschockprotein 70 nach ( HSP 70 -2, HSP 70 -5) • In Modellen heterologer Transplantate wurde EPO-R auf der Plasmamembran von Tumorzellen nicht funktionell exprimiert • In keiner Studie zeigte sich, dass pharmakologisch relevante ESADosen das Tumorzellwachstum stimulieren • ESA hatten keinen negativen Einfluss auf die Zytotoxizität einer CT • Erythropoetin war nicht proangiogen und verstärkte die Metastasenentstehung nicht Laufende Studien werden Informationen zur Funktion von EPO-R bei Tumoren liefern

Zusammenfassung: Kenntnisse über EPO-R Offene Fragen • Gibt es auf Tumorzellen EPO-R? • Rezeptoren lassen sich mit Hilfe eines unspezifischen Antikörpers auf Tumorzellen nachweisen – EPO-R und HSP-70 haben sehr ähnliche Strukturen • Ist der EPO-R auf Tumorzellen funktionsfähig? • Es gibt keine Belege dafür, dass EPO-R oder HSP-70 durch ESA aktiviert werden • Können ESA in vivo EPO-R auf Tumorzellen stimulieren? • Es gibt keine Belege dafür, dass ESA innerhalb der zugelassenen Anwendungsgebiete bei Patienten mit CT Tumorzellen stimulieren

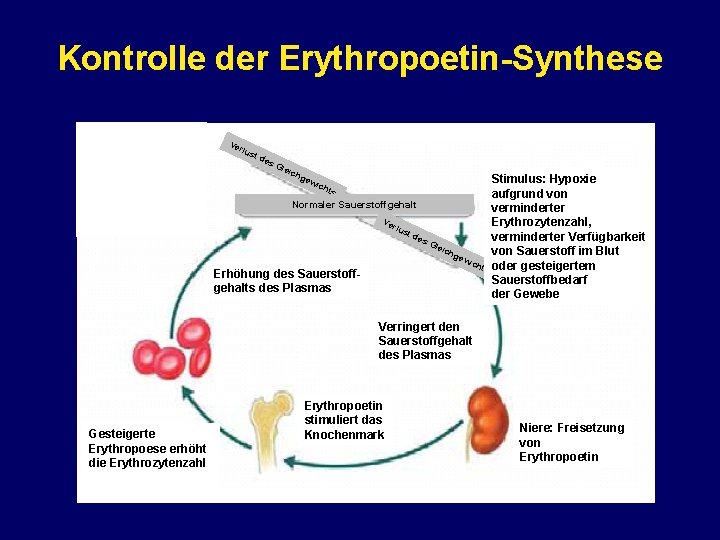
Kontrolle der Erythropoetin-Synthese Ve rlu st d es Gle ich gew ich Stimulus: Hypoxie aufgrund von Normaler Sauerstoffgehalt verminderter Ve Erythrozytenzahl, rlu st d es verminderter Verfügbarkeit Gle ich von Sauerstoff im Blut gew ich ts oder gesteigertem Erhöhung des Sauerstoffbedarf gehalts des Plasmas der Gewebe ts Verringert den Sauerstoffgehalt des Plasmas Gesteigerte Erythropoese erhöht die Erythrozytenzahl Erythropoetin stimuliert das Knochenmark Niere: Freisetzung von Erythropoetin

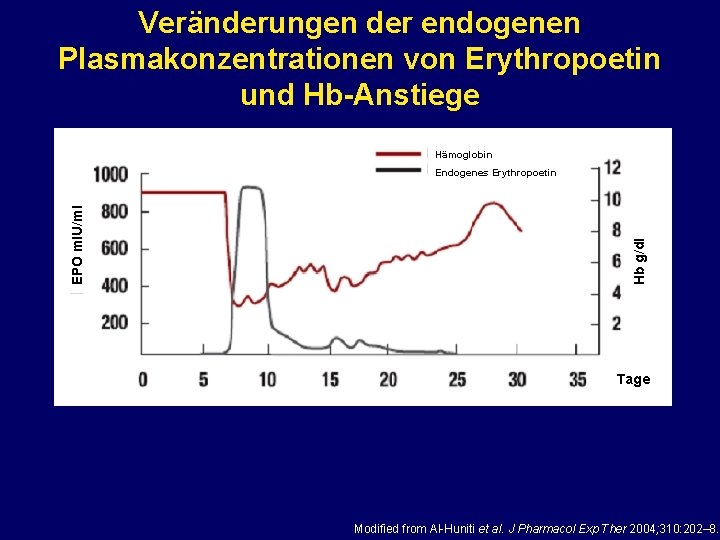
Veränderungen der endogenen Plasmakonzentrationen von Erythropoetin und Hb-Anstiege Hämoglobin Hb g/dl EPO m. IU/ml Endogenes Erythropoetin Tage Modified from Al-Huniti et al. J Pharmacol Exp Ther 2004; 310: 202– 8.

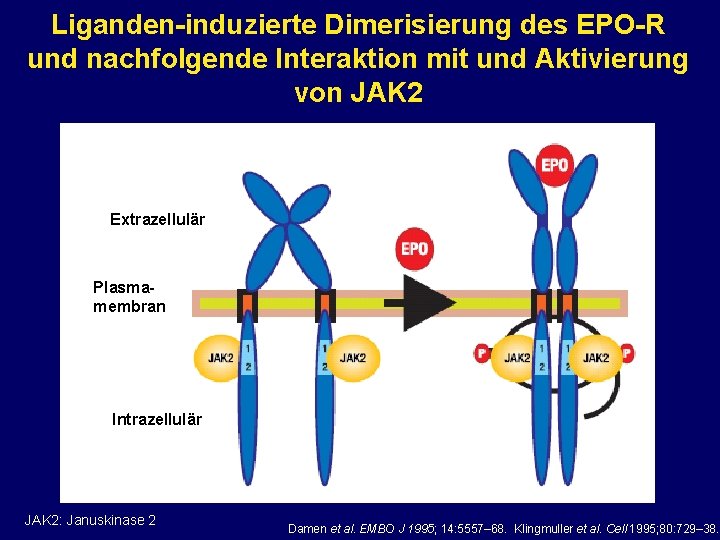
Liganden-induzierte Dimerisierung des EPO-R und nachfolgende Interaktion mit und Aktivierung von JAK 2 Extrazellulär Plasmamembran Intrazellulär JAK 2: Januskinase 2 Damen et al. EMBO J 1995; 14: 5557– 68. Klingmuller et al. Cell 1995; 80: 729– 38.

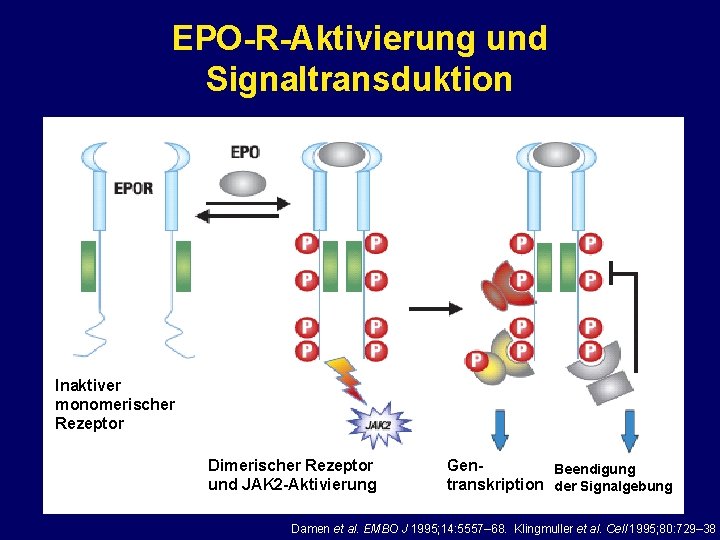
EPO-R-Aktivierung und Signaltransduktion Inaktiver monomerischer Rezeptor Dimerischer Rezeptor und JAK 2 -Aktivierung Gen. Beendigung transkription der Signalgebung Damen et al. EMBO J 1995; 14: 5557– 68. Klingmuller et al. Cell 1995; 80: 729– 38

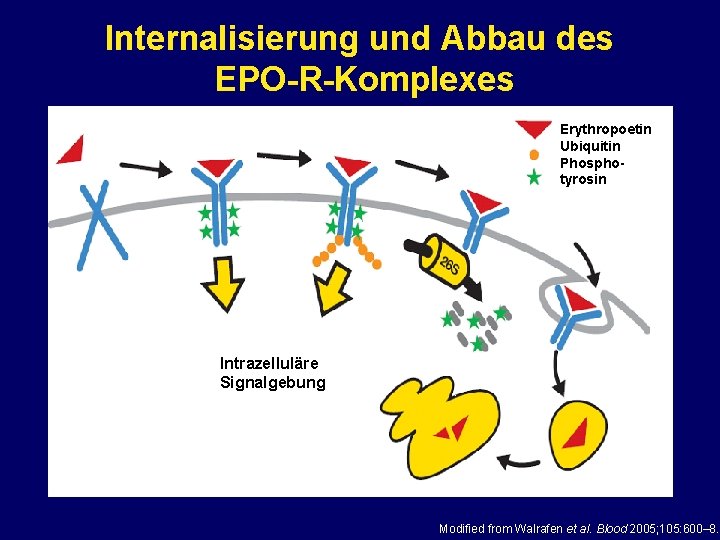
Internalisierung und Abbau des EPO-R-Komplexes Erythropoetin Ubiquitin Phosphotyrosin Intrazelluläre Signalgebung Modified from Walrafen et al. Blood 2005; 105: 600– 8.

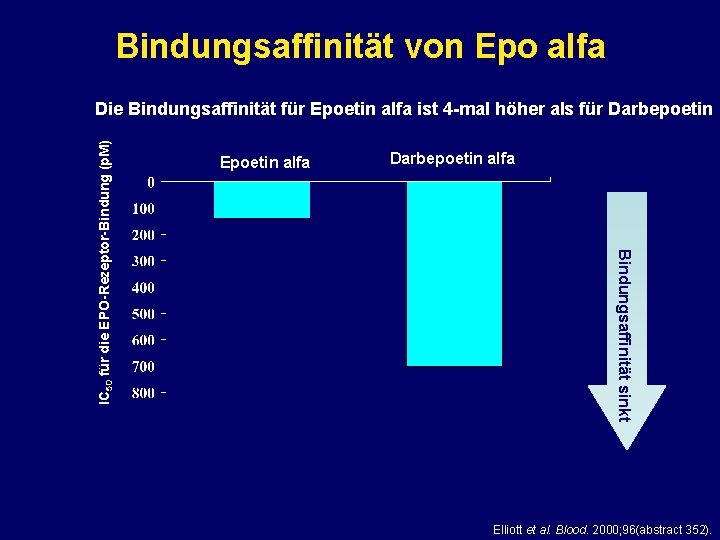
Bindungsaffinität von Epo alfa Epoetin alfa Darbepoetin alfa Bindungsaffinität sinkt IC 50 für die EPO-Rezeptor-Bindung (p. M) Die Bindungsaffinität für Epoetin alfa ist 4 -mal höher als für Darbepoetin Elliott et al. Blood. 2000; 96(abstract 352).
 Janusgesicht bedeutung
Janusgesicht bedeutung Das gehirn und seine wirklichkeit
Das gehirn und seine wirklichkeit Das ist der daumen der pflückt die pflaumen
Das ist der daumen der pflückt die pflaumen Tingkah laku ikan terhadap alat tangkap purse seine
Tingkah laku ikan terhadap alat tangkap purse seine Rue de seine paris
Rue de seine paris Ehret eure eltern
Ehret eure eltern Joseph von eichendorff abendrot
Joseph von eichendorff abendrot Meine deine seine ihre
Meine deine seine ihre Seine gelée 1987
Seine gelée 1987 Eure madrie seine foot
Eure madrie seine foot Missionsreise
Missionsreise Label the seine thames elbe tiber and danube rivers
Label the seine thames elbe tiber and danube rivers Jeder hat seine eigene meinung
Jeder hat seine eigene meinung Slidetodoc.com
Slidetodoc.com Wo verbrachte mozart seine kindheit
Wo verbrachte mozart seine kindheit Drift long lines
Drift long lines Meine deine seine ihre
Meine deine seine ihre Funktionen des sachrechnens nach winter
Funktionen des sachrechnens nach winter Logische funktionen informatik
Logische funktionen informatik Zusammenfassung lineare funktionen
Zusammenfassung lineare funktionen Exekutive funktionen und selbstregulation
Exekutive funktionen und selbstregulation Rekonstruktion von funktionen
Rekonstruktion von funktionen Syntaktische kategorien und funktionen
Syntaktische kategorien und funktionen Exekutivfunktionen
Exekutivfunktionen Neigungswinkel berechnen
Neigungswinkel berechnen Lineares wachstum beispiel alltag
Lineares wachstum beispiel alltag Callotsches dreieck
Callotsches dreieck Trigonometrie deckblatt
Trigonometrie deckblatt Leitziele richtziele grobziele feinziele
Leitziele richtziele grobziele feinziele Funktionen eines leitbildes
Funktionen eines leitbildes