DEPARTAMENTO DE CIENCIAS DE LA VIDA Y DE

























- Slides: 45

DEPARTAMENTO DE CIENCIAS DE LA VIDA Y DE LA AGRICULTURA INGENIERÍA EN BIOTECNOLOGÍA “CARACTERIZACIÓN Y EVALUACIÓN DE BACTERIAS Pseudomonas sp. SOLUBILIZADORAS DE FÓSFORO, PRESENTES EN LA RIZÓSFERA DEL MAÍZ (Zea mays L) DE LOS ENSAYOS EXPERIMENTALES DEL INIAP DE LAS PROVINCIAS DE IMBABURA, BOLÍVAR, CHIMBORAZO Y PICHINCHA” Proyecto para optar al Grado Académico o Título de: INGENIERA EN BIOTECNOLOGÍA Ana Katherine Pincay Verdezoto Sangolquí - Ecuador Septiembre, 2014

“CARACTERIZACIÓN Y EVALUACIÓN DE BACTERIAS Pseudomonas sp. SOLUBILIZADORAS DE FÓSFORO, PRESENTES EN LA RIZÓSFERA DEL MAÍZ (Zea mays L) DE LOS ENSAYOS EXPERIMENTALES DEL INIAP DE LAS PROVINCIAS DE IMBABURA, BOLÍVAR, CHIMBORAZO Y PICHINCHA” Índice de contenidos 1. Introducción 2. Objetivos 3. Materiales y métodos 4. Resultados 5. Discusión 6. Conclusiones 7. Recomendaciones Ama Katherine Pincay Verdezoto, 2014

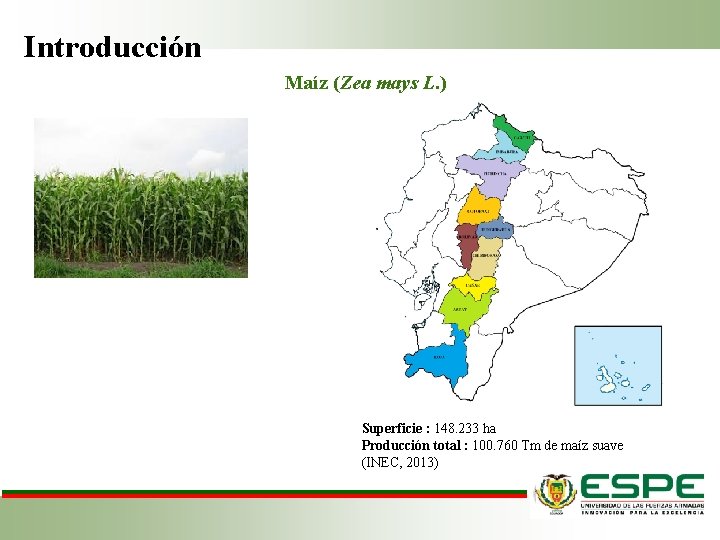
Introducción Maíz (Zea mays L. ) Superficie : 148. 233 ha Producción total : 100. 760 Tm de maíz suave (INEC, 2013)

Introducción Deficiencia de Fósforo en el Maíz Crecimiento lento Poco desarrollo del sistema radicular Coloración atípica en las hojas Disminuye su eficiencia fotosintética Reduce los procesos metabólicos Disminuye el rendimiento de la cosecha.

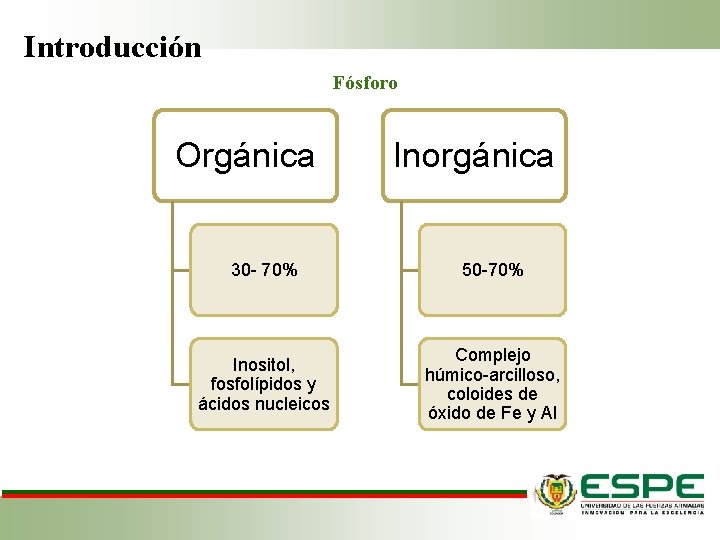
Introducción Fósforo Orgánica Inorgánica 30 - 70% 50 -70% Inositol, fosfolípidos y ácidos nucleicos Complejo húmico-arcilloso, coloides de óxido de Fe y Al

Introducción Fósforo P Soluble P Intercambiable P Insoluble • (H 2 PO 4 -) y (HPO 42 -) • Concentración: 200 a 400 g/h • Iones que rodean a las partículas coloidales • 800 a 2500 kg de P 2 O 5/ha • Forma parte de minerales

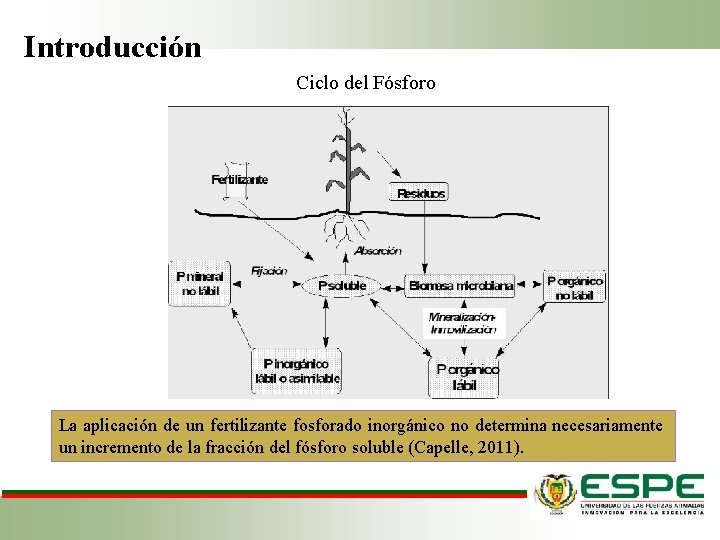
Introducción Ciclo del Fósforo La aplicación de un fertilizante fosforado inorgánico no determina necesariamente un incremento de la fracción del fósforo soluble (Capelle, 2011).

Introducción Microorganismos solubilizadores de fósforo Intervienen en los procesos de la solubilización, inmovilización y mineralización del fósforo de los depósitos orgánicos e inorgánicos (Coyne & Rasskin, 2000) Pseudomonas sp Fácil adaptabilidad (PGPR) (BCA) Degradan compuestos halogenados e hidrocarburos derivados del petróleo Metabolismo: oxidativo no fermentativo Tamaño: 0, 5 a 0, 8 µm x 1, 5 a 3, 0 µm, Pigmentos: piocianina o la fluoresceína (Bashan et al. , 2007)

Objetivos OBJETIVO GENERAL Caracterizar y evaluar Pseudomonas sp. , solubilizadoras de fósforo, presentes en la rizósfera del maíz (Zea mays) cultivado en los ensayos experimentales del INIAP de las provincias de Imbabura, Bolívar, Chimborazo y Pichincha.

Objetivos OBJETIVOS ESPECÍFICOS ØAislar bacterias Pseudomonas sp. , presentes en la rizósfera de maíz de las provincias de Imbabura, Bolívar, Chimborazo y Pichincha. ØCaracterizar macroscópica, microscópica, bioquímica y molecularmente las cepas de Pseudomonas sp. aisladas. ØDeterminar bajo condiciones in vitro, la capacidad de las bacterias aisladas para solubilizar fósforo y seleccionar aquellas con mayor porcentaje, para obtener un banco de cepas de Pseudomonas sp. ØEvaluar a nivel de invernadero el efecto que tiene Pseudomonas sp. , en el desarrollo del maíz (Zea mays).

Hipótesis Ha: Las bacterias aisladas de las muestras de rizósfera del cultivo de maíz pertenecen al género Pseudomonas y son capaces de solubilizar fósforo.

Materiales y métodos Evaluación funcional en invernadero de las cepas bacterianas Aislamiento, Caracterización de Pseudomonas sp.

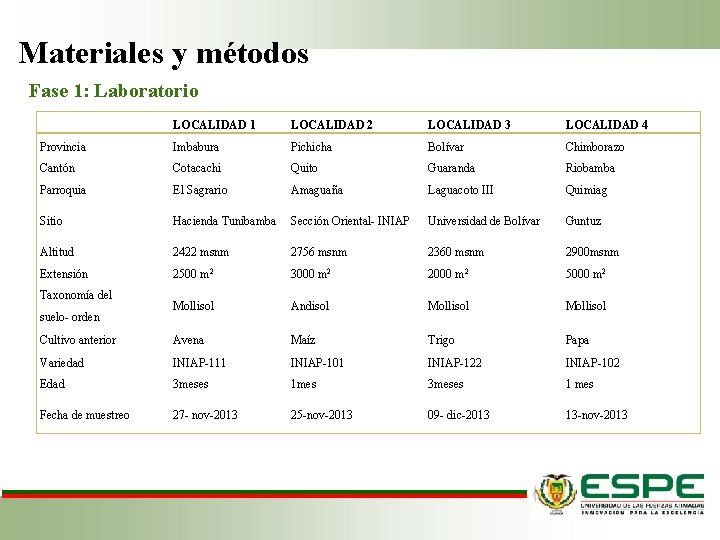
Materiales y métodos Fase 1: Laboratorio LOCALIDAD 1 LOCALIDAD 2 LOCALIDAD 3 LOCALIDAD 4 Provincia Imbabura Pichicha Bolívar Chimborazo Cantón Cotacachi Quito Guaranda Riobamba Parroquia El Sagrario Amaguaña Laguacoto III Quimiag Sitio Hacienda Tunibamba Sección Oriental- INIAP Universidad de Bolívar Guntuz Altitud 2422 msnm 2756 msnm 2360 msnm 2900 msnm Extensión 2500 m 2 3000 m 2 2000 m 2 5000 m 2 Mollisol Andisol Mollisol Cultivo anterior Avena Maíz Trigo Papa Variedad INIAP-111 INIAP-101 INIAP-122 INIAP-102 Edad 3 meses 1 mes 3 meses 1 mes Fecha de muestreo 27 - nov-2013 25 -nov-2013 09 - dic-2013 13 -nov-2013 Taxonomía del suelo- orden

Fase 1: Laboratorio Muestreo Suelo no cultivado Suelo agrícola

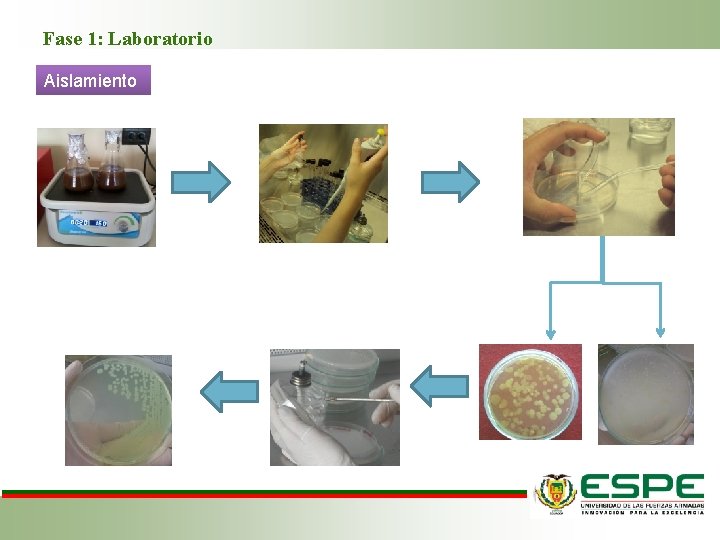
Fase 1: Laboratorio Aislamiento

Fase 1: Laboratorio Caracterización de Pseudomonas sp Morfológica Bioquímica Molecular E 338 F; E 969 R, U 341 F; U 1053 R, 27 F; 1525 R Funcional

Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Tabla 2. 1: Tratamientos para el ensayo en invernadero. Tratamiento Código T 1 ca. I 2 Cepa 1 de suelo agrícola de Imbabura Descripción T 2 ca. I 3 Cepa 2 de suelo agrícola de Imbabura T 3 ca. I 6 Cepa 3 de suelo agrícola de Imbabura T 4 cn. I 1 Cepa 1 de suelo en estado natural de Imbabura T 5 cn. I 3 Cepa 2 de suelo en estado natural de Imbabura T 6 cn. I 5 Cepa 3 de suelo en estado natural de Imbabura T 7 ca. P 1 Cepa 1 de suelo agrícola de Pichincha T 8 ca. P 2 Cepa 1 de suelo agrícola de Pichincha T 9 ca. P 3 Cepa 1 de suelo agrícola de Pichincha T 10 cn. P 1 Cepa 1 de suelo en estado natural de Pichincha T 11 cn. P 2 Cepa 1 de suelo en estado natural de Pichincha T 12 cn. P 3 Cepa 1 de suelo en estado natural de Pichincha T 13 ca. B 1 Cepa 1 de suelo agrícola de Bolívar T 14 ca. B 4 Cepa 2 de suelo agrícola de Bolívar T 15 ca. B 5 Cepa 3 de suelo agrícola de Bolívar T 16 cn. B 1 Cepa 1 de suelo en estado natural de Bolívar T 17 cn. B 2 Cepa 2 de suelo en estado natural de Bolívar T 18 cn. B 5 Cepa 3 de suelo en estado natural de Bolívar T 19 ca. C 1 Cepa 1 de suelo agrícola de Chimborazo T 20 ca. C 2 Cepa 2 de suelo agrícola de Chimborazo T 21 ca. C 4 Cepa 3 de suelo agrícola de Chimborazo T 22 cn. C 1 Cepa 1 de suelo en estado natural de Chimborazo T 23 cn. C 2 Cepa 2 de suelo en estado natural de Chimborazo T 24 cn. C 3 Cepa 3 de suelo en estado natural de Chimborazo Testigo f T Sin cepa bacteriana más fertilización fosfatada Testigo absoluto T 0 Sin cepa bacteriana sin fertilización c: cepa; a: suelo agrícola; n: suelo no cultivado; I: Imbabura; P: Pichincha B: Bolívar; C: Chimborazo

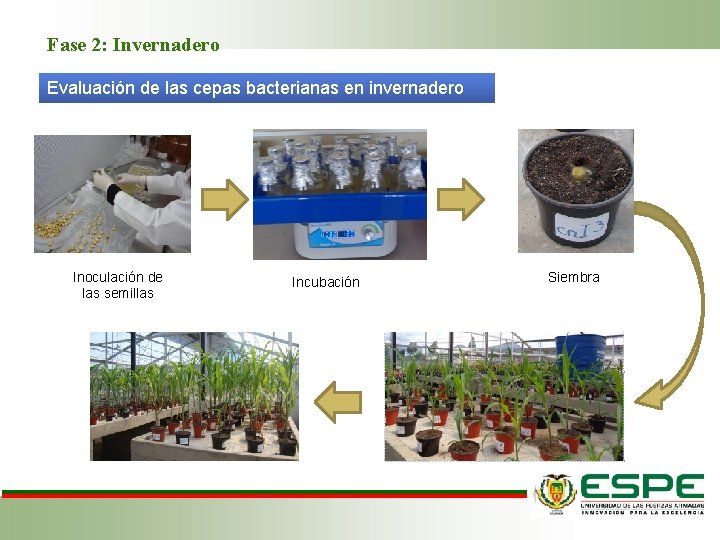
Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Manejo del sustrato 0. 3 g de Urea 0. 2 g de Muriato de potasio 0. 11 g de Sulpomag 0, 22 g de súper fosfato triple Desinfección y Pre germinación Preparación del inóculo Selección de semillas

Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Inoculación de las semillas Incubación Siembra

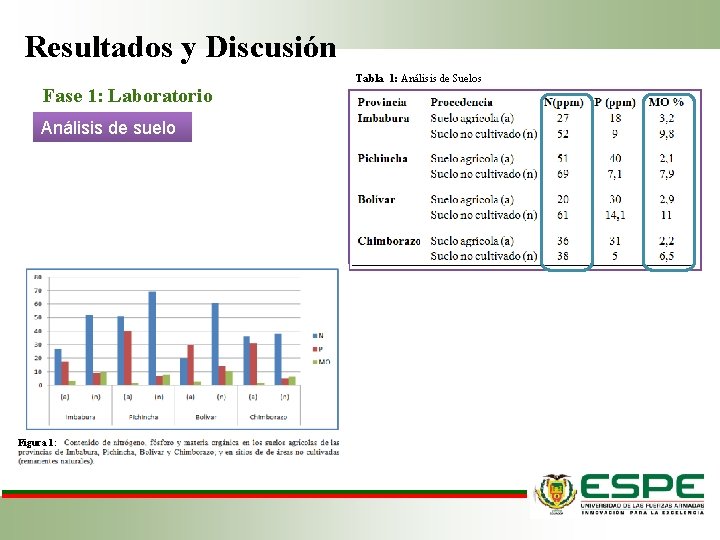
Resultados y Discusión Fase 1: Laboratorio Análisis de suelo Figura 1: Tabla 1: Análisis de Suelos

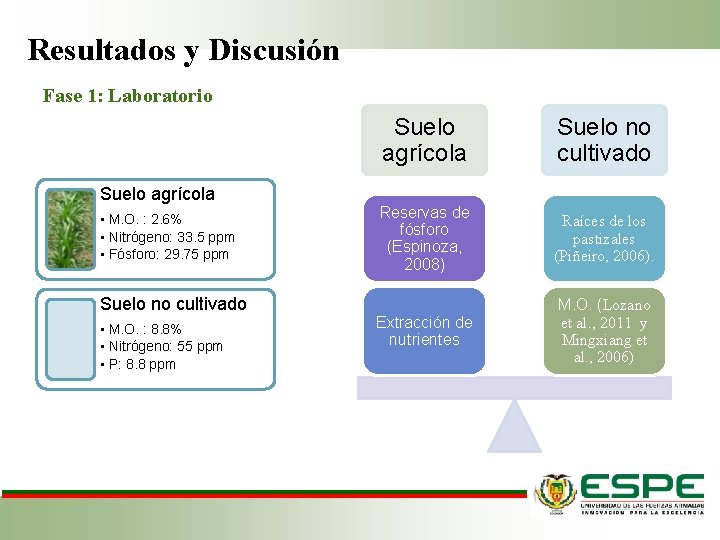
Resultados y Discusión Fase 1: Laboratorio Suelo agrícola • M. O. : 2. 6% • Nitrógeno: 33. 5 ppm • Fósforo: 29. 75 ppm Suelo no cultivado • M. O. : 8. 8% • Nitrógeno: 55 ppm • P: 8. 8 ppm Suelo agrícola Suelo no cultivado Reservas de fósforo (Espinoza, 2008) Raíces de los pastizales (Piñeiro, 2006). Extracción de nutrientes M. O. (Lozano et al. , 2011 y Mingxiang et al. , 2006)

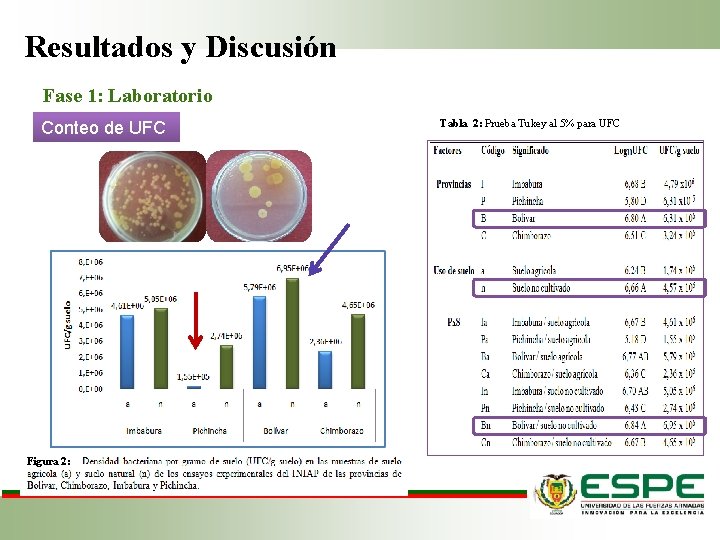
Resultados y Discusión Fase 1: Laboratorio Conteo de UFC Figura 2: Tabla 2: Prueba Tukey al 5% para UFC

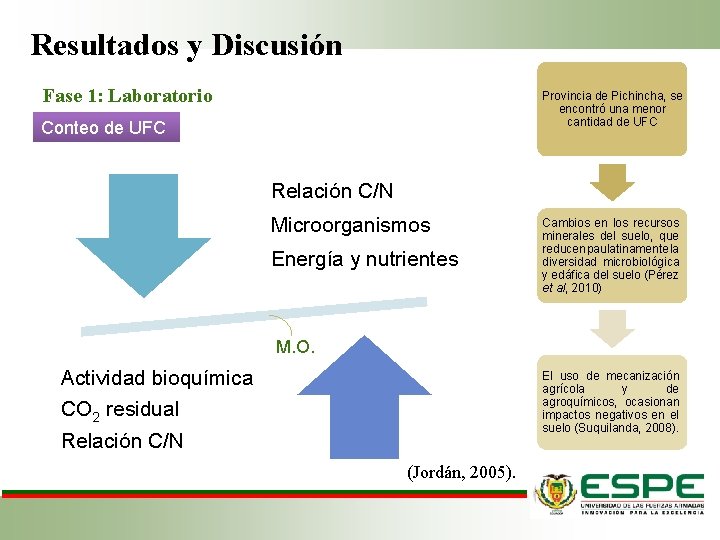
Resultados y Discusión Fase 1: Laboratorio Provincia de Pichincha, se encontró una menor cantidad de UFC Conteo de UFC Relación C/N Microorganismos Energía y nutrientes Cambios en los recursos minerales del suelo, que reducen paulatinamente la diversidad microbiológica y edáfica del suelo (Pérez et al, 2010) M. O. Actividad bioquímica CO 2 residual Relación C/N El uso de mecanización agrícola y de agroquímicos, ocasionan impactos negativos en el suelo (Suquilanda, 2008). (Jordán, 2005).

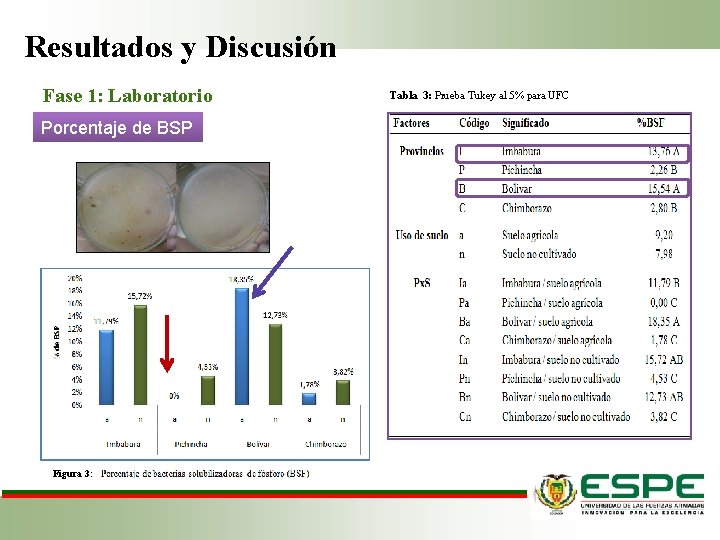
Resultados y Discusión Fase 1: Laboratorio Porcentaje de BSP Figura 3: Tabla 3: Prueba Tukey al 5% para UFC

Resultados y Discusión Fase 1: Laboratorio Porcentaje de BSP La cantidad de fósforo presente en el suelo no influye en la cantidad de microorganismos solubilizadores (Fernández et al. , 2005). Los monocultivos influyen en la selección natural de los grupos microbianos presentes en la rizosfera, debido a que los exudados propios de una misma planta condicionan el desarrollo de grupos microbianos específicos (Pérez et al, 2010). En suelos pobres de fósforo las BSP tienen mayor capacidad de solubilización, mientras que en suelos con aportes de fertilizante solubles, las bacterias pierden ésta capacidad de solubilización Micanova y Novakova (2002) Tipo de suelo Ciclo del cultivo Manejo agronómico. %BSF (Fernández et al. , 2005)

Resultados y Discusión Fase 1: Laboratorio Aislamiento y caracterización morfológica Tabla 4: Aislamientos Figura 4: Aislamiento Primario Morfología A # B C D Cepas Imbabura- Suelo Agrícola 0 4 2 0 6 Imbabura- Suelo no cultivado 1 3 1 0 5 Pichincha- Suelo Agrícola 0 1 2 0 3 Pichincha- Suelo no cultivado 1 2 0 0 3 Bolívar- Suelo Agrícola 1 3 2 0 6 Bolívar- Suelo no cultivado 1 6 0 0 7 Chimborazo- Suelo Agrícola 0 1 1 2 4 Chimborazo- Suelo no cultivado 0 2 1 1 4 Total 4 22 9 3 38 Muestra Figura 5: Aislamiento secundario. (a)Grandes, circulares, planas, translucidas, consistencia viscosa, superficie lisa y halo amarillo verdoso. (b) Medianas, circulares, planas, de color crema, consistencia cremosa, superficie lisa y halo amarillo verdoso. (c) Medianas, circulares, convexas, de color crema, consistencia cremosa, superficie lisa y halo amarillo verdoso. (d) Medianas, circulares, convexas, de color crema sin halo.

Resultados y Discusión Fase 1: Laboratorio Caracterización Bioquímica Figura 6: Tabla 5: Identificación de las cepas aisladas de suelo agrícola y suelo natural

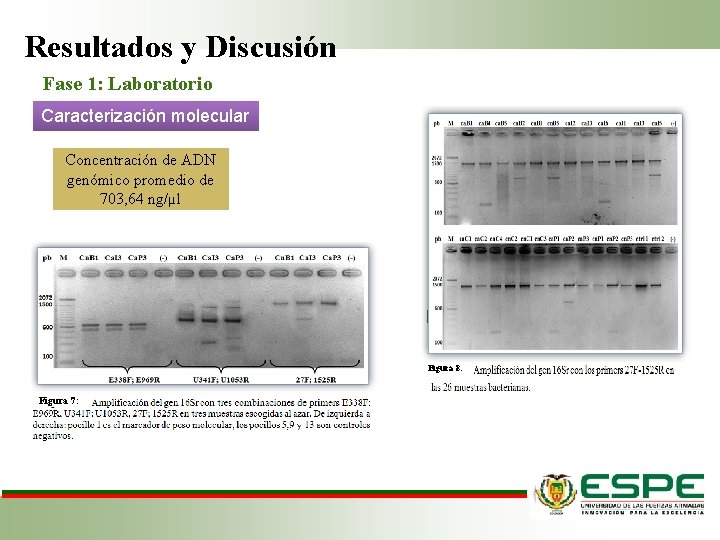
Resultados y Discusión Fase 1: Laboratorio Caracterización molecular Concentración de ADN genómico promedio de 703, 64 ng/µl Figura 8: Figura 7:

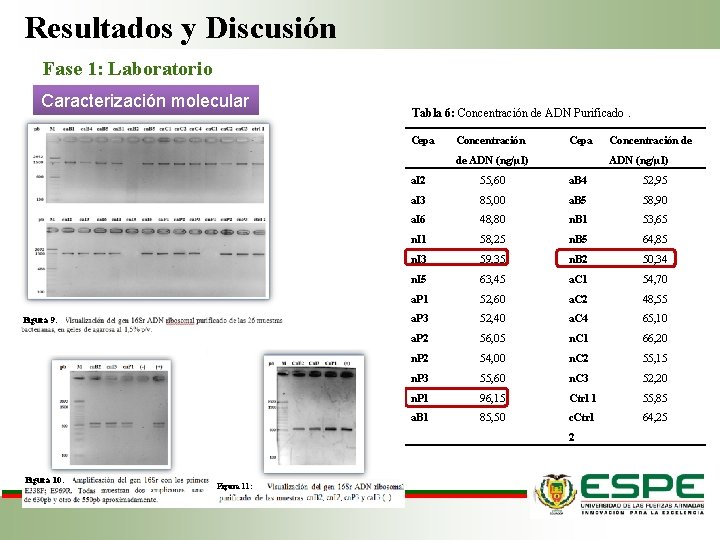
Resultados y Discusión Fase 1: Laboratorio Caracterización molecular Tabla 6: Concentración de ADN Purificado. Cepa Concentración Cepa de ADN (ng/µl) Figura 9: ADN (ng/µl) a. I 2 55, 60 a. B 4 52, 95 a. I 3 85, 00 a. B 5 58, 90 a. I 6 48, 80 n. B 1 53, 65 n. I 1 58, 25 n. B 5 64, 85 n. I 3 59, 35 n. B 2 50, 34 n. I 5 63, 45 a. C 1 54, 70 a. P 1 52, 60 a. C 2 48, 55 a. P 3 52, 40 a. C 4 65, 10 a. P 2 56, 05 n. C 1 66, 20 n. P 2 54, 00 n. C 2 55, 15 n. P 3 55, 60 n. C 3 52, 20 n. P 1 96, 15 Ctrl 1 55, 85 a. B 1 85, 50 c. Ctrl 64, 25 2 Figura 10: Figura 11: Concentración de

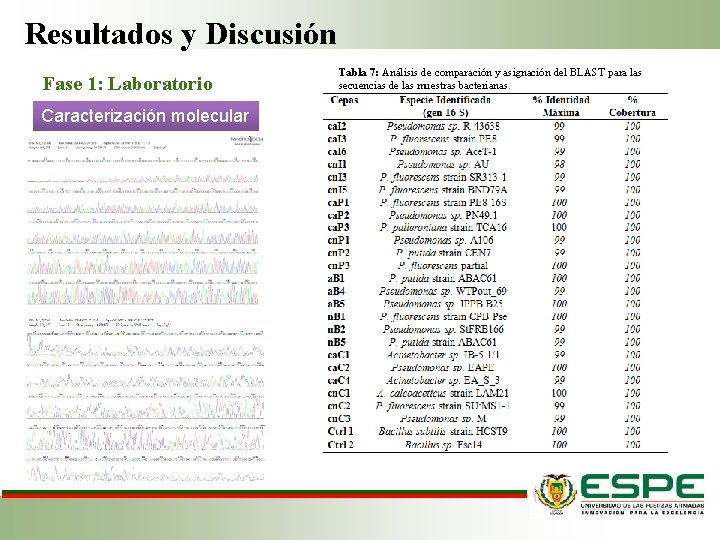
Resultados y Discusión Fase 1: Laboratorio Caracterización molecular Tabla 7: Análisis de comparación y asignación del BLAST para las secuencias de las muestras bacterianas.

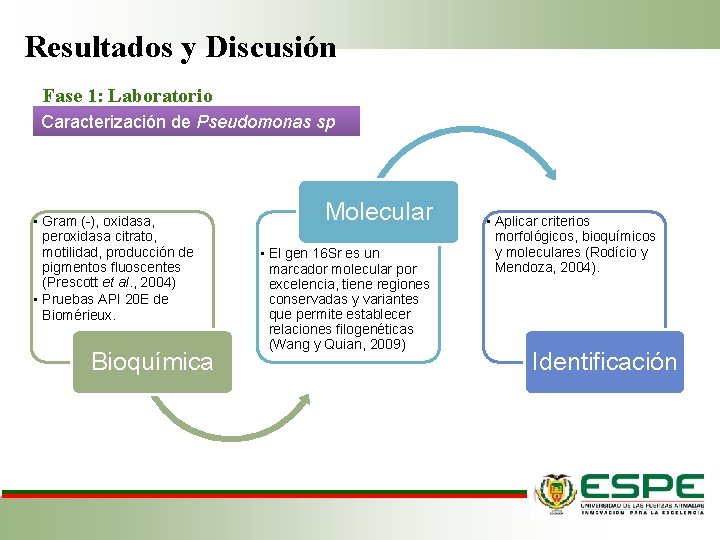
Resultados y Discusión Fase 1: Laboratorio Caracterización de Pseudomonas sp • Gram (-), oxidasa, peroxidasa citrato, motilidad, producción de pigmentos fluoscentes (Prescott et al. , 2004) • Pruebas API 20 E de Biomérieux. Bioquímica Molecular • El gen 16 Sr es un marcador molecular por excelencia, tiene regiones conservadas y variantes que permite establecer relaciones filogenéticas (Wang y Quian, 2009) • Aplicar criterios morfológicos, bioquímicos y moleculares (Rodício y Mendoza, 2004). Identificación

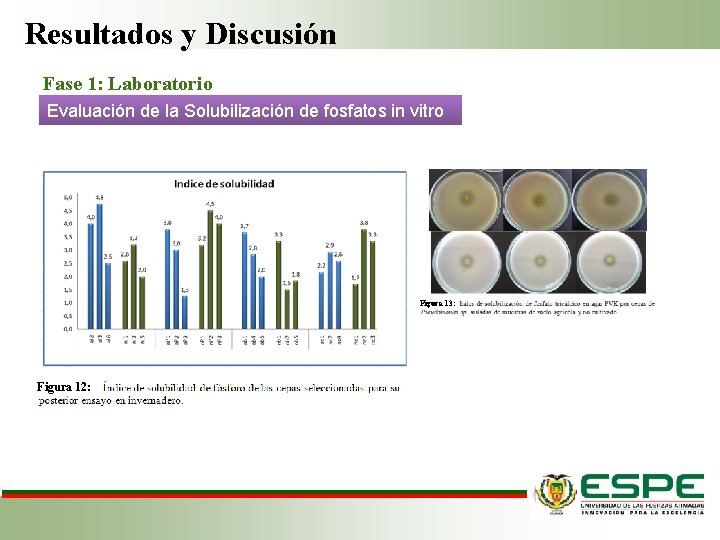
Resultados y Discusión Fase 1: Laboratorio Evaluación de la Solubilización de fosfatos in vitro Figura 13: Figura 12:

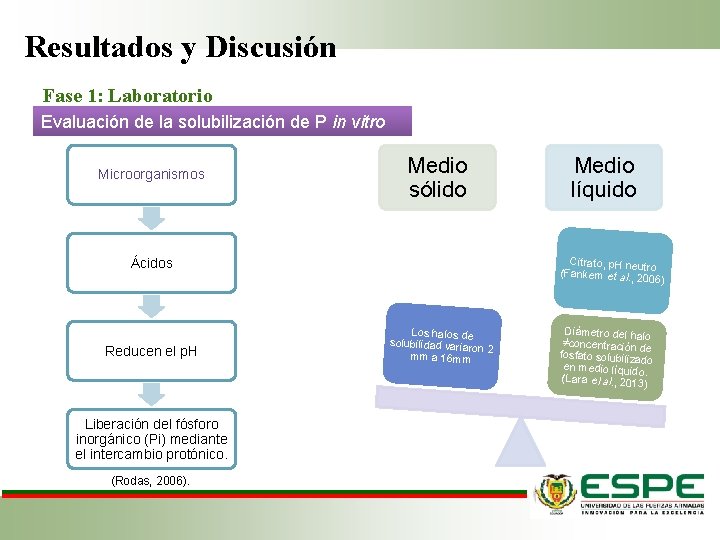
Resultados y Discusión Fase 1: Laboratorio Evaluación de la solubilización de P in vitro Microorganismos Medio sólido Ácidos Medio líquido Citrato, p. H neutro (Fankem et al. , 20 06 ) Reducen el p. H Liberación del fósforo inorgánico (Pi) mediante el intercambio protónico. (Rodas, 2006). Los halos de solubilidad varia ron 2 mm a 16 mm Diámetro del halo ≠concentración de fosfato solubilizad o en medio líquido. (Lara el al. , 2013 )

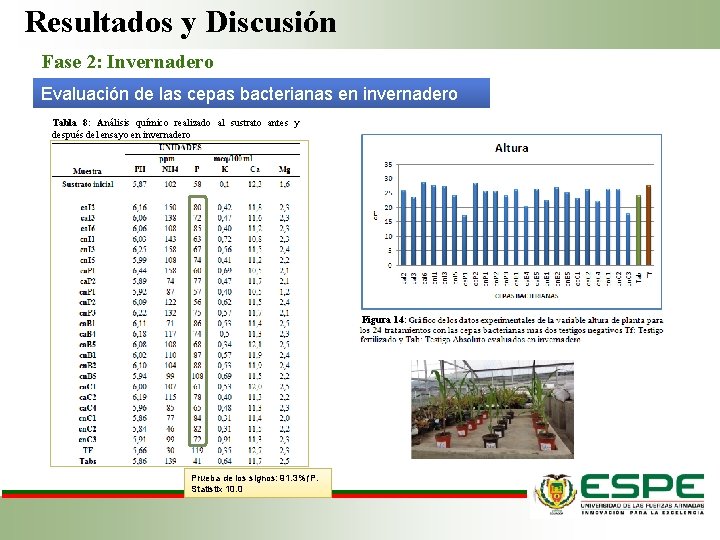
Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Tabla 8: Análisis químico realizado al sustrato antes y después del ensayo en invernadero Figura 14: Prueba de los signos: 91. 3%↑P. Statistix 10. 0

Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero cn. C 2 Tab TF Cn. I 5 Tab TF ca. B 1 Tab TF cn. P 3 Tab TF Figura 15:

Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Figura 1 6: Figura 17:

Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Figura 18: Figura 19: Prueba de los signos: 82. 61% ↑ P 2 O 5 (mg/planta) Statistix 10. 0

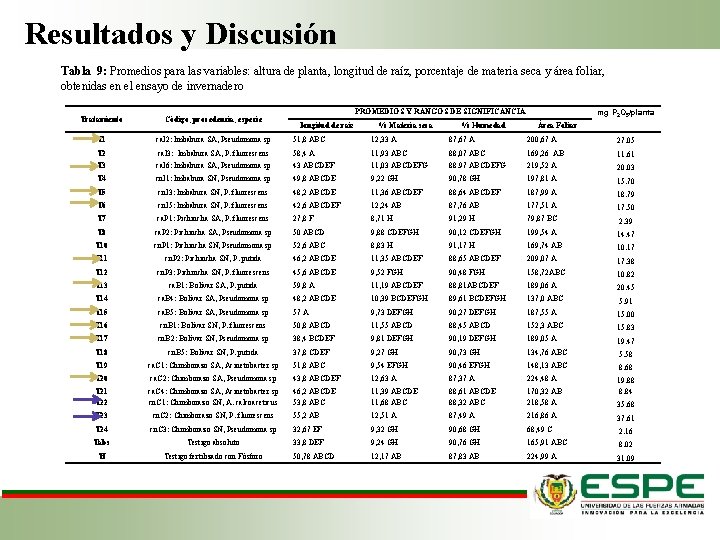
Resultados y Discusión Tabla 9: Promedios para las variables: altura de planta, longitud de raíz, porcentaje de materia seca y área foliar, obtenidas en el ensayo de invernadero mg P 2 O 5/planta PROMEDIOS Y RANGOS DE SIGNIFICANCIA Tratamiento Código, procedencia, especie T 1 ca. I 2: Imbabura SA, Pseudomona sp 51, 8 ABC 12, 33 A 87, 67 A 200, 67 A 27. 05 T 2 ca. I 3: Imbabura SA, P. fluorescens 58, 4 A 11, 93 ABC 88, 07 ABC 169, 26 AB 11. 61 T 3 ca. I 6: Imbabura SA, Pseudomona sp 43 ABCDEF 11, 03 ABCDEFG 88. 97 ABCDEFG 219, 52 A 20. 03 T 4 cn. I 1: Imbabura SN, Pseudomona sp 49, 8 ABCDE 9, 22 GH 90, 78 GH 197, 81 A 15. 70 T 5 cn. I 3: Imbabura SN, P. fluorescens 48, 2 ABCDE 11, 36 ABCDEF 88, 64 ABCDEF 187, 99 A 18. 79 T 6 cn. I 5: Imbabura SN, P. fluorescens 42, 6 ABCDEF 12, 24 AB 87, 76 AB 177, 51 A 17. 50 T 7 ca. P 1: Pichincha SA, P. fluorescens 27, 8 F 8, 71 H 91, 29 H 79, 87 BC 2. 39 T 8 ca. P 2: Pichincha SA, Pseudomona sp 50 ABCD 9, 88 CDEFGH 90, 12 CDEFGH 199, 54 A 14. 47 T 10 cn. P 1: Pichincha SN, Pseudomona sp 52, 6 ABC 8, 83 H 91, 17 H 169, 74 AB 10. 17 T 11 cn. P 2: Pichincha SN, P. putida 46, 2 ABCDE 11, 35 ABCDEF 88, 65 ABCDEF 209, 07 A 17. 38 T 12 cn. P 3: Pichincha SN, P. fluorescens 45, 6 ABCDE 9, 52 FGH 90, 48 FGH 158, 72 ABC 10. 82 T 13 ca. B 1: Bolívar SA, P. putida 59, 8 A 11, 19 ABCDEF 88, 81 ABCDEF 189, 06 A 20. 45 T 14 ca. B 4: Bolívar SA, Pseudomona sp 48, 2 ABCDE 10, 39 BCDEFGH 89, 61 BCDEFGH 137, 0 ABC 5. 91 T 15 ca. B 5: Bolívar SA, Pseudomona sp 57 A 9, 73 DEFGH 90, 27 DEFGH 187, 55 A 15. 00 T 16 cn. B 1: Bolívar SN, P. fluorescens 50, 8 ABCD 11, 55 ABCD 88, 45 ABCD 152, 3 ABC 15. 83 T 17 cn. B 2: Bolívar SN, Pseudomona sp 38, 4 BCDEF 9, 81 DEFGH 90, 19 DEFGH 189, 05 A 19. 47 T 18 cn. B 5: Bolívar SN, P. putida 37, 8 CDEF 9, 27 GH 90, 73 GH 134, 76 ABC 5. 58 T 19 ca. C 1: Chimborazo SA, Acinetobacter sp 51, 8 ABC 9, 54 EFGH 90, 46 EFGH 148, 13 ABC 8. 68 T 20 ca. C 2: Chimborazo SA, Pseudomona sp 43, 8 ABCDEF 12, 63 A 87, 37 A 224, 48 A T 21 T 22 ca. C 4: Chimborazo SA, Acinetobacter sp cn. C 1: Chimborazo SN, A. calcoaceticus 46, 2 ABCDE 53, 8 ABC 11, 39 ABCDE 11, 68 ABC 88, 61 ABCDE 88, 32 ABC 170, 32 AB 218, 58 A 19. 88 8. 84 T 23 cn. C 2: Chimborazo SN, P. fluorescens 55, 2 AB 12, 51 A 87, 49 A 216, 86 A 37. 61 T 24 cn. C 3: Chimborazo SN, Pseudomona sp 32, 67 EF 9, 32 GH 90, 68 GH 68, 49 C 2. 16 Tabs Testigo absoluto 33, 8 DEF 9, 24 GH 90, 76 GH 165, 91 ABC 8. 02 Tf Testigo fertilizado con Fósforo 50, 78 ABCD 12, 17 AB 87, 83 AB 224, 99 A 31. 09 longitud de raíz % Materia seca % Humedad Área Foliar 35. 68

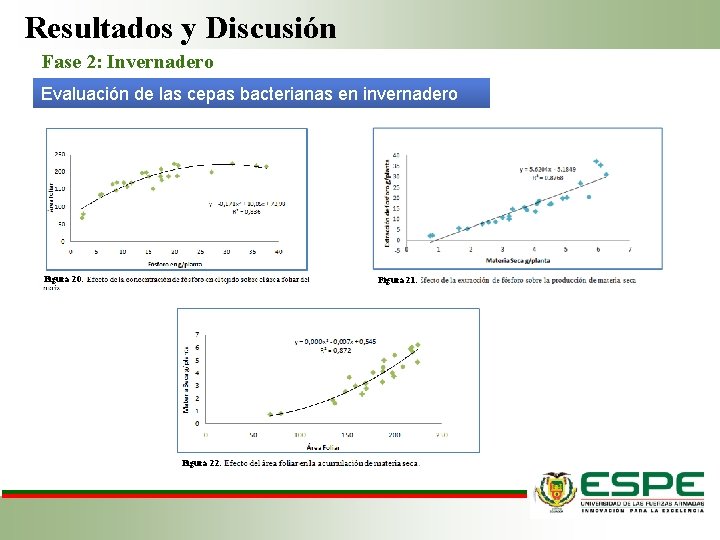
Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Figura 20: Figura 21: Figura 22:

Resultados y Discusión Fase 2: Invernadero Evaluación de las cepas bacterianas en invernadero Sustrato • Vyas & Gulati (2009) inocularon semillas de maíz con Pseudomonas y evaluaron por 90 días, al realizar los análisis de suelo se observó que existió un incremento significativo en la cantidad de fósforo presente en el suelo. Raíz • IAA por PGPR influye a la elongación y acumulación de P y N en sus tejidos. • IAA promueve la elongación de la raíz primaria (Marques et al, 2010) • T 3 (a. I 6), T 13 (a. B 1), T 22 (n. C 1), T 23 (n. C 2), es posible que en estas cepas la cantidad de IAA producido por estas cepas estuvo en equilibrio. Absorción de fósforo • La absorción de fósforo influye en el contenido de biomasa y en área foliar. Debido a que este nutriente juega un papel importante en la morfogénesis y expansión foliar, lo que permite una mejor captación de energía radiante. (Parra et al. , 2011)

CONCLUSIONES Se logró aislar 19 cepas solubilizadoras de fósforo, presentes en la rizósfera de maíz, de la cuales 6 cepas pertenecen a la provincia de Imbabura, 6 son Bolívar, 4 de Chimborazo y 3 de Pichincha. En los suelos no cultivados se aislaron 5 cepas de Imbabura, 7 de Bolívar, 4 de Chimborazo y 3 de Pichincha. Existe mayor porcentaje de materia orgánica y UFC de bacterias en suelos sin disturbación agrícola con respecto a los suelos de uso agrícola. La actividad agrícola y sobre todo el monocultivo disminuye la cantidad de nutrientes, la población bacteriana, y por consiguiente la fertilidad del suelo se reduce. La caracterización microbiológica indicó que de las 38 cepas aisladas de las muestras de suelo analizadas, 33 cepas fueron identificadas como Pseudomonas sp. 3 pertenecen al género Acinetobacter y 2 al género Burkoldela.

CONCLUSIONES Las cepas a. I 2, a. I 3, n. P 2, n. P 3 presentaron mayor índice de solubilización in vitro sin embargo esto no se vio reflejado en el ensayo de invernadero, ya que las cepas más eficientes en promover el desarrollo de la planta fueron n. C 1 (A. calcoaceticus) y n. C 2 (P. fluorescens), mostrando valores mayores en cuanto a longitud de raíz, % de materia seca, área foliar, y acumulación de P en los tejidos, con respecto al testigo absoluto y testigo fertilizado. Al comparar el testigo absoluto con los demás tratamientos se obtuvo que las cepas a. I 1, a. I 6, n. I 3, n. I 5, n. P 2, a. B 1, a. B 5, n. B 1, n. B 2, a. C 2 y n. C 2 fueron superiores en todas las variables evaluadas. La absorción de P disponible en el suelo dio lugar a un aumento en la producción de biomasa, atribuible a un aumento del área foliar, cuya consecuencia es un aumento en la cantidad de radiación fotosintéticamente activa interceptada.

RECOMENDACIONES ØSe debería realizar pruebas de solubilización de fósforo en medio líquido para determinar con mayor certeza que bacterias son mejores solubilizadoras de fósforo. ØPara una mejor relación entre la materia seca y el área foliar se debe calcular el índice de área foliar ya que este nos da un dato más real sobre la acumulación de biomasa. ØSe deberían hacer estudios bajo condiciones de invernadero para observar el comportamiento que tienen estos microorganismos al realizar fertilizaciones orgánicas vs fertilizaciones químicas.

RECOMENDACIONES ØEs importante realizar estudios consorcios bacterianos que sean promotoras de crecimiento, ya que en muchos estudios se ha visto que los consorcios bacterianos producen mejores efectos que un solo tipo de bacteria. ØDebido a que cada microorganismo se comporta de diversas formas en función de las condiciones ambientales, se debería realizar ensayos en campo para evaluar el comportamiento de estos microorganismos. ØComo perspectivas futuras de investigación se debería estudiar la capacidad que tiene Pseudomona como agente de control biológico.

AGRADECIMIENTOS
 Ies suel naturales
Ies suel naturales Ciencias de la vida carrera
Ciencias de la vida carrera La señora guajardo compra un departamento
La señora guajardo compra un departamento Departamento ceres
Departamento ceres Organización del departamento de enfermería
Organización del departamento de enfermería Atributo multivaluado
Atributo multivaluado Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Universidad ixil
Universidad ixil Departamento de farmacologia
Departamento de farmacologia Departamento solicitante
Departamento solicitante El significado de departamento
El significado de departamento Departamento de economia
Departamento de economia Departamento forestal
Departamento forestal Bachillerato abierto puebla
Bachillerato abierto puebla Zootecnia ufpr
Zootecnia ufpr Departamentos en una empresa
Departamentos en una empresa Departamento de marketing organigrama
Departamento de marketing organigrama Potencialidades productivas de cochabamba
Potencialidades productivas de cochabamba Departamento de higiene de los alimentos
Departamento de higiene de los alimentos Departamento ceres
Departamento ceres Estructura de una agencia publicitaria
Estructura de una agencia publicitaria Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Projeto doutorado
Projeto doutorado Organigrama housekeeping
Organigrama housekeeping V
V E a vida e a vida o que é diga lá meu irmão
E a vida e a vida o que é diga lá meu irmão Eu vim para que tenham vida e vida em abundância
Eu vim para que tenham vida e vida em abundância Que eu repita é bonita
Que eu repita é bonita Louvor sobre maturidade
Louvor sobre maturidade Vida antigua y vida nueva en cristo
Vida antigua y vida nueva en cristo Proyecto de vida que me sostiene en la vida
Proyecto de vida que me sostiene en la vida Universidad de el salvador facultad de ciencias economicas
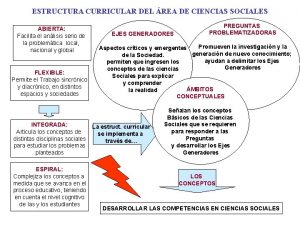
Universidad de el salvador facultad de ciencias economicas Ejes generadores de ciencias sociales
Ejes generadores de ciencias sociales Ciencias naturales capas de la tierra
Ciencias naturales capas de la tierra Tericas
Tericas Ciencias naturales 10
Ciencias naturales 10 Ciencias
Ciencias Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Unach ciencias quimicas
Unach ciencias quimicas Ciencias materiales
Ciencias materiales Ciencias empresariales ejemplos
Ciencias empresariales ejemplos Estandares de ciencias naturales
Estandares de ciencias naturales Mostrámelo
Mostrámelo Clasificación de las ciencias
Clasificación de las ciencias Iessuel ccnn
Iessuel ccnn