DEPARTAMENTO DE CIENCIAS DE LA VIDA INGENIERA EN


























- Slides: 45

DEPARTAMENTO DE CIENCIAS DE LA VIDA INGENIERÍA EN BIOTECNOLOGÍA EVALUACIÓN DE BIOAEROSOLES, BACTERIAS Y HONGOS, EN EL LABORATORIO DE MICROBIOLOGÍA – BIOTECNOLOGÍA DE LA ESPE Y CONSTRUCCIÓN PREVIA DE UN MUESTREADOR DE BURBUJEO EXPERIMENTAL. Tesista: Directora: Codirector: Andrés López M. M. Sc. Alma Koch Ing. Mat. Pedro Romero

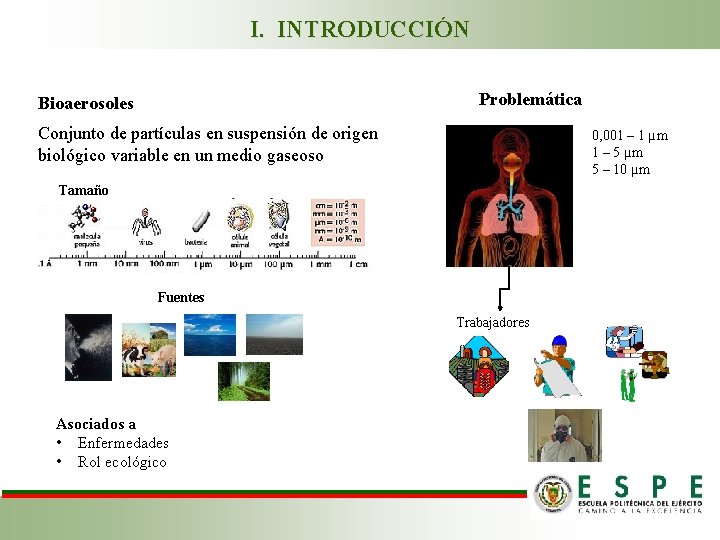
I. INTRODUCCIÓN Problemática Bioaerosoles Conjunto de partículas en suspensión de origen biológico variable en un medio gaseoso 0, 001 – 1 µm 1 – 5 µm 5 – 10 µm Tamaño Fuentes Trabajadores Asociados a • Enfermedades • Rol ecológico

I. INTRODUCCIÓN 2. Objetivos de la Investigación Objetivo General Evaluar los bioaerosoles (bacterias y hongos) en el Laboratorio de Microbiología - Biotecnología de la ESPE y construir previamente un muestreador de burbujeo experimental. Objetivos Específicos 1. Determinar la existencia de bioaerosoles. 2. Establecer las posibles fuentes de emisión de bioaerosoles. 3. Evaluar tareas y puestos de trabajo y su relación con los bioaerosoles. 4. Construir un muestreador de burbujeo experimental en base al diseño de Agranovski et al. (2002). 5. Tomar muestras de bioaerosoles con el muestreador de burbujeo experimental (Agranovski et al. , 2002). 6. Identificar las muestras de bioaerosoles recolectadas usando técnicas de cultivo convencionales. 7. Cuantificar la concentración de bioaerosoles. 8. Documentar la presencia de bioaerosoles.

I. INTRODUCCIÓN 3. Hipótesis nula • La presencia de bioaerosoles, bacterias y hongos en el Laboratorio de Microbiología - Biotecnología de la ESPE no es significativa. Hipótesis alternativa • La presencia de bioaerosoles, bacterias y hongos en el Laboratorio de Microbiología - Biotecnología de la ESPE es significativa.

II. MATERIALES Y MÉTODOS 1. Participantes Tesista: Directora: Codirector: Andrés López M. M. Sc. Alma Koch Ing. Mat. Pedro Romero Área de Investigaciones Área de Docencia Personal del Laboratorio Estudiantes Centro de Investigaciones Científicas (CEINCI) de la ESPE Área de Biología Molecular 2. Zona de Estudio Investigación de campo y análisis de laboratorio: Laboratorio de Microbiología - Biotecnología de la ESPE (constituido por tres áreas).

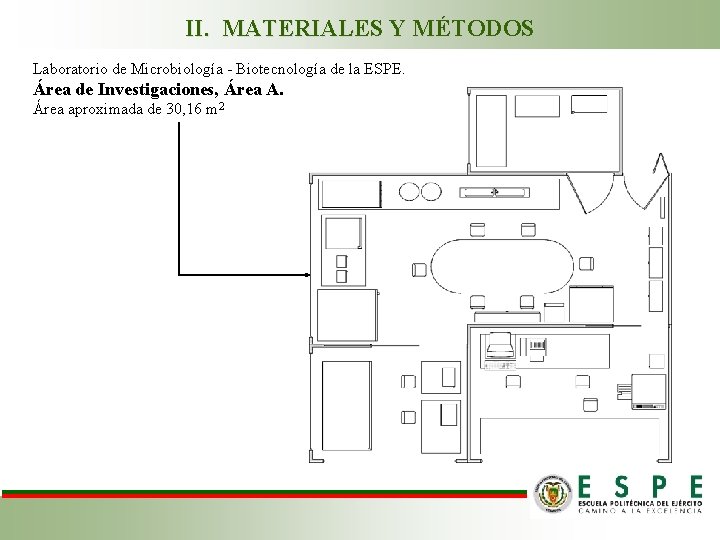
II. MATERIALES Y MÉTODOS Laboratorio de Microbiología - Biotecnología de la ESPE. Área de Investigaciones, Área A. Área aproximada de 30, 16 m 2

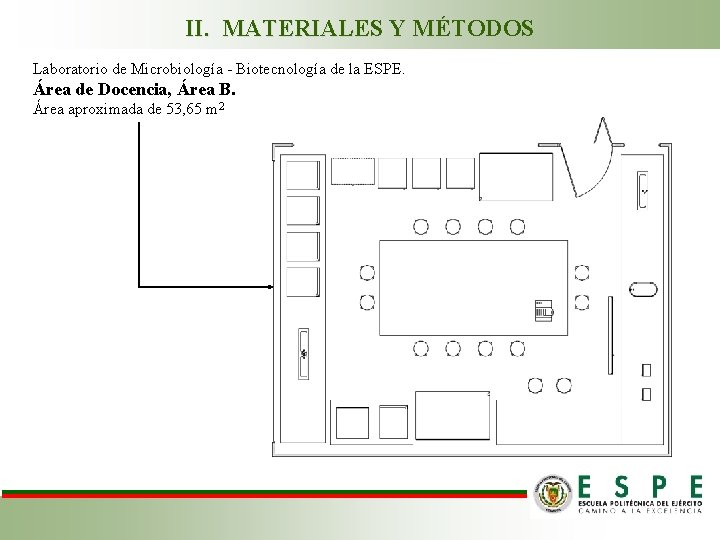
II. MATERIALES Y MÉTODOS Laboratorio de Microbiología - Biotecnología de la ESPE. Área de Docencia, Área B. Área aproximada de 53, 65 m 2

II. MATERIALES Y MÉTODOS Laboratorio de Microbiología - Biotecnología de la ESPE. Área de Biología Molecular, Área C. Área aproximada de 46, 34 m 2

II. MATERIALES Y MÉTODOS 3. Diseño experimental (Gutiérrez & De La Vara, 2008). Diseño de bloques completos al azar (DBCA) Modelo estadístico Pruebas • LSD de Fisher • Shapiro Wilks • Levene • Independencia Hipótesis Arreglo de los datos en el DBCA para la investigación Número de tratamientos 3 áreas x 3 días x duplicado = 18

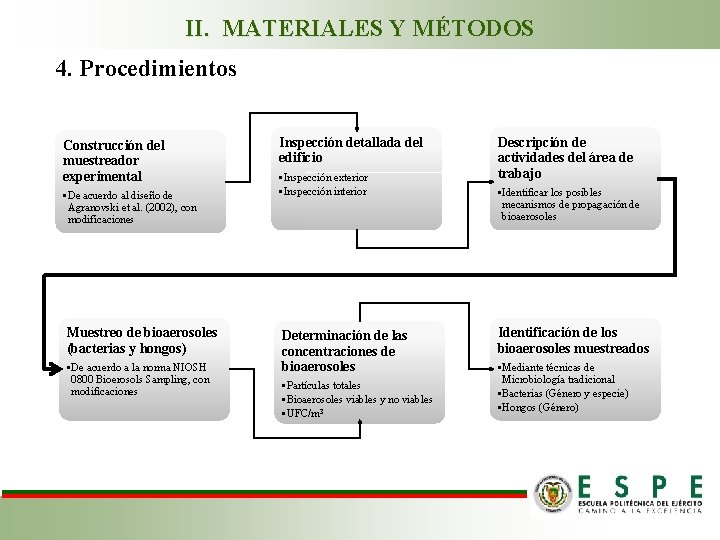
II. MATERIALES Y MÉTODOS 4. Procedimientos Construcción del muestreador experimental • De acuerdo al diseño de Agranovski et al. (2002), con modificaciones Muestreo de bioaerosoles (bacterias y hongos) • De acuerdo a la norma NIOSH 0800 Bioerosols Sampling, con modificaciones Inspección detallada del edificio • Inspección exterior • Inspección interior Determinación de las concentraciones de bioaerosoles • Partículas totales • Bioaerosoles viables y no viables • UFC/m 3 Descripción de actividades del área de trabajo • Identificar los posibles mecanismos de propagación de bioaerosoles Identificación de los bioaerosoles muestreados • Mediante técnicas de Microbiología tradicional • Bacterias (Género y especie) • Hongos (Género)

II. MATERIALES Y MÉTODOS 4. 1. Construcción del muestreador experimental Muestreadores experimentales construidos Diseño Material de construcción Acrílico (b) Esquema del muestreador: (a) vista tridimensional y vista lateral, y (b) vista de planta (Agranovski, Reponen, Willeke, & Grinshpun, 2002) Material de construcción PVC

II. MATERIALES Y MÉTODOS 4. 1. Construcción del muestreador experimental Principio de funcionamiento Producción de burbujas para fotografías (Agranovski, Braddock, & Myojo, 1999) Muestreador en funcionamiento Absorción de aerosoles en burbujeo • Circulación de aire en el interior de la burbuja • Deposición inercial • Sedimentación • Difusión

II. MATERIALES Y MÉTODOS 4. 2. Inspección detallada del edificio (exterior e interior) 4. 3. Descripción de actividades del área de trabajo Registro de inspección exterior e interior Registro de actividades durante la evaluación

II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Tipos de bioaerosoles a muestrear Bacterias y hongos Puntos de muestreo 2 puntos de muestreo por cada área Número de muestras 3 áreas x 3 días x duplicado = 18 Tiempo y flujo de muestreo • 8 h continuas diarias • 4 L/min Temperatura, humedad relativa y presión atmosférica Fluido de recolección Tripticase Soy Broth (TSB) Medios de cultivo • Bacterias Tripticase Soy Agar (TSA) con 0, 04% de actidiona • Hongos Malt Extract Agar (MEA) con 0, 01% de cloranfenicol Registro muestreo de bioaerosoles

II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Limpieza y desinfección del equipo muestreador Limpieza Desinfección Equipos muestreadores sellados y listos Preparación de los equipos muestreadores Relleno del dispositivo muestreador de bioaerosoles con 40 m. L de medio TSB mediante un dosificador Equipos muestreadores B 1, B 2 y B 3 con 40 m. L de medio TSB listos

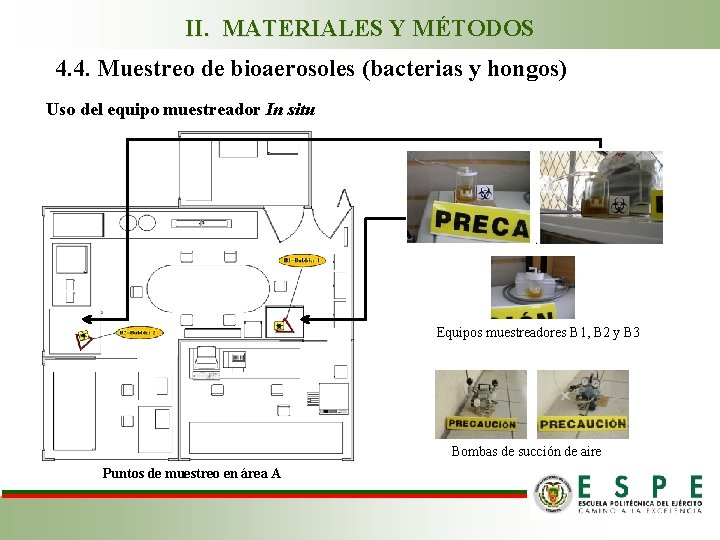
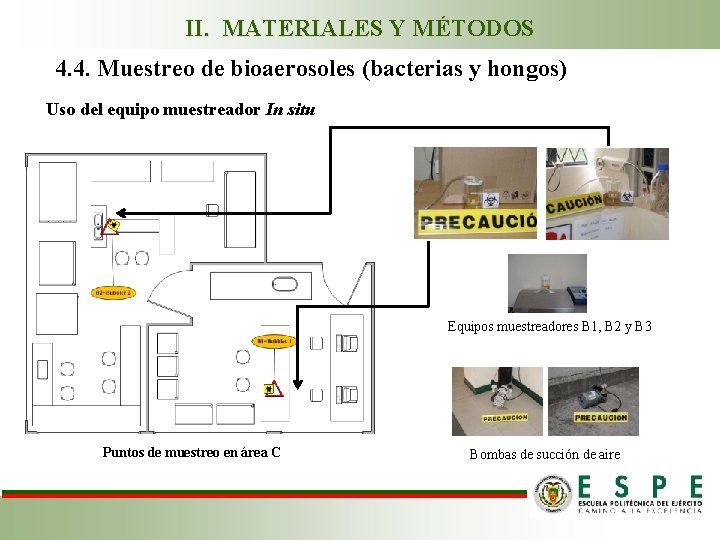
II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Uso del equipo muestreador In situ Equipos muestreadores B 1, B 2 y B 3 Bombas de succión de aire Puntos de muestreo en área A

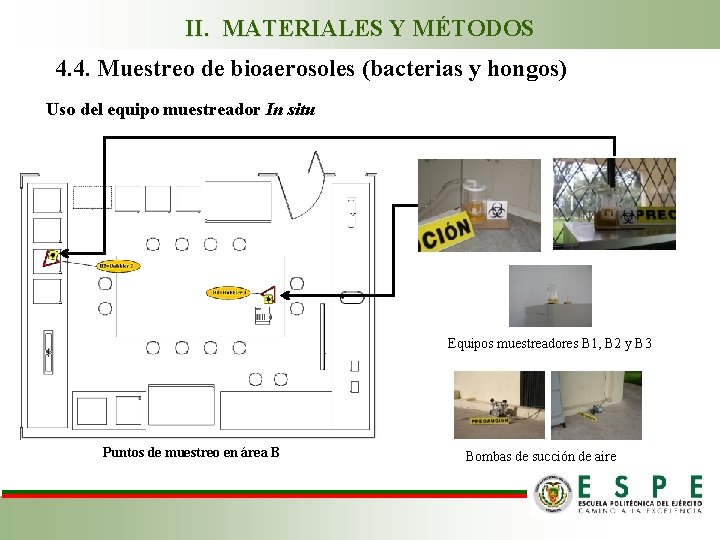
II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Uso del equipo muestreador In situ Equipos muestreadores B 1, B 2 y B 3 Puntos de muestreo en área B Bombas de succión de aire

II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Uso del equipo muestreador In situ Equipos muestreadores B 1, B 2 y B 3 Puntos de muestreo en área C Bombas de succión de aire

II. MATERIALES Y MÉTODOS 4. 4. Muestreo de bioaerosoles (bacterias y hongos) Procesamiento de las muestras de bioaerosoles Volumen final (80 m. L) Equipos al finalizar la toma de muestras División en alícuotas (40 m. L) Enjuague y recuperación Refrigeración

II. MATERIALES Y MÉTODOS 4. 5. Determinación de las concentraciones de bioaerosoles Recuento total de partículas biológicas y no biológicas Conteo en la Cámara de Neubauer Recuento de bioaerosoles viables y no viables Diluciones seriadas (10 -1 y 10 -3) y cultivo en medios MEA y TSA

II. MATERIALES Y MÉTODOS 4. 5. Determinación de las concentraciones de bioaerosoles UFC/m 3 de aire (Agranovski, Reponen, Willeke, & Grinshpun, 2002) Corrección de las mediciones observadas (TULAS, 2011)

II. MATERIALES Y MÉTODOS 4. 6. Identificación de los bioaerosoles muestreados Selección de bioaerosoles (bacterias y hongos) Evaluación morfológica, se escogieron las colonias distintas Aislamiento de bioaerosoles (bacterias y hongos) Medios de cultivo • Bacterias Tripticase Soy Agar (TSA) con 0, 04% de actidiona • Hongos Malt Extract Agar (MEA) con 0, 01% de cloranfenicol • Algunas bacterias y hongos Potato Dextrose Agar (PDA)

II. MATERIALES Y MÉTODOS 4. 6. Identificación de los bioaerosoles muestreados Bacterias Hongos • • • Tinción Gram Prueba de la Catalasa Prueba de Oxidasa • • Software Identax Bacterial identification System Evaluación macroscópica Evaluación microscópica • Técnica del celo • Tinción de KOH y azul de metileno modificada • Tinción Gram Determinación del género Bergey’s Manual of Determinative Bacteriology, 2001

III. RESULTADOS Y DISCUSIÓN 1. Construcción previa del muestreador de burbujeo experimental Equipos muestreadores B 1, B 2 y B 3 (Agranovski et al. , 2002) construidos para la Evaluación de Bioaerosoles (bacterias y hongos)

III. RESULTADOS Y DISCUSIÓN 2. Inspecciones exterior e interior del edificio • Buenas condiciones, • Poco polvo • No había evidencias visibles de fuentes microbianas, nutrientes o agua. Interior • No existen sistemas de ventilación o filtración de aire • La infraestructura física (pisos, mesas de trabajo, ventanas) no cumplen con los requerimientos adecuados para un laboratorio de Microbiología. Exterior Área B

III. RESULTADOS Y DISCUSIÓN 3. Actividades en el entorno de trabajo Área A Área B

III. RESULTADOS Y DISCUSIÓN 3. Actividades en el entorno de trabajo Área C Acciones comunes Movimiento del aire generado por • Caminar • Hablar • Toser • Estornudar • Reaerolización de partículas del piso y de las superficies Fuentes: • Bacterias aire interior, ocupación humana, sus actividades • Hongos aire exterior, plantas, suelo

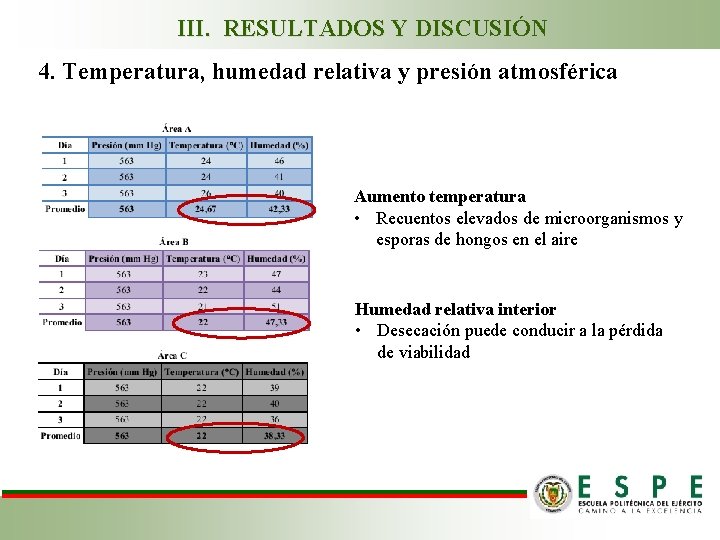
III. RESULTADOS Y DISCUSIÓN 4. Temperatura, humedad relativa y presión atmosférica Aumento temperatura • Recuentos elevados de microorganismos y esporas de hongos en el aire Humedad relativa interior • Desecación puede conducir a la pérdida de viabilidad

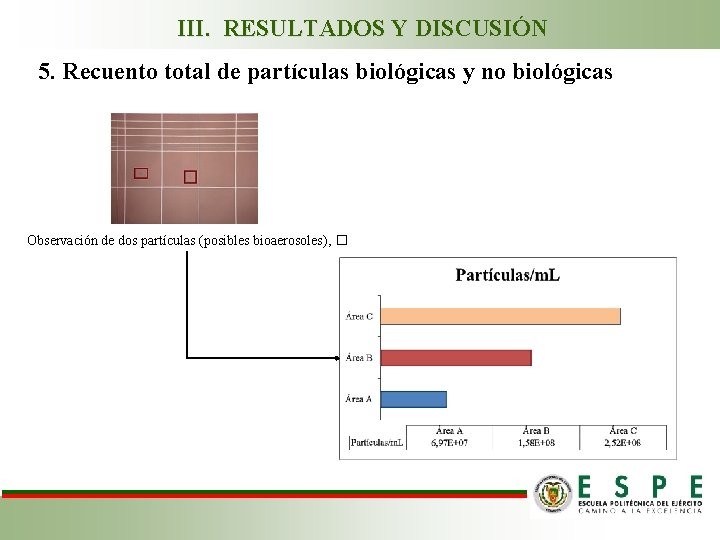
III. RESULTADOS Y DISCUSIÓN 5. Recuento total de partículas biológicas y no biológicas Observación de dos partículas (posibles bioaerosoles), �

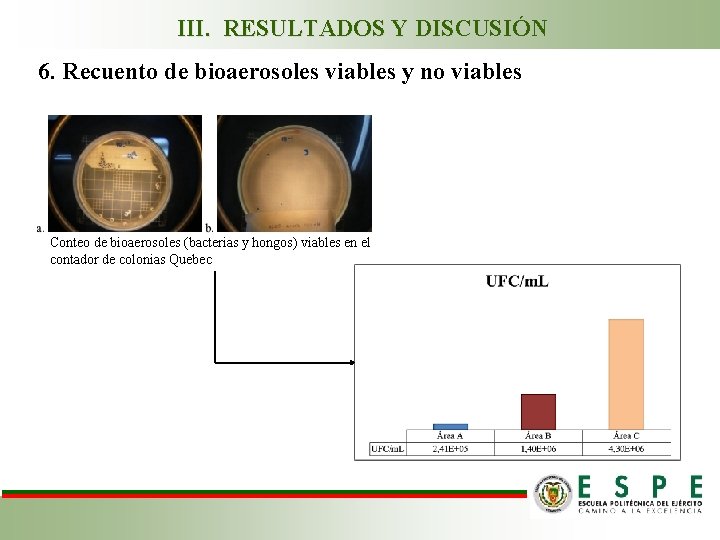
III. RESULTADOS Y DISCUSIÓN 6. Recuento de bioaerosoles viables y no viables Conteo de bioaerosoles (bacterias y hongos) viables en el contador de colonias Quebec

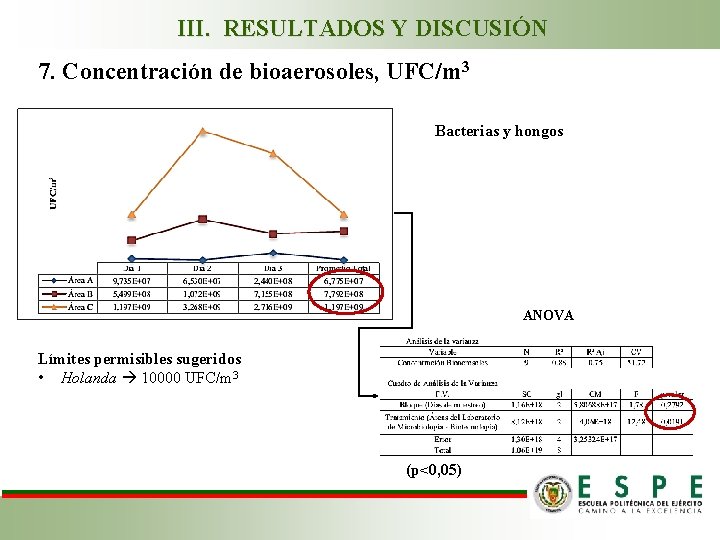
III. RESULTADOS Y DISCUSIÓN 7. Concentración de bioaerosoles, UFC/m 3 Bacterias y hongos ANOVA Límites permisibles sugeridos • Holanda 10000 UFC/m 3 (p<0, 05)

III. RESULTADOS Y DISCUSIÓN 7. Concentración de bioaerosoles, UFC/m 3 Bacterias ANOVA Límites permisibles sugeridos • Unión Europea 10000 UFC/m 3 • OMS 500 UFC/m 3 (p<0, 05)

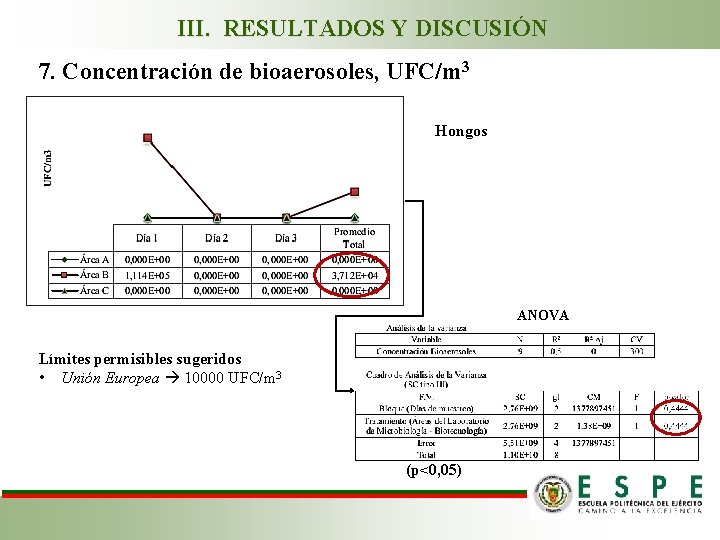
III. RESULTADOS Y DISCUSIÓN 7. Concentración de bioaerosoles, UFC/m 3 Hongos ANOVA Límites permisibles sugeridos • Unión Europea 10000 UFC/m 3 (p<0, 05)

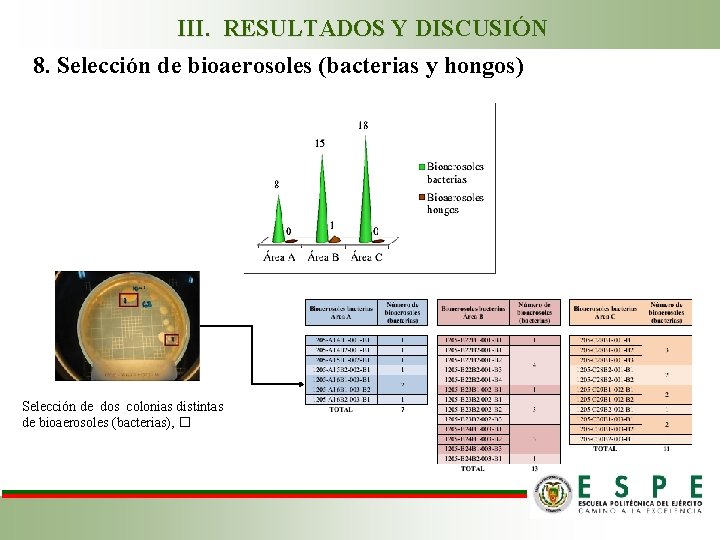
III. RESULTADOS Y DISCUSIÓN 8. Selección de bioaerosoles (bacterias y hongos) Selección de dos colonias distintas de bioaerosoles (bacterias), �

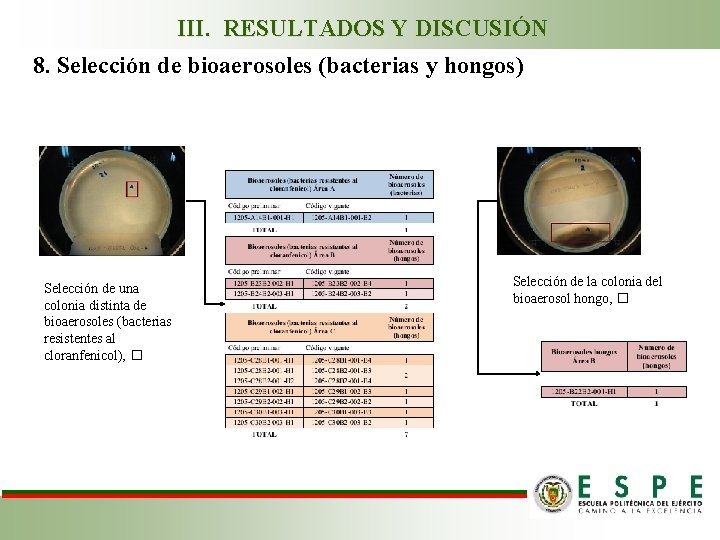
III. RESULTADOS Y DISCUSIÓN 8. Selección de bioaerosoles (bacterias y hongos) Selección de una colonia distinta de bioaerosoles (bacterias resistentes al cloranfenicol), � Selección de la colonia del bioaerosol hongo, �

III. RESULTADOS Y DISCUSIÓN 9. Aislamiento de bioaerosoles (bacterias y hongos) Medio TSA Medio MEA Medio PDA

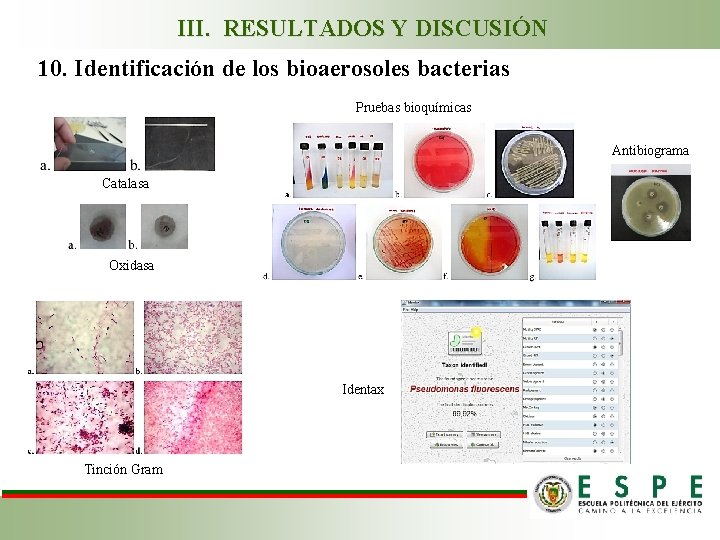
III. RESULTADOS Y DISCUSIÓN 10. Identificación de los bioaerosoles bacterias Pruebas bioquímicas Antibiograma Catalasa Oxidasa Identax Tinción Gram

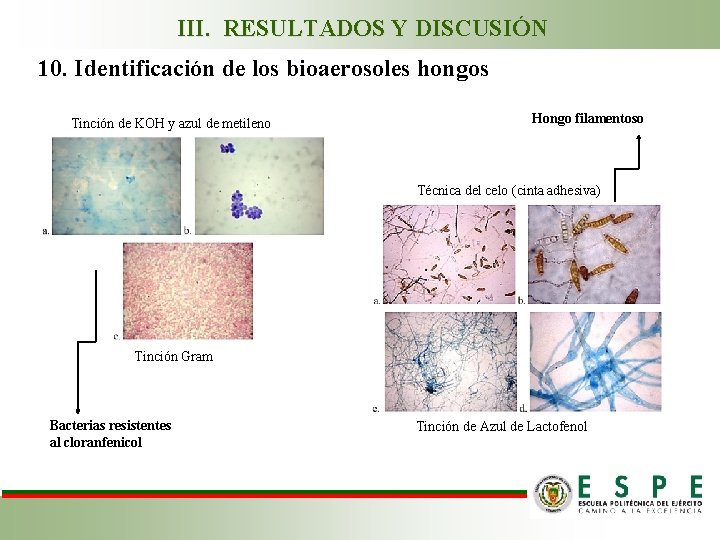
III. RESULTADOS Y DISCUSIÓN 10. Identificación de los bioaerosoles hongos Tinción de KOH y azul de metileno Hongo filamentoso Técnica del celo (cinta adhesiva) Tinción Gram Bacterias resistentes al cloranfenicol Tinción de Azul de Lactofenol

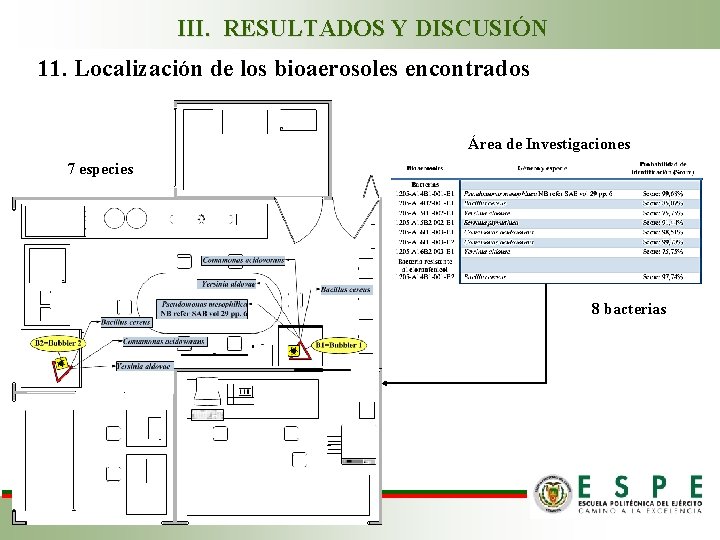
III. RESULTADOS Y DISCUSIÓN 11. Localización de los bioaerosoles encontrados Área de Investigaciones 7 especies 8 bacterias

III. RESULTADOS Y DISCUSIÓN 11. Localización de los bioaerosoles encontrados Área de Docencia 11 especies 1 género 15 bacterias 1 hongo

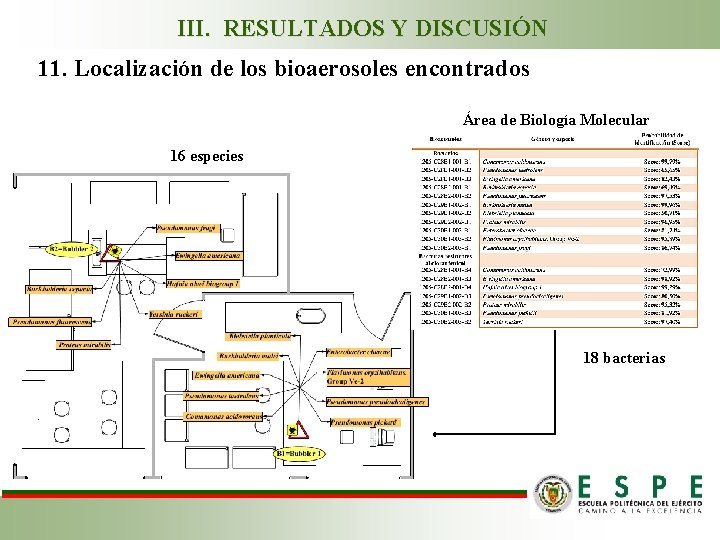
III. RESULTADOS Y DISCUSIÓN 11. Localización de los bioaerosoles encontrados Área de Biología Molecular 16 especies 18 bacterias

IV. CONCLUSIONES • Las posibles fuentes de emisión de los bioaerosoles encontrados fueron el movimiento del aire generado por las personas al caminar, al hablar, toser, estornudar, la reaerolización de partículas del piso y de las superficies y también el aire proveniente del ambiente exterior. • Se analizaron las tareas y puestos de trabajo durante la evaluación de bioaerosoles y se descubrió que la apertura y cierre de puertas constituye la acción predominante que probablemente permite la proliferación de los bioaerosoles, además de la presencia de seres humanos, otras actividades y el aire exterior. • La viabilidad de los bioaerosoles en las tres áreas analizadas se mantuvo entre 0, 654% y 2, 386% y los factores principales que posiblemente los afectaron son la humedad y la temperatura ambiental durante la evaluación. • El área de Biología Molecular registró la mayor concentración de bioaerosoles, la de Docencia mostró una concentración intermedia y la de Investigaciones reveló la menor concentración.

IV. CONCLUSIONES • Se evidenció que casi todas las concentraciones de bioaerosoles detectadas excedieron los límites sugeridos por la Organización Mundial de la Salud, la Unión Europea, y Holanda. • De las tres áreas del Laboratorio de Microbiología - Biotecnología se aislaron 42 bioaerosoles (41 bacterias y 1 hongo), 38 bioaerosoles bacterias fueron bacilos Gram negativos, mientras que 3 fueron bacilos Gram positivos, de igual manera se halló un sólo bioaerosol hongo filamentoso. Los bioaerosoles bacterias fueron predominantes sobre los hongos. • Sobre los géneros de bioaerosoles descubiertos se obtuvo que 2 son de Enterobacter, 3 de Yersinia, 1 de Serratia, 5 de Ewingella, 4 de Burkholderia, 1 de Klebsiella, 2 de Proteus, 19 de Pseudomonas, 1 de Hafnia, 3 de Bacillus y 1 de Alternaria spp. • Se comprobó que la presencia de bioaerosoles, bacterias y hongos, en el Laboratorio de Microbiología - Biotecnología de la ESPE es significativa.

V. RECOMENDACIONES Se debería: • Ampliar la información sobre bioaerosoles en el Ecuador realizando nuevas investigaciones en otros ambientes laborales. • Investigar los bioaerosoles recolectados ya que algunos tienen diversas aplicaciones. • Incrementar la concentración del agente antibacteriano cloranfenicol en el medio de cultivo MEA o utilizar otras alternativas. • • Extender el número de muestras y la inversión económica para mejorar la inferencia estadística. • Rediseñar y adecuar las instalaciones del Laboratorio de Microbiología – Biotecnología de la ESPE para lograr un eficiente desarrollo de sus actividades. Implementar algún sistema de control de bioaerosoles para disminuir sus concentraciones en el Laboratorio de Microbiología - Biotecnología de la ESPE.

AGRADECIMIENTOS • A la Escuela Superior Politécnica del Ejército por el apoyo y recursos brindados. • A mi querida madre Sarita, que me enseñó, apoyó y respaldó mis anhelos y sueños para convertirme en el ser humano que soy. • A todos esos dilectos amigos y amigas de mi madre, que se preocuparon y me apoyaron para que culmine con éxito mi estudio. • A M. Sc. Almita Koch Kaiser y al Ing. -Mat. Pedro Romero, Directora y Codirector de mi Tesis, por su acogida, respaldo y conocimientos brindados. • A Ing. Jessie Maisincho y la Dra. Ligia Ayala por su apoyo y colaboración. • A mis apreciados amigos y amigas.
 Ies suel departamento de ciencias naturales
Ies suel departamento de ciencias naturales Ingenieramédicaprogramadoraperiodistahijastra
Ingenieramédicaprogramadoraperiodistahijastra Sharpdevelop
Sharpdevelop Universidad nacional de ingeniera
Universidad nacional de ingeniera Ciencias de la vida carrera
Ciencias de la vida carrera Departamento solicitante
Departamento solicitante El significado de departamento
El significado de departamento Departamento de economia
Departamento de economia Departamento forestal
Departamento forestal Bachillerato abierto puebla
Bachillerato abierto puebla Zootecnia ufpr
Zootecnia ufpr Projeto doutorado
Projeto doutorado Organigrama departamento de marketing
Organigrama departamento de marketing Cuál es la potencialidad de cochabamba
Cuál es la potencialidad de cochabamba Departamento de higiene de los alimentos
Departamento de higiene de los alimentos Departamento ceres
Departamento ceres Departamento de investigación en una agencia de publicidad
Departamento de investigación en una agencia de publicidad Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Organigrama de housekeeping
Organigrama de housekeeping Huila clima
Huila clima Finestra terapeutica
Finestra terapeutica La señora guajardo compra un departamento
La señora guajardo compra un departamento Organización del departamento de enfermería
Organización del departamento de enfermería Departamento ceres
Departamento ceres Multivaluado
Multivaluado Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Universidad ixil
Universidad ixil Departamentos en una empresa
Departamentos en una empresa Eu vejo a pureza da resposta
Eu vejo a pureza da resposta Louvor sobre maturidade
Louvor sobre maturidade E a vida e a vida o que é diga lá meu irmão
E a vida e a vida o que é diga lá meu irmão De que debo desprenderme
De que debo desprenderme La vida antigua y la nueva
La vida antigua y la nueva Eu vim para que todos tenham vida
Eu vim para que todos tenham vida Objetivos de ciencias naturales
Objetivos de ciencias naturales Ciencias
Ciencias Instituto suel fuengirola
Instituto suel fuengirola Este oeste norte sur
Este oeste norte sur Lineamientos curriculares de ciencias naturales
Lineamientos curriculares de ciencias naturales Ciencias naturales
Ciencias naturales Facultad de ciencias medicas y biologicas dr ignacio chavez
Facultad de ciencias medicas y biologicas dr ignacio chavez Camaleon y las naturales ciencias
Camaleon y las naturales ciencias Reduccion reuso y reciclado ciencias naturales
Reduccion reuso y reciclado ciencias naturales Ciencia de la tierra y el espacio
Ciencia de la tierra y el espacio Centro interdisciplinario de ciencias de la salud
Centro interdisciplinario de ciencias de la salud Bienvenidos a la clase de ciencias naturales
Bienvenidos a la clase de ciencias naturales