DEPARTAMENTO DE CIENCIAS DE LA VIDA INGENIERA EN



















- Slides: 38

DEPARTAMENTO DE CIENCIAS DE LA VIDA INGENIERÍA EN BIOTECNOLOGÍA ESTANDARIZACIÓN Y VALIDACIÓN DE UN PROTOCOLO DE HPLC (HIGH PERFORMANCE LIQUID CHROMATOGRAPHY) PARA MEDIR COENZIMA Q 10 EN PLAQUETAS. MYRIAN IBETH CHILUIZA JÁCOME SANGOLQUÍ, 14 DE AGOSTO DEL 2012

ÍNDICE INTRODUCCIÓN MATERIALES Y MÉTODOS RESULTADOS DISCUSIÓN CONCLUSIONES RECOMENDACIONES

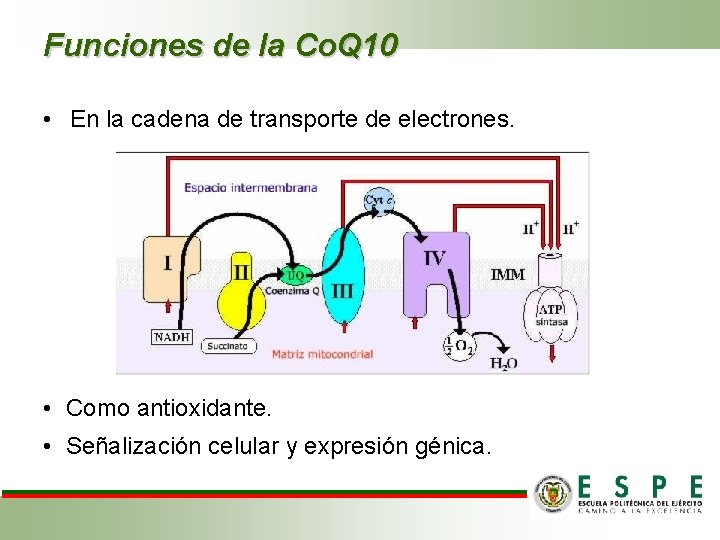
INTRODUCCIÓN • Coenzima Q 10 (Fuente: Coenzyme Q 10 Nutrition Health, 2012) • Es una quinona isoprenoide no proteica, liposoluble, y móvil, que se encuentra prácticamente en todas las membranas celulares. • Sirve como transportador de electrones y colector de átomos de hidrógeno en la cadena respiratoria mitocondrial. • La designación química de su forma natural es: 2, 3 dimetoxi-5 -metil-6 poliprenil parabenzoquinona.

Funciones de la Co. Q 10 • En la cadena de transporte de electrones. • Como antioxidante. • Señalización celular y expresión génica.

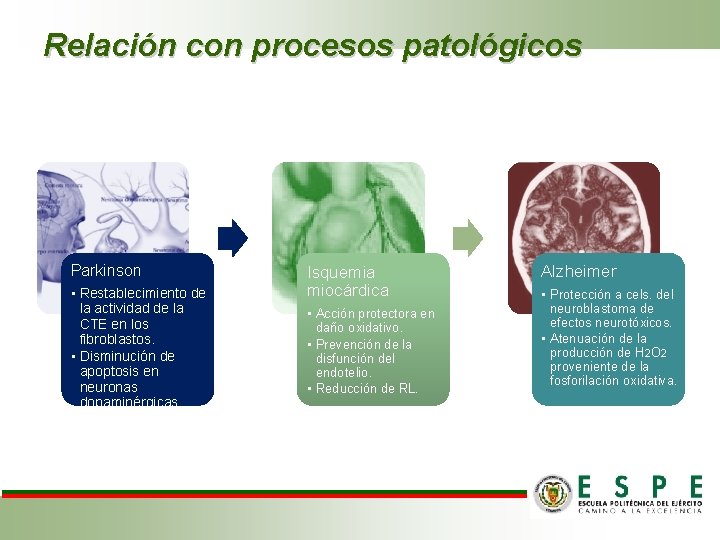
Relación con procesos patológicos Parkinson • Restablecimiento de la actividad de la CTE en los fibroblastos. • Disminución de apoptosis en neuronas dopaminérgicas. Isquemia miocárdica • Acción protectora en daño oxidativo. • Prevención de la disfunción del endotelio. • Reducción de RL. Alzheimer • Protección a cels. del neuroblastoma de efectos neurotóxicos. • Atenuación de la producción de H 2 O 2 proveniente de la fosforilación oxidativa.

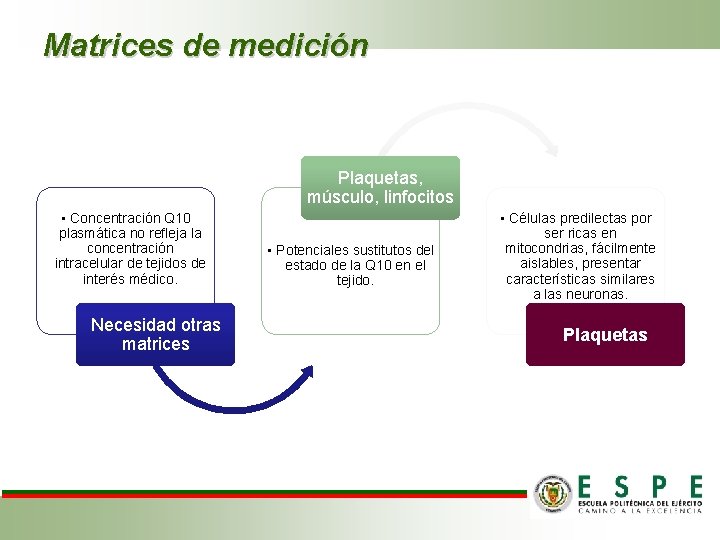
Matrices de medición Plaquetas, músculo, linfocitos • Concentración Q 10 plasmática no refleja la concentración intracelular de tejidos de interés médico. Necesidad otras matrices • Potenciales sustitutos del estado de la Q 10 en el tejido. • Células predilectas por ser ricas en mitocondrias, fácilmente aislables, presentar características similares a las neuronas. Plaquetas

Objetivos Objetivo general: Estandarizar y validar un protocolo de medición de Coenzima Q 10 en plaquetas mediante la metodología de HPLC.

Objetivos específicos: • Establecer que no existan interferencias de otros compuestos con la medición del analito (coenzima Q 10) en esta metodología. • Demostrar que los resultados de la prueba son directamente proporcionales a la concentración del principio activo, garantizando la capacidad del método para obtener resultados lineales. • Comprobar que el método planteado es exacto y produce resultados consistentes.

Hipótesis: El protocolo óptimo para la medición de coenzima Q 10, sobre la base de la metodología HPLC (cromatografía líquida de alto rendimiento) permite la medición precisa y confiable de los niveles de Co. Q 10 en plaquetas.

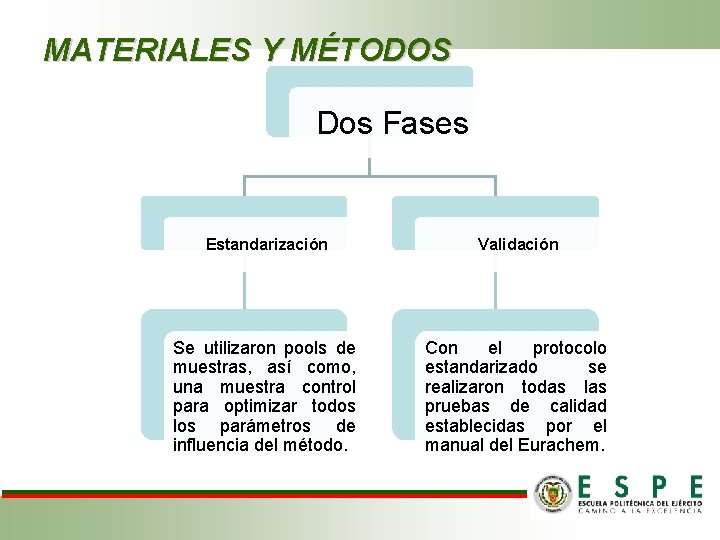
MATERIALES Y MÉTODOS Dos Fases Estandarización Validación Se utilizaron pools de muestras, así como, una muestra control para optimizar todos los parámetros de influencia del método. Con el protocolo estandarizado se realizaron todas las pruebas de calidad establecidas por el manual del Eurachem.

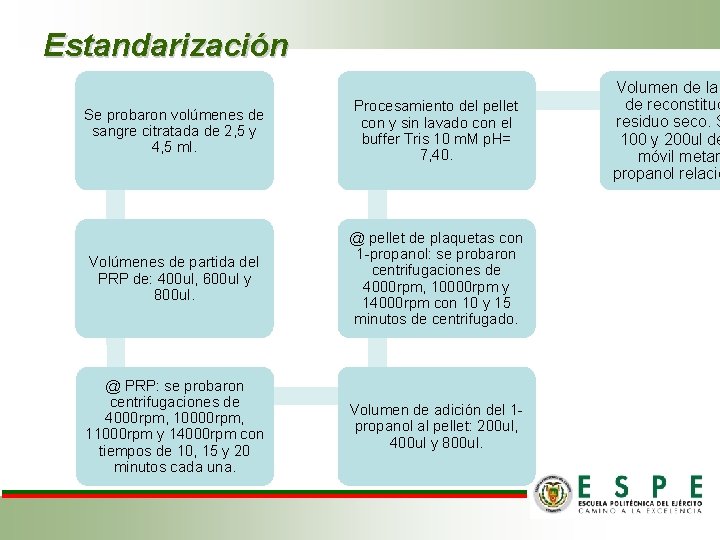
Estandarización Se probaron volúmenes de sangre citratada de 2, 5 y 4, 5 ml. Procesamiento del pellet con y sin lavado con el buffer Tris 10 m. M p. H= 7, 40. Volúmenes de partida del PRP de: 400 ul, 600 ul y 800 ul. @ pellet de plaquetas con 1 -propanol: se probaron centrifugaciones de 4000 rpm, 10000 rpm y 14000 rpm con 10 y 15 minutos de centrifugado. @ PRP: se probaron centrifugaciones de 4000 rpm, 10000 rpm, 11000 rpm y 14000 rpm con tiempos de 10, 15 y 20 minutos cada una. Volumen de adición del 1 propanol al pellet: 200 ul, 400 ul y 800 ul. Volumen de la de reconstituc residuo seco. S 100 y 200 ul de móvil metan propanol relació

Estandarización Temperatura de la muestra. Se utilizó 4ºC ± 2 y 8ºC ± 2. Temperatura de la columna. Se utilizó 25ºC ± 5 y 30ºC ± 5. Flujo: se probaron flujos de 0, 3 ml/min, 0, 4 ml/min y 0, 5 ml/min. Fase móvil: metanol 60%: 1 -propanol 40%, metanol 70%: 1 -propanol 30% y metanol 80%: 1 propanol 20%. Volumen de inyección: 10 ul, 20 ul, 50 ul y 90 ul. Condiciones cromatográficas Absorbancia: se detectaron las muestras a longitud de onda abierta de 210 a 400 nm.

Validación Objetivos de la validación: • Incertidumbre del método menor al 30%. • Robustez del método dentro del rango: 90 a 110. • Precisión: rango de repetibilidad y reproducibilidad menor a 0, 05. • Linealidad (correlación) igual o mayor a un R 2 de 0, 99. • Veracidad (porcentaje de recuperación) mayor o igual al 90%.

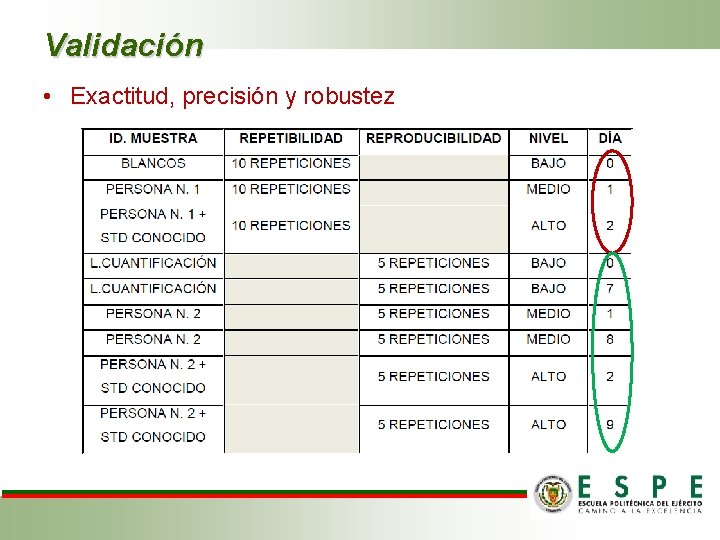
Validación • Exactitud, precisión y robustez

Validación • Límite de detección y cuantificación 10 blancos de muestra • Concentración del 10% del promedio de las muestras LD = Xblancos + 3 Sblancos LC = Xblancos + 10 Sblancos • Lectura 10 estándares preparados al límite de detección y 5 estándares preparados al límite de cuantificación, el día 1 de esta prueba. • Y el día 8 se corrieron 5 estándares preparados al límite de cuantificación.

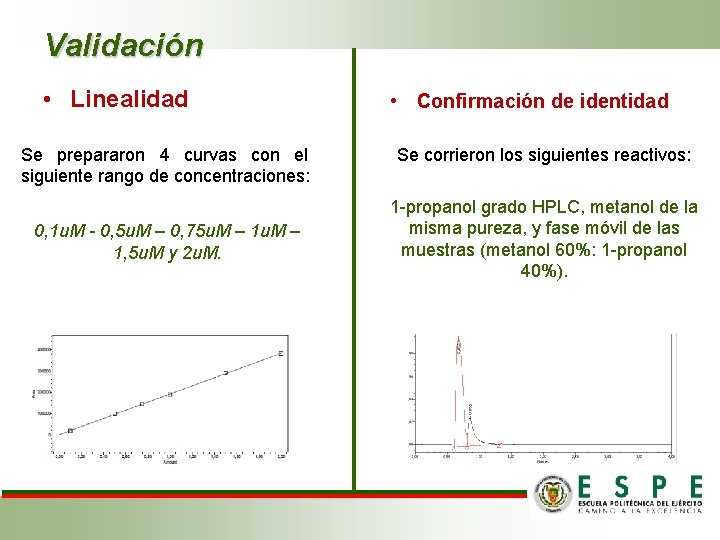
Validación • Linealidad Se prepararon 4 curvas con el siguiente rango de concentraciones: 0, 1 u. M - 0, 5 u. M – 0, 75 u. M – 1, 5 u. M y 2 u. M. • Confirmación de identidad Se corrieron los siguientes reactivos: 1 -propanol grado HPLC, metanol de la misma pureza, y fase móvil de las muestras (metanol 60%: 1 -propanol 40%).

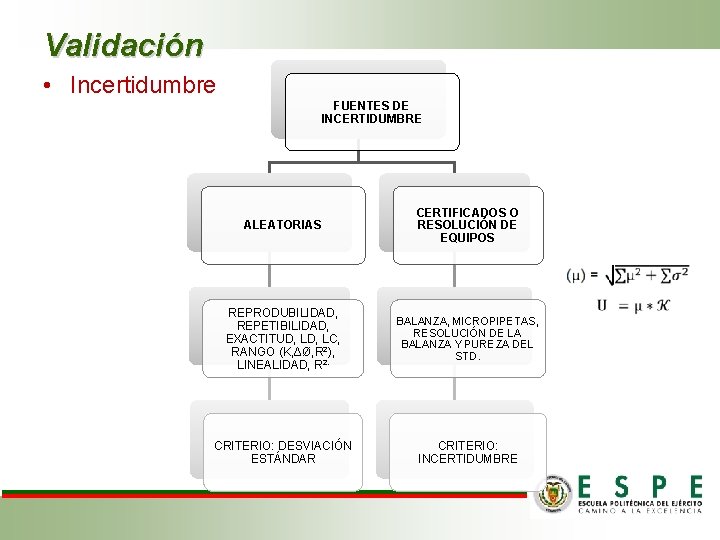
Validación • Incertidumbre FUENTES DE INCERTIDUMBRE ALEATORIAS CERTIFICADOS O RESOLUCIÓN DE EQUIPOS REPRODUBILIDAD, REPETIBILIDAD, EXACTITUD, LC, RANGO (K, ΔØ, R 2), LINEALIDAD, R 2. BALANZA, MICROPIPETAS, RESOLUCIÓN DE LA BALANZA Y PUREZA DEL STD. CRITERIO: DESVIACIÓN ESTÁNDAR CRITERIO: INCERTIDUMBRE

Muestras Criterios de inclusión: • • 35 muestras Sexo: masculino o femenino. Nacionalidad ecuatoriana. De 18 a 30 años de edad. Sin trastornos metabólicos aparentes. • Sin ingesta de medicamentos. • Previa autorización.

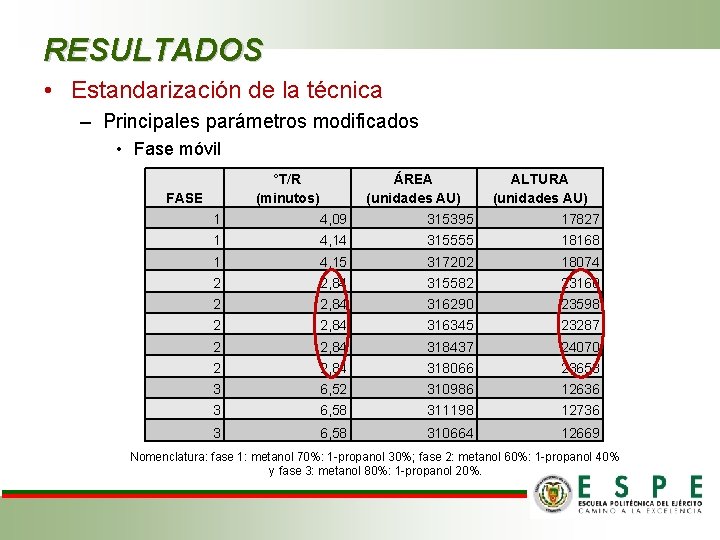
RESULTADOS • Estandarización de la técnica – Principales parámetros modificados • Fase móvil °T/R (minutos) FASE ÁREA (unidades AU) ALTURA (unidades AU) 1 4, 09 315395 17827 1 4, 14 315555 18168 1 4, 15 317202 18074 2 2, 84 315582 23160 2 2, 84 316290 23598 2 2, 84 316345 23287 2 2, 84 318437 24070 2 2, 84 318066 23658 3 6, 52 310986 12636 3 6, 58 311198 12736 3 6, 58 310664 12669 Nomenclatura: fase 1: metanol 70%: 1 -propanol 30%; fase 2: metanol 60%: 1 -propanol 40% y fase 3: metanol 80%: 1 -propanol 20%.

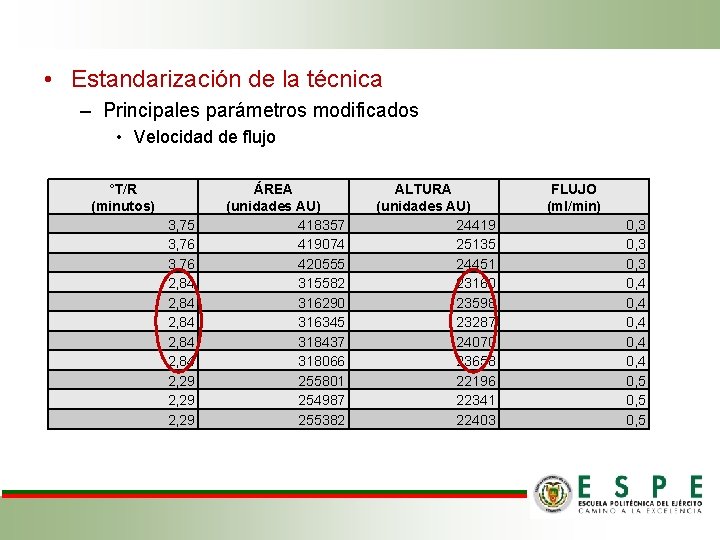
• Estandarización de la técnica – Principales parámetros modificados • Velocidad de flujo °T/R (minutos) 3, 75 3, 76 2, 84 2, 84 2, 29 ÁREA (unidades AU) 418357 419074 420555 315582 316290 316345 318437 318066 255801 254987 255382 ALTURA (unidades AU) 24419 25135 24451 23160 23598 23287 24070 23658 22196 22341 22403 FLUJO (ml/min) 0, 3 0, 4 0, 4 0, 5

• Estandarización de la técnica – Protocolo óptimo de determinación de Co. Q 10 en plaquetas

• Estandarización de la técnica – Protocolo óptimo de determinación de Co. Q 10 en plaquetas Condiciones cromatográficas: – Fase móvil: metanol 60%: 1 -propanol 40%. – Flujo: 0, 4 ml/min. – Volumen de inyección: 90 ul. – Corrida isocrática. – Temperatura de la muestra: 8ºC ± 2. – Temperatura de la columna: 25ºC ± 5. – Absorbancia: 275 nm.

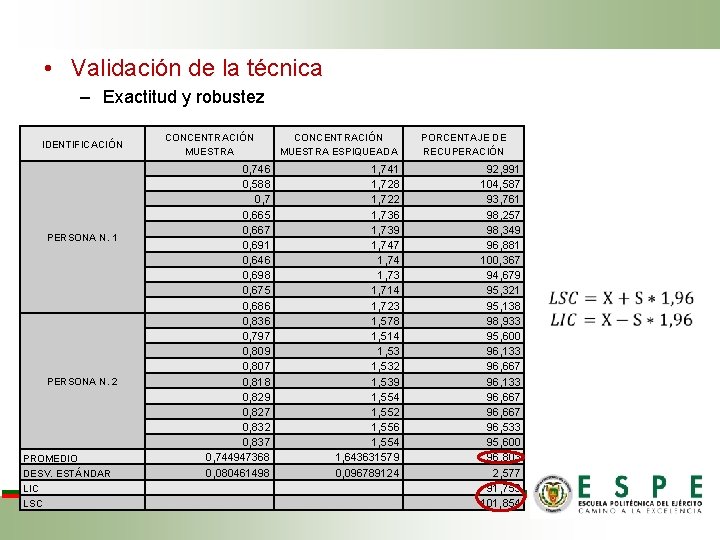
• Validación de la técnica – Exactitud y robustez CONCENTRACIÓN MUESTRA IDENTIFICACIÓN 0, 746 0, 588 0, 7 0, 665 0, 667 0, 691 0, 646 0, 698 0, 675 0, 686 0, 836 0, 797 0, 809 0, 807 0, 818 0, 829 0, 827 0, 832 0, 837 0, 744947368 0, 080461498 PERSONA N. 1 PERSONA N. 2 PROMEDIO DESV. ESTÁNDAR LIC LSC CONCENTRACIÓN MUESTRA ESPIQUEADA 1, 741 1, 728 1, 722 1, 736 1, 739 1, 747 1, 74 1, 73 1, 714 1, 723 1, 578 1, 514 1, 532 1, 539 1, 554 1, 552 1, 556 1, 554 1, 643631579 0, 096789124 PORCENTAJE DE RECUPERACIÓN 92, 991 104, 587 93, 761 98, 257 98, 349 96, 881 100, 367 94, 679 95, 321 95, 138 98, 933 95, 600 96, 133 96, 667 96, 533 95, 600 96, 803 2, 577 91, 753 101, 854

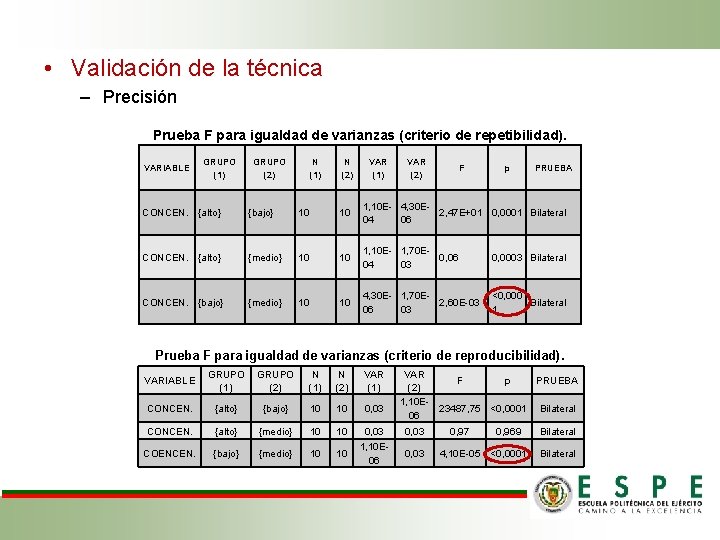
• Validación de la técnica – Precisión Prueba F para igualdad de varianzas (criterio de repetibilidad). VARIABLE GRUPO (1) GRUPO (2) N (1) N (2) VAR (1) VAR (2) F p PRUEBA CONCEN. {alto} {bajo} 10 10 1, 10 E- 4, 30 E 2, 47 E+01 0, 0001 Bilateral 04 06 CONCEN. {alto} {medio} 10 10 1, 10 E- 1, 70 E 0, 06 04 03 0, 0003 Bilateral CONCEN. {bajo} {medio} 10 10 4, 30 E- 1, 70 E 2, 60 E-03 06 03 <0, 000 Bilateral 1 Prueba F para igualdad de varianzas (criterio de reproducibilidad). VARIABLE GRUPO (1) GRUPO (2) N (1) N (2) VAR (1) VAR F p PRUEBA (2) 1, 10 E 23487, 75 <0, 0001 Bilateral 06 CONCEN. {alto} {bajo} 10 10 0, 03 CONCEN. {alto} {medio} 10 10 0, 03 0, 97 0, 969 Bilateral COENCEN. {bajo} {medio} 10 10 1, 10 E 06 0, 03 4, 10 E-05 <0, 0001 Bilateral

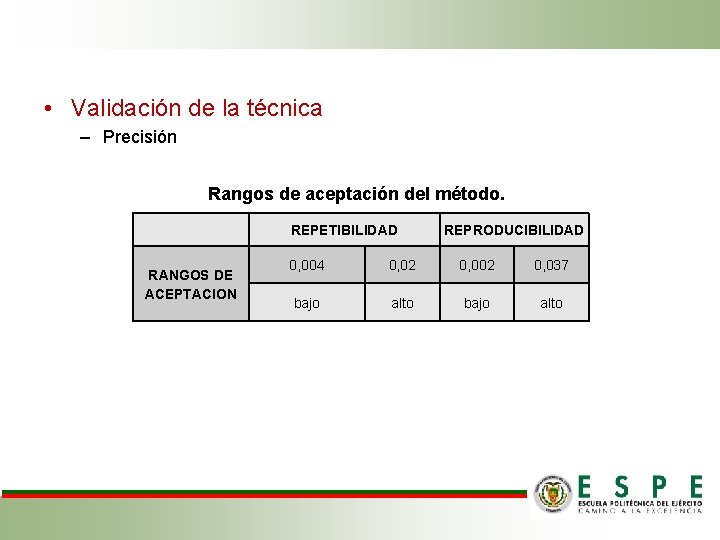
• Validación de la técnica – Precisión Rangos de aceptación del método. REPETIBILIDAD RANGOS DE ACEPTACION REPRODUCIBILIDAD 0, 004 0, 02 0, 037 bajo alto

• Validación de la técnica – Sensibilidad del método: límite de detección y cuantificación. Concentración de los blancos de muestra. IDENTIFICACIÓN BLANCOS DE MUESTRA PROMEDIO DESVIACIÓN ESTÁNDAR CONCENTRACIÓN 0, 018 0, 016 0, 018 0, 017 0, 015 0, 016 0, 022 0, 015 0, 018 0, 017 0, 002 LD = Xblancos + 3 Sblancos LC = Xblancos + 10 Sblancos Límite de detección y límite de cuantificación del método. CRITERIO CONCENTRACIÓN (umol/L) LD 0, 023+/-0, 002 LC 0, 038+/-0, 002

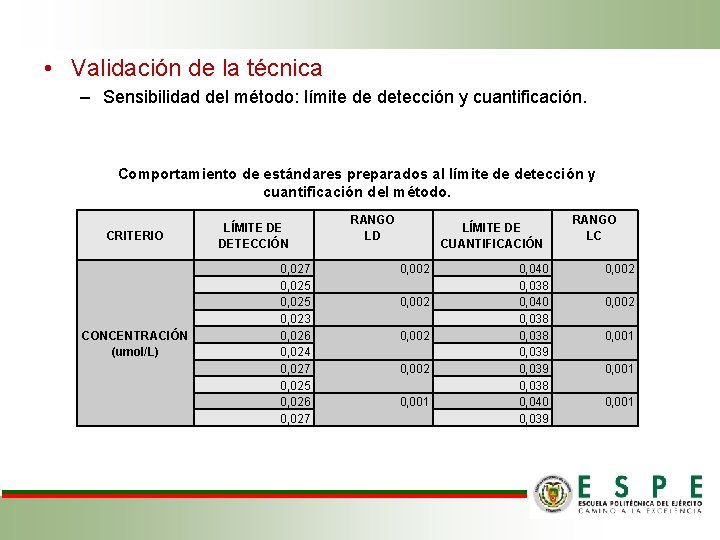
• Validación de la técnica – Sensibilidad del método: límite de detección y cuantificación. Comportamiento de estándares preparados al límite de detección y cuantificación del método. CRITERIO CONCENTRACIÓN (umol/L) LÍMITE DE DETECCIÓN 0, 027 0, 025 0, 023 0, 026 0, 024 0, 027 0, 025 0, 026 0, 027 RANGO LD LÍMITE DE CUANTIFICACIÓN 0, 002 0, 001 0, 040 0, 038 0, 039 0, 038 0, 040 0, 039 RANGO LC 0, 002 0, 001

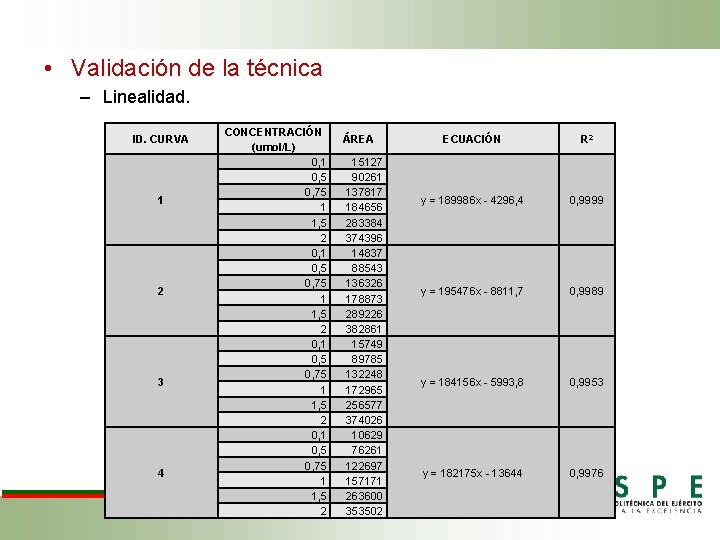
• Validación de la técnica – Linealidad. ID. CURVA 1 2 3 4 CONCENTRACIÓN (umol/L) 0, 1 0, 5 0, 75 1 1, 5 2 ÁREA 15127 90261 137817 184656 283384 374396 14837 88543 136326 178873 289226 382861 15749 89785 132248 172965 256577 374026 10629 76261 122697 157171 263600 353502 ECUACIÓN R 2 y = 189986 x - 4296, 4 0, 9999 y = 195476 x - 8811, 7 0, 9989 y = 184156 x - 5993, 8 0, 9953 y = 182175 x - 13644 0, 9976

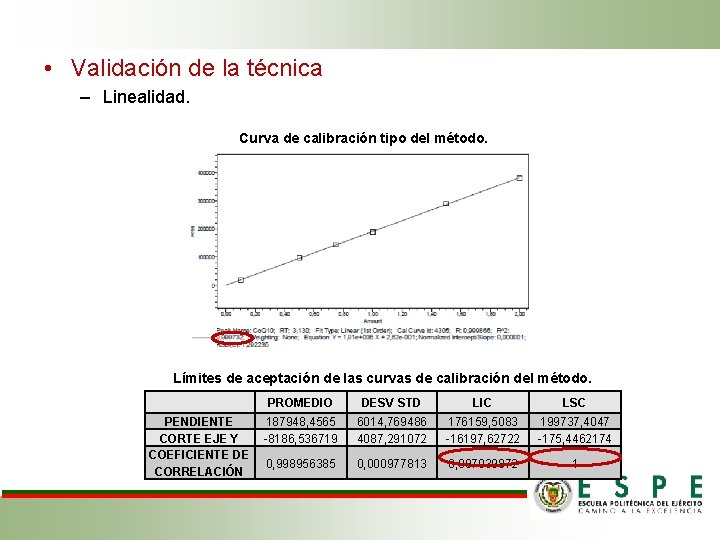
• Validación de la técnica – Linealidad. Curva de calibración tipo del método. Límites de aceptación de las curvas de calibración del método. PROMEDIO PENDIENTE 187948, 4565 CORTE EJE Y -8186, 536719 COEFICIENTE DE 0, 998956385 CORRELACIÓN DESV STD LIC LSC 6014, 769486 4087, 291072 176159, 5083 -16197, 62722 199737, 4047 -175, 4462174 0, 000977813 0, 997039872 1

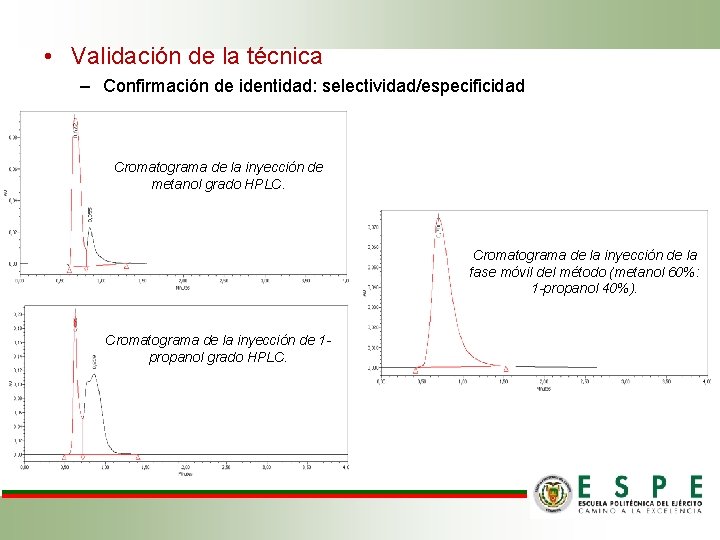
• Validación de la técnica – Confirmación de identidad: selectividad/especificidad Cromatograma de la inyección de metanol grado HPLC. Cromatograma de la inyección de la fase móvil del método (metanol 60%: 1 -propanol 40%). Cromatograma de la inyección de 1 propanol grado HPLC.

• Validación de la técnica – Incertidumbre Desviaciones estándares de las fuentes aleatorias de incertidumbre del método (Evaluación Tipo A). CRITERIO DESVIACIÓN ESTÁNDAR Reproducibilidad 0, 018742406 Repetibilidad 0, 010327956 Exactitud 0, 053768778 LD 0, 001354006 LC 0, 001024374 Rango 0, 000977813 Linealidad 0, 000977813 Incertidumbres asociadas a las fuentes sistemáticas de incertidumbre del método (Evaluación Tipo B). MATERIAL Balanza Micropipeta Resolución balanza Estándar Co. Q 10 INCERTIDUMBRE UNIDADES 0, 00001 ml 0, 0005 ml 0, 057917294 ml incertidumbre estándar del método: 0, 07 incertidumbre expandida: 0, 14.

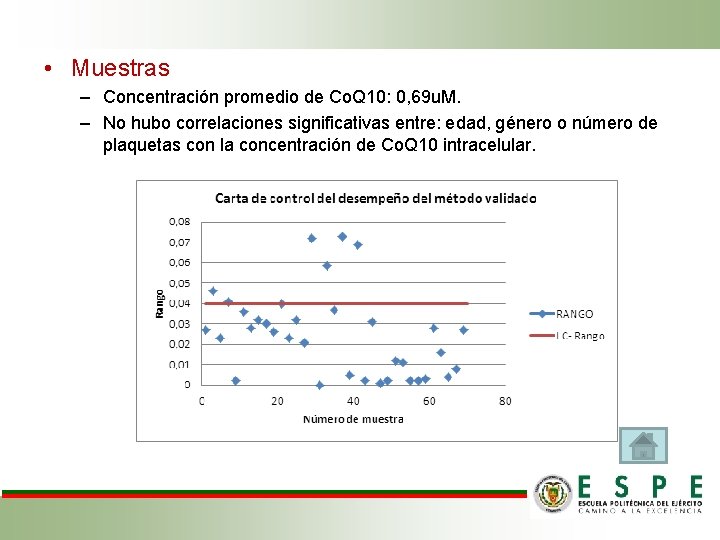
• Muestras – Concentración promedio de Co. Q 10: 0, 69 u. M. – No hubo correlaciones significativas entre: edad, género o número de plaquetas con la concentración de Co. Q 10 intracelular.

DISCUSIÓN • Estandarización Fase móvil. Ventajas: disminución del tiempo de retención, incremento del área y altura de las muestras y mayor compatibilidad con las mismas. Desventaja: tiempo de vida media de la solución patrón en el 1 -propanol. Velocidad del flujo. • Tiempo de retención corto, características cromatográficas deseables. Volumen de PRP, sangre total, 1 -propanol y fase móvil (extracción Q 10). • El incremento del volumen del PRP y la sangre total, así como, la disminución del volumen de reconstitución (fase móvil) de la muestra, permitió una mayor concentración de la Co. Q 10. • La disminución del 1 -propanol no trajo efectos adversos y fue necesaria para disminuir el tiempo de secado. Volumen de inyección. • Componente clave para la visualización óptima del pico cromatográfico de coenzima Q 10 de las muestras.

• Validación Exactitud. Porcentaje de recuperación del 96, 8%, cumple con objetivos de validación del método y las normas internacionales. En comparación con Contin (2011): 89 – 95, 3%, éste método es más exacto. Precisión. • Lím. Repetibilidad: 0, 004 - 0, 02, Lím. Reproducibilidad: 0, 002 – 0, 037. • Lim. Repetibilidad Contin: 0, 04 – 0, 057, Lím. Reproducibilidad: 0, 043 – 0, 063. Robustez. • De 91, 75 a 101, 85% de recuperación, cumple con objetivo de validación (90 – 110%), recomendado por el Eurachem. Sensibilidad. • Dos criterios: límite de detección de 5, 31 picomol/1 E 9 plaquetas y límite de cuantificación de 8, 04 picomol/1 E 9 plaquetas. En comparación con Contin: LD de 21 picomol/1 E 9 plaquetas y LC de 84 picomol/1 E 9 plaquetas.

• Validación Linealidad. Coeficiente de correlación promedio: 0, 998, cumple con objetivos de validación y normas internacionales (Eurachem, ICH y USP). Confirmación de identidad. • No existe ninguna interferencia al tiempo de retención de la Co. Q 10. Incertidumbre. • Incertidumbre expandida del método: 14%, cumple con objetivos de validación y criterios del Eurachem. Muestras. • Promedio concentración: 0, 7 u. M. No correlación entre: edad, género, número de plaquetas y concentración Q 10 en plaquetas. • Carta de control: 30 muestras bajo control y 5 muestras atípicas.

CONCLUSIONES La exactitud, precisión, linealidad, y sensibilidad del presente método, presentan mejores resultados que los obtenidos en el protocolo propuesto por Contin (2011). El volumen de inyección, así como los volúmenes de plasma rico en plaquetas y de redisolución del residuo seco, determinaron la visualización óptima del pico de coenzima Q 10. Se evidenció que la fase móvil implementada brinda importantes ventajas sobre la fase móvil original. Se estandarizó y validó un protocolo de medición de coenzima Q 10 en plaquetas, mediante la metodología de HPLC. Se estableció que no existieron interferencias de otros compuestos en la medición del analito, mediante esta metodología. Se demostró que los resultados de la prueba son directamente proporcionales a la concentración del principio activo, garantizando la capacidad del método para obtener resultados lineales. Se comprobó que el método planteado es exacto y produce resultados consistentes.

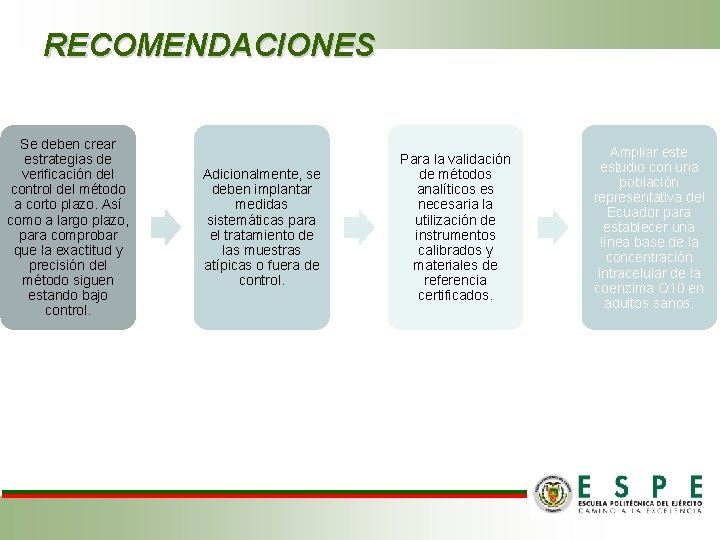
RECOMENDACIONES Se deben crear estrategias de verificación del control del método a corto plazo. Así como a largo plazo, para comprobar que la exactitud y precisión del método siguen estando bajo control. Adicionalmente, se deben implantar medidas sistemáticas para el tratamiento de las muestras atípicas o fuera de control. Para la validación de métodos analíticos es necesaria la utilización de instrumentos calibrados y materiales de referencia certificados. Ampliar este estudio con una población representativa del Ecuador para establecer una línea base de la concentración intracelular de la coenzima Q 10 en adultos sanos.

AGRADECIMIENTO
 Unicelulares y pluricelulares
Unicelulares y pluricelulares Universidad nacional de ingeniera
Universidad nacional de ingeniera 1.ingenieramédicaprogramadoraperiodistahijastra
1.ingenieramédicaprogramadoraperiodistahijastra Universidad alonso de ojeda
Universidad alonso de ojeda Ciencias de la vida carrera
Ciencias de la vida carrera Organigrama del departamento de housekeeping
Organigrama del departamento de housekeeping Huila clima
Huila clima Departamento de farmacologia
Departamento de farmacologia La señora guajardo compra un departamento
La señora guajardo compra un departamento Departamento ceres
Departamento ceres Organización del departamento de enfermería
Organización del departamento de enfermería Atributos compuestos modelo relacional
Atributos compuestos modelo relacional Organigrama de departamento de contabilidad
Organigrama de departamento de contabilidad Universidad ixil
Universidad ixil Departamentos en una empresa
Departamentos en una empresa El significado de departamento
El significado de departamento Departamento solicitante
Departamento solicitante Departamento de economia
Departamento de economia Departamento forestal
Departamento forestal Zootecnia ufpr
Zootecnia ufpr Departamento de preparatoria abierta puebla
Departamento de preparatoria abierta puebla Sesc - departamento nacional
Sesc - departamento nacional Demanda insatisfecha formula
Demanda insatisfecha formula Potencialidades productivas del departamento de cochabamba
Potencialidades productivas del departamento de cochabamba Departamento de higiene de los alimentos
Departamento de higiene de los alimentos Departamento de investigación en una agencia de publicidad
Departamento de investigación en una agencia de publicidad Departamento ceres
Departamento ceres Objetivos del departamento de enfermería
Objetivos del departamento de enfermería Cuales han sido mis logros ejemplos
Cuales han sido mis logros ejemplos Vida antigua y vida nueva en cristo
Vida antigua y vida nueva en cristo Eu vim para que todos tenham vida
Eu vim para que todos tenham vida Gonzaguinha e a vida o que é diga lá meu irmão
Gonzaguinha e a vida o que é diga lá meu irmão Louvor sobre maturidade
Louvor sobre maturidade E a vida e a vida o que é diga lá meu irmão
E a vida e a vida o que é diga lá meu irmão Ciencias
Ciencias Coreografia bpmn
Coreografia bpmn Aportes de la antropología a las ciencias sociales
Aportes de la antropología a las ciencias sociales Estandares de ciencias naturales
Estandares de ciencias naturales Bangolou
Bangolou






























































