DEFINICIN DE MATERIA Materia es cualquier cosa que








- Slides: 15

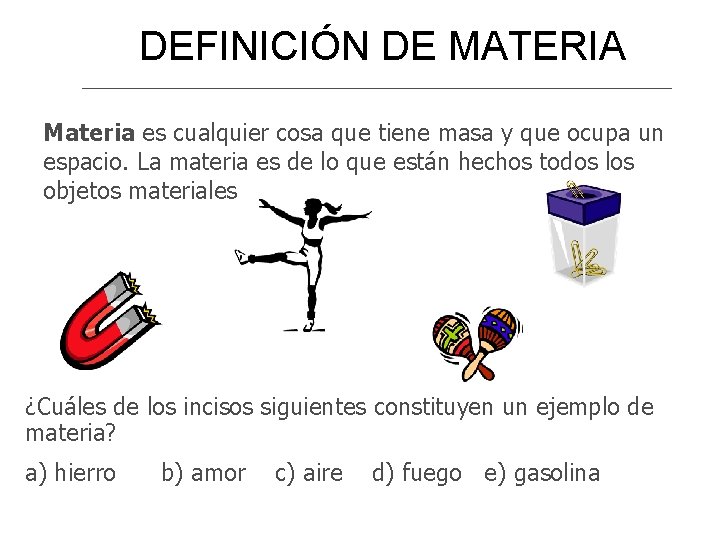
DEFINICIÓN DE MATERIA Materia es cualquier cosa que tiene masa y que ocupa un espacio. La materia es de lo que están hechos todos los objetos materiales ¿Cuáles de los incisos siguientes constituyen un ejemplo de materia? a) hierro b) amor c) aire d) fuego e) gasolina

COMPARACIÓN DE MASAS La Materia tiene masa La masa es una magnitud relacionada con la cantidad de materia que tiene un objeto, es decir podemos medirla.

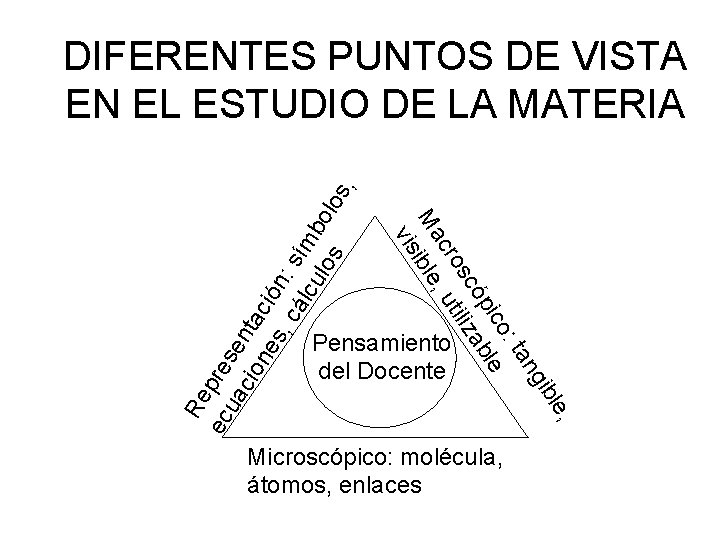
ng : ta ico ble óp sc iliza cro , ut Ma ible vis Re ec pre ua se cio nta ne ció s, n cá : sí lcu mb los olo s , DIFERENTES PUNTOS DE VISTA EN EL ESTUDIO DE LA MATERIA Pensamiento del Docente e, ibl Microscópico: molécula, átomos, enlaces

ESTUDIO DE LA MATERIA A NIVEL MACROSCÓPICO Estados de Agregación Estructura Composición: Reacciones Químicas y Cambios Energéticos que las acompañan. H 2 O 2 H 2 O

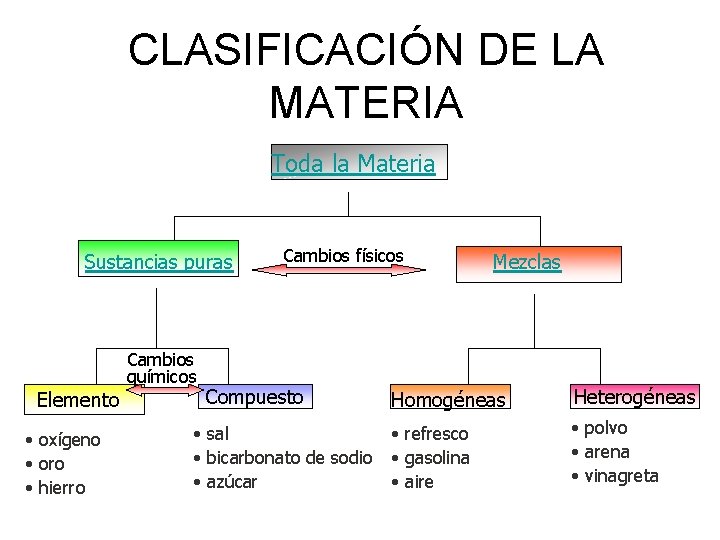
CLASIFICACIÓN DE LA MATERIA Toda la Materia Sustancias puras Cambios químicos Elemento • oxígeno • oro • hierro Cambios físicos Compuesto • sal • bicarbonato de sodio • azúcar Mezclas Homogéneas Heterogéneas • refresco • gasolina • aire • polvo • arena • vinagreta

PROPIEDADES DE LA MATERIA Propiedades Físicas: Aquellas que pueden ser observadas o medidas sin que ocurra cambio en la composición química de la sustancia. Cambio Físico: Altera alguna propiedad física. Propiedades Químicas: Aquellas que pueden ser observadas o medidas dependiendo de la habilidad de las sustancias para reaccionar y formar una nueva sustancia que tiene propiedades diferentes. Cambio Químico: Altera la composición química de la sustancia.

PROPIEDADES DE LA MATERIA • Propiedades Intensivas – No cambian cuando cambia el tamaño de la muestra, ejemplo: densidad, temperatura de ebullición, temperatura de fusión, tensión superficial • Propiedades Extensivas – Cambian las propiedades cuando cambia el tamaño de la muestra, ejemplo: volumen de un líquido, la masa de un sólido, la presión de un gas.

CONCEPTO DE ELECTROLITOS La gran diferencia entre el cloruro de sodio y el azúcar, que se evidencia cuando se enciende el bombillo, consiste en que el cloruro de sodio conduce la electricidad cuando se disuelve en el agua, en cambio la sacarosa no. De aquí que: Las sustancias que conducen la electricidad cuando se disuelven en agua ó cuando se funden, son llamadas ELECTROLITOS. Aquellas que no lo hacen, son llamadas NO ELECTROLITOS “ El cloruro de sodio es un electrolito” “ El azúcar es un no electrolito”

CARACTERÍSTICAS DE LOS ELECTROLITOS Cuando el cloruro de sodio se disuelve en el agua, la molécula (Na+ Cl-) se separa en sus iones. Mientras que el azúcar, al disolverse en el agua, todos los átomos que conforman la molécula permanecen unidos y no existe la posibilidad de formación de iones. La composición química de estas dos sustancias o más exactamente, las fuerzas que mantiene unida la materia en ambos casos es diferente.

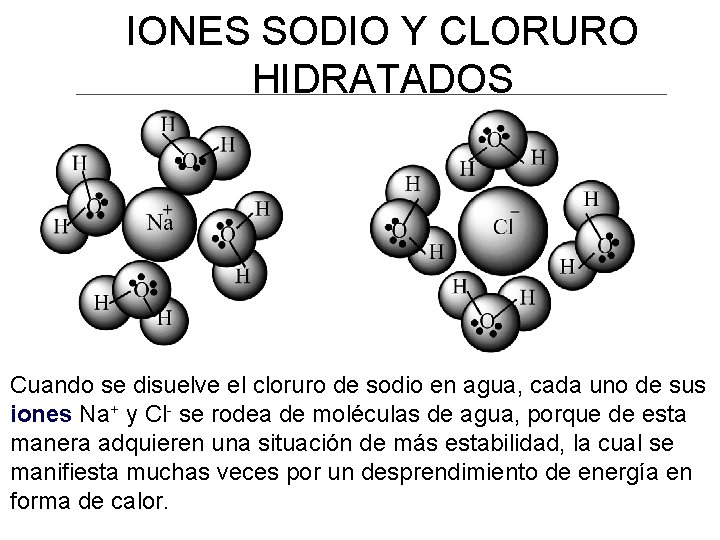
IONES SODIO Y CLORURO HIDRATADOS Cuando se disuelve el cloruro de sodio en agua, cada uno de sus iones Na+ y Cl- se rodea de moléculas de agua, porque de esta manera adquieren una situación de más estabilidad, la cual se manifiesta muchas veces por un desprendimiento de energía en forma de calor.

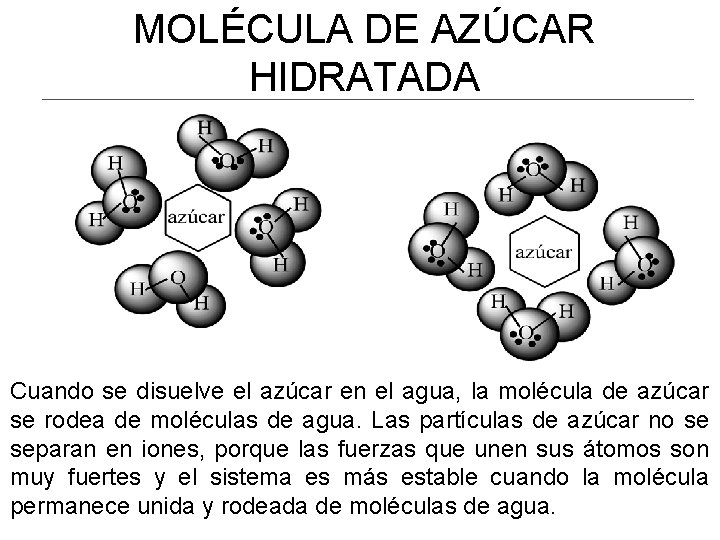
MOLÉCULA DE AZÚCAR HIDRATADA Cuando se disuelve el azúcar en el agua, la molécula de azúcar se rodea de moléculas de agua. Las partículas de azúcar no se separan en iones, porque las fuerzas que unen sus átomos son muy fuertes y el sistema es más estable cuando la molécula permanece unida y rodeada de moléculas de agua.

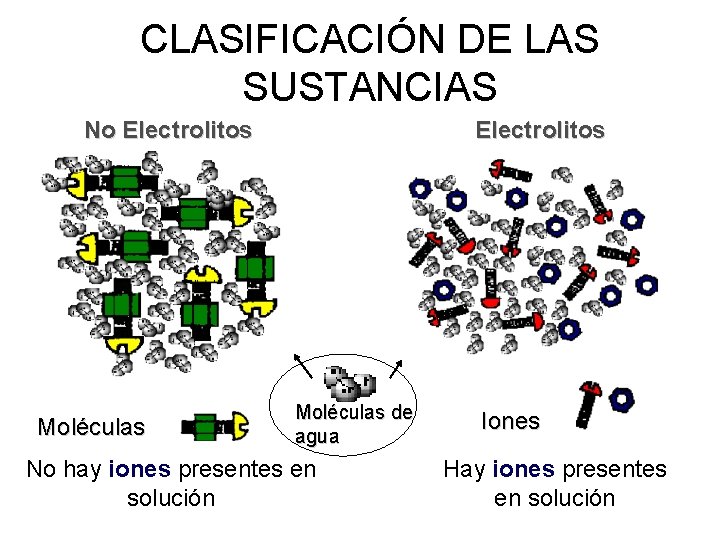
CLASIFICACIÓN DE LAS SUSTANCIAS No Electrolitos Moléculas de agua No hay iones presentes en solución Iones Hay iones presentes en solución

ELECTROLITO FUERTE La sustancia, en solución, está totalmente separada en sus iones. Son electrolitos fuertes: el ácido clorhídrico (componente activo del Ácido Muriático), el hidróxido de sodio (componente activo de destapadores de cañería).

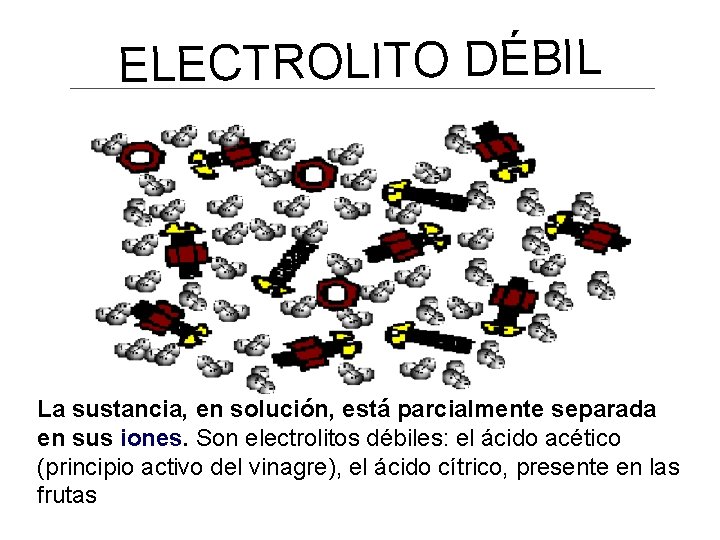
ELECTROLITO DÉBIL La sustancia, en solución, está parcialmente separada en sus iones. Son electrolitos débiles: el ácido acético (principio activo del vinagre), el ácido cítrico, presente en las frutas

ELECTROLITOS Las sustancias: azúcar, ácido cítrico y ácido acético, no electrolitos débiles, pertenecen a la familia de los compuestos orgánicos. Las sustancias cloruro de sodio, ácido clorhídrico e hidróxido de sodio, todas electrolitos fuertes, pertenecen a la familia de los compuestos inorgánicos Por tanto, podríamos suponer que en la mayoría de los casos: 1) las sustancias orgánicas se comportan como no electrolitos débiles 2) las sustancias inorgánicas se comportan como electrolitos fuertes