d PRVKY prvky se zaplnnmi sten i pln




![Vlastnosti d-prvků – oxidační stavy – pestrost a proměnlivost [Mn(CO)5]– ; [Mn 2(CO)10]; –I Vlastnosti d-prvků – oxidační stavy – pestrost a proměnlivost [Mn(CO)5]– ; [Mn 2(CO)10]; –I](https://slidetodoc.com/presentation_image_h2/60a91cb9b29c7fd6e22d5c7c80346b3a/image-11.jpg)


- Slides: 16

d – PRVKY • prvky se zaplněnými (částečně či úplně) d či f orbitaly Obecné vlastnosti • všechny jsou kovy • tvoří slitiny navzájem • mnohé z nich jsou dostatečně elektropositivní – rozpouští se v kyselinách • existují v různém mocenství, jejich ionty a sloučeniny jsou barevné (alespoň v jednom oxidačním čísle) • tvoří paramagnetické sloučeniny

d – PRVKY

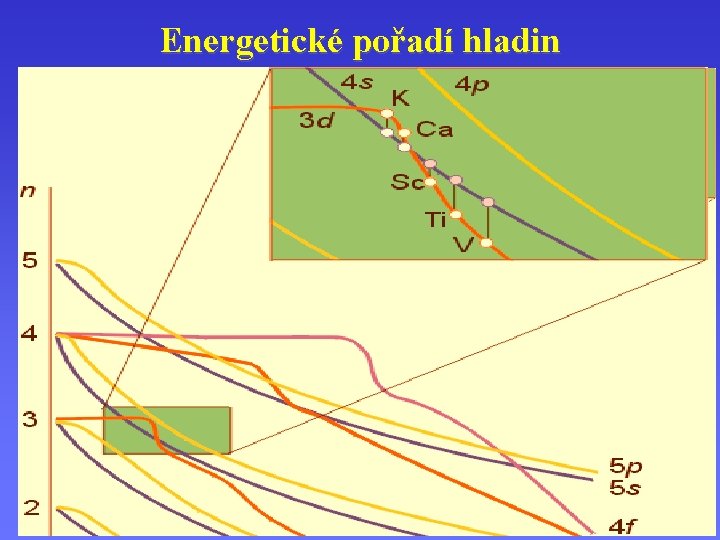
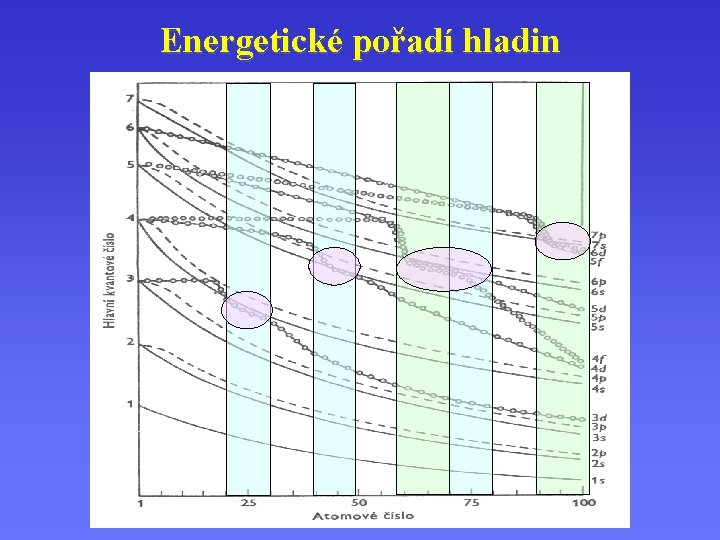
Energetické pořadí hladin 1 s, 2 p, 3 s, 3 p, 4 s 3 d, 3 d 4 p, 5 s, 4 d, 5 p, 6 s, 4 f 5 d, 6 p, 7 s, 5 f, 6 d, 7 p …

Energetické pořadí hladin

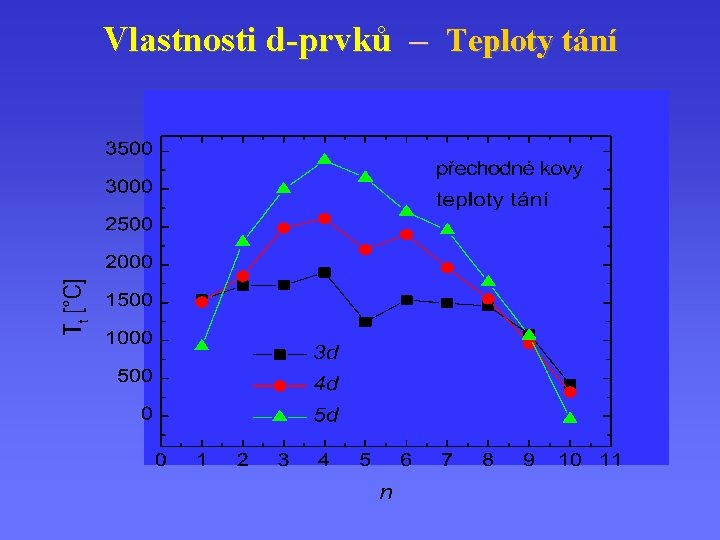
Vlastnosti d-prvků Fyzikální vlastnosti – – – KOVY pevný stav (až na rtuť), vysoký bod tání velká mechanická pevnost; kujnost a tažnost vysoká reflektivita (kovový lesk) velká tepelná a elektrická vodivost částečně zaplněné energetické pásy, EF magnetické vlastnosti (para, fero, feri, antiferi) Krystalové mříže: kubická plošně, tělesně centrovaná; hexagonální

Vlastnosti d-prvků – Teploty tání

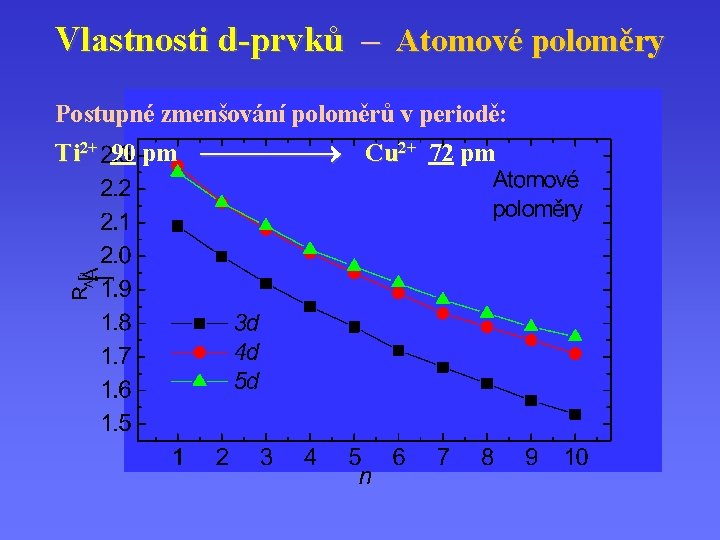
Vlastnosti d-prvků – Atomové poloměry Postupné zmenšování poloměrů v periodě: Ti 2+ 90 pm Cu 2+ 72 pm

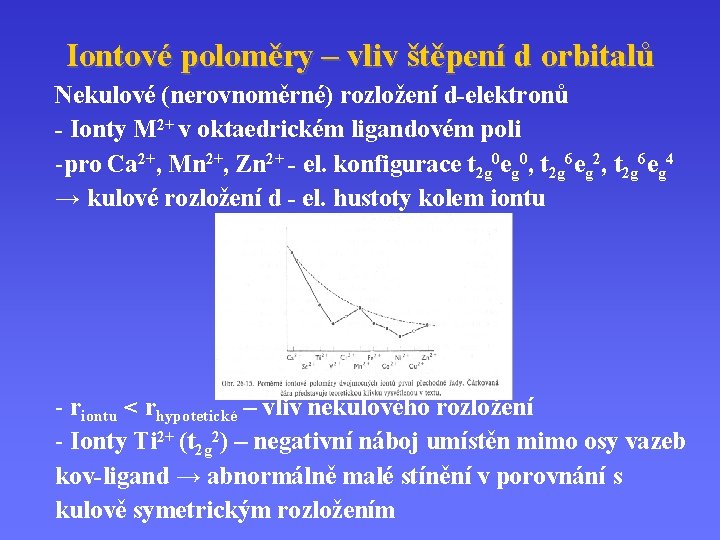
Iontové poloměry – vliv štěpení d orbitalů Nekulové (nerovnoměrné) rozložení d-elektronů - Ionty M 2+ v oktaedrickém ligandovém poli -pro Ca 2+, Mn 2+, Zn 2+ - el. konfigurace t 2 g 0 eg 0, t 2 g 6 eg 2, t 2 g 6 eg 4 → kulové rozložení d - el. hustoty kolem iontu - riontu < rhypotetické – vliv nekulového rozložení - Ionty Ti 2+ (t 2 g 2) – negativní náboj umístěn mimo osy vazeb kov-ligand → abnormálně malé stínění v porovnání s kulově symetrickým rozložením

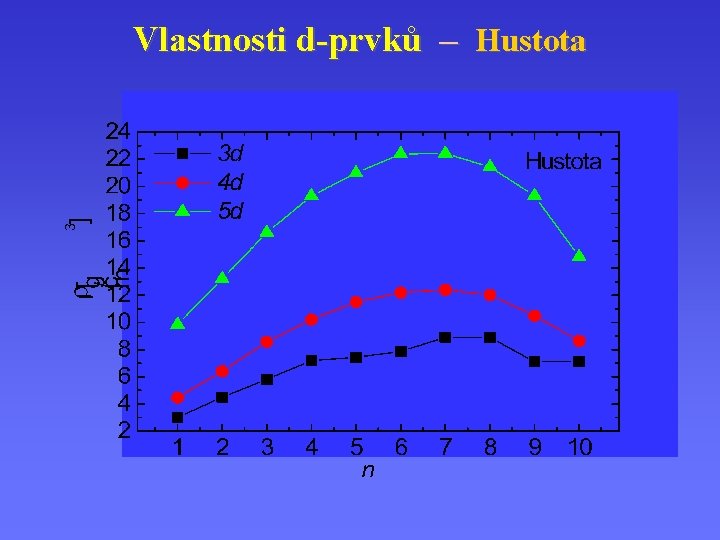
Vlastnosti d-prvků – Hustota

Vlastnosti d-prvků Chemické vlastnosti – většina sloučenin - paramagnetická – diamagnetické sloučeniny – konfigurace typu (n-1)d 0 ns 0 – známá barevnost sloučenin a komplexů – u sloučenin s nejvyšším ox. číslem – kovalentní vazby – iontový charakter vazeb roste se snižujícím se ox. číslem – nejsou dostatečně elektropozitivní – sloučeniny nejsou vyhraněnými zásadami – naopak jsou amfoterní nebo kyselé (ve vyšším oxidačním stavu)
![Vlastnosti dprvků oxidační stavy pestrost a proměnlivost MnCO5 Mn 2CO10 I Vlastnosti d-prvků – oxidační stavy – pestrost a proměnlivost [Mn(CO)5]– ; [Mn 2(CO)10]; –I](https://slidetodoc.com/presentation_image_h2/60a91cb9b29c7fd6e22d5c7c80346b3a/image-11.jpg)
Vlastnosti d-prvků – oxidační stavy – pestrost a proměnlivost [Mn(CO)5]– ; [Mn 2(CO)10]; –I 0 ionizační E Mg Mn – – – 1. 737 717 [Mn(H 2 O)6]2+. . Mn. O 4– II+ VII+ 2. 1450 1509 3. 7731 3259 podobnost ve skupinách – převládá v bloku d stálost vyšších oxidačních stavů – stoupá směrem dolů ! zásaditost roste s klesajícím oxidačním stavem zásaditost v daném ox. st. klesá s rostoucí velikostí prvku kyselost roste se vzrůstajícím oxidačním stavem

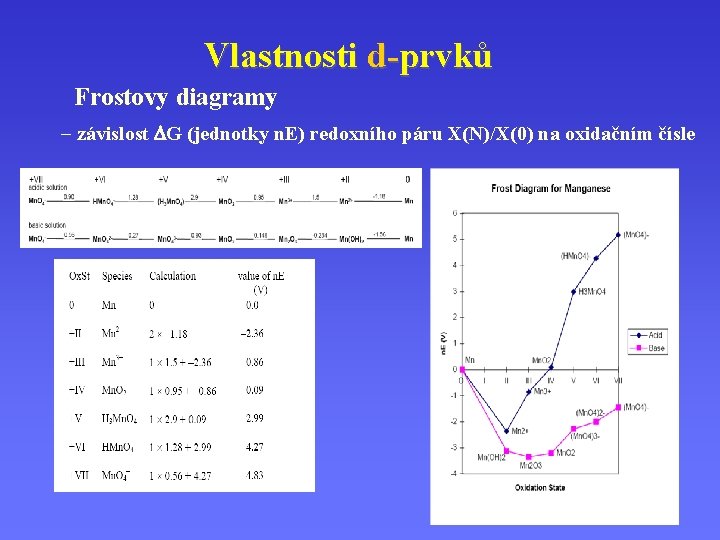
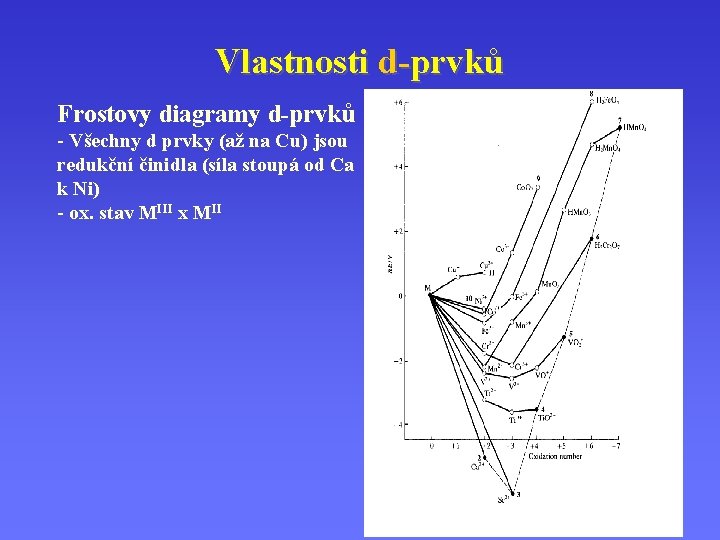
Vlastnosti d-prvků Frostovy diagramy - závislost DG (jednotky n. E) redoxního páru X(N)/X(0) na oxidačním čísle

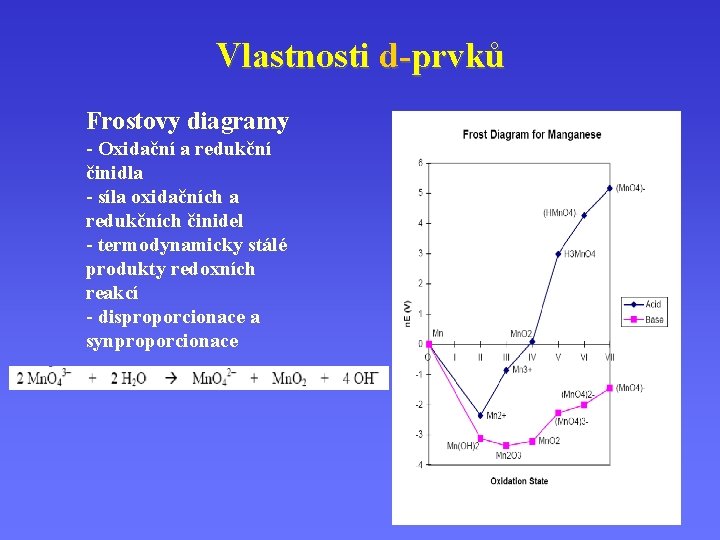
Vlastnosti d-prvků Frostovy diagramy - Oxidační a redukční činidla - síla oxidačních a redukčních činidel - termodynamicky stálé produkty redoxních reakcí - disproporcionace a synproporcionace

Vlastnosti d-prvků Frostovy diagramy d-prvků - Všechny d prvky (až na Cu) jsou redukční činidla (síla stoupá od Ca k Ni) - ox. stav MIII x MII

Prvky první přechodné řady - V každé skupině se prvky (např. V, Cr) první řady odlišují od těžších homologů (Nb, Ta , Mo, W) - chemie vodných roztoků je jednodušší - el. konfigurace 3 dn 4 s 2 až na Cr (3 d 5 4 s 1) a Cu (3 d 10 4 s 1) - od Ti k Mn – nejvyšší mocenství Tin+, Mnn+ (n = celkového počet d a s elektronů), stabilizace v oxosloučeninách, fluoridech, chloridech. Stabilita klesá od Ti. IV k Mn. VII (Fe, Co, Ni – obtížné získat vyšší ox. stavy) - v kyslíkatých aniontech ox. stavů IV až VII – atom kovu obklopen tetraedricky x do ox. stavu IV – oktaedrické uspořádaní - s rostoucím ox. číslem jsou oxidy daného prvku kyselejší, halogenidy kovalentnější – snadná hydrolýza - ox. stavy < II – s ligandy typu p kyselin (výjimka Cu)

Prvky druhé a třetí přechodné řady - odlišují se od lehčích analogů – Co. II – tetraedrické i oktaedrické komplexy x Rh. II, Ir. II – vzácné a nestálé komplexy, Cr. VI – silné oxidační činidlo x Mo. VI, WVI – stálé, tvorba polynukleárních oxoaniontů - poloměry – atomy a ionty podobné poloměry – důsledkem lantanidové kontrakce u prvků třetí přechodné řady x výrazně menší poloměry u prvků první přechodné řady - oxidační stavy – vyšší ox. stavy jsou stálejší (Pt. F 6, Ru. O 4 u lehčích analogů neexistují) - vodné roztoky – akvoionty nízkých a středních ox. čísel nejsou definovány, tvoří oxo- a haloanionty,