Cytotoxicit Ncrose et Apoptose Cours de la cinquime








































- Slides: 61

Cytotoxicité Nécrose et Apoptose Cours de la cinquiéme annèe Dr M. H. BELMAHI LOGO www. wondershare. com

Plan u I. Introduction. u II. Cytotoxicité. u III. Nécrose. u IV. Apoptose. u V. Conclusion. Company Logo

I. Introduction: La toxicité d’une substance Signe clinique Mécanisme d’action Signe biologique Lésion biochimique Perturbation physiologie Company Logo Perturbation anatomopathologique

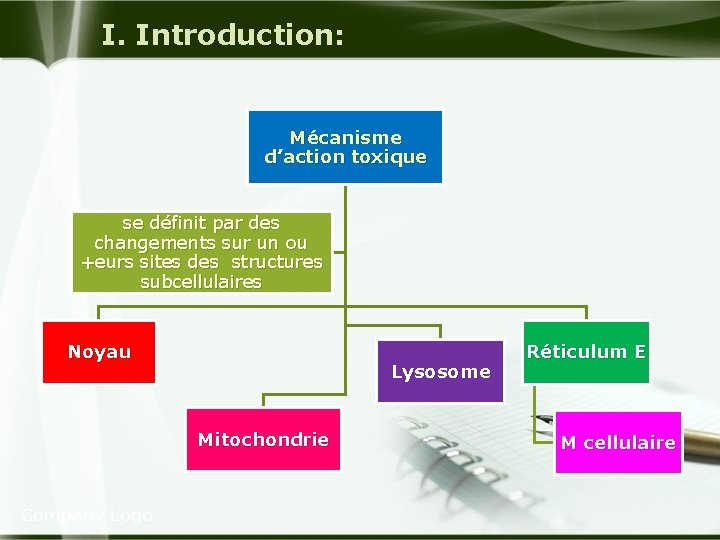
I. Introduction: Mécanisme d’action toxique se définit par des changements sur un ou +eurs sites des structures subcellulaires Noyau Lysosome Mitochondrie Company Logo Réticulum E M cellulaire

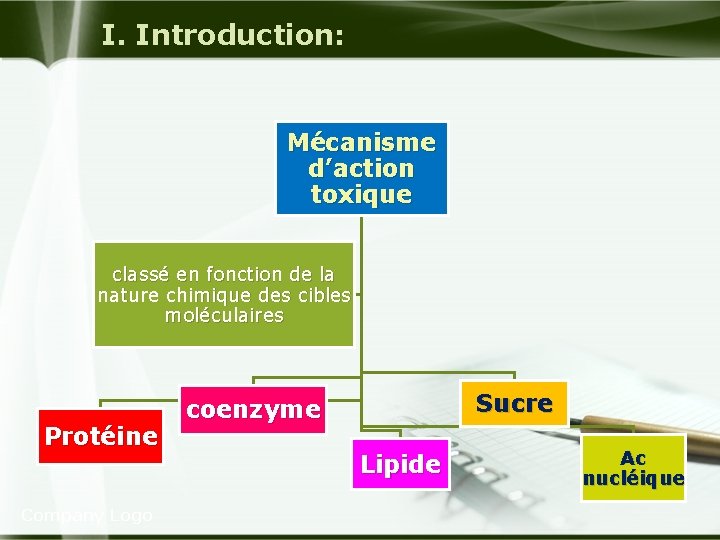
I. Introduction: Mécanisme d’action toxique classé en fonction de la nature chimique des cibles moléculaires Protéine Company Logo Sucre coenzyme Lipide Ac nucléique

II. Cytotoxicité: 1 - Définition: Atteinte d’une fonction ou structure dépassant les capacités d’adaptation a un stimulus Cytotoxicité Arrêt irréversible des fonctions vitales avec modification des structures au niveau moléculaire Lésion cellulaire La mort cellulaire Irréversible autophagie Réversible Nécrose Dégénérescence Company Logo Nécrose Secondaire a une lésion cellulaire Apoptose: mort cellulaire programmé

II. Cytotoxicité: 1 - Définition: Type d’agressi on La réponse cell a une agression dépend Sa durée Company Logo Sa sévérité

II. Cytotoxicité: 1 - Définition: Son type Son état Company Logo Les conséquen ces sur la cell dépendent Sa capacité d’adaptati on

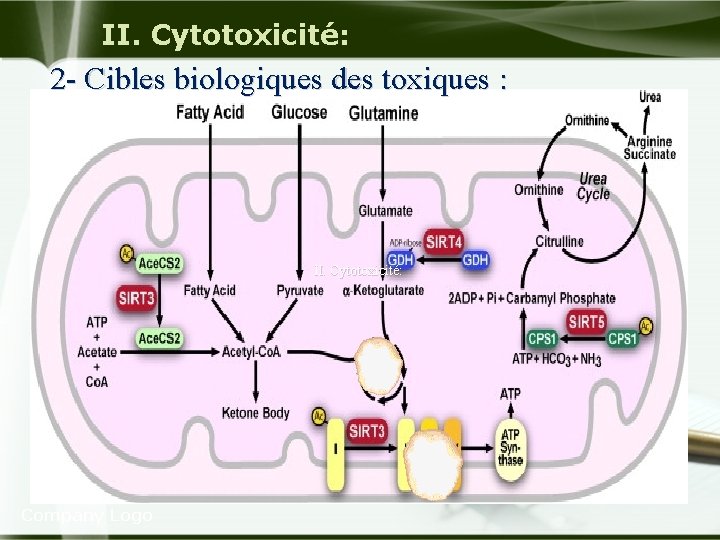
II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u Dans la cellule quatre systèmes sont particulièrement vulnérables aux agressions et liés entre eux: la respiration aérobie. le maintien de l'intégrité des membranes cellulaires. les synthèses protéiques la préservation de l'intégrité de l'appareil génétique. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : Action primaire sur les structures cellulaires: A Lésions biochimiques mitochondriales: u Elle peut siéger soit sur les réactions enzymatiques du cycle tricarboxylique(cycle de Krebs). u Soit sur la chaîne de transporteurs d'e- couplant les oxydations aux phosphorylations. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : II. Cytotoxicité: Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u Lésion sur les réactions enzymatiques du cycle de Krebs: L’oxydation de l'acide pyruvique est une étape essentielle du métabolisme oxydatif et son inhibition est la cause principale de la toxicité de l'As (thioloprive). u Action sur la chaîne respiratoire: u Ex : 1 -L'ion CN-: u L'ion CN- se combine avec le ferrique (Fe 3+) de la cytochrome oxydase (cytochrome a+ cytochrome a 3 =dernier chaînon de la chaîne respiratoire) et bloque ainsi la respiration cellulaire. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u Remarque : La formation de radicaux libres hautement réactifs 02 , OH pourrait altérer rapidement et d'une façon irréversible des constituants ou des structures cellulaires bloquant notamment la phosphorylation oxydative c'est probablement le cas du chloroforme et de l'halothane dont la déshalogenation métabolique fournirait des RL en quantité anormalement augmentée chez les sujets génétiquement prédisposés, ou recevant des inducteurs enzymatiques (barbiturique). Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u Ces lésions biochimiques mitochondriales ont pour conséquences: Diminution de la respiration cellulaire ayant pour conséquence une chute de concentration en ATP. Diminution de la phosphorylation oxydative, Diminution de la béta-oxydation des acides gras Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : B Action sur le réticulum endoplasmique: u Au cours de l'intoxication au CCL 4 deux phénomènes paraissent évoluer séparément: u d'une part la surcharge graisseuse du foie qui commence 60 minutes après le début de l'intoxication : l'inhibition précoce de la synthèse protéique qui soit responsable de la surcharge graisseuse (globuline). u Et d'autres part la nécrose cellulaire hépatique qui ne s'observe le plus souvent que 10à 12 heurs plus tard. il est bien démontré que la réaction initiale responsable de son action toxique est son action hémolytique au niveau du réticulum endoplasmique lisse du foie avec production de deux radicaux libres: CCl 3 -Cl →CCl 3*+Cl* Copany Logo

2 - Cibles biologiques des toxiques : u C Action des toxiques sur les ribosomes: u De nombreux toxiques entraînent une diminution de la synthèse protéique parmi lesquelles enzymes. u Exemple: la streptomycine altère le noyau et les ribosomes des cellules sensorielles alors que les terminaisons nerveuses et les fibres qui ne synthétisent pas leurs protéines ne sont pas touchées. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : D Action sur les membranes: u De nombreux mécanismes peuvent être mis en évidence: a) Inhibition spécifique d'enzymes à siège membranaire: § Na+/K+ATPase Mg dépendante inhibée par les glucosides tonicardiaques Ex : digitaline qui inhibe spécifiquement l'activité de la pompe ATPase et le transport actif du Na+ et K+. • ATPase calcique sensible à certains toxiques qui peuvent se fixer par covalence (paracétamol, chloroforme , Cd, Pb). Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : b) processus physique intéressant la perméabilité des membranes: u La tetraodontoxine (tetrodotoxine) qui bloque l'entrée intracellulaire du Na+ à travers la membrane, ce qui inhibe la propagation de l'influx nerveux u De nombreux médicaments sont appelés stabilisateurs de membrane car ils diminuent l'intensité des transferts lors de l'excitation (tranquillisants, antiépileptiques) à forte dose l'effet inhibiteur deviendra toxique. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u certains composés ne traversent pas les membranes agissent par leur simple pouvoir osmotique, d'autres perturbent profondément les membranes lipoprotéiques: détergents, peroxydes halogénés, acides ou bases. u certains par contre perturbent de façon transitoire les fonctions membranaires, les anesthésiques généraux volatils ont des formules moléculaires très diverses et des actions semblables sur le cerveau. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : C) Lipoperoxydation: u Action des radicaux libres sur la membrane: u Le RL est responsable d’un processus d’oxydation. u Le R° est le radical libre initiateur de la réaction ; l’attaque initiale s'effectue sur le groupement méthylène séparant deux doubles liaisons dans l'acide gras. u In-vivo, les conséquences peuvent être graves. Des structures membranaires au sein de la cellule (riches en phospholipides contenant des acides gras insaturés) seront altérées entraînant la mort des cellules. Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : E Action sur les lysosomes : u Ils interviennent dans la dégradation de macromolécules et de complexes organiques. Ainsi, certains toxiques en inhibant les enzymes de dégradation, provoquent le stockage lysosomial de lipides (phospholipidose) ou de protéines. u Divers produits, tels que l'isophorone, 1. 4 dichlorobenzéne est capable de se fixer sur l'alpha 2 microglobuline, une protéine de bas PM synthétisée par le foie, chez le rat male, et éliminée par voie rénale. Cette protéine va alors s'accumuler dans les lysosomes des tubules rénaux proximaux Company Logo

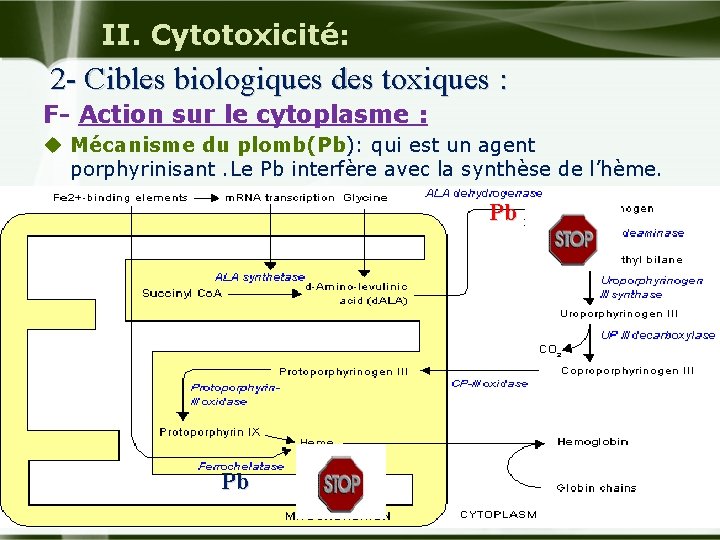
II. Cytotoxicité: 2 - Cibles biologiques des toxiques : F Action sur le cytoplasme : u Mécanisme du plomb(Pb): qui est un agent porphyrinisant. Le Pb interfère avec la synthèse de l’hème. Pb Pb Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : G Action sur le noyau : u Formation d'agents alkylant : u forment des intermédiaires cationiques réactifs les ions carbonium ou carbocations, en raison du pouvoir fortement attracteur des électrons des groupes auxquels le résidu alkyl est initialement fixé (Cl 2 par ex) ces intermédiaires sont fortement électrophiles. u Le diméthyl nitrosamine est métabolisé au niveau du RE, le métabolite obtenue libère un réactif cationique (électrophile). Ce cation réactif se lie à des bases pyrimidiques ou puriques des macromolécules (ADN et/ou ARN). Ex : Guanine donne : 7 méthyl guanine ou o 6 methylguanine Company Logo

II. Cytotoxicité: 2 - Cibles biologiques des toxiques : u Cible moléculaire: Protéines Coenzymes Lipide -Prot de structure : hexane, silice -Enzyme: - spec: inh irrév de l Act chol/ les OP , et rév/carbamate - inh non spec : Pb , Mg -Inh de la synt des enz : : une dose : aigue d'éthanol inhibe l'expression du CYP 2 E 1. -La pyrithiamine peut inhiber la thiamine kinase qui est impliquée dans la synthèse d'une coenzyme: thiamine pyrophosphate. -La lipoperoxydation provoquée /CCl 4. -l’éther ou l’halothane. Company Logo -Le NADPH peut être détruit par la présence de RL produits par des molécules toxiques (CCL 4). -Une dissolution de la membrane phospholipidique est possible lors du contact avec des solvants et des détergents amphotères. Ac nucléique - Les anti- métabolites (aminoptérine et le méthotréxate) peuvent être incorporés dans l'ADN et l’ARN et interférer avec leur réplication. -L'éthylène glycol : métabolites à fct aldéh(aldéhyde glycolique, glyoxal, Ac glyoxylique) inhibe la synthèse protéique, la réplication de l'ADN et l'ARNr.

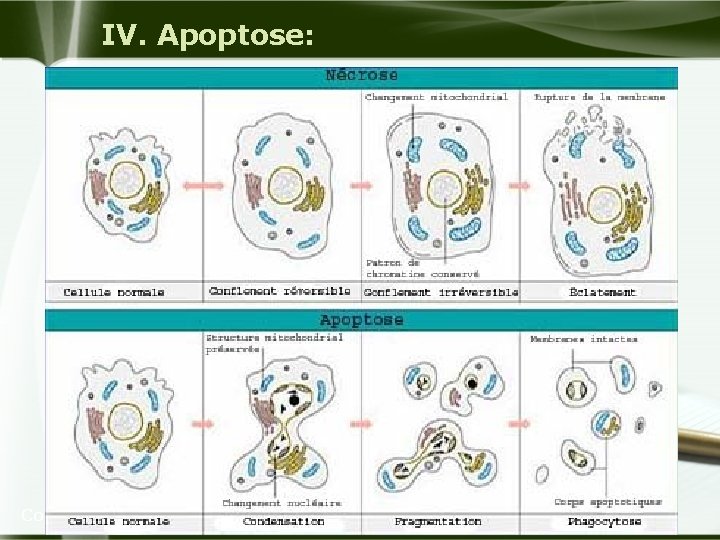
II. Cytotoxicité: u La cellule peut mourir par deux types de processus : la nécrose et l'apoptose. u La nécrose qui apparaît après une lésion cellulaire d'origine chimique ou physique résultant d'un processus dégénératif. u L'apoptose ou mort programmée est un processus actif dépendant de l'expression de gènes spécifiques conduisant à l'autodestruction cellulaire et jouant un rôle important lors de l'embryogenèse et dans les renouvellements tissulaires et certaines atteintes toxiques peuvent en être la cause. Company Logo

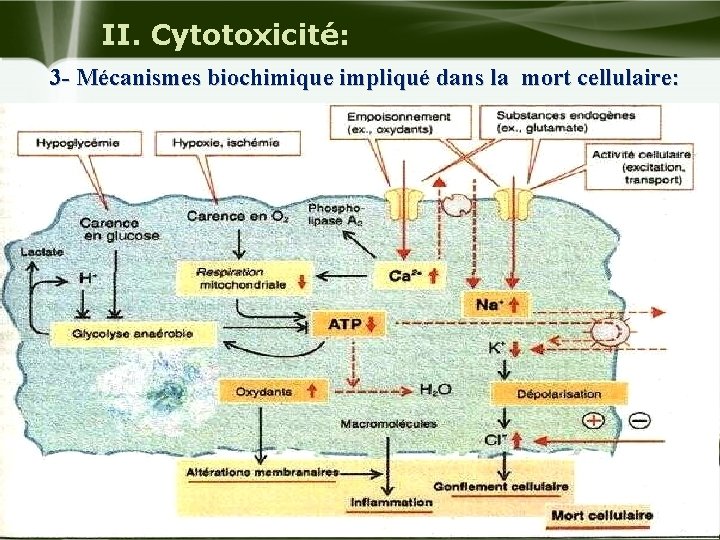
II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: u Plusieurs mécanismes jouent un rôle déterminant dans la cascade des événements qui conduisent à la nécrose ou l'apoptose il s'agit : De l'augmentation anormale de la concentration cytosolique en Ca 2+ libre ; La déplétion en ATP ; Altération de l'état d'oxydoréduction liée l'effondrement du taux de glutathion et surproduction de radicaux libres. Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: Ca++ et cytotoxicité : u Une augmentation non contrôlée du Ca 2+ cytosolique est souvent le premier événement dans le développement de la toxicité. u L'accumulation de [ca 2+] cytosolique serait aussi l'origine de la neurotoxicité des métaux lourds (Pb, Hg) et de certaines molécules organiques. u L'augmentation [Ca 2+] contribue également la cytotoxicité de différents agents hépatotoxiques (CCL 4, acétaminophéne, les quinones). Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: Les conséquences sont en général : u La perte des capacités à répondre aux signaux d'environnement : (hormones, neuromédiateurs, facteurs de croissance). u L'activation d'enzymes dépendantes du Ca++ impliquées dans des processus de dégradation ; L'activation des calpaines (protéases cytosolique) par le Ca++, entraînerait la dégradation des protéines du cytosquelette et des protéines d'ancrage au niveau membranaire provoquant la formation de protrusions cytoplasmiques caractéristiques des atteintes toxiques précoces. u D'autres groupes d'enzymes sont activées spécifiquement par le Ca 2+ et jouent un rôle essentiel dans l'évolution vers la nécrose ou l'apoptose il s'agit de certaines phospholipases et endonucleases: Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: u Les phospholipases A 2 sont Ca 2+ et calmoduline dépendantes. Elles régulent le relargage d'acide arachidonique à partir des phospholipides membranaires. u Si l'augmentation de [Ca 2+] est soutenue, ceci donne de graves altérations de la membrane plasmique. u Les endonucleases sont activées lors de l'apoptose et qui sont spécifiques du Ca 2+ et du Mg 2+. Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: Rôle de la déplétion en glutathion dans les mécanismes de toxicité : u La déplétion en GSH expose la cellule à différentes agressions toxiques (RL, oxydants, molécules à caractère électrophile. . . ) et les ressources cellulaires en GSH jouent un rôle déterminant dans la résistance à ces agressions en particulier le stress oxydant. u De nombreux agents électrophiles sont capables d'induire une déplétion en GSH. u Ex : L'adriamycine, le bromobenzéne sont bien connus pour induire un stress oxydant (NO 2, 03). Company Logo

II. Cytotoxicité: 3 - Mécanismes biochimique impliqué dans la mort cellulaire: Rôle de la déplétion en ATP et/ou la diminution du rapport ATP/ADP: u Ces événements sont consécutifs à des atteintes mitochondriales directes ou indirectes et entraînent : u des troubles concernant toutes les activités cellulaires qui nécessitent de l’énergie: B oxydation, synthèse protéique… u Elle conduit à un arrêt rapide des fonctions essentielles de la cellule. u une élévation du Ca 2+ par inhibition des ATP ases contrôlant l’homéostasie calcique. Company Logo

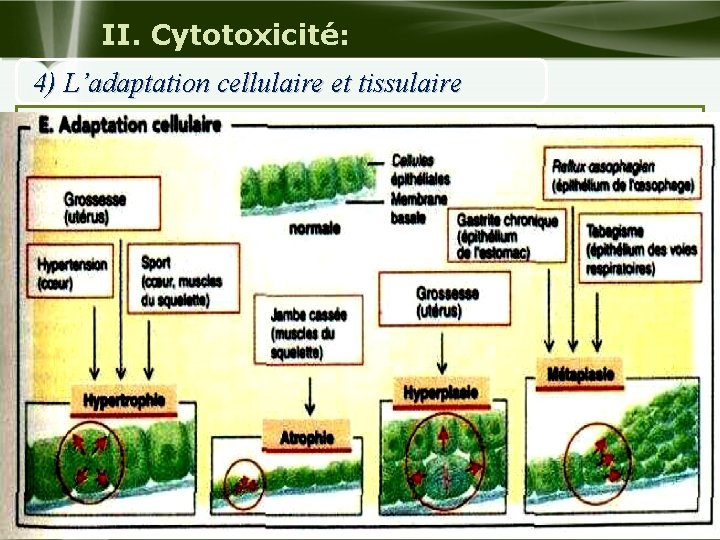
II. Cytotoxicité: 4) L’adaptation cellulaire et tissulaire

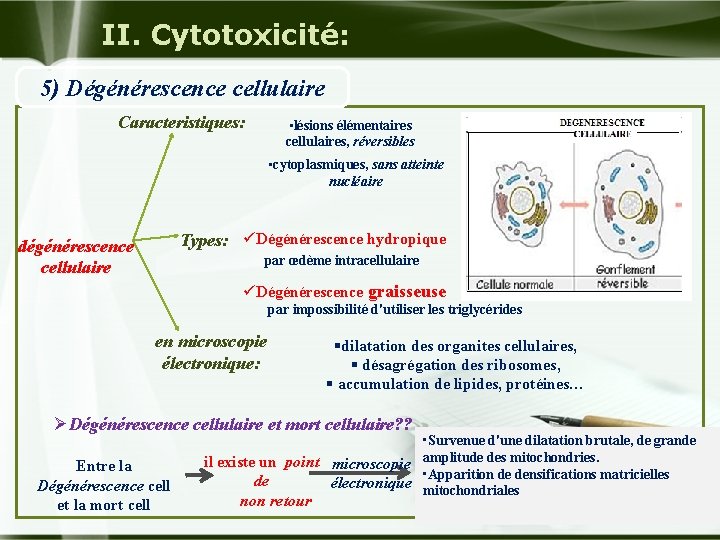
II. Cytotoxicité: 5) Dégénérescence cellulaire : u La nécrose (modifications cellulaires irréversibles) peut être précédée de lésions réversibles, dites lésions dégénératives (ensemble des lésions élémentaires cellulaires). Celles ci sont réversibles et peuvent aussi conduire à un retour à la normale. Company Logo

II. Cytotoxicité: 5) Dégénérescence cellulaire Caracteristiques: • lésions élémentaires cellulaires, réversibles • cytoplasmiques, sans atteinte nucléaire Types: üDégénérescence hydropique dégénérescence cellulaire par œdème intracellulaire üDégénérescence graisseuse par impossibilité d'utiliser les triglycérides en microscopie électronique: §dilatation des organites cellulaires, § désagrégation des ribosomes, § accumulation de lipides, protéines… ØDégénérescence cellulaire et mort cellulaire? ? Entre la Dégénérescence cell et la mort cell • Survenue d'une dilatation brutale, de grande il existe un point microscopie amplitude des mitochondries. • Apparition de densifications matricielles de électronique mitochondriales non retour

III. Nécrose : 1 - Définition : u La mort cellulaire nécrotique est un processus passif résultant d'une séquence d'événements cellulaires et tissulaires, qui survient à la suite de perturbations profondes de l'environnement cellulaire. u Elle est la conséquence d’une lésion initiale, spécifique ou non, qui peut être provoquée par un agent physique ou chimique. u La nécrose conduit à une perte cellulaire toujours secondaire à des conditions pathologiques et elle se caractérise de façon constante par une réaction inflammatoire. Company Logo

III. Nécrose : 1 - Définition : u désigne les modifications morphologiques irréversibles coïncidant avec la mort cellulaire. Ces modifications touchent aussi bien le noyau que le cytoplasme. u Elles sont observables lorsque la cellule morte reste dans un environnement vivant, et doit donc être distinguée de l’autolyse. Company Logo

III. Nécrose : 2 - Causes de la nécrose se produit dans des conditions pathologiques: u Anoxie, en particulier ischémie, hypoxie sévère. u la privation de glucose. u variation de l'osmolarité, du p. H et de l'environnement. u Agents physiques, traumatisme mécanique, thermique, radiations. u Agents chimiques et médicamenteux. u Agents infectieux : virus, bactéries, champignons, parasites. u Réactions immunologiques. u Déséquilibres nutritionnels. Company Logo

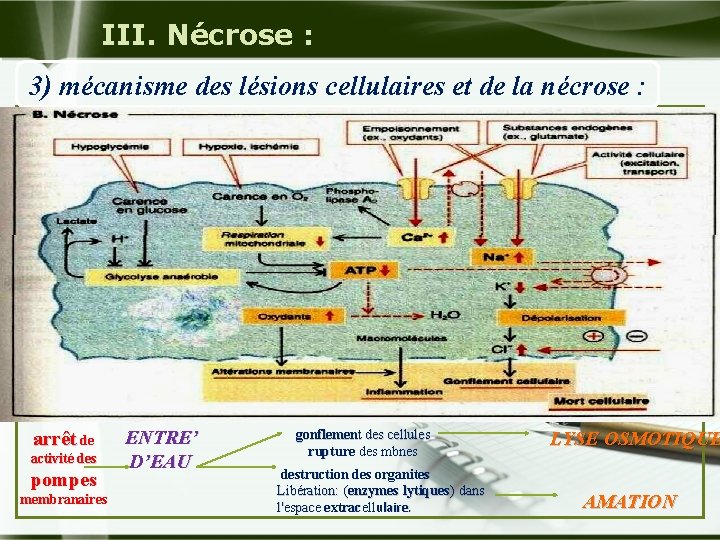
III. Nécrose : 3) mécanisme des lésions cellulaires et de la nécrose : arrêt de activité des pompes membranaires ENTRE’ D’EAU gonflement des cellules rupture des mbnes destruction des organites Libération: (enzymes lytiques) dans l'espace extracellulaire. LYSE OSMOTIQUE AMATION

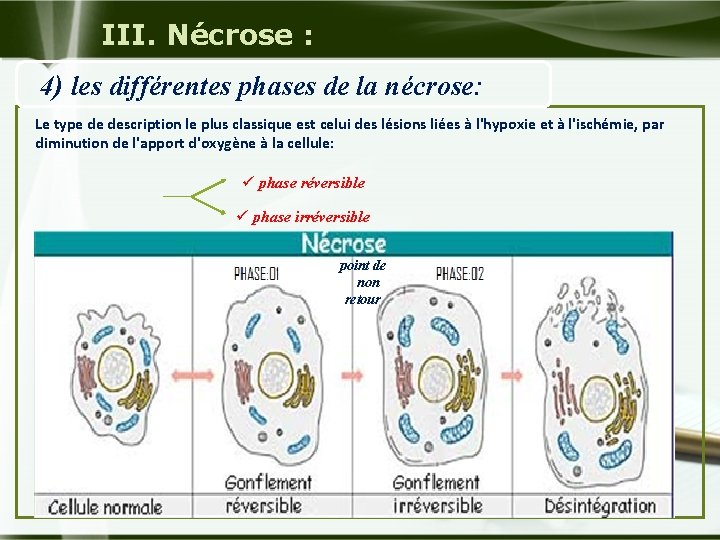
. III. Nécrose : 4) les différentes phases de la nécrose: Le type de description le plus classique est celui des lésions liées à l'hypoxie et à l'ischémie, par diminution de l'apport d'oxygène à la cellule: ü phase réversible ü phase irréversible point de non retour

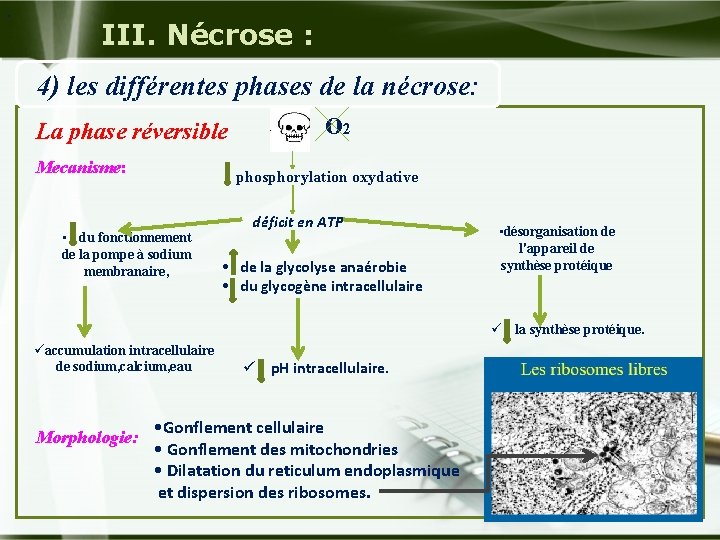
. III. Nécrose : 4) les différentes phases de la nécrose: La phase réversible Mecanisme: o 2 phosphorylation oxydative • du fonctionnement de la pompe à sodium membranaire, déficit en ATP • de la glycolyse anaérobie • du glycogène intracellulaire • désorganisation de l'appareil de synthèse protéique ü la synthèse protéique. üaccumulation intracellulaire de sodium, calcium, eau Morphologie: ü p. H intracellulaire. • Gonflement cellulaire • Gonflement des mitochondries • Dilatation du reticulum endoplasmique et dispersion des ribosomes.

III. Nécrose : 4) les différentes phases de la nécrose: La phase irréversible: Mécanisme: (point de "non retour" des lésions réversibles) §mitochondrie 2+ Ø Ca §mbrane §cytosquelette ØLesion mbne lysosomiales Ø radicaux libres dérivés de l'oxygène Morphologie: §modifications de la perméab des mbranes inter et ext §(+)phospholipases endogènes üDysfonctions mitochondriales irréversibles üPerte des pholipides mbranaires üanomalies • (+)protéases endogènes • Libèration des enzymes dans le cytoplasme üdigestion enzyque des constituants ü Lésions des membranes et constituants cellulaires • Gonflement des mitochondries • Lésions des membranes cellulaires (zones de rupture) • Rupture des lysosomes

III. Nécrose : 5) aspect de la nécrose: • dénaturation protéique modifications observables en microscopie optique • digestion des organites par les ü ARN cytoplasm(responsable de la enzymes protéolytiques des basophilie cytoplasm) éosinophile lysosomes. ü liaison de l'éosine aux cytoplasme protéines cytoplasm dénaturées NECROSE CELLULAIRE: modifications nucléaires • agglutination des amas chromatiniens contre la membrane nucléaire. NECROSE TISSULAIRE: aspects § homogène §vacuolaire • dissolution nucléaire avec perte des affinités tinctoriales • fragmentation de la masse nucléaire. Groupes de cellules soumises au méme type d’agression

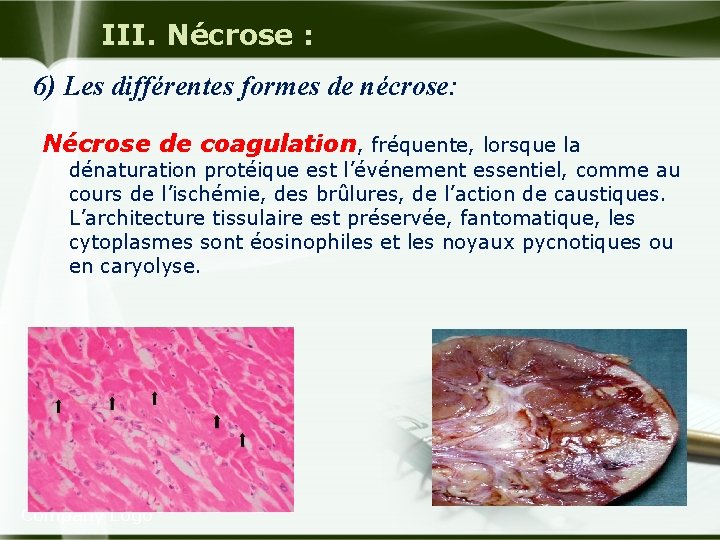
III. Nécrose : 6) Les différentes formes de nécrose: Nécrose de coagulation, fréquente, lorsque la dénaturation protéique est l’événement essentiel, comme au cours de l’ischémie, des brûlures, de l’action de caustiques. L’architecture tissulaire est préservée, fantomatique, les cytoplasmes sont éosinophiles et les noyaux pycnotiques ou en caryolyse. Company Logo

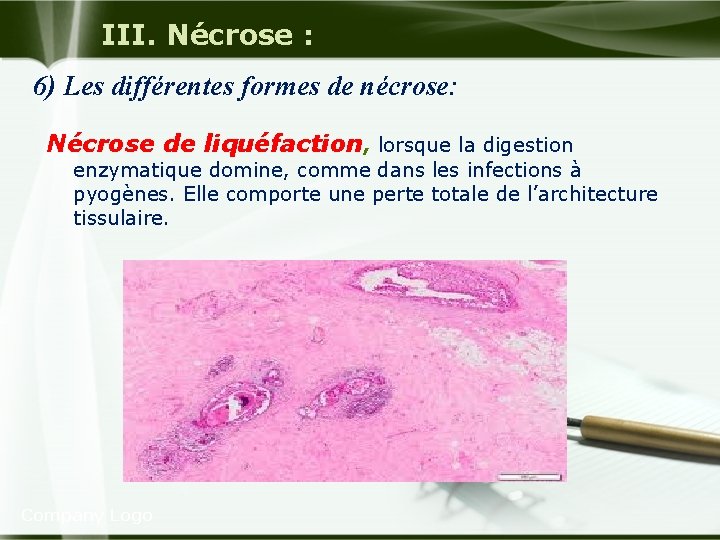
III. Nécrose : 6) Les différentes formes de nécrose: Nécrose de liquéfaction, lorsque la digestion enzymatique domine, comme dans les infections à pyogènes. Elle comporte une perte totale de l’architecture tissulaire. Company Logo

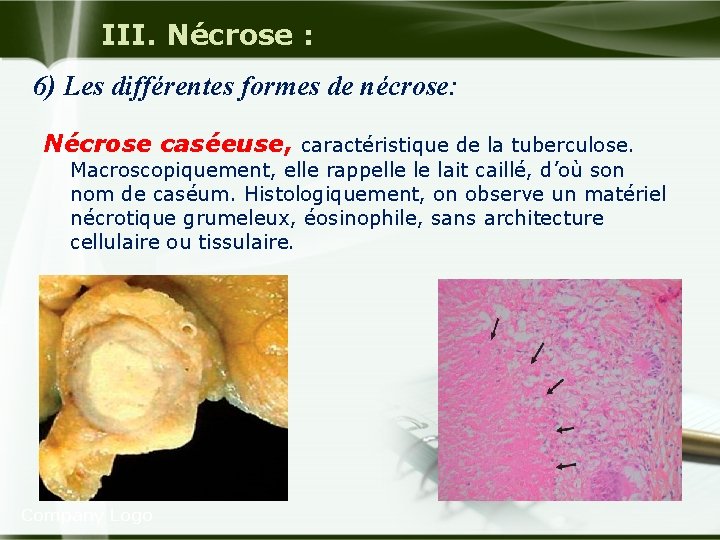
III. Nécrose : 6) Les différentes formes de nécrose: Nécrose caséeuse, caractéristique de la tuberculose. Macroscopiquement, elle rappelle le lait caillé, d’où son nom de caséum. Histologiquement, on observe un matériel nécrotique grumeleux, éosinophile, sans architecture cellulaire ou tissulaire. Company Logo

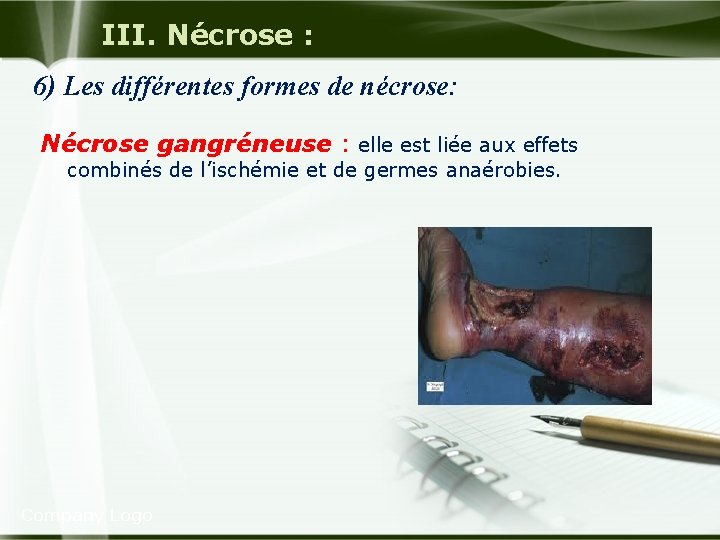
III. Nécrose : 6) Les différentes formes de nécrose: Nécrose gangréneuse : elle est liée aux effets combinés de l’ischémie et de germes anaérobies. Company Logo

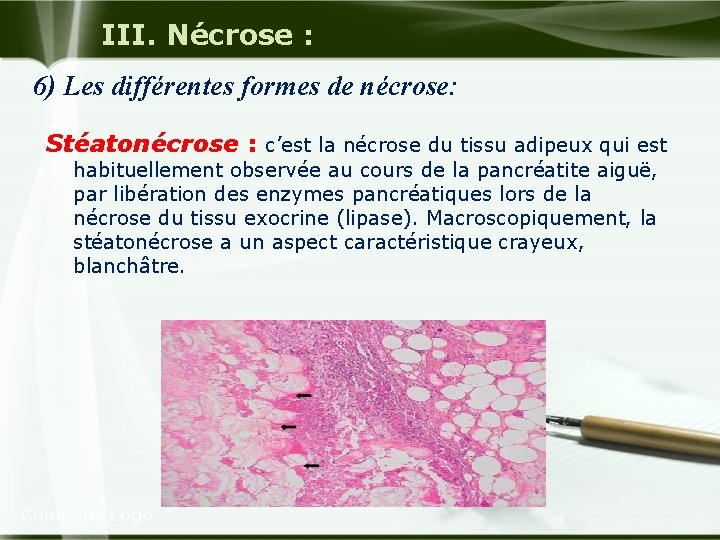
III. Nécrose : 6) Les différentes formes de nécrose: Stéatonécrose : c’est la nécrose du tissu adipeux qui est habituellement observée au cours de la pancréatite aiguë, par libération des enzymes pancréatiques lors de la nécrose du tissu exocrine (lipase). Macroscopiquement, la stéatonécrose a un aspect caractéristique crayeux, blanchâtre. Company Logo

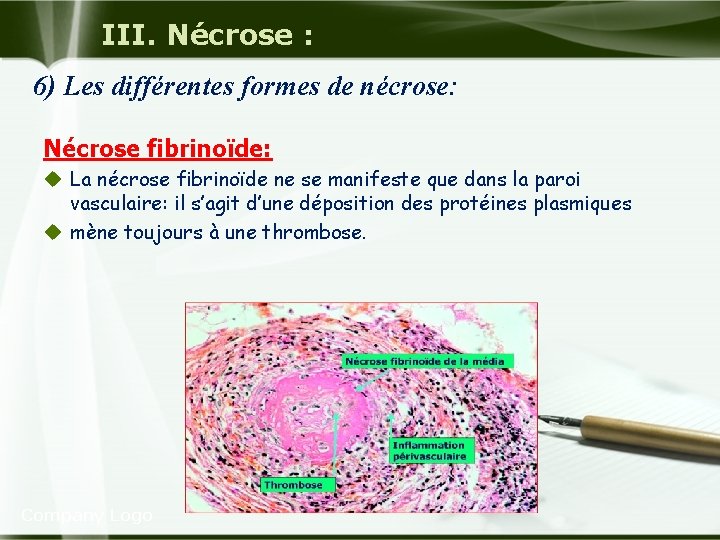
III. Nécrose : 6) Les différentes formes de nécrose: Nécrose fibrinoïde: u La nécrose fibrinoïde ne se manifeste que dans la paroi vasculaire: il s’agit d’une déposition des protéines plasmiques u mène toujours à une thrombose. Company Logo

III. Nécrose : 7) Evolution de la nécrose: u Habituellement la nécrose, quelle qu’elle soit, induit une réaction inflammatoire commune autour des cellules nécrosées, et selon la localisation, l’étendue, et la cause on aboutit soit à une restitution soit à une cicatrice. Company Logo

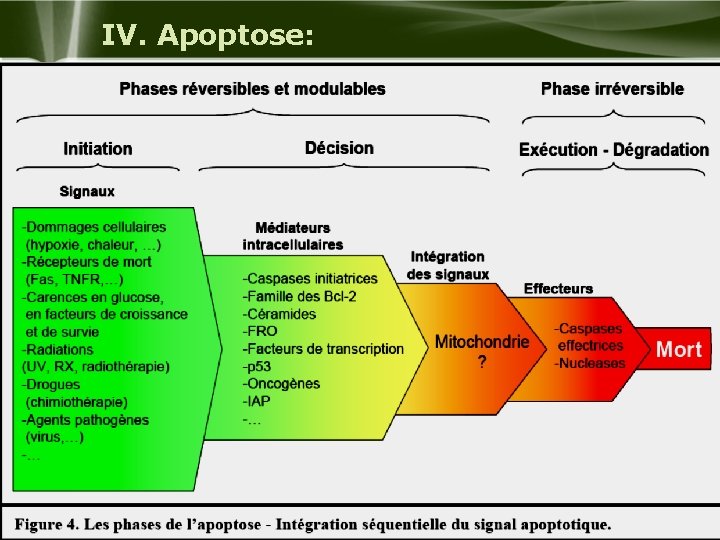
IV. Apoptose: 1 - Définition : Ø L’apoptose est la mort cellulaire programmée. Nommée ainsi d’après le terme grec « tombé » elle fut individualisée en 1973 (Schweichel et Merker) pour qualifier la mort cellulaire destinée à éliminer des cellules indésirables. Ø Elle concerne des cellules isolées, et non pas des groupes de cellules comme dans la nécrose. Ø La mort cellulaire programmée est le plus souvent un mécanisme physiologique de « suicide » cellulaire essentiel au développement, à la maturation, et au renouvellement normal des tissus. Ø C’est un processus actif nécessitant des signaux d’activation, une transduction de signal, l’expression de gènes et une synthèse protéique. Company Logo

IV. Apoptose: 1 - Définition : u Par opposition à la nécrose, la mort cellulaire programmée nécessite un contrôle cellulaire qui s’établit, par l’intermédiaire d’une panoplie de molécules. Cette mort fait suite à une variété de stimuli environnementaux, physiologiques ou pathologiques afin d’éliminer les cellules inutiles, en excès, infectées ou endommagées. u La mort cellulaire programmée est reconnue comme étant essentielle dans le développement et dans les mécanismes de défense chez tous les organismes. Company Logo

IV. Apoptose: Company Logo

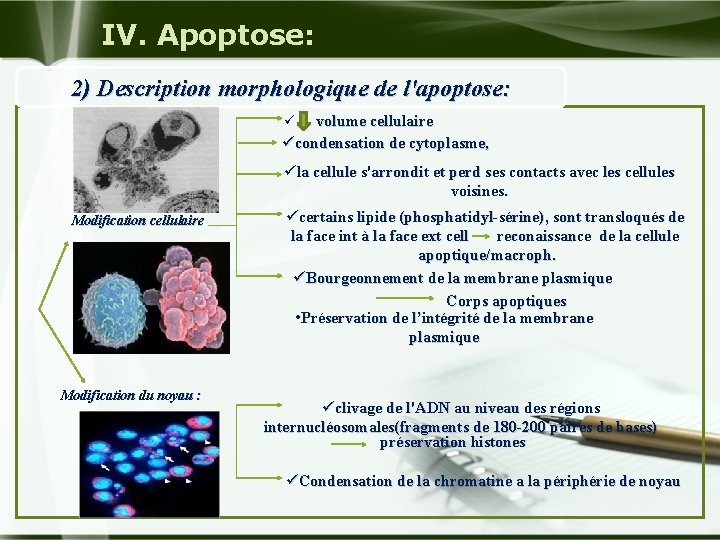
IV. Apoptose: 2) Description morphologique de l'apoptose: ü volume cellulaire ücondensation de cytoplasme, üla cellule s'arrondit et perd ses contacts avec les cellules voisines. Modification cellulaire Modification du noyau : ücertains lipide (phosphatidyl-sérine), sont transloqués de la face int à la face ext cell reconaissance de la cellule apoptique/macroph. üBourgeonnement de la membrane plasmique Corps apoptiques • Préservation de l’intégrité de la membrane plasmique üclivage de l'ADN au niveau des régions internucléosomales(fragments de 180 -200 paires de bases) préservation histones üCondensation de la chromatine a la périphérie de noyau

IV. Apoptose: Company Logo

IV. Apoptose: 3) Facteurs d’initiation de l’apoptose: Øl'altération des fonctions cellulaires et/ou modification de l'environnement normal de la cellule: • concentration des radicaux libres, • un choc thermique, • concentration intracellulaire de calcium ou un défaut métabolique. Exemple: modification génotoxique de l'ADN l'activation de la protéine p 53 1. réparation de l'ADN. arrêt du cycle cellulaire l'induction de la transcription de protéines en cas echec 2. proapoptotiques cellule mutante est éliminée par apoptose. Øla réception d'un signal de « mort » : • L'apoptose peut être induite dans certaines conditions physiologiques par une famille de ligands extracellulaires de la famille du Tumor Necrosis Factor (TNF). Exemple: • destruction des lymphocytes auto-réactifs

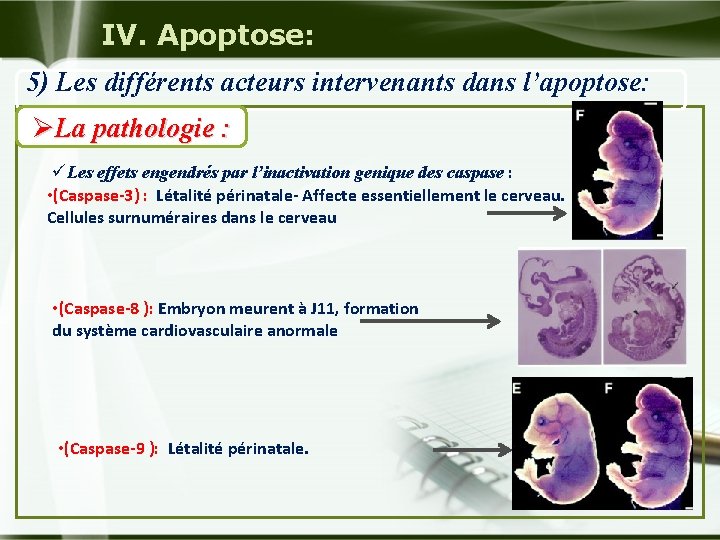
IV. Apoptose: 5) Les différents acteurs intervenants dans l’apoptose: ØLa pathologie : üLes effets engendrés par l’inactivation genique des caspase : • (Caspase-3) : Létalité périnatale- Affecte essentiellement le cerveau. Cellules surnuméraires dans le cerveau • (Caspase-8 ): Embryon meurent à J 11, formation du système cardiovasculaire anormale • (Caspase-9 ): Létalité périnatale.

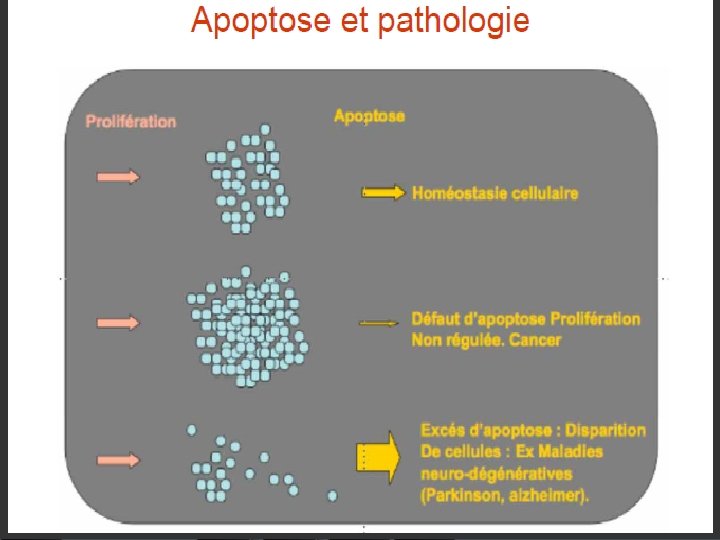
IV. Apoptose: 8) Rôle physiologique de l’apoptose: endommagées ücontrôle de l'homéostasie élimination de cellules en surnombre potentiellement dangereuses üassurance qualité cellulaire üDans la vie embryonnaire: la morphogénèse des organes dépend de l'élimination massive de certaines ébauches selon un mécanisme apoptotique. Souris E 13, 5 j Souris E 14, 5 j la formation des espaces interdigitaux üSystème immunitaire: élimination des clones de lymphocytes auto-réactifs.

Company Logo

V. Conclusion : L'étude, du mécanisme d'action des toxiques présente un aspect essentiel de la toxicologie. En effet, elle permet de prévoir les manifestations pathologiques résultant d'une exposition , de développer des antidotes, de formuler des tests biologiques de détection, et d'étendre nos connaissances sur certains désordres métaboliques de divers processus biochimiques. Company Logo

Company Logo