Curso conceito A Reviso de orgnica Vtor Diniz


















- Slides: 37

Curso conceito A Revisão de orgânica Vítor Diniz

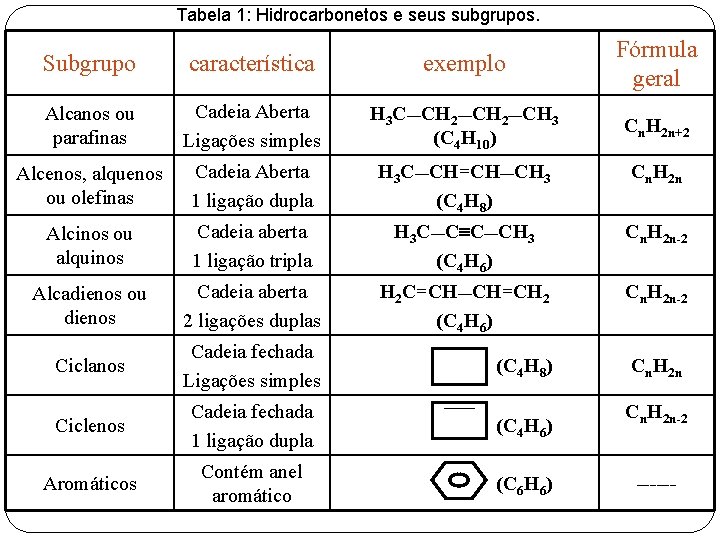
Hidrocarbonetos: subdivisão e nomenclatura �Subdivisões dos hidrocarbonetos Para facilitar o estudo e a nomenclatura dos hidrocarbonetos, eles são divididos em subgrupos ou classes, conforme tabela a seguir:

Tabela 1: Hidrocarbonetos e seus subgrupos. Subgrupo característica exemplo Fórmula geral Alcanos ou parafinas Cadeia Aberta Ligações simples H 3 C—CH 2—CH 3 (C 4 H 10) Cn. H 2 n+2 Alcenos, alquenos ou olefinas Cadeia Aberta 1 ligação dupla H 3 C—CH=CH—CH 3 (C 4 H 8) Cn. H 2 n Alcinos ou alquinos Cadeia aberta 1 ligação tripla H 3 C—C C—CH 3 (C 4 H 6) Cn. H 2 n-2 Alcadienos ou dienos Cadeia aberta 2 ligações duplas H 2 C=CH—CH=CH 2 (C 4 H 6) Cn. H 2 n-2 Ciclanos Cadeia fechada Ligações simples (C 4 H 8) Cn. H 2 n Ciclenos Cadeia fechada 1 ligação dupla (C 4 H 6) Aromáticos Contém anel aromático (C 6 H 6) Cn. H 2 n-2 ------

Os hidrocarbonetos aromáticos costumam ser subdividos em: • Mononucleares: apresentam apenas um anel benzênico CH 3 • Polinucleares: apresentam dois ou mais anéis benzênicos. Polinucleares isolados Polinucleares condensados

Nomenclatura de Hidrocarbonetos de cadeia não-ramificada Os químicos elaboraram um método lógico para dar nome aos compostos orgânicos, pois é impossível decorar tantos nomes diferentes. A nomenclatura de compostos orgânicos segue as regras elaboradas pela IUPAC (União Internacional de Química Pura e Aplicada). Segundo essas regras, o nome de um composto orgânico é formado unindo três fragmentos: PREFIXO + INFIXO + SUFIXO

PREFIXO Indica o número de átomos de carbono presentes na molécula, conforme tabela 2. Tabela 2: Nomenclatura de prefixos Prefixo met et prop No. de carbonos 1 2 3 but pent hex hept oct non 4 5 6 7 8 9 dec 10

INFIXO Indica o tipo de ligação entre os átomos de carbono, conforme tabela 3 Tabela 3: Nomenclatura de infixos Infixo Tipo de ligação an Ligação simples en Ligação dupla in Ligação tripla dien 2 ligações duplas

SUFIXO Indica o grupo de substâncias orgânicas ou função orgânica a que o composto pertence. Tabela 4: Nomenclatura para sufixos Sufixo Indica que o composto é um o Hidrocarboneto ol al Álcool Aldeído ona oico Cetona Ácido carboxílico

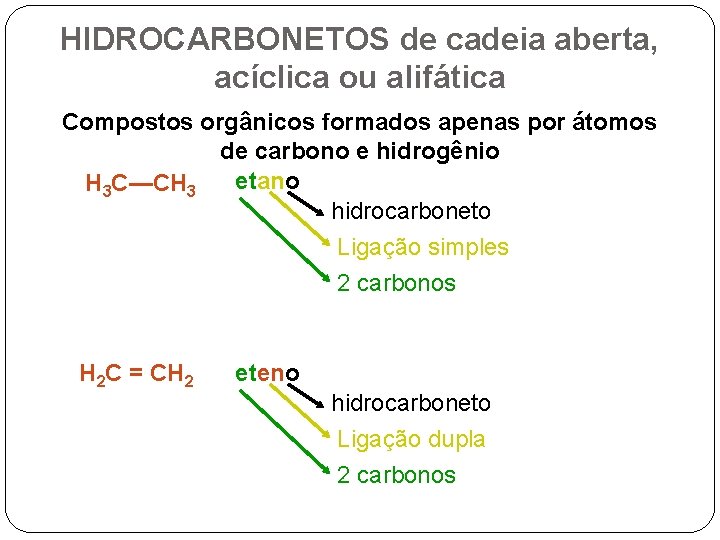
HIDROCARBONETOS de cadeia aberta, acíclica ou alifática Compostos orgânicos formados apenas por átomos de carbono e hidrogênio etano H 3 C—CH 3 hidrocarboneto Ligação simples 2 carbonos H 2 C = CH 2 eteno hidrocarboneto Ligação dupla 2 carbonos

H 2 C CH 2 etino hidrocarboneto Ligação tripla 2 carbonos H 3 C —CH 2 — CH 3 propano hidrocarboneto Ligação simples 3 carbonos

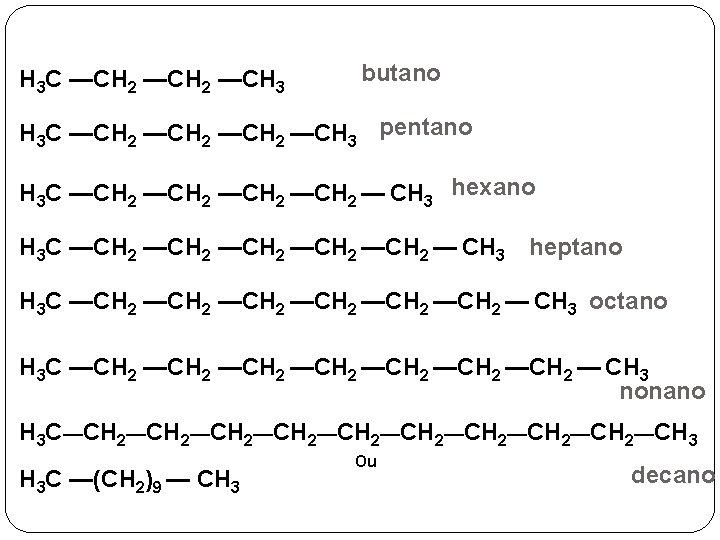
H 3 C —CH 2 —CH 3 butano H 3 C —CH 2 —CH 3 pentano H 3 C —CH 2 — CH 3 hexano H 3 C —CH 2 —CH 2 — CH 3 heptano H 3 C —CH 2 —CH 2 — CH 3 octano H 3 C —CH 2 —CH 2 — CH 3 nonano H 3 C—CH 2—CH 2—CH 2—CH 3 H 3 C —(CH 2)9 — CH 3 Ou decano

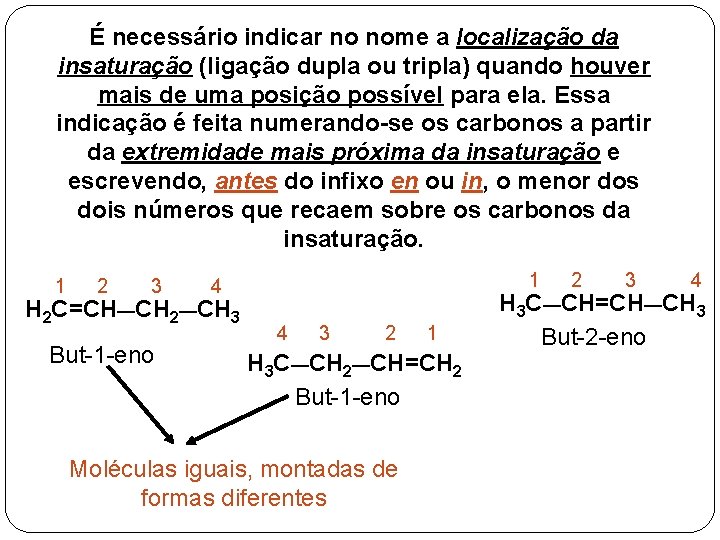
É necessário indicar no nome a localização da insaturação (ligação dupla ou tripla) quando houver mais de uma posição possível para ela. Essa indicação é feita numerando-se os carbonos a partir da extremidade mais próxima da insaturação e escrevendo, antes do infixo en ou in, o menor dos dois números que recaem sobre os carbonos da insaturação. 1 2 3 H 2 C=CH—CH 2—CH 3 But-1 -eno 1 4 4 3 2 1 H 3 C—CH 2—CH=CH 2 But-1 -eno Moléculas iguais, montadas de formas diferentes 2 3 4 H 3 C—CH=CH—CH 3 But-2 -eno

1 2 3 4 H 2 C=CH—CH 2—CH 3 But-1 -eno (CORRETO) 1 2 3 4 H 3 C—CH 2—CH=CH 2 But-3 -eno (INCORRETO) Para o but-1 -eno, o nome but-3 -eno é considerado INCORRETO, pois, de acordo com a regra, a numeração teria começado pela extremidade errada.

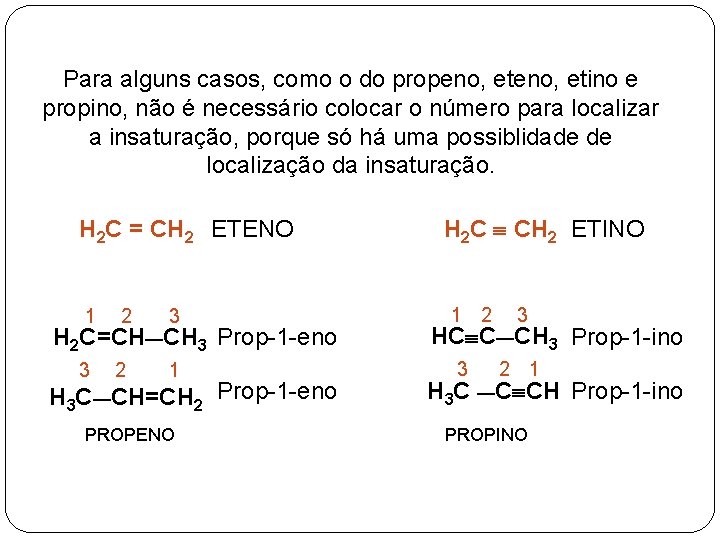
Para alguns casos, como o do propeno, etino e propino, não é necessário colocar o número para localizar a insaturação, porque só há uma possiblidade de localização da insaturação. H 2 C = CH 2 ETENO 1 2 3 3 2 1 H 2 C=CH—CH 3 Prop-1 -eno H 3 C—CH=CH 2 Prop-1 -eno PROPENO H 2 C CH 2 ETINO 1 2 3 HC C—CH 3 Prop-1 -ino 3 2 1 H 3 C —C CH Prop-1 -ino PROPINO

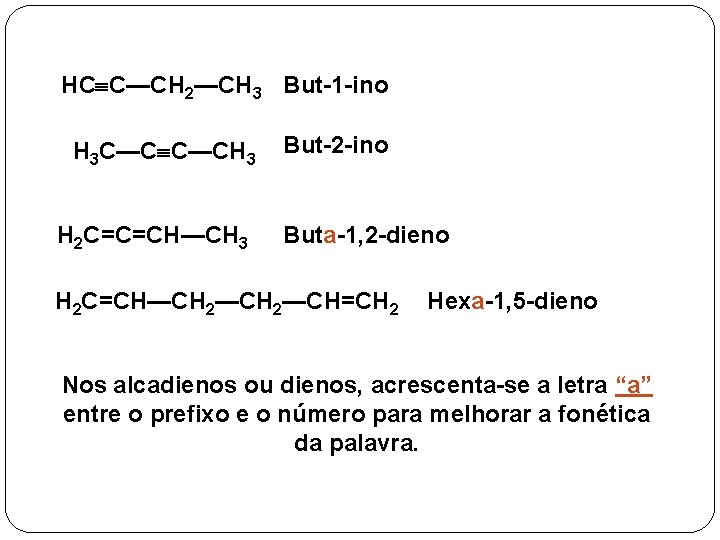
HC C—CH 2—CH 3 But-1 -ino H 3 C—C C—CH 3 H 2 C=C=CH—CH 3 But-2 -ino Buta-1, 2 -dieno H 2 C=CH—CH 2—CH=CH 2 Hexa-1, 5 -dieno Nos alcadienos ou dienos, acrescenta-se a letra “a” entre o prefixo e o número para melhorar a fonética da palavra.

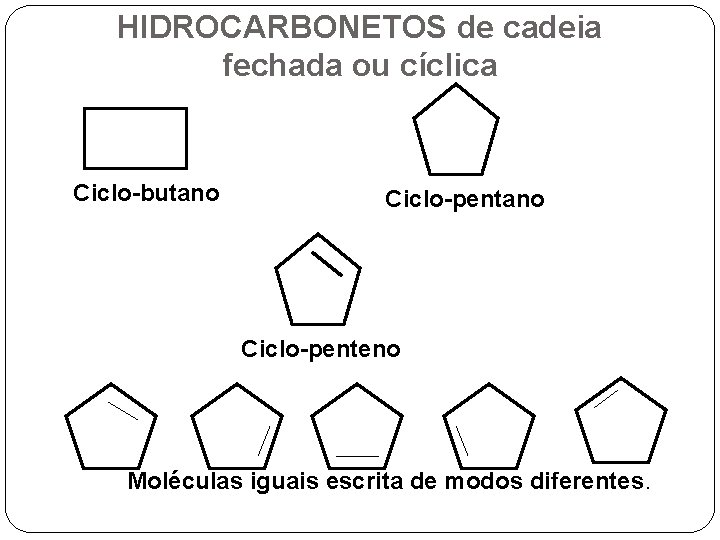
HIDROCARBONETOS de cadeia fechada ou cíclica Ciclo-butano Ciclo-penteno Moléculas iguais escrita de modos diferentes.

Em casos como os seguintes, é necessário localizar as duplas ligações. A numeração deve ser feita de modo que as insaturações sejam representadas com os menores números possíveis. 1 6 5 8 2 4 3 Ciclo-hexa-1, 3 -dieno 1 7 2 6 3 5 4 Ciclo-octa-1, 4 -dieno

Uma visão geral das reações orgânicas Tópicos 1. Rupturas de ligações 2. Classificação dos reagentes 3. Mecanismos de reações orgânicas 4. Classificação das reações orgânicas 5. Diagrama de energia e estado de transição 6. Reações de oxi-redução de orgânicos

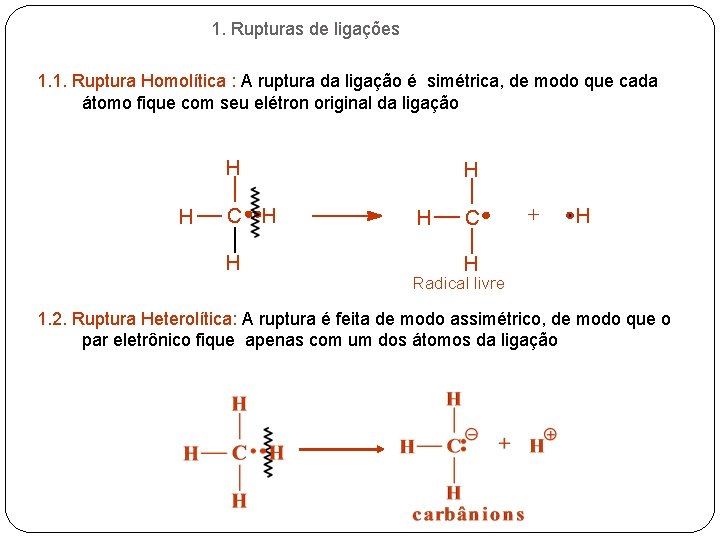
1. Rupturas de ligações 1. 1. Ruptura Homolítica : A ruptura da ligação é simétrica, de modo que cada átomo fique com seu elétron original da ligação H H C + H H Radical livre 1. 2. Ruptura Heterolítica: A ruptura é feita de modo assimétrico, de modo que o par eletrônico fique apenas com um dos átomos da ligação

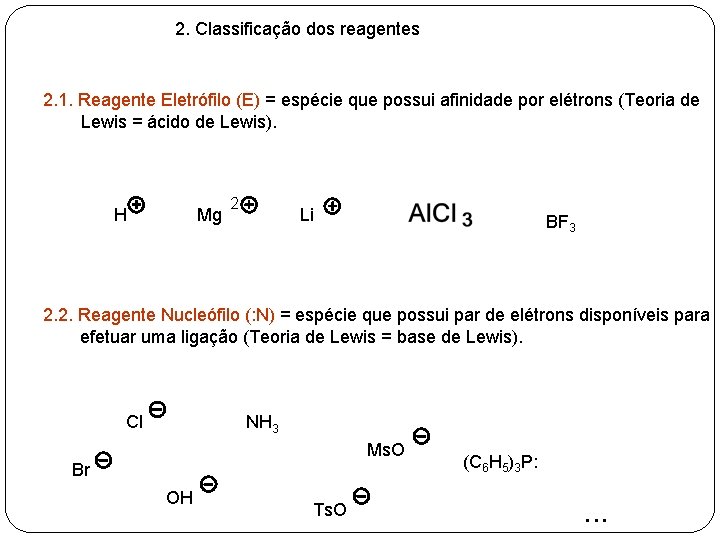
2. Classificação dos reagentes 2. 1. Reagente Eletrófilo (E) = espécie que possui afinidade por elétrons (Teoria de Lewis = ácido de Lewis). H Mg 2 Li BF 3 2. 2. Reagente Nucleófilo (: N) = espécie que possui par de elétrons disponíveis para efetuar uma ligação (Teoria de Lewis = base de Lewis). Cl NH 3 Ms. O Br OH Ts. O (C 6 H 5)3 P: . . .

3. Mecanismos de reações orgânicas É a descrição das várias etapas pelas quais uma reação passa, como a ruptura das ligações, os ataques eletrofílicos e nucleofílicos ao reagente orgânico, a formação de novas ligações e de compostos intermediários

3. 1. Mecanismo via radicais Características dos radicais • Ocorrem em moléculas apolares ou com baixa diferença de eletronegatividade • São eletronicamente neutros • Muito reativos • As reações radicalares não são muito comuns quando comparado a reações polares

3. 1. Mecanismo via radicais Reação H H C H H + Cl luz ou Cl calor H H C Cl H + H Cl

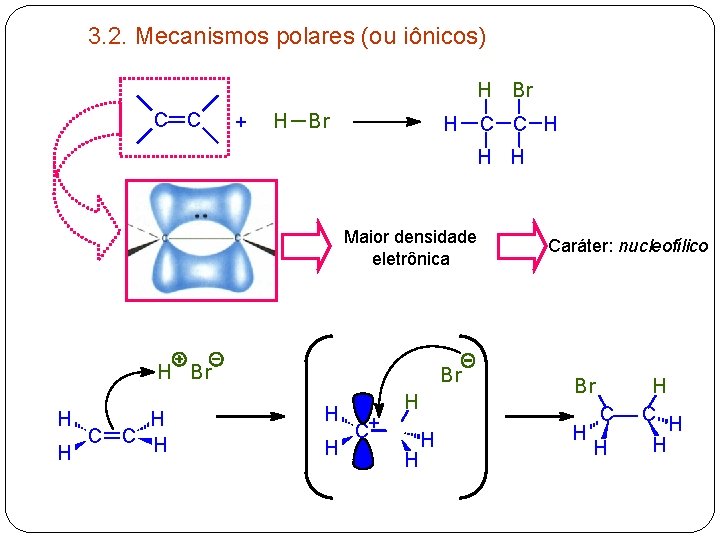
3. 2. Mecanismos polares (ou iônicos) Ocorre em função da distribuição assimétrica dos elétrons devido a diferença de eletronegatividade entre os átomos _ Yd d+ C Y = O, N, Cl, Br, I Md + _ d C Y = Mg ou Li

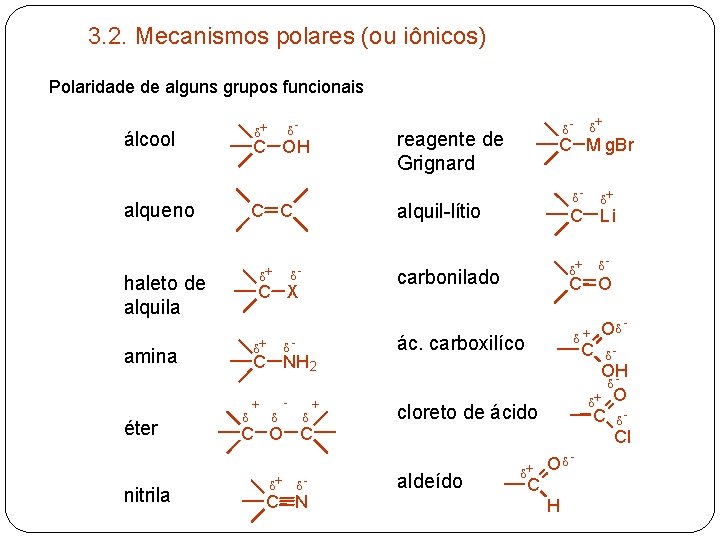
3. 2. Mecanismos polares (ou iônicos) Polaridade de alguns grupos funcionais d+ álcool d+ d amina d - C NH 2 d + d d d + d - C N d - C O d+ ác. carboxilíco C d+ Od d - - OH d d+ O C d. Cl cloreto de ácido aldeído d+ d+ C O C d+ - C Li carbonilado C X d+ C M g. Br alquil-lítio - d+ - d reagente de Grignard C C haleto de alquila nitrila - C OH alqueno éter d Od C H -

3. 2. Mecanismos polares (ou iônicos) H Br C C + H Br H C C H H H Maior densidade eletrônica H Br H H C C H H Br H H C+ H H H Caráter: nucleofílico Br H C H H

4. Classificação das reações orgânicas 4. 1. Reações de adição 4. 2. Reações de substituição 4. 3. Reações de eliminação 4. 4. Reações de rearranjo

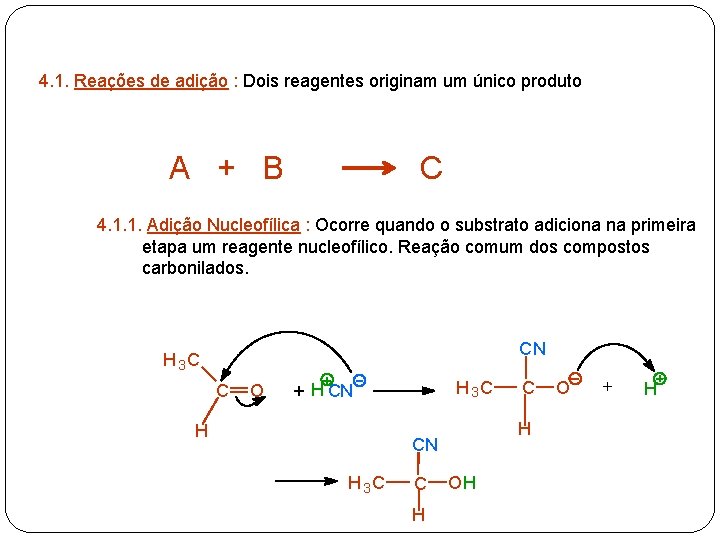
4. 1. Reações de adição : Dois reagentes originam um único produto A + B C 4. 1. 1. Adição Nucleofílica : Ocorre quando o substrato adiciona na primeira etapa um reagente nucleofílico. Reação comum dos compostos carbonilados. CN H 3 C C O H 3 C + H CN H 3 C C H C OH O + H

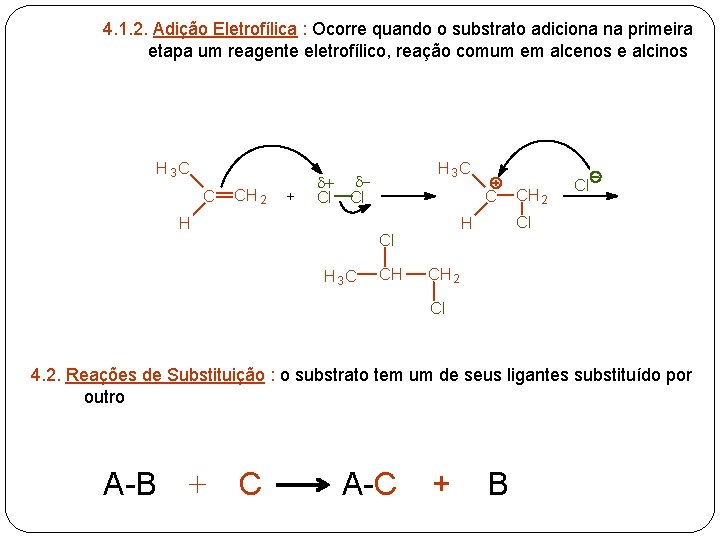
4. 1. 2. Adição Eletrofílica : Ocorre quando o substrato adiciona na primeira etapa um reagente eletrofílico, reação comum em alcenos e alcinos H 3 C C CH 2 + d+ Cl H 3 C d. Cl H C H 3 C CH Cl Cl H Cl CH 2 Cl 4. 2. Reações de Substituição : o substrato tem um de seus ligantes substituído por outro A-B + C A-C + B

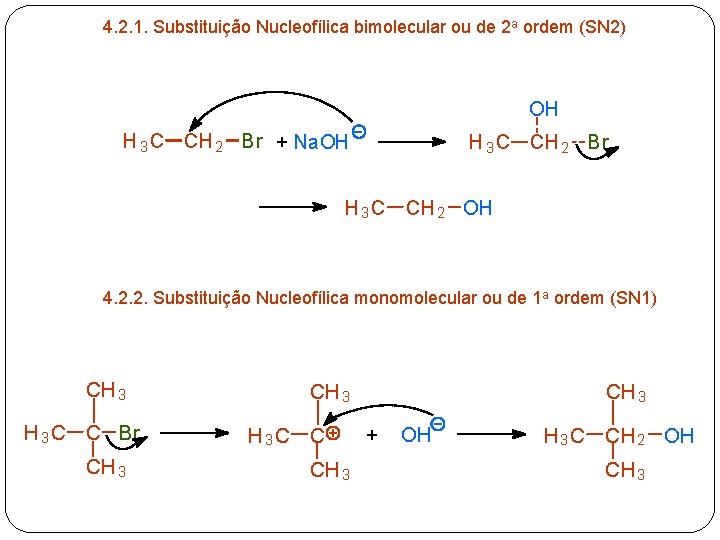
4. 2. 1. Substituição Nucleofílica bimolecular ou de 2 a ordem (SN 2) OH H 3 C CH 2 Br + Na. OH H 3 C CH 2 Br H 3 C CH 2 OH 4. 2. 2. Substituição Nucleofílica monomolecular ou de 1 a ordem (SN 1) CH 3 C C Br CH 3 H 3 C C CH 3 + OH H 3 C CH 2 OH CH 3

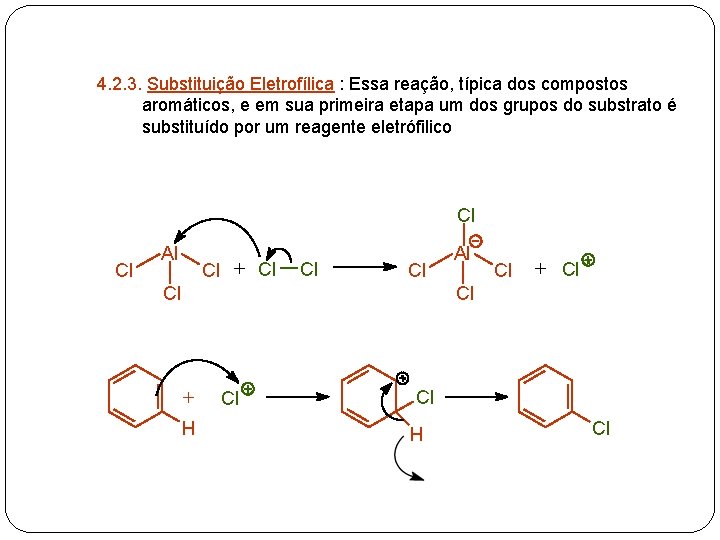
4. 2. 3. Substituição Eletrofílica : Essa reação, típica dos compostos aromáticos, e em sua primeira etapa um dos grupos do substrato é substituído por um reagente eletrófilico Cl Cl Al Cl + Cl Cl Cl + H Cl Cl H Cl

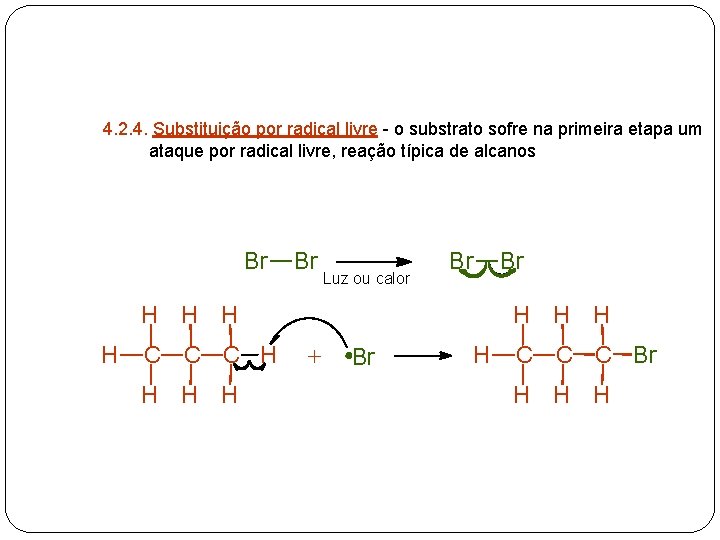
4. 2. 4. Substituição por radical livre - o substrato sofre na primeira etapa um ataque por radical livre, reação típica de alcanos Br H H C C C H H Br + Luz ou calor Br Br H H H C C C Br H H H

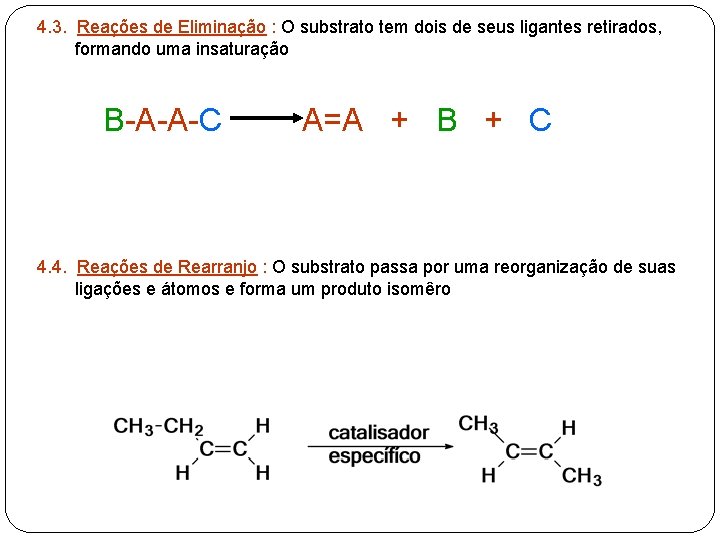
4. 3. Reações de Eliminação : O substrato tem dois de seus ligantes retirados, formando uma insaturação B-A-A-C A=A + B + C 4. 4. Reações de Rearranjo : O substrato passa por uma reorganização de suas ligações e átomos e forma um produto isomêro

5. Diagrama de energia e Estado de Transição H H C C H H Br H C C H H Energia H H H Br H H H C C Br H H Segundo estado de transição Evolução da reação

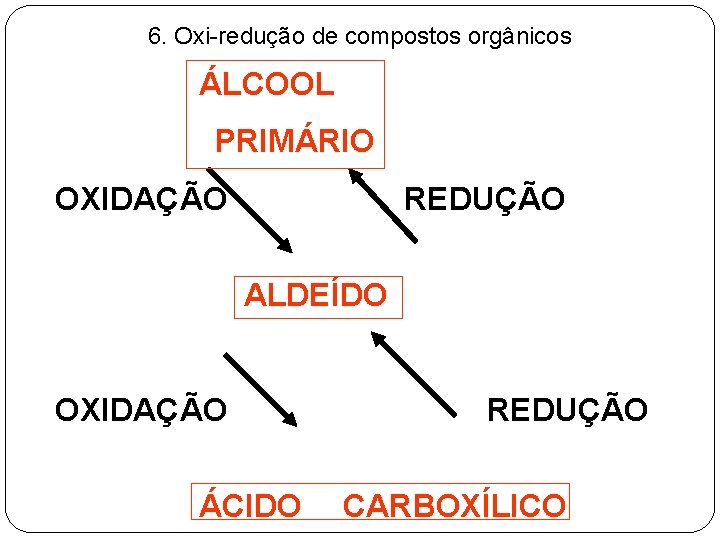
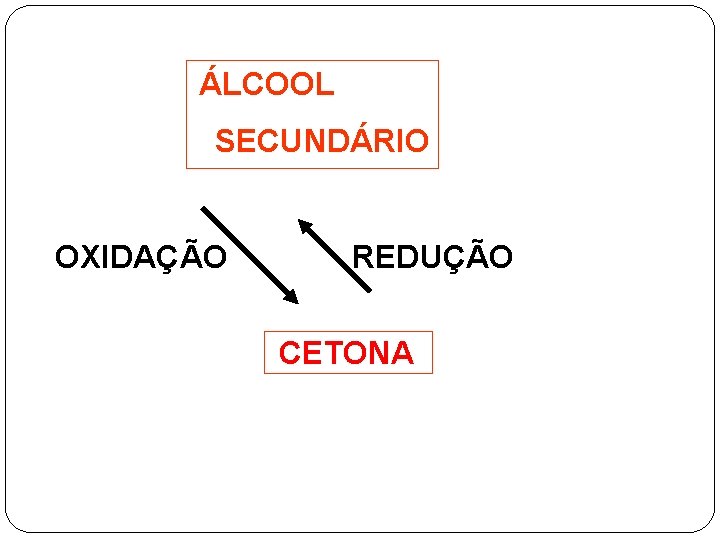
6. Oxi-redução de compostos orgânicos ÁLCOOL PRIMÁRIO OXIDAÇÃO REDUÇÃO ALDEÍDO OXIDAÇÃO ÁCIDO REDUÇÃO CARBOXÍLICO

ÁLCOOL SECUNDÁRIO OXIDAÇÃO REDUÇÃO CETONA

Referências Bibliográficas Mc. Murry, J. Química orgânica, 4ª ed. Livros Técnicos e Científicos Editora S. A. , 1996. Mc. Murry, J. Organic chemistry, 3ª ed. Books/ Cole Publishing Company, 1992 Solomons, T. W. G. Organic Chemistry, John Wiley & Sons, Inc. , 1996.
 Qual é o desejo do poeta
Qual é o desejo do poeta Victor hugo desejos
Victor hugo desejos Reviso software
Reviso software Gravituy
Gravituy Conceito de processo e o conceito de thread
Conceito de processo e o conceito de thread Carmen simone grilo diniz
Carmen simone grilo diniz Esteban duarte diniz
Esteban duarte diniz Curso dns básico
Curso dns básico Definicio
Definicio Curso de modelamiento de base de datos
Curso de modelamiento de base de datos Oración inicio de curso 2020 21
Oración inicio de curso 2020 21 Usmp derecho
Usmp derecho Curso bacula
Curso bacula Curso tecnico em agroecologia
Curso tecnico em agroecologia Curso nacional de atualização em pneumologia
Curso nacional de atualização em pneumologia Curso de circuito fechado de tv
Curso de circuito fechado de tv Diploma fin de curso primaria
Diploma fin de curso primaria Que es ept
Que es ept Curso patrón de lancha deportiva de bahía
Curso patrón de lancha deportiva de bahía Linx microvix
Linx microvix Desde o inicio de seu curso o jovem gerente tinha aprendido
Desde o inicio de seu curso o jovem gerente tinha aprendido Curso bpl laboratorio
Curso bpl laboratorio Curso de evangelismo
Curso de evangelismo Farmacovigilancia curso
Farmacovigilancia curso Dr alejandro guerrero
Dr alejandro guerrero E.p.t curso
E.p.t curso Curso de magnetismo espiritual
Curso de magnetismo espiritual Curso variadores de frecuencia
Curso variadores de frecuencia Sistema sav
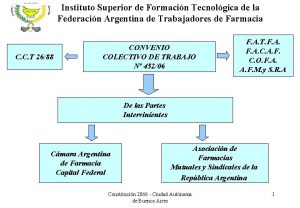
Sistema sav Fatfa curso auxiliar de farmacia
Fatfa curso auxiliar de farmacia El curso favorito de los alumnos de una escuela.
El curso favorito de los alumnos de una escuela. Http://docs.google.com
Http://docs.google.com Diploma fin curso
Diploma fin curso Desenho instrucional
Desenho instrucional Curso word 2007
Curso word 2007 Fisioterapia veterinaria curso
Fisioterapia veterinaria curso Curso siltra
Curso siltra Curso de compiladores
Curso de compiladores