Cu hi 1 Hon thnh s H 3














- Slides: 16

Câu hỏi: (1) Hoàn thành sơ đồ H 3 PO 4 (2) (3) (4) (5) (1) (2) (3) (4) (5) + Quøi tím + H 2 O ? + Oxít KL + Na. OH A + H 2 A A A + CO 2 + H 2 O Dd H 3 PO 4 laøm cho quøi tím hoùa ñoû 2 H 3 PO 4 + 6 Na → 2 Na 3 PO 4+ 3 H 2 2 H 3 PO 4 + 3 Na 2 O → 2 Na 3 PO 4+ 3 H 2 O H 3 PO 4 + 3 Na. OH → Na 3 PO 4+ 3 H 2 O 2 H 3 PO 4 + 3 Na 2 CO 3 → 2 Na 3 PO 4 +3 CO 2+ 3 H 2 O


Muối photphat có 3 loại: �Muối photphat trung hòa �Muối đihiđrophotphat �Muối hiđrophotphat [Mở rộng: quặng Apatit: 3 Ca 3(PO 4)2. Ca. F 2]

I. III. IV. TÍNH CHẤT VẬT LÝ TÍNH CHẤT HÓA HỌC NHẬN BIẾT ION PHOTPHAT ĐIỀU CHẾ

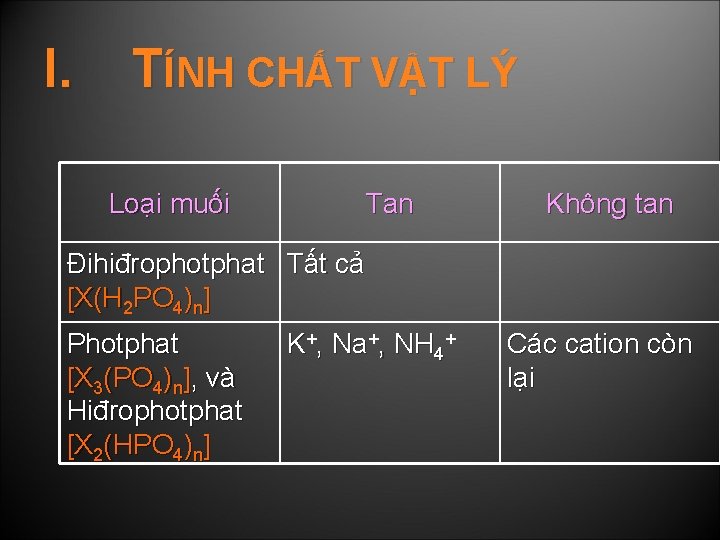
I. TÍNH CHẤT VẬT LÝ Loại muối Tan Không tan Đihiđrophotphat Tất cả [X(H 2 PO 4)n] Photphat [X 3(PO 4)n], và Hiđrophotphat [X 2(HPO 4)n] K+, Na+, NH 4+ Các cation còn lại

II. 1. 2. TÍNH CHẤT HÓA HỌC Sự thủy phân Phản ứng trao đổi

II. 1. Sự TÍNH CHẤT HÓA HỌC thủy phân PO 43 - + H 2 O HPO 42 - + OH(1) HPO 42 - + H 2 O H 2 PO 4 - + OH(2) H 2 PO 4 + H 2 O H 3 PO 4 + OH (3) hoặc: PO 43 - + 3 H 2 O H 3 PO 4 + 3 OHHPO 42 - + 2 H 2 O H 3 PO 4 + 2 OHVậy: Đối với muối tạo thành từ ion kim loại mạnh thì môi trường của dd muối sẽ có tính bazơ. Đối với muối tạo thành từ ion kim loại yếu hoặc NH 4+ thì môi trường của dd muối sẽ phụ thuộc vào độ thủy phân của hai ion (vì lúc đó, ion kim loại yếu hoặc NH 4+ cũng sẽ thủy phân tạo H+) Vd: Na 3 PO 4 + H 2 O Na 2 HPO 4 + Na. OH (NH 4)3 PO 4 NH 4+ + H 2 O PO 43 - + 3 H 2 O H+ + OH(NH 4)3 PO 4 + 3 H 2 O → 3 NH 4+ + PO 43 NH 4 OH + H+ H 3 PO 4 + 3 OHH 2 O 3 NH 4 OH + H 3 PO 4

II. 2. Phản TÍNH CHẤT HÓA HỌC ứng trao đổi - Tác dụng với dd muối khác - Tác dụng với dd kiềm - Tác dụng với axit a)Tác dụng với dung dịch muối khác: 2 chất tham gia là những muối tan và sản phẩm phải là chất điện li yếu (kết tủa, khí, …) Vd: Na 3 PO 4 + 3 Ag. NO 3 → Ag PO ↓ + 3 Na. NO 3 3 Ba. Cl 2 + 2 Na 3 PO 4 → 3 4 Ba 3(PO 4)2↓ + 6 Na. Cl Ca(H 2 PO 4)2 + 6 Ag. NO 3 → 2 Ag 3 PO 4↓ + Ca(NO 3)2 + 4 HNO 3 ( Phản ứng III xảy ra vì H 2 PO 4 - + 2 H 2 O PO 43 - +2 H 3 O+ sau đó PO 43 - + 3 Ag+ → Ag 3 PO 4↓)

II. TÍNH CHẤT HÓA HỌC Vậy đối với dạng axit của muối photphat, ta có dạng pứ: A+B→C+D+E Trong đó: A: là muối đihiđrophotphat của tất cả các KL hoặc là muối hiđrophotphat của KL kiềm và amôni. B: là muối tan của các cation (ngoại trừ KL kiềm và amôni) C, D: là hai sản phẩm muối trung hòa của phản ứng trao đổi. E: là axit được tạo thành từ ion (-) của muối B. Vd: Na 2 HPO 4 + Ba. Cl 2 → Ba 3(PO 4)2↓ + 4 Na. Cl + 2 HCl 2 3

II. b) Tác TÍNH CHẤT HÓA HỌC dụng với dung dịch kiềm: Điều kiện đối với chất tham gia: cả muối và bazơ đều tan (lưu ý tính tan của các loại muối photphat ở phần I). Chú ý: H 2 PO 4 - + 2 OHPO 43 - + 2 H 2 O HPO 42 - + OHPO 43 - + H 2 O → Muối axit (tan) + Bazơ (tan) → muối trung hòa + H 2 O Đặt tên cation tạo thành muối photphat là Xn+ phản ứng chỉ xảy ra khi: Đối với [X 3(PO 4)n]: Xn+: NH 4+ Vd: (NH 4)3 PO 4 + 3 Na. OH → Na 3 PO 4 + 3 NH 3↑ + 3 H 2 O Đối với [X 2(HPO 4)n]: Xn+: Na+, K+, NH 4+ Vd: 3 Na 2 HPO 4 + 3 KOH → 2 Na 3 PO 4 + K 3 PO 4 + 3 H 2 O Đối với [X(H 2 PO 4)n]: tất cả các ion kim Vd: 3 Ca(H 2 PO 4)2 + 6 Ba(OH)2 → loại và NH 4+ Ca 3(PO 4)2↓ + 2 Ba 3(PO 4)2↓ + 6 H 2 O

II. c) TÍNH CHẤT HÓA HỌC Tác dụng axit: Điều kiện: axit tham gia phản ứng là chất điện li mạnh hơn H 3 PO 4 (hoặc là chính H 3 PO 4). Chú ý: PO 43+ H+ HPO 42 - + H+ H 2 PO 4 - + H+ H 3 PO 4 Vd: Ca 3(PO 4)2 + 3 H 2 SO 4 → 2 H 3 PO 4 + 3 Ca. SO 4 hoặc Ca 3(PO 4)2 + 2 H 2 SO 4 → Ca(H 2 SO 4)2 + 2 Ca. SO 4 (có thể thay H 2 SO 4 bằng HCl) Ca 3(PO 4)2 + 4 H 3 PO 4 → 3 Ca(H 2 PO 4)2 Ngoài ra, Ca 3(PO 4)2 cũng phản ứng với Si. O 2 và C ở nhiệt độ cao: Ca 3(PO 4)2 + 3 Si. O 2 + 5 C → 3 Ca. Si. O 3 + 5 CO↑ + 2 P(hơi) 2000 o. C

III. NHẬN BIẾT ION PHOTPHAT Ta nhận biết các muối photphat chủ yếu dựa vào tính tan và tính chất hóa học của các muối photphat. Đối với muối PO 43 - người ta thường dùng Ag+ (Ag. NO 3, …) vì sản phẩm có Ag 3 PO 4 là kết tủa vàng tan trong axit. 3 Ag+ + PO 43 - → Ag 3 PO 4↓ Hoặc dùng Ba 2+ vì tạo ↓ trắng: Ba 2+ + PO 43 - → Ba 3(PO 4)2↓ Ngoài ra người ta cũng dựa vào tính chất hóa học: tác dụng với axit, tác dụng với bazơ của muối photphat.

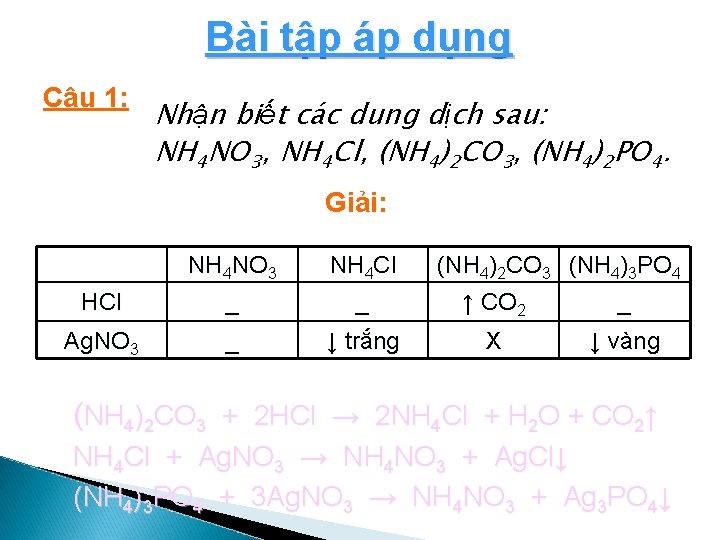
Bài tập áp dụng Câu 1: Nhận biết các dung dịch sau: NH 4 NO 3, NH 4 Cl, (NH 4)2 CO 3, (NH 4)2 PO 4. Giải: NH 4 NO 3 NH 4 Cl (NH 4)2 CO 3 (NH 4)3 PO 4 HCl _ _ ↑ CO 2 _ Ag. NO 3 _ ↓ trắng X ↓ vàng (NH 4)2 CO 3 + 2 HCl → 2 NH 4 Cl + H 2 O + CO 2↑ NH 4 Cl + Ag. NO 3 → NH 4 NO 3 + Ag. Cl↓ (NH 4)3 PO 4 + 3 Ag. NO 3 → NH 4 NO 3 + Ag 3 PO 4↓

IV. ĐIỀU CHẾ Trong phòng thí nghiệm, ta có thể dễ dàng điều chế muối photphat (dựa vào tính tan của muối) từ bazơ, axit, … hay từ photpho như chuỗi phản ứng sau: 4 P + 5 O 2 2 P 2 O 5 to → P 2 O 5 + 3 H 2 O → 2 H 3 PO 4 + 3 Ca(OH)2 → Ca 3(PO 4)2 + 6 H 2 O

Bài tập Từ quặng phophoric có thể điều chế axit photphoric theo sơ đồ sau: t , Si. O Quặng phophoric → Pt → P 2 O 5 → H 3 PO 4 Tính khối lượng bột quặng 73% Ca 3(PO 4)2 cần để sản xuất 1, 96 tấn H 3 PO 4 50% (hiệu suất 90%) o o 2 Giải: , Si. O P → t Ca 3(PO 4)2 t → P 2 O 5 → H 3 PO 4 m(1 mol): 310(g) → 98(g) o m(thực): m. H 3 PO 4 3, 1(tấn) 2 o ← 0, 98(tấn) cần sản xuất = (1, 96. 50)/100 = 0, 98 (tấn) m. Ca 3(PO 4)2 cần bđ = (3, 1. 100)/90 = 3, 44 (tấn) mquặng photphoric cần = (3, 44. 100)/73 = 4, 7 (tấn)

Bài thuyết trình của nhóm đến đây xin được kết thúc, cám ơn cô và các bạn đã chú ý theo dõi.