CP NHT IU TR UNG TH I TRC














![HIỆU QUẢ KHÁNG EGFR TRONG ĐIỀU TRỊ BƯỚC 1 Nghiên cứu CRYSTAL[1] COIN[2] NORDIC HIỆU QUẢ KHÁNG EGFR TRONG ĐIỀU TRỊ BƯỚC 1 Nghiên cứu CRYSTAL[1] COIN[2] NORDIC](https://slidetodoc.com/presentation_image_h/ea04a6d7a38ee67626ea14609fd80be9/image-30.jpg)

- Slides: 46

CẬP NHẬT ĐIỀU TRỊ UNG THƯ ĐẠI TRỰC TRÀNG TỪ ASCO và ESMO 2017 XU HƯỚNG CÁ THỂ HÓA ĐIỀU TRỊ BS. CK 2. Nguyễn Ngọc Anh Trưởng khoa Khoa Ung bướu

CẬP NHẬT HOÁ TRỊ BỔ TRỢ UNG THƯ ĐẠI TRỰC TRÀNG GIAI ĐOẠN SỚM

Các yếu tố tiên lượng carcinôm đại tràng • Giai đoạn lâm sàng: yếu tố quan trọng nhất • Tổng số hạch khảo sát • Độ mô học CEA Các yếu tố tiên lượng khác: • • Tắc ruột hay thủng ruột – Dạng đại thể của bướu – Xâm nhiễm mạch máu hay mạch bạch huyết, xâm nhiễm quanh thần kinh … – 3

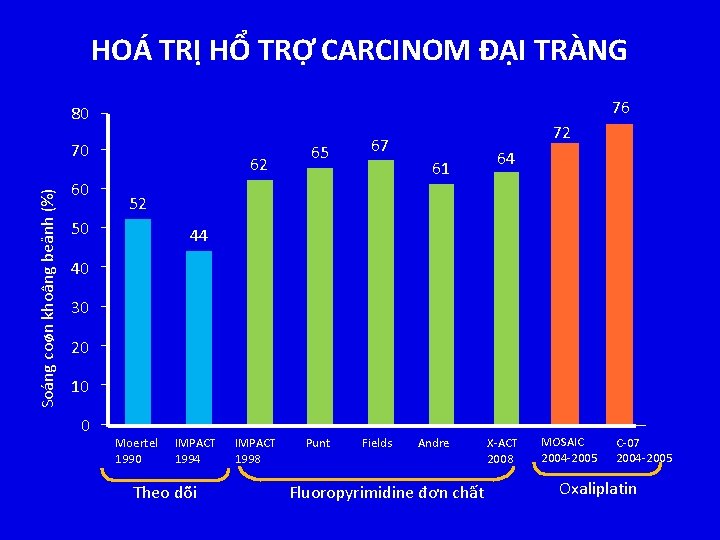
HOÁ TRỊ HỔ TRỢ CARCINOM ĐẠI TRÀNG 76 80 Soáng coøn khoâng beänh (%) 70 60 62 65 72 67 61 64 52 50 44 40 30 20 10 0 Moertel 1990 IMPACT 1994 Theo dõi IMPACT 1998 Punt Fields Andre Fluoropyrimidine đơn chất X-ACT 2008 MOSAIC 2004 -2005 C-07 2004 -2005 Oxaliplatin

IDEA: Phân tích Tổng hợp hóa trị hỗ trợ Oxaliplatin 3 tháng so với 6 tháng trong Ung thư đại tràng gđ III 5

IDEA: CƠ SỞ NGHIÊN CỨU • Điều trị tiêu chuẩn UT ĐT Gđ III: phác đồ có oxaliplatin 6 tháng (FOLFOX 4/m. FOLFOX 6, CAPOX)[1] Độc tính TK liên quan liều tích lũy oxaliplatin[2] Độc tính TK Grade 3 /12. 5% bn ĐT FOLFOX/6 tháng[3] • ↓ thời gian ĐT mà không ↓hiệu quả & ↓ sử dụng nguồn lực • NC IDEA phân tích để xác định có hay không HT hỗ trợ phác đồ có oxaliplatin 3 tháng không thấp hơn sv 6 tháng/ bn UT ĐT gđ III[4] 1. André T, et al. Curr Colorectal Cancer Rep. 2013; 9: 261 -269. 2. Park SB, et al. CA Cancer J Clin. 2013; 63: 419 -437. 3. André T, et al. J Clin Oncol. 2009; 27: 3109 -3116. 4. Shi Q, et al. ASCO 2017. Abstract LBA 1.

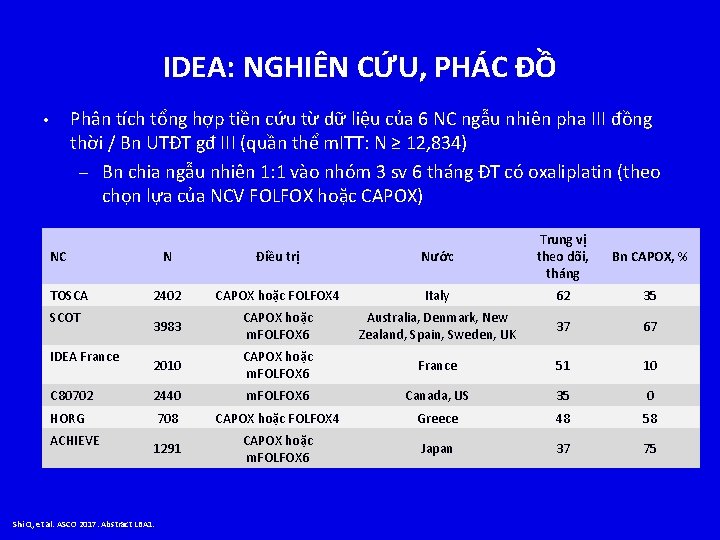
IDEA: NGHIÊN CỨU, PHÁC ĐỒ Phân tích tổng hợp tiền cứu từ dữ liệu của 6 NC ngẫu nhiên pha III đồng thời / Bn UTĐT gđ III (quần thể m. ITT: N ≥ 12, 834) – Bn chia ngẫu nhiên 1: 1 vào nhóm 3 sv 6 tháng ĐT có oxaliplatin (theo chọn lựa của NCV FOLFOX hoặc CAPOX) • N Điều trị Nước Trung vị theo dõi, tháng 2402 CAPOX hoặc FOLFOX 4 Italy 62 35 3983 CAPOX hoặc m. FOLFOX 6 Australia, Denmark, New Zealand, Spain, Sweden, UK 37 67 2010 CAPOX hoặc m. FOLFOX 6 France 51 10 C 80702 2440 m. FOLFOX 6 Canada, US 35 0 HORG 708 CAPOX hoặc FOLFOX 4 Greece 48 58 1291 CAPOX hoặc m. FOLFOX 6 Japan 37 75 NC TOSCA SCOT IDEA France ACHIEVE Shi Q, et al. ASCO 2017. Abstract LBA 1. Bn CAPOX, %

IDEA: CÁC KẾT CỤC NGHIÊN CỨU • Kết cuộc chính: DFS / quần thể m. ITT* – • Phân tích phân nhóm theo phác đồ, nhóm nguy cơ Các kết cuộc phụ: tuân thủ ĐT, tính an toàn *Nhận ≥ 1 liều thuốc NC. Shi Q, et al. ASCO 2017. Abstract LBA 1.

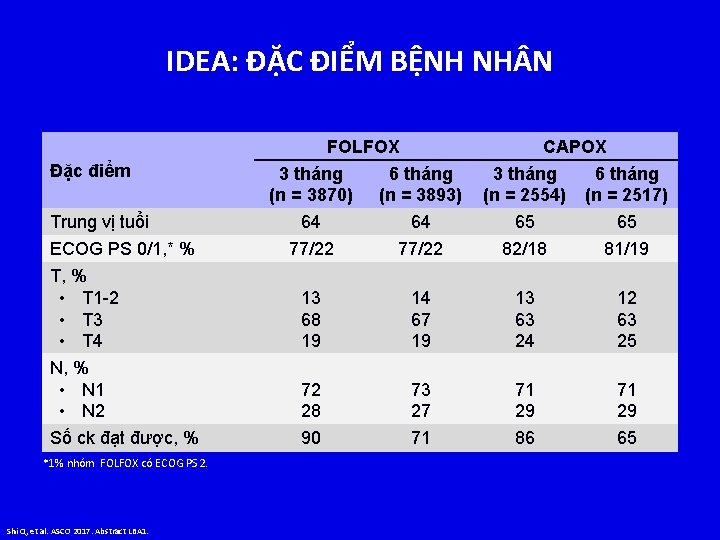
IDEA: ĐẶC ĐIỂM BỆNH NH N FOLFOX Đặc điểm CAPOX 3 tháng (n = 3870) 6 tháng (n = 3893) 3 tháng (n = 2554) 6 tháng (n = 2517) 64 64 65 65 77/22 82/18 81/19 T, % • T 1 -2 • T 3 • T 4 13 68 19 14 67 19 13 63 24 12 63 25 N, % • N 1 • N 2 72 28 73 27 71 29 Số ck đạt được, % 90 71 86 65 Trung vị tuổi ECOG PS 0/1, * % *1% nhóm FOLFOX có ECOG PS 2. Shi Q, et al. ASCO 2017. Abstract LBA 1.

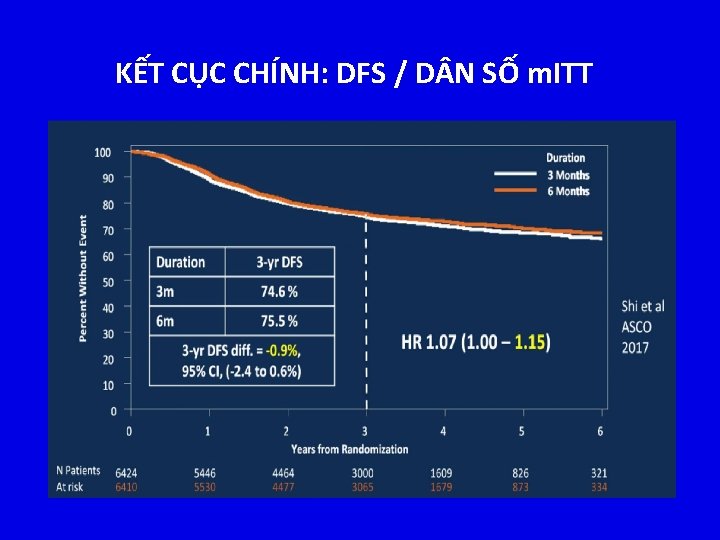
KẾT CỤC CHÍNH: DFS / D N SỐ m. ITT

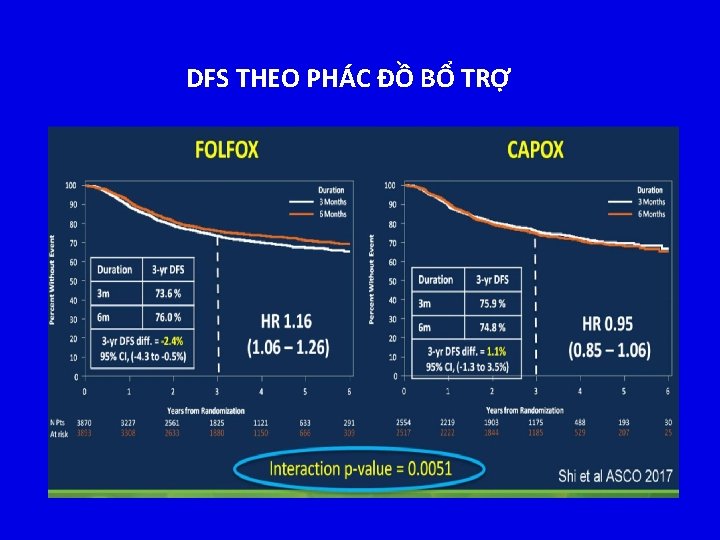
DFS THEO PHÁC ĐỒ BỔ TRỢ

IDEA: DFS/ QUẦN THỂ D N SỐ m. ITT, PH N NHÓM NGUY CƠ ĐT oxaliplatin 3 tháng không thua kém sv 6 tháng không được chứng minh – DFS HR: 1. 07 (95% CI: 1. 00 -1. 15) – Khác biệt DFS 3 năm: -0. 9% (95% CI: -2. 4% - 0. 6%) Tỉ lệ DFS 3 năm khác biệt 20% giữa nhóm nguy cơ thấp (T 1 -3, N 1) sv nguy cơ cao (T 4 or N 2) Nhóm nguy cơ T 1 -3, N 1 T 4 or N 2 HR 3 tháng tốt hơn 6 tháng tốt hơn 1. 01 1. 12 . 11 0. 5 Shi Q, et al. ASCO 2017. Abstract LBA 1. Reproduced with permission. P 1 1. 12 HR 1. 5

IDEA: DFS THEO NHÓM NGUY CƠ & PHÁC ĐỒ BỔ TRỢ Nhóm nguy cơ Phác đồ 3 tháng tốt hơn 6 tháng tốt hơn HR (95% CI) T 1 -3, N 1 FOLFOX CAPOX Không chứng minh Không thấp hơn 1. 10 (0. 96 -1. 26) 0. 85 (0. 71 -1. 01) T 4 or N 2 FOLFOX CAPOX Thấp hơn Không chứng minh 1. 20 (1. 07 -1. 35) 1. 02 (0. 89 -1. 17) HR 1. 0 1. 12 Ranh giới không thấp hơn Noninferiority margin Shi Q, et al. ASCO 2017. Abstract LBA 1. Reproduced with permission.

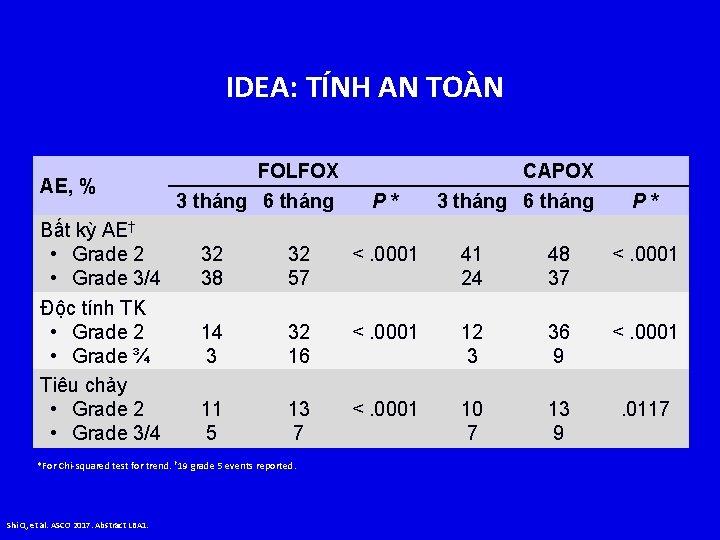
IDEA: TÍNH AN TOÀN AE, % Bất kỳ AE† • Grade 2 • Grade 3/4 Độc tính TK • Grade 2 • Grade ¾ Tiêu chảy • Grade 2 • Grade 3/4 FOLFOX 3 tháng 6 tháng P* 32 38 32 57 <. 0001 41 24 48 37 <. 0001 14 3 32 16 <. 0001 12 3 36 9 <. 0001 11 5 13 7 <. 0001 10 7 13 9 . 0117 *For Chi-squared test for trend. † 19 grade 5 events reported. Shi Q, et al. ASCO 2017. Abstract LBA 1. P* CAPOX 3 tháng 6 tháng

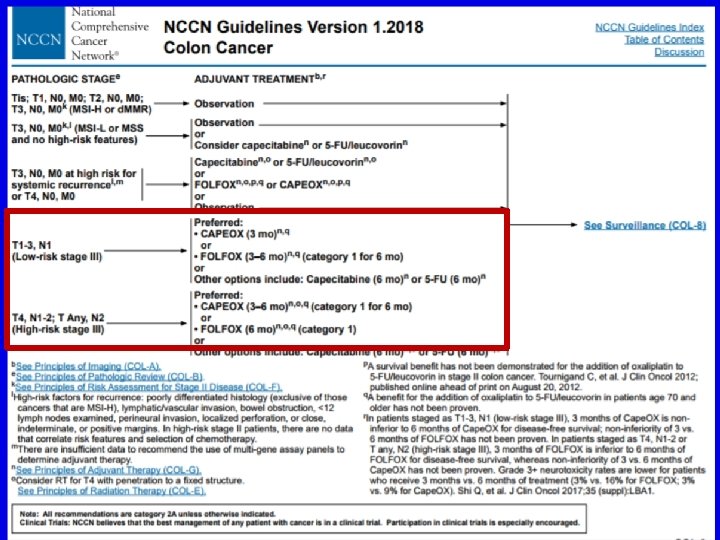
IDEA: KẾT LUẬN • • • DFS không thấp hơn khi hóa trị hỗ trợ có oxaliplatin 3 sv 6 tháng chưa được xác định/ bn UTĐT gđ III – Hiệu quả của thời gian ĐT/DFS thay đổi theo nhóm nguy cơ & phác đồ – Sự khác biệt về kết quả/NC có thể do thay đổi về tỉ lệ bn ĐT CAPOX – Cần các NC khác để xác định có hay không sự khác biệt giữa các phác đồ theo lịch trình, cách dùng thuốc Thời gian ĐT ngắn hơn: tuân thủ ĐT tốt hơn, độc tính TK grade ≥ 2 ít hơn nhiều NC khuyến cáo tiếp cận lợi ích- nguy cơ khi chọn lựa thời gian ĐT hỗ trợ có oxaliplatin – Nguy cơ thấp (T 1 -3, N 1): 3 tháng – Nguy cơ cao (T 4, N 2, hoặc các yếu tố nguy cơ cao khác): 3 -6 tháng tùy thuộc độ dung nạp, ý muốn bn, nguy cơ tái phát, phác đồ (FOLFOX sv CAPOX) Shi Q, et al. ASCO 2017. Abstract LBA 1.

6 THÁNG SAU ASCO 2017. . . Khảo sát kết quả NC IDEA gửi đến các Hội đồng ung thư tổng quát & đường tiêu hoá ở Alliance & SWOG. Có 454 phản hồi Quốc gia/ vùng n % Hoa Kỳ 80 18% Anh 46 10% Các nước châu u khác 66 15% Nhật 247 54% Úc/ New Zealand 15 3%

KẾT LUẬN TỪ CÁC PHẢN HỒI • • • 70% sẽ Điều trị 3 tháng CAPOX hoặc FOLFOX/ nhóm “nguy cơ thấp” gđ III (T 1 -3 N 1) 70% Điều trị 6 tháng CAPOX hoặc FOLFOX/ nhóm T 4 trong khi 98% Điều trị 6 tháng nhóm N 2 1/3 các phản hồi cân nhắc FOLFOX & CAPOX khác biệt về hiệu quả/ Điều trị hỗ trợ Jeffrey Meyerhardt, ASCO GI 2018

18

CẬP NHẬT ĐIỀU TRỊ UNG THƯ ĐẠI TRỰC TRÀNG CĂN

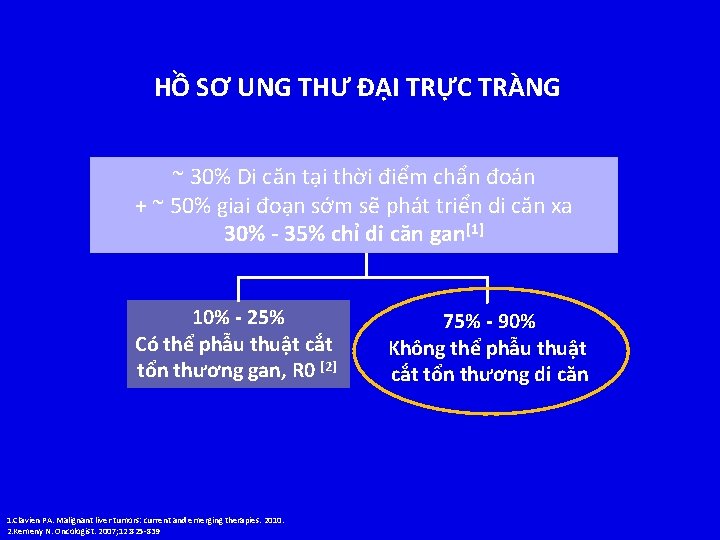
HỒ SƠ UNG THƯ ĐẠI TRỰC TRÀNG ~ 30% Di căn tại thời điểm chẩn đoán + ~ 50% giai đoạn sớm sẽ phát triển di căn xa 30% - 35% chỉ di căn gan[1] 10% - 25% Có thể phẫu thuật cắt tổn thương gan, R 0 [2] 1. Clavien PA. Malignant liver tumors: current and emerging therapies. 2010. 2. Kemeny N. Oncologist. 2007; 12: 825 -839 75% - 90% Không thể phẫu thuật cắt tổn thương di căn

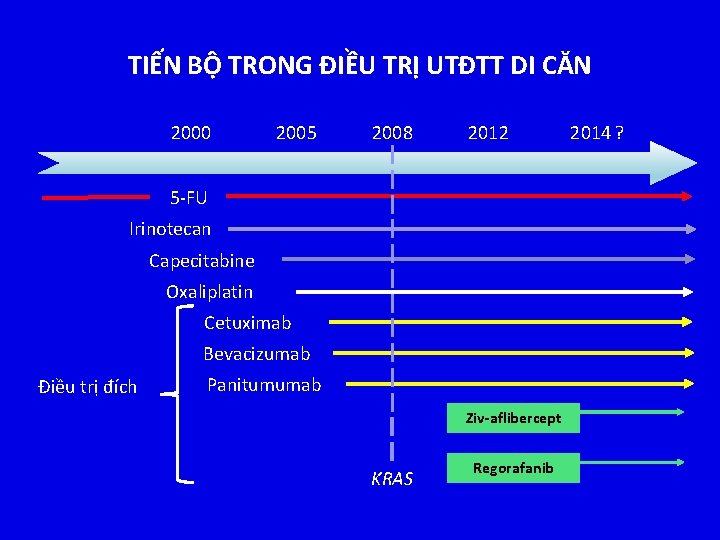
TIẾN BỘ TRONG ĐIỀU TRỊ UTĐTT DI CĂN 2000 2005 2008 2012 5 -FU Irinotecan Capecitabine Oxaliplatin Cetuximab Bevacizumab Điều trị đích Panitumumab Ziv-aflibercept KRAS Regorafanib 2014 ?

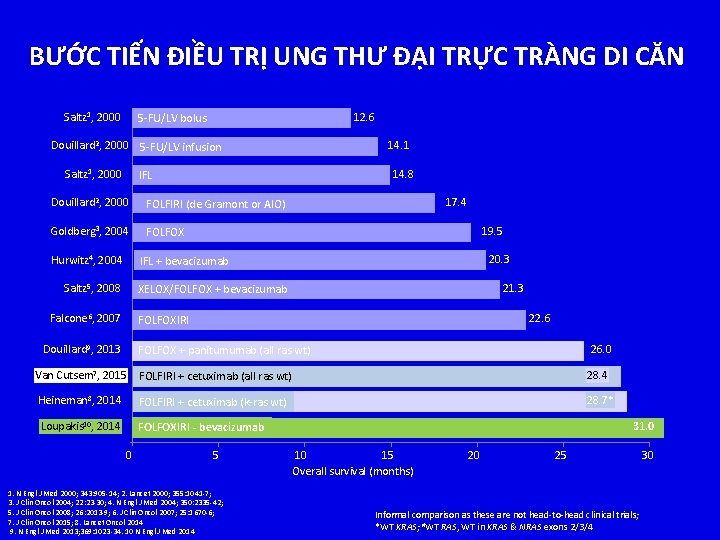
BƯỚC TIẾN ĐIỀU TRỊ UNG THƯ ĐẠI TRỰC TRÀNG DI CĂN Saltz 1, 2000 12. 6 5 -FU/LV bolus 14. 1 Douillard 2, 2000 5 -FU/LV infusion Saltz 1, 2000 14. 8 IFL Douillard 2, 2000 FOLFIRI (de Gramont or AIO) Goldberg 3, 2004 FOLFOX Hurwitz 4, 2004 17. 4 19. 5 20. 3 IFL + bevacizumab Saltz 5, 2008 21. 3 XELOX/FOLFOX + bevacizumab Falcone 6, 2007 22. 6 FOLFOXIRI Douillard 9, 2013 26. 0 FOLFOX + panitumumab (all ras wt) Van Cutsem 7, 2015 FOLFIRI + cetuximab (all ras wt) 28. 4 Heineman 8, 2014 FOLFIRI + cetuximab (k-ras wt) 28. 7* Loupakis 10, 2014 FOLFOXIRI - bevacizumab 0 5 1. N Engl J Med 2000; 343: 905 -14; 2. Lancet 2000; 355: 1041 -7; 3. J Clin Oncol 2004; 22: 23 -30; 4. N Engl J Med 2004; 350: 2335 -42; 5. J Clin Oncol 2008; 26: 2013 -9; 6. J Clin Oncol 2007; 25: 1670 -6; 7. J Clin Oncol 2015; 8. Lancet Oncol 2014 9. N Engl J Med 2013; 369: 1023 -34. 10 N Engl J Med 2014 31. 0 10 15 Overall survival (months) 20 25 Informal comparison as these are not head-to-head clinical trials; *WT KRAS; #WT RAS, WT in KRAS & NRAS exons 2/3/4 30

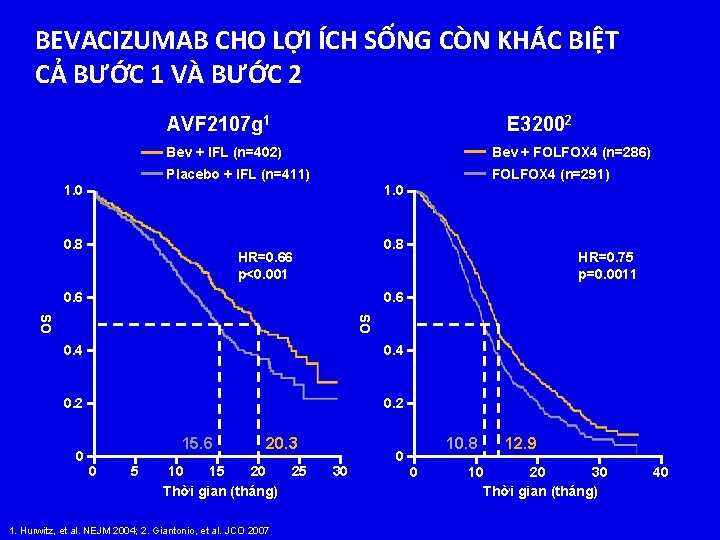
BEVACIZUMAB CHO LỢI ÍCH SỐNG CÒN KHÁC BIỆT CẢ BƯỚC 1 VÀ BƯỚC 2 AVF 2107 g 1 E 32002 Bev + IFL (n=402) Bev + FOLFOX 4 (n=286) Placebo + IFL (n=411) FOLFOX 4 (n=291) 1. 0 0. 8 HR=0. 66 p<0. 001 OS 0. 6 HR=0. 75 p=0. 0011 0. 4 0. 2 0 15. 6 0 5 20. 3 10 15 20 25 Thời gian (tháng) 1. Hurwitz, et al. NEJM 2004; 2. Giantonio, et al. JCO 2007 30 0 10. 8 0 12. 9 10 20 30 Thời gian (tháng) 40

Y HỌC BẰNG CHỨNG: BEVACIZUMAB CÓ THỂ KẾT HỢP TẤT CẢ PHÁC ĐỒ HOÁ TRỊ ĐANG SỬ DỤNG FOLFOX XELOX FOLF(OX)IRI “Bevacizumab kết hợp với hóa trị có fluoropyrimidine được chỉ định cho điều trị bệnh nhân bị ung thư đại trực XELODA tràng di căn. ” 5 FU/LV XELIRI

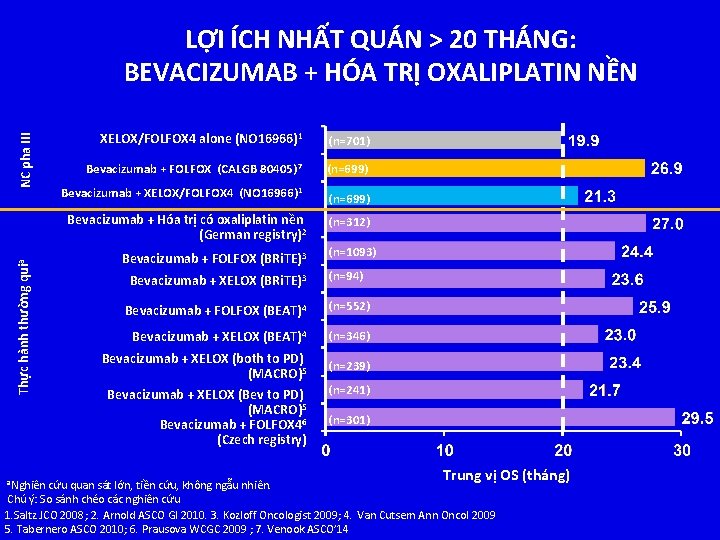
NC pha III LỢI ÍCH NHẤT QUÁN > 20 THÁNG: BEVACIZUMAB + HÓA TRỊ OXALIPLATIN NỀN XELOX/FOLFOX 4 alone (NO 16966)1 (n=701) Bevacizumab + FOLFOX (CALGB 80405) 7 (n=699) Bevacizumab + XELOX/FOLFOX 4 (NO 16966) 1 (n=699) Thực hành thường quia Bevacizumab + Hóa trị có oxaliplatin nền (German registry)2 a. Nghiên Bevacizumab + FOLFOX (BRi. TE)3 (n=312) (n=1093) Bevacizumab + XELOX (BRi. TE)3 (n=94) Bevacizumab + FOLFOX (BEAT)4 (n=552) Bevacizumab + XELOX (BEAT)4 (n=346) Bevacizumab + XELOX (both to PD) (MACRO)5 (n=239) Bevacizumab + XELOX (Bev to PD) (MACRO)5 Bevacizumab + FOLFOX 46 (Czech registry) (n=301) (n=241) Trung vị OS (tháng) cứu quan sát lớn, tiền cứu, không ngẫu nhiên. Chú ý: So sánh chéo các nghiên cứu 1. Saltz JCO 2008; 2. Arnold ASCO GI 2010. 3. Kozloff Oncologist 2009; 4. Van Cutsem Ann Oncol 2009 5. Tabernero ASCO 2010; 6. Prausova WCGC 2009 ; 7. Venook ASCO’ 14

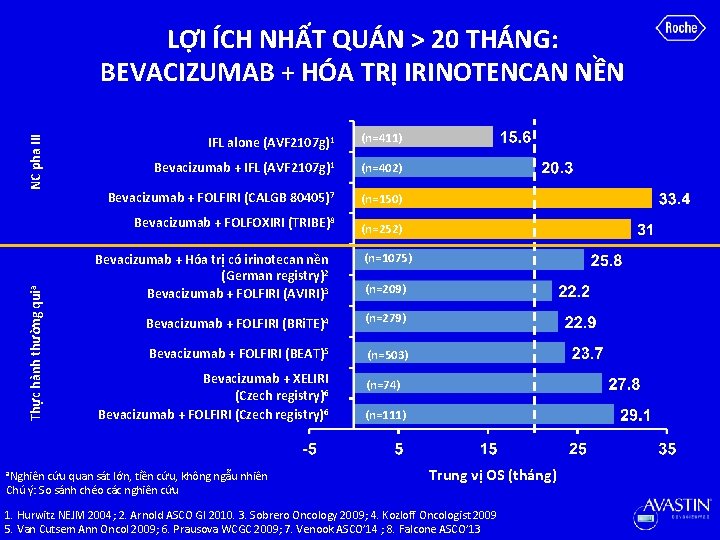
Thực hành thường quia NC pha III LỢI ÍCH NHẤT QUÁN > 20 THÁNG: BEVACIZUMAB + HÓA TRỊ IRINOTENCAN NỀN a. Nghiên IFL alone (AVF 2107 g)1 (n=411) Bevacizumab + IFL (AVF 2107 g)1 (n=402) Bevacizumab + FOLFIRI (CALGB 80405)7 (n=150) Bevacizumab + FOLFOXIRI (TRIBE)8 (n=252) Bevacizumab + Hóa trị có irinotecan nền (German registry)2 Bevacizumab + FOLFIRI (AVIRI)3 (n=1075) (n=209) Bevacizumab + FOLFIRI (BRi. TE)4 (n=279) Bevacizumab + FOLFIRI (BEAT)5 (n=503) Bevacizumab + XELIRI (Czech registry)6 Bevacizumab + FOLFIRI (Czech registry)6 cứu quan sát lớn, tiền cứu, không ngẫu nhiên Chú ý: So sánh chéo các nghiên cứu (n=74) (n=111) Trung vị OS (tháng) 1. Hurwitz NEJM 2004; 2. Arnold ASCO GI 2010. 3. Sobrero Oncology 2009; 4. Kozloff Oncologist 2009 5. Van Cutsem Ann Oncol 2009; 6. Prausova WCGC 2009; 7. Venook ASCO’ 14 ; 8. Falcone ASCO’ 13

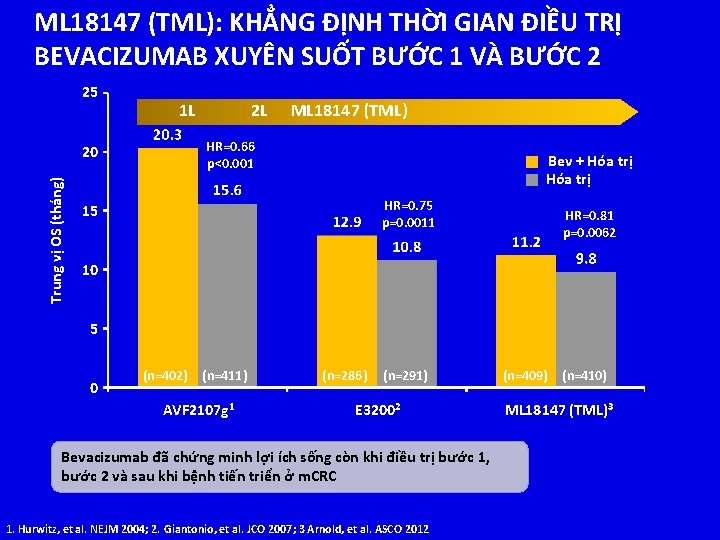
ML 18147 (TML): KHẲNG ĐỊNH THỜI GIAN ĐIỀU TRỊ BEVACIZUMAB XUYÊN SUỐT BƯỚC 1 VÀ BƯỚC 2 25 1 L ML 18147 (TML) HR=0. 66 p<0. 001 20 Trung vị OS (tháng) 2 L Bev + Hóa trị HR=0. 75 p=0. 0011 15 HR=0. 81 p=0. 0062 10 5 0 (n=402) (n=411) AVF 2107 g 1 (n=286) (n=291) E 32002 Bevacizumab đã chứng minh lợi ích sống còn khi điều trị bước 1, bước 2 và sau khi bệnh tiến triển ở m. CRC 1. Hurwitz, et al. NEJM 2004; 2. Giantonio, et al. JCO 2007; 3 Arnold, et al. ASCO 2012 (n=409) (n=410) ML 18147 (TML)3

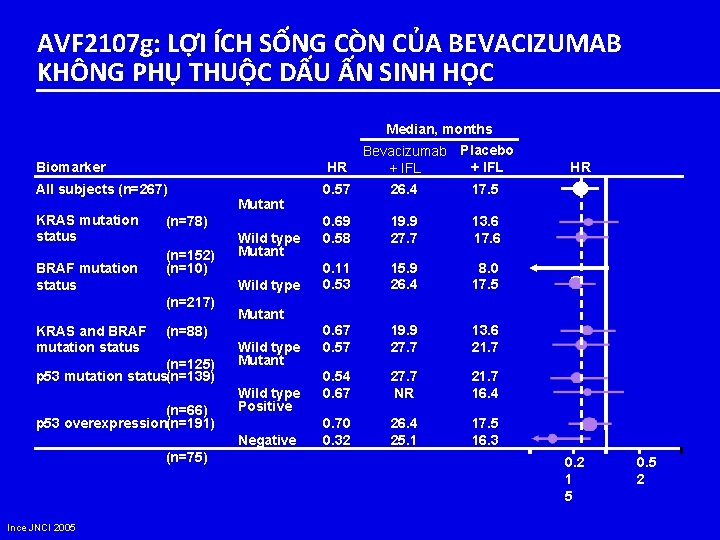
AVF 2107 g: LỢI ÍCH SỐNG CÒN CỦA BEVACIZUMAB KHÔNG PHỤ THUỘC DẤU ẤN SINH HỌC Median, months Bevacizumab Placebo HR + IFL 0. 57 26. 4 17. 5 Biomarker All subjects (n=267) KRAS mutation status BRAF mutation status Mutant (n=78) (n=152) (n=10) Wild type Mutant Wild type (n=217) KRAS and BRAF mutation status (n=66) p 53 overexpression(n=191) Wild type Mutant Wild type Positive Negative (n=75) 0. 69 0. 58 19. 9 27. 7 13. 6 17. 6 0. 11 0. 53 15. 9 26. 4 8. 0 17. 5 0. 67 0. 57 19. 9 27. 7 13. 6 21. 7 0. 54 0. 67 27. 7 NR 21. 7 16. 4 0. 70 0. 32 26. 4 25. 1 17. 5 16. 3 Mutant (n=88) (n=125) p 53 mutation status(n=139) Ince JNCI 2005 HR 0. 2 1 5 0. 5 2

KHÁNG EGFR: CÁC ĐẶC ĐIỂM CHÍNH • • Các marker phân tử xác định bn KHÔNG CÓ lợi ích từ EGFR m. Abs • Đột biến RAS (KRAS/NRAS) • Đột biến BRAF • Biểu lộ quá mức HER 2 Vị trí bướu có thể xác định khả năng có lợi ích • Không có lợi ích cho bướu bên P • • Tỉ lệ ứng cử viên cho liệu pháp EGFR m. Ab đang thu hẹp Chỉ xn đột biến RAS sẽ sớm không đủ Phải xđ bn sử dụng bước 1 Vì các AEs (skin rash): tác động đến Qo. L, giao tiếp XH ĐT bước 1 có thời gian ĐT dài nhất Hiệu quả OS có ý nghĩa với các bước sau đó ngay cả khi sử dụng đơn độc
![HIỆU QUẢ KHÁNG EGFR TRONG ĐIỀU TRỊ BƯỚC 1 Nghiên cứu CRYSTAL1 COIN2 NORDIC HIỆU QUẢ KHÁNG EGFR TRONG ĐIỀU TRỊ BƯỚC 1 Nghiên cứu CRYSTAL[1] COIN[2] NORDIC](https://slidetodoc.com/presentation_image_h/ea04a6d7a38ee67626ea14609fd80be9/image-30.jpg)
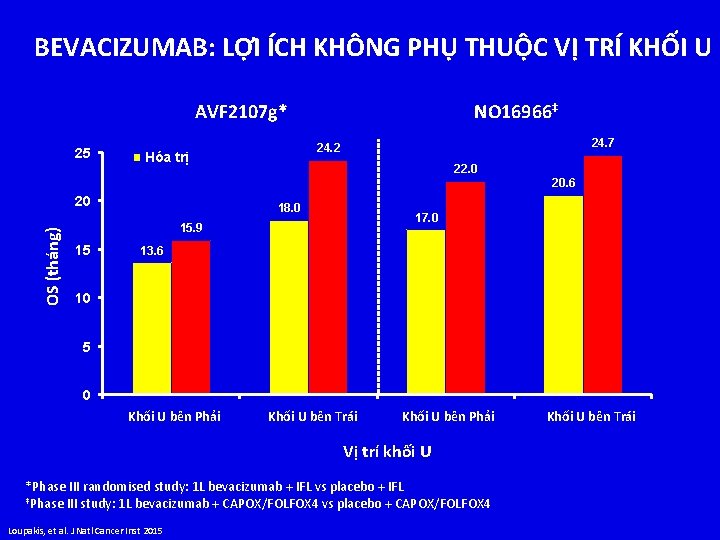
HIỆU QUẢ KHÁNG EGFR TRONG ĐIỀU TRỊ BƯỚC 1 Nghiên cứu CRYSTAL[1] COIN[2] NORDIC VII[3] PRIME[4] Điều trị FOLFIRI/Cetux sv FOLFIRI PFS, tháng HR (p ) OS, tháng HR (p) 9, 9 sv 8, 4 0, 696 (, 0012) 23, 5 sv 20, 0 0, 796 (, 0093) FOLFOX/XELOX/ Cetux sv FOLFOX/XELOX 8, 6 sv 8, 6 0, 96 (, 60) 17, 0 sv 17, 9 1, 04 (, 67) FLOX/Cetux sv FLOX FOLFOX 4/Pmab sv FOLFOX 4 7, 9 sv 8, 7 9, 6 sv 8, 0 1, 07 (, 66) 0, 80 (, 02) 20, 1 sv 22, 0 23, 9 sv 19, 7 Kết quả PFS xấu hơn với panitumumab + FOLFOX 4 trên bệnh nhân có đột biến [4] 1. Van Cutsem E, et al. J Clin Oncol. 2011; 29: 2011 -2019. 2. Maughan TS, et al. Lancet. 2011; 377: 2103 -2114. 3. Tveit K, et al. ASCO GI 2011. Abstract 365. 4. Douillard JY, et al. J Clin Oncol. 2010; 28: 4697 -4705. 1, 14 (, 66) 0, 83 (, 072)

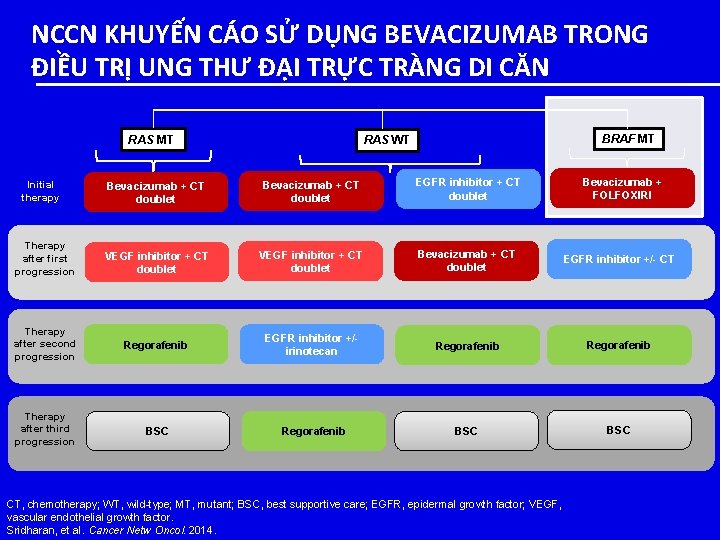
NCCN KHUYẾN CÁO SỬ DỤNG BEVACIZUMAB TRONG ĐIỀU TRỊ UNG THƯ ĐẠI TRỰC TRÀNG DI CĂN RAS MT BRAF MT RAS WT Bevacizumab + FOLFOXIRI Bevacizumab + CT doublet EGFR inhibitor + CT doublet Therapy after first progression VEGF inhibitor + CT doublet Bevacizumab + CT doublet EGFR inhibitor +/- CT Therapy after second progression Regorafenib EGFR inhibitor +/irinotecan Regorafenib Therapy after third progression BSC Regorafenib BSC Initial therapy CT, chemotherapy; WT, wild-type; MT, mutant; BSC, best supportive care; EGFR, epidermal growth factor; VEGF, vascular endothelial growth factor. Sridharan, et al. Cancer Netw Oncol. 2014.

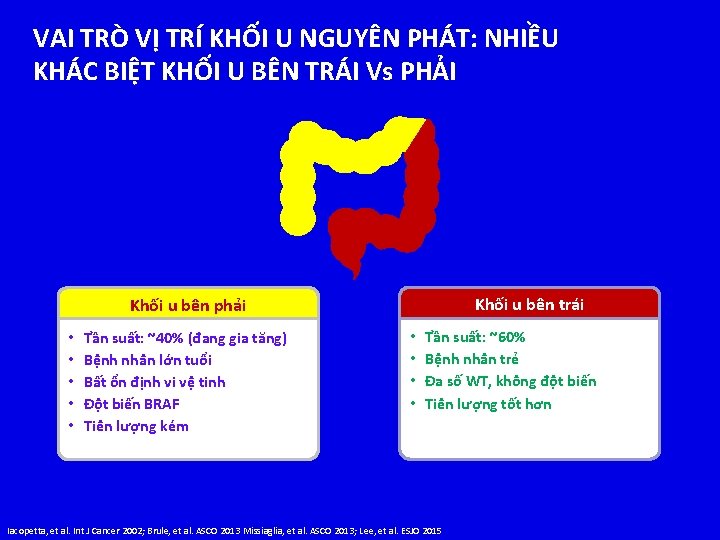
VAI TRÒ VỊ TRÍ KHỐI U NGUYÊN PHÁT: NHIỀU KHÁC BIỆT KHỐI U BÊN TRÁI Vs PHẢI Khối u bên trái Khối u bên phải • • • Tần suất: ~40% (đang gia tăng) Bệnh nhân lớn tuổi Bất ổn định vi vệ tinh Đột biến BRAF Tiên lượng kém • • Tần suất: ~60% Bệnh nhân trẻ Đa số WT, không đột biến Tiên lượng tốt hơn Iacopetta, et al. Int J Cancer 2002; Brule, et al. ASCO 2013 Missiaglia, et al. ASCO 2013; Lee, et al. ESJO 2015

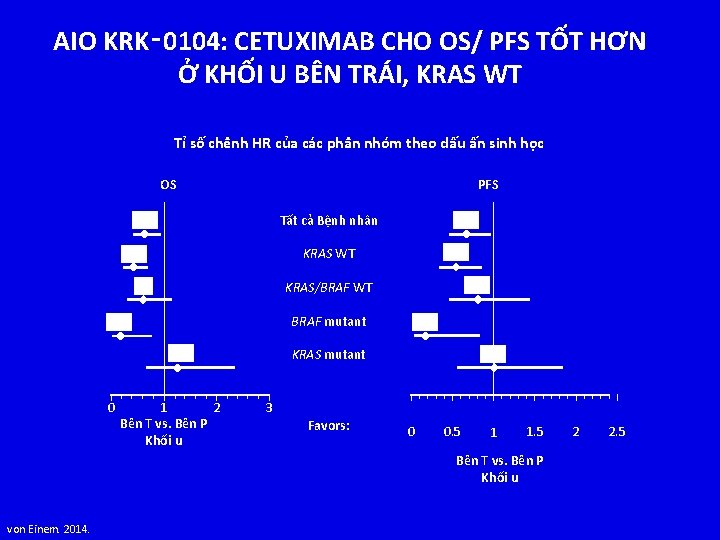
AIO KRK‑ 0104: CETUXIMAB CHO OS/ PFS TỐT HƠN Ở KHỐI U BÊN TRÁI, KRAS WT Tỉ số chênh HR của các phân nhóm theo dấu ấn sinh học OS PFS 0. 63 0. 42 0. 54 KRAS WT 0. 6 0. 81 KRAS/BRAF WT BRAF mutant 0. 16 1. 26 0 0. 67 Tất cả Bệnh nhân 1 2 Bên T vs. Bên P Khối u 0. 17 1. 01 KRAS mutant 3 Favors: 0 0. 5 1 1. 5 Bên T vs. Bên P Khối u von Einem. 2014. 2 2. 5

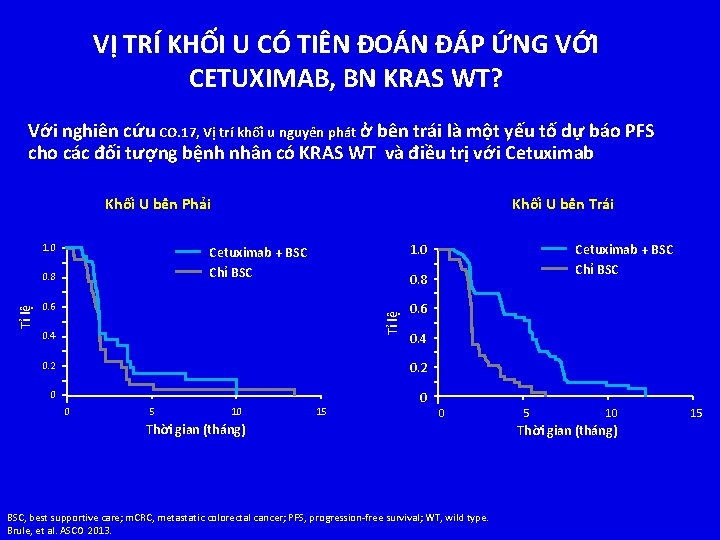
VỊ TRÍ KHỐI U CÓ TIÊN ĐOÁN ĐÁP ỨNG VỚI CETUXIMAB, BN KRAS WT? Với nghiên cứu CO. 17, Vị trí khối u nguyên phát ở bên trái là một yếu tố dự báo PFS cho các đối tượng bệnh nhân có KRAS WT và điều trị với Cetuximab Khối U bên Phải 1. 0 Cetuximab + BSC Chỉ BSC 0. 8 0. 6 Tỉ lệ Khối U bên Trái 0. 4 0. 2 0. 6 0. 4 0. 2 0 0 5 10 15 0 0 Thời gian (tháng) BSC, best supportive care; m. CRC, metastatic colorectal cancer; PFS, progression-free survival; WT, wild type. Brule, et al. ASCO 2013. 5 10 Thời gian (tháng) 15

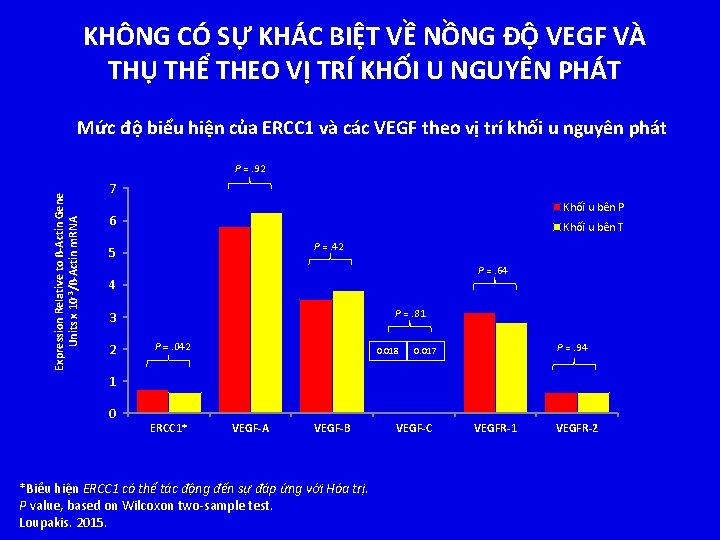
KHÔNG CÓ SỰ KHÁC BIỆT VỀ NỒNG ĐỘ VEGF VÀ THỤ THỂ THEO VỊ TRÍ KHỐI U NGUYÊN PHÁT Mức độ biểu hiện của ERCC 1 và các VEGF theo vị trí khối u nguyên phát Expression Relative to ß-Actin Gene Units x 10 -3/ß-Actin m. RNA P =. 92 7 Khối u bên P 6 Khối u bên T P =. 42 5 P =. 64 4 P =. 81 3 2 P =. 042 0. 018 P =. 94 0. 017 1 0 ERCC 1* VEGF-A VEGF-B *Biểu hiện ERCC 1 có thể tác động đến sự đáp ứng với Hóa trị. P value, based on Wilcoxon two-sample test. Loupakis. 2015. VEGF-C VEGFR-1 VEGFR-2

BEVACIZUMAB: LỢI ÍCH KHÔNG PHỤ THUỘC VỊ TRÍ KHỐI U AVF 2107 g* 25 NO 16966‡ 24. 7 24. 2 Hóa trị 22. 0 20. 6 OS (tháng) 20 18. 0 17. 0 15. 9 15 13. 6 10 5 0 Khối U bên Phải Khối U bên Trái Khối U bên Phải Vị trí khối U *Phase III randomised study: 1 L bevacizumab + IFL vs placebo + IFL ‡Phase III study: 1 L bevacizumab + CAPOX/FOLFOX 4 vs placebo + CAPOX/FOLFOX 4 Loupakis, et al. J Natl Cancer Inst 2015 Khối U bên Trái

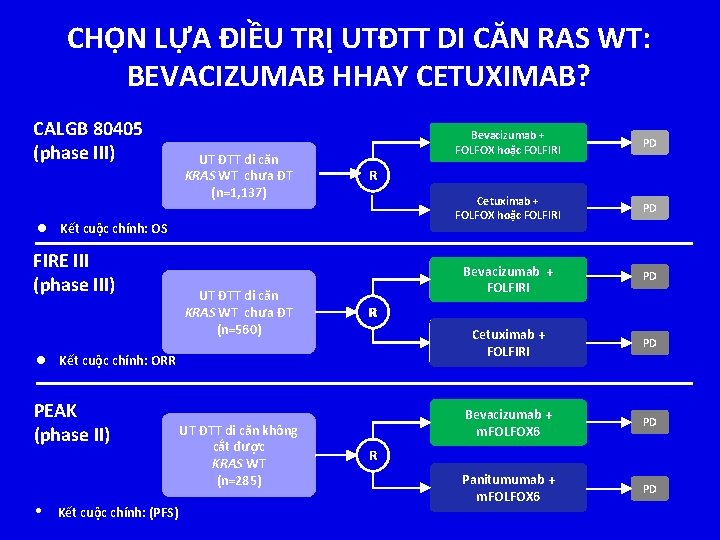
CHỌN LỰA ĐIỀU TRỊ UTĐTT DI CĂN RAS WT: BEVACIZUMAB HHAY CETUXIMAB? CALGB 80405 (phase III) UT ĐTT di căn KRAS WT chưa ĐT (n=1, 137) UT ĐTT di căn KRAS WT chưa ĐT (n=560) • Kết cuộc chính: (PFS) UT ĐTT di căn không cắt được KRAS WT (n=285) Cetuximab + FOLFOX hoặc FOLFIRI PD Bevacizumab + FOLFIRI PD Cetuximab + FOLFIRI PD Bevacizumab + m. FOLFOX 6 PD Panitumumab + m. FOLFOX 6 PD R l Kết cuộc chính: ORR PEAK (phase II) PD R l Kết cuộc chính: OS FIRE III (phase III) Bevacizumab + FOLFOX hoặc FOLFIRI R

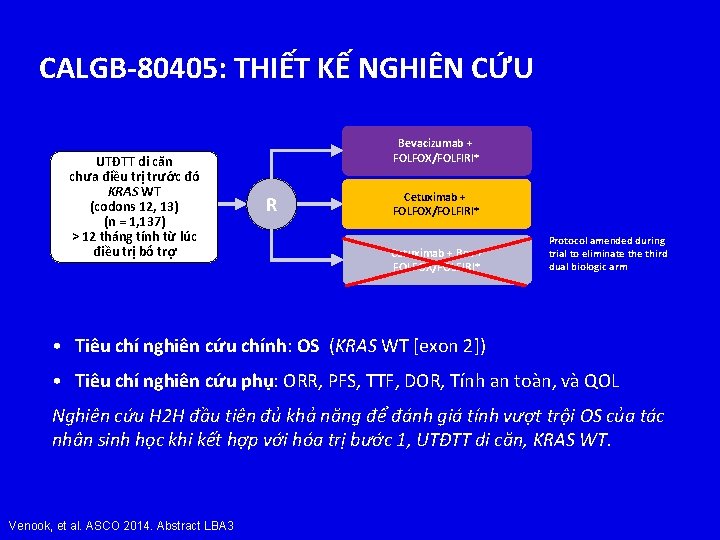
CALGB-80405: THIẾT KẾ NGHIÊN CỨU UTĐTT di căn chưa điều trị trước đó KRAS WT (codons 12, 13) (n = 1, 137) > 12 tháng tính từ lúc điều trị bổ trợ Bevacizumab + FOLFOX/FOLFIRI* R Cetuximab + FOLFOX/FOLFIRI* Cetuximab + Bev + FOLFOX/FOLFIRI* Protocol amended during trial to eliminate third dual biologic arm • Tiêu chí nghiên cứu chính: OS (KRAS WT [exon 2]) • Tiêu chí nghiên cứu phụ: ORR, PFS, TTF, DOR, Tính an toàn, và QOL Nghiên cứu H 2 H đầu tiên đủ khả năng để đánh giá tính vượt trội OS của tác nhân sinh học khi kết hợp với hóa trị bước 1, UTĐTT di căn, KRAS WT. Venook, et al. ASCO 2014. Abstract LBA 3

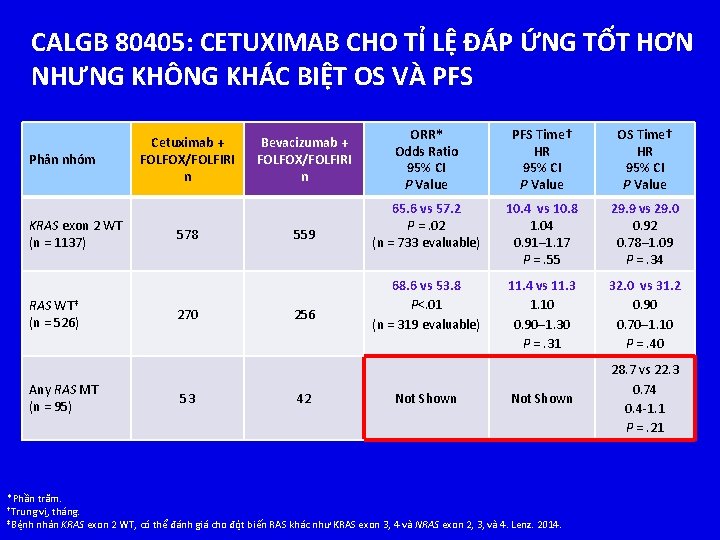
CALGB 80405: CETUXIMAB CHO TỈ LỆ ĐÁP ỨNG TỐT HƠN NHƯNG KHÔNG KHÁC BIỆT OS VÀ PFS Phân nhóm KRAS exon 2 WT (n = 1137) RAS WT‡ (n = 526) Any RAS MT (n = 95) Cetuximab + FOLFOX/FOLFIRI n 578 270 53 Bevacizumab + FOLFOX/FOLFIRI n 559 256 42 ORR* Odds Ratio 95% CI P Value PFS Time† HR 95% CI P Value OS Time† HR 95% CI P Value 65. 6 vs 57. 2 P =. 02 (n = 733 evaluable) 10. 4 vs 10. 8 1. 04 0. 91– 1. 17 P =. 55 29. 9 vs 29. 0 0. 92 0. 78– 1. 09 P =. 34 68. 6 vs 53. 8 P<. 01 (n = 319 evaluable) 11. 4 vs 11. 3 1. 10 0. 90– 1. 30 P =. 31 32. 0 vs 31. 2 0. 90 0. 70– 1. 10 P =. 40 Not Shown 28. 7 vs 22. 3 0. 74 0. 4 -1. 1 P =. 21 Not Shown *Phần trăm. †Trung vị, tháng. ‡Bệnh nhân KRAS exon 2 WT, có thể đánh giá cho đột biến RAS khác như KRAS exon 3, 4 và NRAS exon 2, 3, và 4. Lenz. 2014.

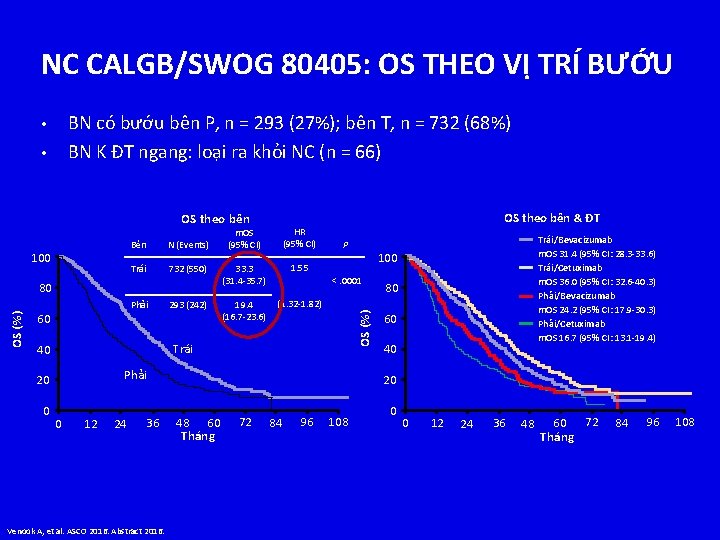
NC CALGB/SWOG 80405: OS THEO VỊ TRÍ BƯỚU BN có bướu bên P, n = 293 (27%); bên T, n = 732 (68%) BN K ĐT ngang: loại ra khỏi NC (n = 66) • • OS theo bên Bên N (Events) Trái 732 (550) 33. 3 (31. 4 -35. 7) 1. 55 293 (242) 19. 4 (16. 7 -23. 6) (1. 32 -1. 82) 80 OS (%) Phải 60 OS theo bên & ĐT P Phải 20 0 12 24 36 Venook A, et al. ASCO 2016. Abstract 2016. Trái/Bevacizumab m. OS 31. 4 (95% CI: 28. 3 -33. 6) Trái/Cetuximab m. OS 36. 0 (95% CI: 32. 6 -40. 3) Phải/Bevacizumab m. OS 24. 2 (95% CI: 17. 9 -30. 3) Phải/Cetuximab m. OS 16. 7 (95% CI: 13. 1 -19. 4) 100 <. 0001 Trái 40 0 HR (95% CI) OS (%) 100 m. OS (95% CI) 80 60 40 20 48 60 Tháng 72 84 96 108 0 0 12 24 36 48 60 72 Tháng 84 96 108

KHUYẾN CÁO NCCN: KHÁNG EGFR CHỈ SỬ DỤNG KHI RAS WT VÀ KHỐI U BÊN TRÁI

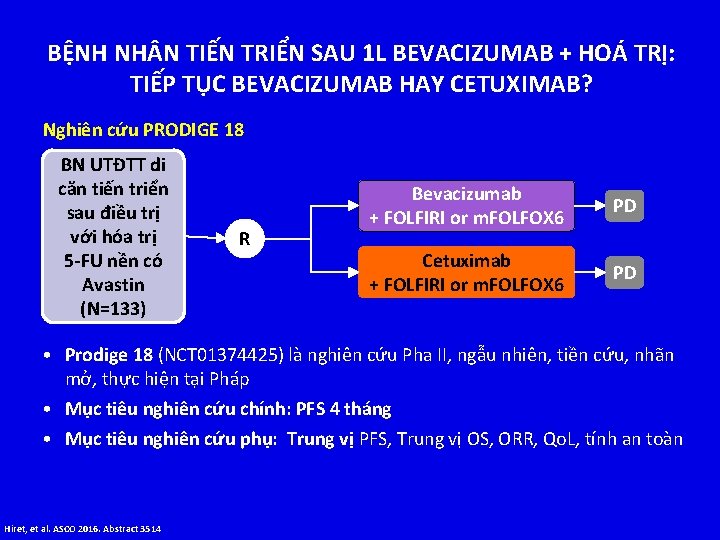
BỆNH NH N TIẾN TRIỂN SAU 1 L BEVACIZUMAB + HOÁ TRỊ: TIẾP TỤC BEVACIZUMAB HAY CETUXIMAB? Nghiên cứu PRODIGE 18 BN UTĐTT di căn tiến triển sau điều trị với hóa trị 5 -FU nền có Avastin (N=133) R Bevacizumab + FOLFIRI or m. FOLFOX 6 PD Cetuximab + FOLFIRI or m. FOLFOX 6 PD • Prodige 18 (NCT 01374425) là nghiên cứu Pha II, ngẫu nhiên, tiền cứu, nhãn mở, thực hiện tại Pháp • Mục tiêu nghiên cứu chính: PFS 4 tháng • Mục tiêu nghiên cứu phụ: Trung vị PFS, Trung vị OS, ORR, Qo. L, tính an toàn Hiret, et al. ASCO 2016. Abstract 3514

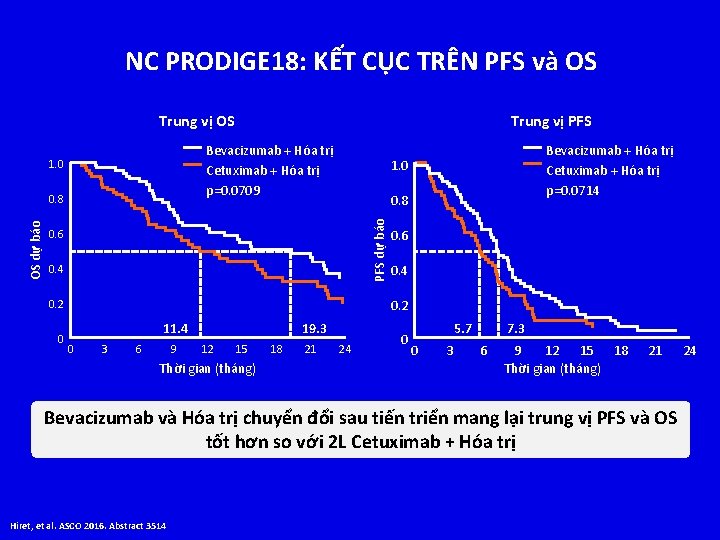
NC PRODIGE 18: KẾT CỤC TRÊN PFS và OS Trung vị OS Bevacizumab + Hóa trị Cetuximab + Hóa trị p=0. 0709 1. 0 0. 8 0. 6 0. 4 0. 2 0 Bevacizumab + Hóa trị Cetuximab + Hóa trị p=0. 0714 1. 0 PFS dự báo 0. 8 OS dự báo Trung vị PFS 11. 4 0 3 6 9 19. 3 12 15 Thời gian (tháng) 18 21 24 0 5. 7 0 3 7. 3 6 9 12 15 18 Thời gian (tháng) 21 Bevacizumab và Hóa trị chuyển đổi sau tiến triển mang lại trung vị PFS và OS tốt hơn so với 2 L Cetuximab + Hóa trị Hiret, et al. ASCO 2016. Abstract 3514 24

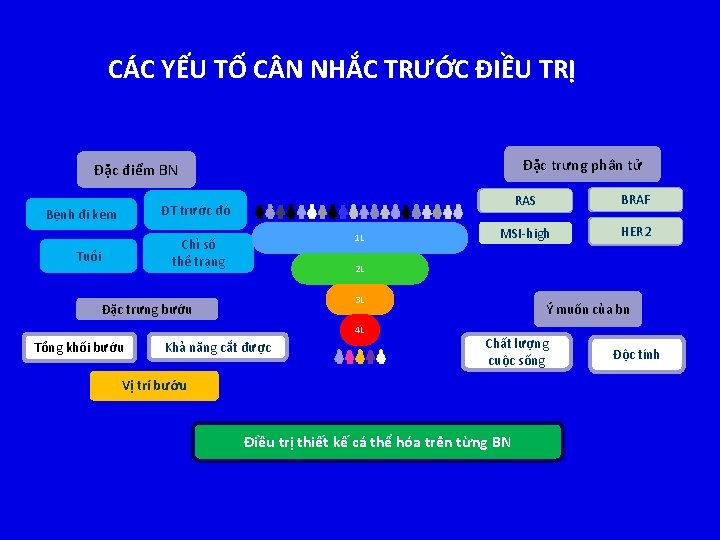
CÁC YẾU TỐ C N NHẮC TRƯỚC ĐIỀU TRỊ Đặc trưng phân tử Đặc điểm BN RAS BRAF MSI-high HER 2 ĐT trước đó Bệnh đi kèm 1 L Chỉ số thể trạng Tuổi 2 L 3 L Đặc trưng bướu 4 L Tổng khối bướu Khả năng cắt được Ý muốn của bn Chất lượng cuộc sống Vị trí bướu Điều trị thiết kế cá thể hóa trên từng BN Độc tính

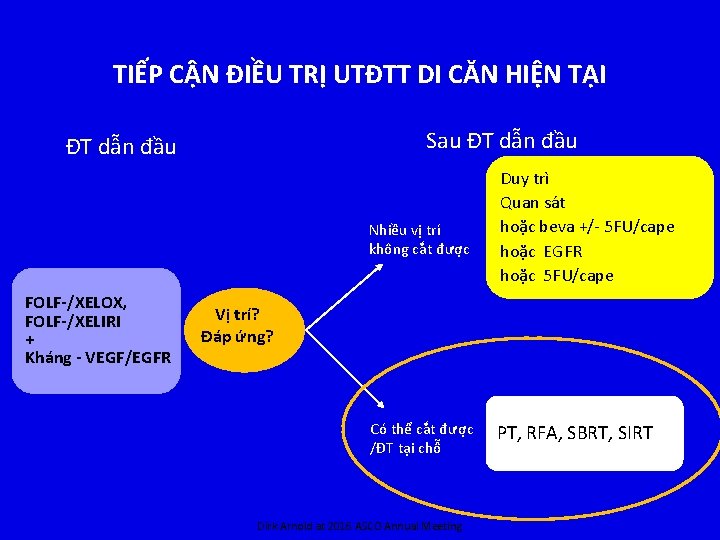
TIẾP CẬN ĐIỀU TRỊ UTĐTT DI CĂN HIỆN TẠI Sau ĐT dẫn đầu Nhiều vị trí không cắt được FOLF-/XELOX, FOLF-/XELIRI + Kháng - VEGF/EGFR Duy trì Quan sát hoặc beva +/- 5 FU/cape hoặc EGFR hoặc 5 FU/cape Vị trí? Đáp ứng? Có thể cắt được /ĐT tại chỗ Dirk Arnold at 2016 ASCO Annual Meeting PT, RFA, SBRT, SIRT

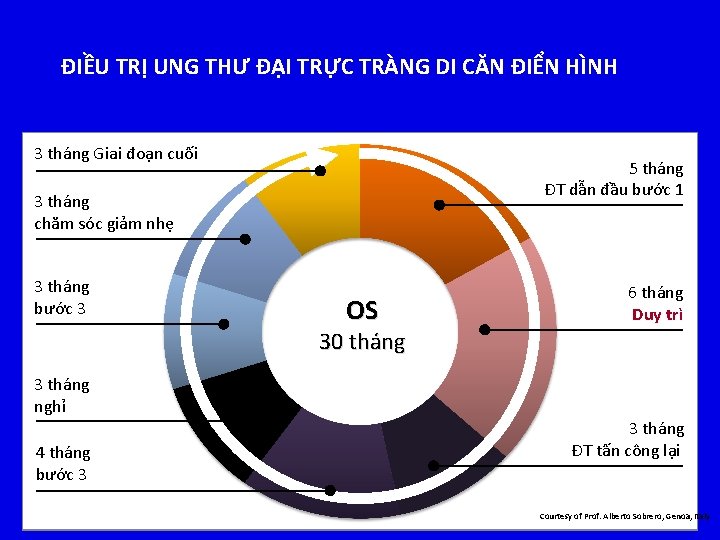
ĐIỀU TRỊ UNG THƯ ĐẠI TRỰC TRÀNG DI CĂN ĐIỂN HÌNH 3 tháng Giai đoạn cuối 5 tháng ĐT dẫn đầu bước 1 3 tháng chăm sóc giảm nhẹ 3 tháng bước 3 OS OS 3030 months tháng 6 tháng Duy trì 3 tháng nghỉ 4 tháng bước 3 3 tháng ĐT tấn công lại Courtesy of Prof. Alberto Sobrero, Genoa, Italy