CORSO DI DI CHIMICA ORGANICA DEGLI INQUINANTI ORGANICI









- Slides: 14

CORSO DI DI CHIMICA ORGANICA DEGLI INQUINANTI ORGANICI ANNO 2007 Dr PROF. Armando ARMANDO Zarrelli ZARRELLI (Dipartimento di Chimica di Scienze Organica Chimiche e Biochimica, Università Federico IIII di di Napoli) Napoli Tel. 081 -674472/163 E-mail: zarrelli@unina. it

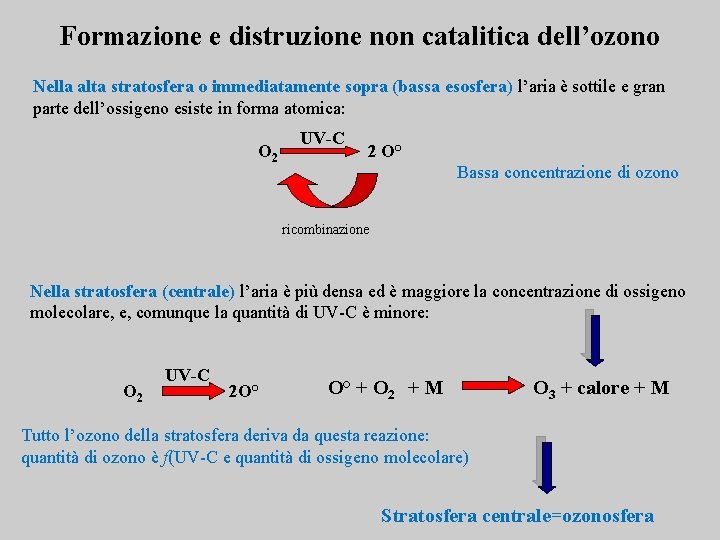
Formazione e distruzione non catalitica dell’ozono Nella alta stratosfera o immediatamente sopra (bassa esosfera) l’aria è sottile e gran parte dell’ossigeno esiste in forma atomica: O 2 UV-C 2 O° Bassa concentrazione di ozono ricombinazione Nella stratosfera (centrale) l’aria è più densa ed è maggiore la concentrazione di ossigeno molecolare, e, comunque la quantità di UV-C è minore: O 2 UV-C 2 O° O° + O 2 + M O 3 + calore + M Tutto l’ozono della stratosfera deriva da questa reazione: quantità di ozono è f(UV-C e quantità di ossigeno molecolare) Stratosfera centrale=ozonosfera

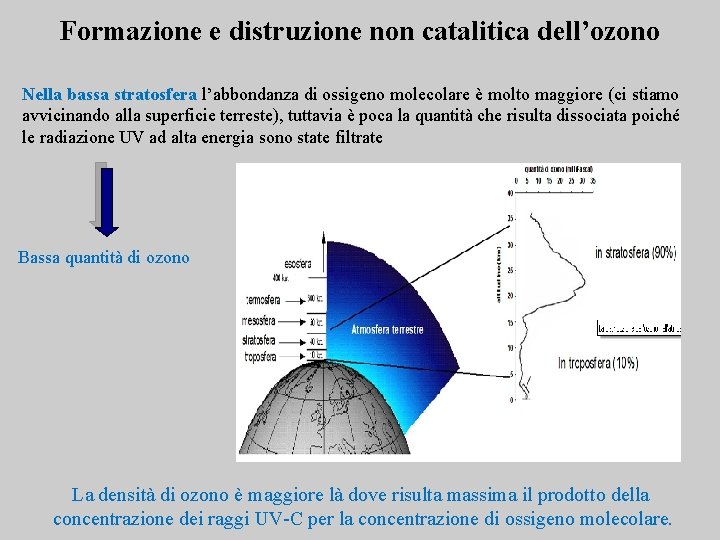
Formazione e distruzione non catalitica dell’ozono Nella bassa stratosfera l’abbondanza di ossigeno molecolare è molto maggiore (ci stiamo avvicinando alla superficie terreste), tuttavia è poca la quantità che risulta dissociata poiché le radiazione UV ad alta energia sono state filtrate Bassa quantità di ozono La densità di ozono è maggiore là dove risulta massima il prodotto della concentrazione dei raggi UV-C per la concentrazione di ossigeno molecolare.

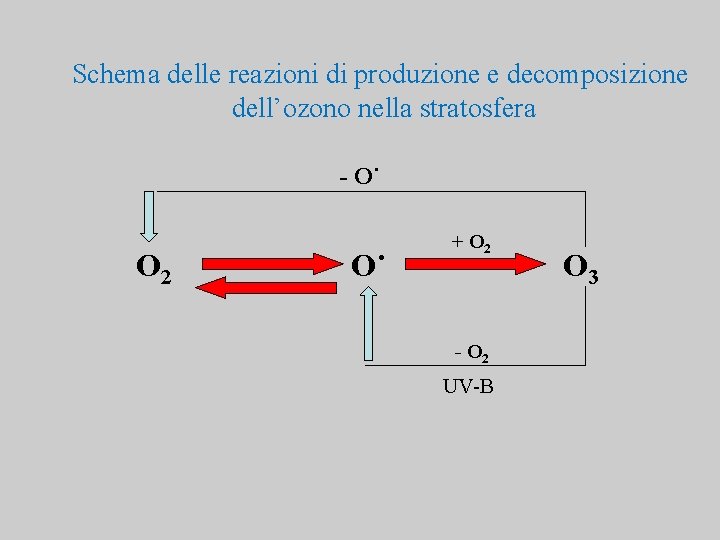
Schema delle reazioni di produzione e decomposizione dell’ozono nella stratosfera - O˙ O 2 O˙ + O 2 - O 2 UV-B O 3

Attenzione La concentrazione di ozono è massima ad una altezza di 25 -30 Km in corrispondenza della quale però la densità è minima. Ciò in virtù della rarefazione dell’area per cui le molecole di ozono sono tante in confronto a tutte le altre (concentrazione alta), ma poche in funzione dell’unità di volume (densità bassa per un volume molto alto). Negli strati più bassi, le molecole di ozono nell’aria sono di meno (concentrazioni basse) ma c’è ne sono di più nell’unità di volume (densità alta, meno molecole ma in un volume più piccolo)…chi si è perso?

Nei primi anni ’ 60 si comprese che esistono altri meccanismi di distruzione dell’ozono dati da alcune specie X: X + O 3 XO + O 2 X sono catalizzatori ed esistono in atmosfera come radicali liberi

Processi catalitici nella distruzione di ozono X XO + O 3 XO + O 2 + O X + O 2 La reazione globale: O 3 + O X = CATALIZZATORE (atomico o molecolare) 2 O 2 v. Nella parte bassa della stratosfera: la distruzione di ozono attraverso reazioni che richiedono ossigeno atomico è molto lenta (bassa concentrazione di raggi UV-C) v. La maggior parte dell’ozono viene distrutto attraverso queste reazioni nella parte centrale e superiore della stratosfera (quindi aumenta nella bassa stratosfera)

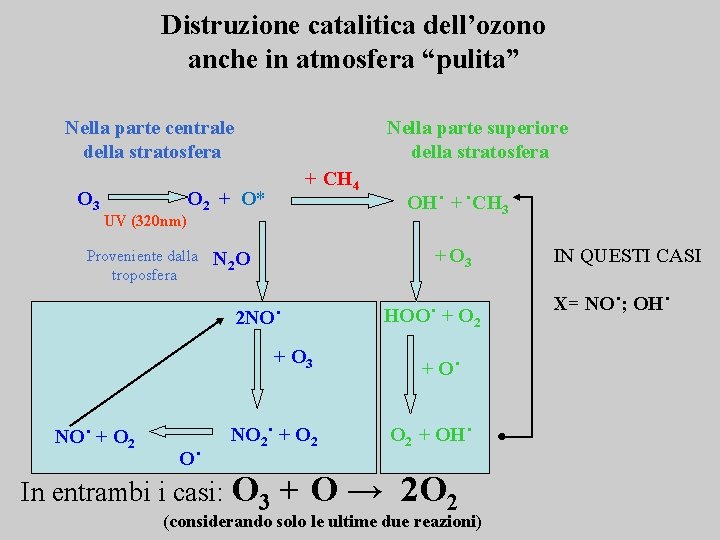
Distruzione catalitica dell’ozono anche in atmosfera “pulita” Nella parte centrale della stratosfera O 3 Nella parte superiore della stratosfera + CH 4 O 2 + O* UV (320 nm) Proveniente dalla troposfera + O 3 N 2 O 2 NO˙ + O 3 NO˙ + O 2 O˙ NO 2˙ + O 2 In entrambi i casi: O 3 OH˙ + ˙CH 3 HOO˙ + O 2 + O˙ O 2 + OH˙ + O → 2 O 2 (considerando solo le ultime due reazioni) IN QUESTI CASI X= NO˙; OH˙

…quindi X = NO° Viene prodotto quando l’ossido nitroso sale dalla troposfera alla stratosfera O* + N 2 O 2 NO° Dà le seguenti reazioni con l’ozono NO° + O 3 NO 2° + O 2 NO 2° + O NO° + O 2 O 3 + O 2 O 2

. e… X = OH° Si origina dalla reazione dell’ossigeno eccitato con metano O* + CH 4 OH° + CH 3° Le reazioni che si hanno sono OH° + O 3 HOO° + O 2 HOO° + O OH° +O 2 O 3 + O 2 O 2

Complessivamente, dunque, dalla somma di tali reazioni radicaliche otteniamo O 3 + O 2 O 2 PERTANTO: L’ozono nella stratosfera viene continuamente formato [O° + O 2 + M → O 3 + calore + M] e decomposto. L’insieme delle reazioni finora discusse rappresentano un equilibrio delicato, ma che fornisce l’azione schermante dell’ozonosfera verso la maggior parte dei raggi UV.

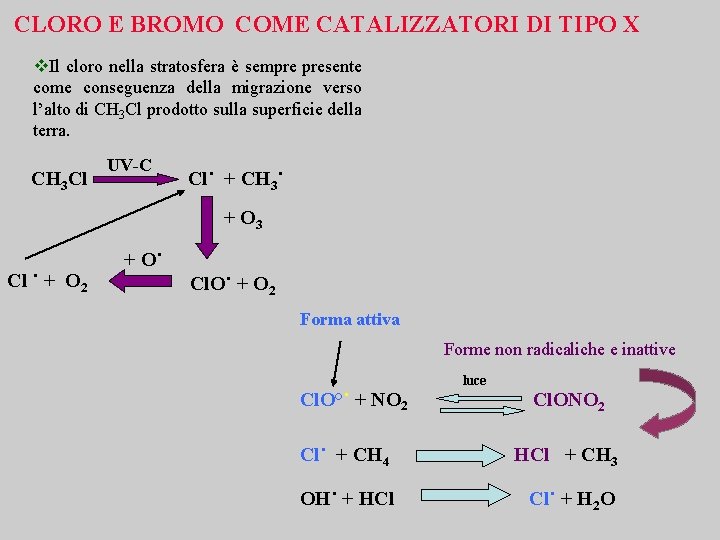
CLORO E BROMO COME CATALIZZATORI DI TIPO X v. Il cloro nella stratosfera è sempre presente come conseguenza della migrazione verso l’alto di CH 3 Cl prodotto sulla superficie della terra. CH 3 Cl UV-C Cl˙ + CH 3˙ + O 3 Cl ˙ + O 2 + O˙ Cl. O˙ + O 2 Forma attiva Forme non radicaliche e inattive Cl. O°˙ + NO 2 luce Cl. ONO 2 Cl˙ + CH 4 HCl + CH 3 OH˙ + HCl Cl˙ + H 2 O

ANCHE IL BROMO COME CATALIZZATORI DL TIPO X v. Il bromo è presente come CH 3 Br che viene usato come fumigante del suolo v. Nella stratosfera viene decomposto dalla luce in bromo atomico v. La forma inattiva è HBr: - la concentrazione di Br° nella stratosfera è minore rispetto al Cl° - la reazione che porta ad HBr è più lenta Br˙ + CH 4 HBr + CH 3 HCl e HBr provocano piogge acide

Formazione ozono nella troposfera • Biossido di azoto (dalle centrali termoelettriche, etc…) subisce dissociazione fotochimica producendo atomi di ossigeno che vanno a formare ozono: UV-A NO 2 O° + O 2 NO° + O 3 O° • La produzione dell’ozono è resa possibile dalla presenza degli inquinanti NOx In condizioni di forte inquinamento la concentrazione di O 3 in prossimità del suolo è dell’ordine di 0. 2 -0. 3 ppm • La riduzione dell’ozono stratosferico contribuisce a ridurre l’effetto serra.