CORROSION COSTOS A CONSIDERAR POR EFECTO DE LA
















- Slides: 24

CORROSION COSTOS A CONSIDERAR POR EFECTO DE LA CORROSION n Pérdida directa por daño a estructuras metálicas n Costos debido al sobrediseño n Costos de mantención n Pérdida por corte de servicio n Costo por accidentes n Pérdida de eficiencia n Contaminación del producto

PROCESO DE CORROSION Ì Tres requisitos Ê Electrolito Ë Electrodos ä Anodo ä Cátodo Paso de electrones

PROCESO DE CORROSION Ánodos y cátodos existen en toda la superficies de hierro y acero, formados por imperfecciones en la superficie, falta de homogeneidad, cortes frescos y formación de óxido rojo TIPOS DE ANODOS Y CATODOS • Dos metales diferentes en contacto • Metal sometido a tensiones • Corte fresco de un metal versus metal antiguo • Variaciones en densidad y composición • Oxido micro escala versus acero

PROCESO DE CORROSION TIPOS DE CELDA GALVANICA • Celda con electrodos diferentes • Celdas de concentración • Celda de aireación diferencial

PROCESO DE CORROSION Serie de galvánica de los metales 1. Magnesio 7. Cobre, bronce 2. Aluminio 8. Grafito 3. Zinc 9. Platino 4. Acero, hierro 10. Oro 5. Hidrógeno 6. Plomo 1: mayor reatividad 7: menor reactividad

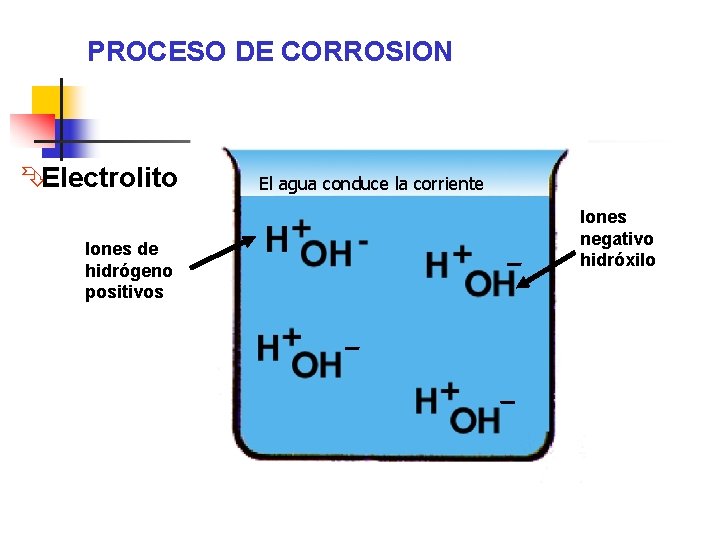
PROCESO DE CORROSION ÊElectrolito Iones de hidrógeno positivos El agua conduce la corriente Iones negativo hidróxilo

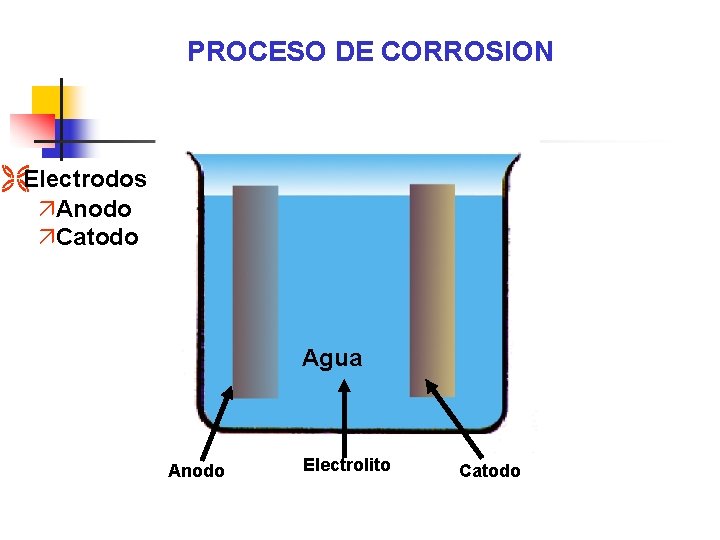
PROCESO DE CORROSION ËElectrodos äAnodo äCatodo Agua Anodo Electrolito Catodo

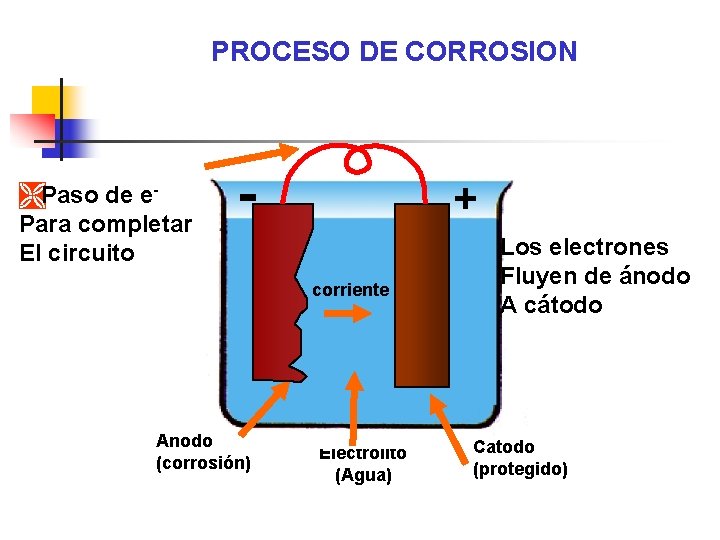
PROCESO DE CORROSION ÌPaso de e. Para completar El circuito - + corriente Anodo (corrosión) Electrolito (Agua) Los electrones Fluyen de ánodo A cátodo Catodo (protegido)

PROCESO DE CORROSION Paso de electrones para Completar el circuito u Puede ser en el mismo metal u Por contacto fisico entre diferentes metales

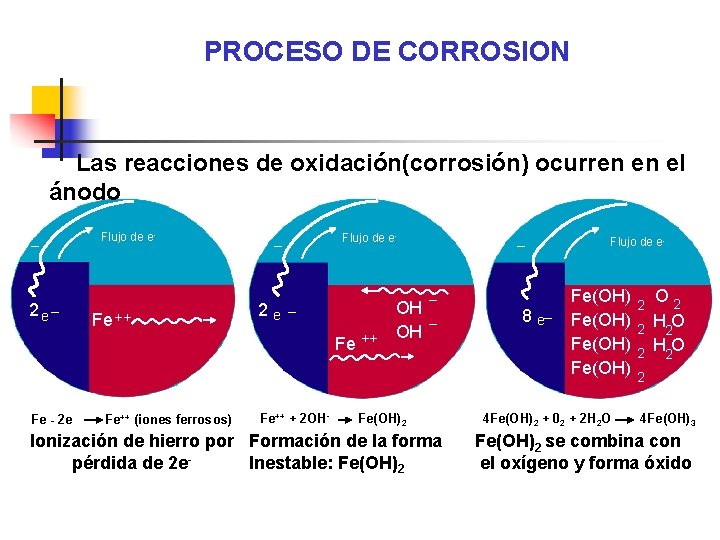
PROCESO DE CORROSION Las reacciones de oxidación(corrosión) ocurren en el ánodo Flujo de e- _ 2 e _ Fe ++ Flujo de e- _ 2 e _ Fe Fe - 2 e Fe ++ (iones ferrosos) Fe++ + 2 OH- ++ OH OH _ _ _ Fe(OH)2 Ionización de hierro por Formación de la forma pérdida de 2 e. Inestable: Fe(OH)2 8 e_ Flujo de e- Fe(OH) 4 Fe(OH)2 + 02 + 2 H 2 O 2 2 2 O 2 H 2 O 2 4 Fe(OH) 3 Fe(OH)2 se combina con el oxígeno y forma óxido

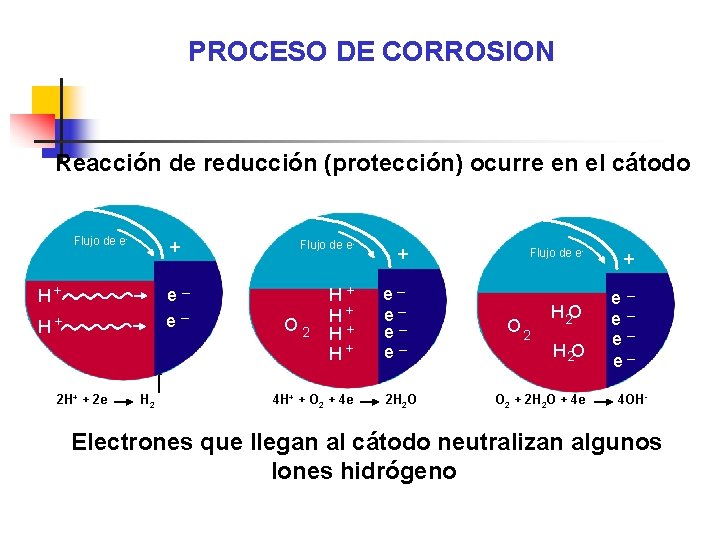
PROCESO DE CORROSION Reacción de reducción (protección) ocurre en el cátodo Flujo de e- + H+ H+ e _ e_ e _ H+ e _ e H+ 2 H+ + 2 e H 2 O 2 4 H+ + O 2 + 4 e Flujo de e- _ 2 H 2 O + _ O 2 H 2 O O 2 + 2 H 2 O + 4 e e _ e _ e 4 OH - Electrones que llegan al cátodo neutralizan algunos Iones hidrógeno

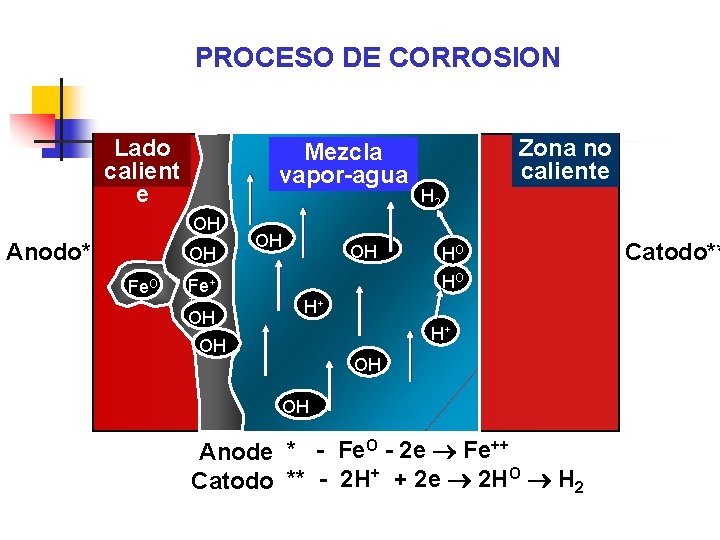
PROCESO DE CORROSION Lado calient e Mezcla vapor-agua OH Anodo* OH Fe. O OH OH OH H 2 HO HO Fe+ + Zona no caliente H+ H+ OH OH OH Anode * - Fe. O - 2 e ® Fe++ Catodo ** - 2 H+ + 2 e ® 2 HO ® H 2 Catodo**

PROCESO DE CORROSION Corrosión por el agua debida a: u Contenido de oxígeno u Alcalinidad/Acidez(p. H) u Gases disueltos(O 2, CO 2) u Ión cloruro

OXIGENO DISUELTO Pri´mera causa de la corrosión Picaduras por oxígeno

CORROSION POR OXIGENO u Ocurre en cualquier parte del sistema u Fácil de reconocer por la formación de pidaduras profundas Pitting

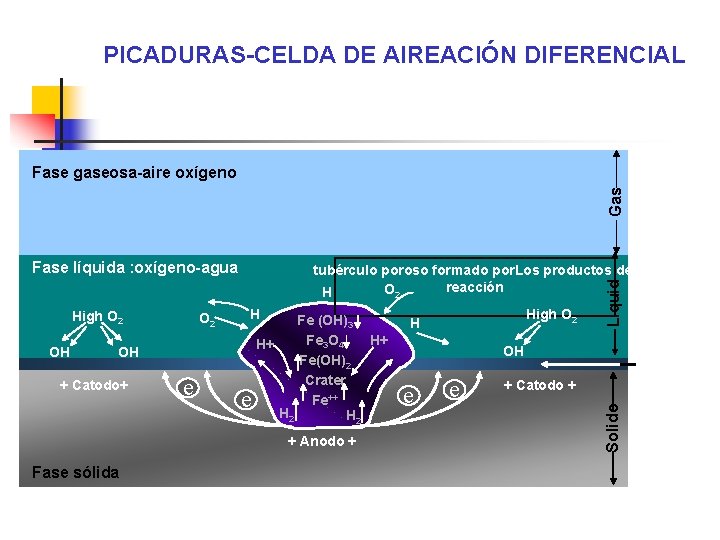
PICADURAS-CELDA DE AIREACIÓN DIFERENCIAL Gas Fase gaseosa-aire oxígeno Fase líquida : oxígeno-agua OH H OH + Catodo+ e e Fe (OH)3 Fe 3 O 4 H+ H+ Fe(OH)2 Crater Fe++ H 2 + Anodo + Fase sólida High O 2 H Liquid O 2 OH e e + Catodo + Solido High O 2 tubérculo poroso formado por. Los productos de reacción O 2 H

CORROSION POR PICADURAS

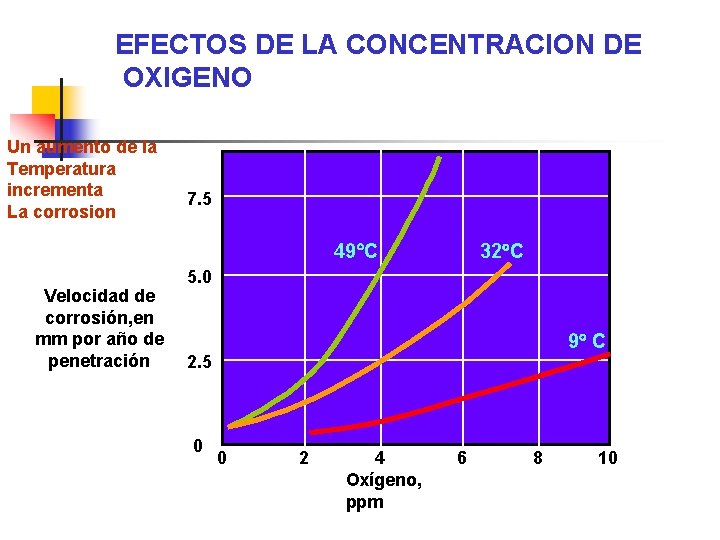
EFECTOS DE LA CONCENTRACION DE OXIGENO Un aumento de la Temperatura incrementa La corrosion 7. 5 49°C Velocidad de corrosión, en mm por año de penetración 32°C 5. 0 9° C 2. 5 0 0 2 4 Oxígeno, ppm 6 8 10

DEPOSITO BAJO CORROSION Disolución del metal Visto desde el interior De la tubería

CORROSION GENERAL Las celdas de corrosión están esparcidas por una superficie muy amplia Común cuando el metal está en contacto Con soluciones ácidas La presencia de cloruros acelera el Proceso de corrosión

ACCIÓN DE LOS CLORUROS O 2 + 2 H 2 O + 4 e 4 OH- 2 Fe. O ® 2 Fe++ + 4 e 2 Fe. O + O 2 + 2 H 2 O + 4 e Fe++ 4 OH- Fe+++ + e / 4 4 Fe++ + O 2 + 2 H 2 O Fe+++ + 4 Clestable que 2 Fe++ + 4 OH- 4 Fe+++ + 4 OHFe. Cl 4 - Formación de complejo muy Consume iones Fe+++ acelerando la disolución del hierro

Sistemas de enfriamiento / Inhibidores de corrosión n n n Cromatos / Dicromatos Nitratos Fosfatos Molibdatos Aceites solubles Silicatos

INHIBIDORES DE CORROSION (reacciones básicas ) Cromatos 2 Feº + 2 Na 2 Cr. O 4 + 2 H 2 O 4 Na. OH n Fe 2 O 3 + Cr 2 O 3 + Nitritos 2 Feº + Na. NO 2 + 2 H 2 O Fe 2 O 3 + Na. OH + NH 3 Hidracina N 2 H 4+O 2 2 H 2 O + N 2 Sulfito Na 2 SO 3 + 1/2 O 2 Na 2 SO 4 n Soluble Oil n

CONTROL DE LA CORROSION EN LOS SISTEMAS DE ENFRIAMIENTO n Anodos de sacrificio Aceites solubles Cromatos Silicatos n Nitrito - Borato ( Liquidewt ) n n n n Nitrito de sodio Borato de sodio Toliltriazol protección del acero Mantiene la alcalinidad protección de aleaciones de cobre Silicato de sodio protección de aluminio