Configuraia electronic a atomului Principii ocupare cu electroni







- Slides: 13


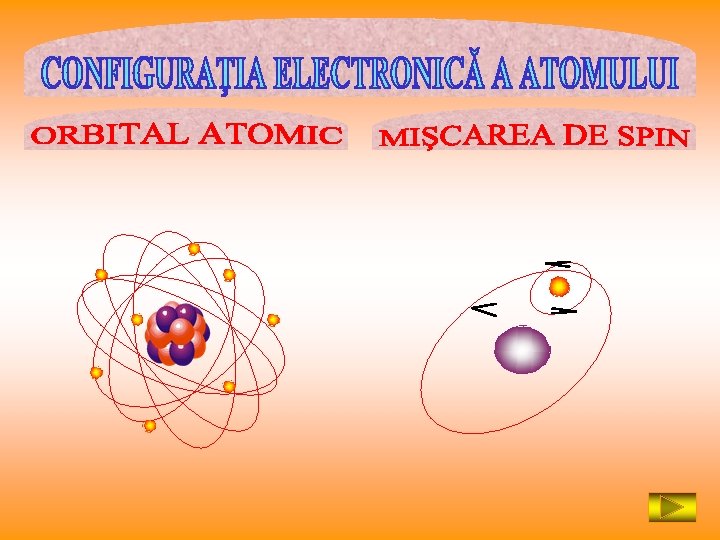
Configuraţia electronică a atomului Principii… ocupare cu electroni a învelişului de electroni Ordinea ocupării straturilor cu electroni Structura atomului Corelaţii… structura atomului – poziţia elementului în sistemul periodic Corelaţii… structura atomului – formarea ionilor pozitivi Corelaţii… structura atomului – formarea ionilor negativi Corelaţii… structura atomului – razele atomilor şi ionilor Corelaţii… structura atomului – caracterul metalic Corelaţii… structura atomului – caracterul nemetalic


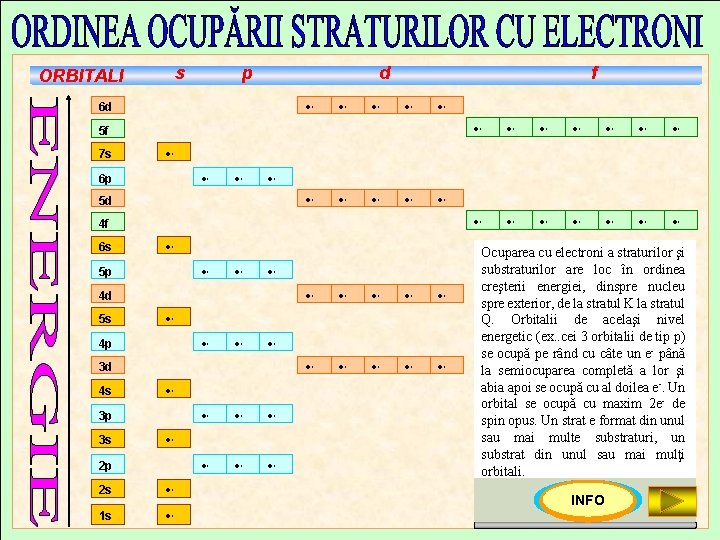
Principiul minimului de energie (principiul stabilităţii): Orbitalii se ocupă cu electroni în ordinea creşterii energiei lor (de la nucleu spre exterior). 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 6 s 2 4 f 14 5 d 10 6 p 6 7 s 2 5 f 14 6 d 10 Principiul de excluziune al lui Pauli: Un orbital poate fi ocupat cu maximum 2 electroni. Regula lui Hund: Orbitalii de aceeaşi energie ai unui substrat se ocupă pe rând, cu câte un electron, până la semiocuparea completă a lor, apoi are loc ocuparea cu al doilea electron (de spin opus). De reţinut! Numărul maxim de electroni de pe un strat este dat de relaţia: Nmax = 2 n 2, unde n=nr. stratului

s ORBITALI p d 6 d f 5 f 7 s 5 p 4 d 4 p 3 d 3 p 3 s 4 f 4 s 5 d 5 s 6 p 6 s 2 p 2 s 1 s Ocuparea cu electroni a straturilor şi substraturilor are loc în ordinea creşterii energiei, dinspre nucleu spre exterior, de la stratul K la stratul Q. Orbitalii de acelaşi nivel energetic (ex. . cei 3 orbitalii de tip p) se ocupă pe rând cu câte un e- până la semiocuparea completă a lor şi abia apoi se ocupă cu al doilea e-. Un orbital se ocupă cu maxim 2 e- de spin opus. Un strat e format din unul sau mai multe substraturi, un substrat din unul sau mai mulţi orbitali. INFO

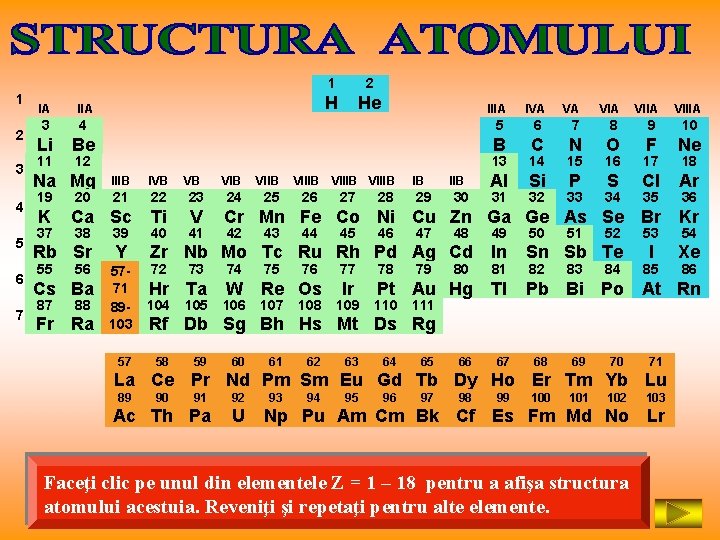
1 2 3 4 5 6 7 IA IIA 3 Li 11 1 2 H He VA VIIA VIIIA 6 7 8 9 10 C N O F Ne IIIA IVA 4 5 Be B 12 Na Mg IIIB IVB VB VIIB 25 VIIIB Al Si P S Cl Ar Kr 23 24 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Sr Y 55 56 Cs Ba 87 88 Fr Ra 5771 89103 57 41 42 43 44 45 46 47 30 17 22 40 29 16 21 39 28 15 20 38 27 IIB 14 19 37 26 IB 13 48 31 49 32 50 33 51 34 52 35 53 54 Sn Sb Te Hr Ta Pb Bi Po At Rn 104 73 105 74 75 76 W Re Os 106 107 108 77 78 Ir Pt Au Hg Tl 109 110 79 80 81 111 82 83 84 85 Rf Db Sg Bh Hs Mt Ds Rg 58 59 60 61 62 63 64 65 66 67 68 69 70 71 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu 89 36 Zr Nb Mo Tc Ru Rh Pd Ag Cd In 72 I 18 90 91 Ac Th Pa 92 U 93 94 95 96 97 98 99 100 101 102 103 Np Pu Am Cm Bk Cf Es Fm Md No Lr Faceţi clic pe unul din elementele Z = 1 – 18 pentru a afişa structura atomului acestuia. Reveniţi şi repetaţi pentru alte elemente. Xe 86

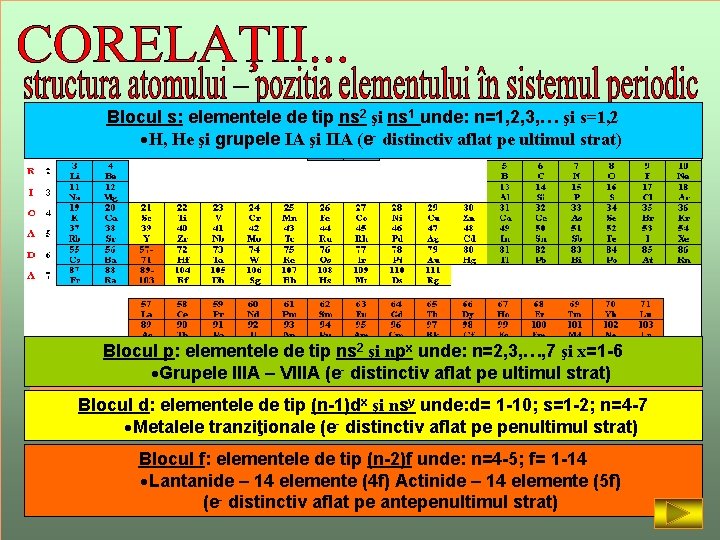
Blocul s: elementele de tip ns 2 şi ns 1 unde: n=1, 2, 3, … şi s=1, 2 ·H, He şi grupele IA şi IIA (e- distinctiv aflat pe ultimul strat) Blocul p: elementele de tip ns 2 şi npx unde: n=2, 3, …, 7 şi x=1 -6 - distinctiv aflat pe ultimul 2 strat) – VIIIAde(epe Observaţii: Nr. ·Grupele maxim de. IIIA electroni un strat este: N max = 2 n (n-nr. stratului) Pentru grupele Numărul electronilor pe ultimul strat. Blocul d: principale: elementele de tip grupei (n-1)dx= şinumărul nsy unde: d= 1 -10; de s=1 -2; n=4 -7 Numărul perioadei = numărul straturilor cu aflat electroni. ·Metalele tranziţionale (e- ocupate distinctiv pe penultimul strat) Indicaţie: Blocul f: elementele de tip (n-2)f unde: n=4 -5; f= 1 -14 Faceţi clic pe ·fiecare categorie pentru a afişa caracteristicile blocurilor Lantanide – 14(culoare) elemente (4 f) Actinide – 14 elemente (5 f) de elemente. Clic iar pentru a le ascunde. (e- distinctiv aflat pe antepenultimul strat)

H+ -1 e - -1 e- -2 e- -3 e-

+3 e- +2 e- +1 e- Creşte electronegativitatea

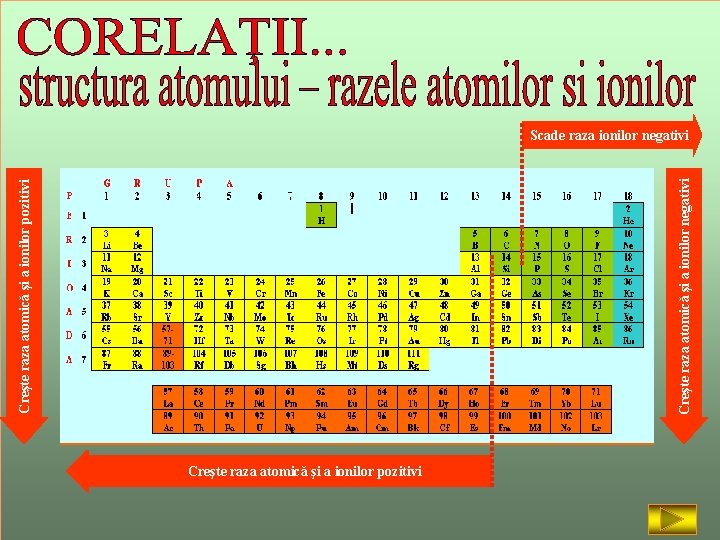
Creşte raza atomică şi a ionilor negativi Creşte raza atomică şi a ionilor pozitivi Scade raza ionilor negativi Creşte raza atomică şi a ionilor pozitivi

Creşte caracterul metalic. Creşte distanţa electronilor de pe ultimul strat faţă de nucleu. Scade atracţia nucleului asupra electronilor de pe ultimul strat. Scade energia de ionizare. Creşte caracterul metalic. Scade sarcina nucleară. Scade atracţia nucleului asupra electronilor de pe ultimul strat. Scade nr de electroni cedaţi. Scade energia de ionizare.

Creşte caracterul nemetalic. Scade distanţa electronilor de pe ultimul strat faţă de nucleu. Creşte atracţia nucleului asupra electronilor de pe ultimul strat. Creşte caracterul nemetalic. Scade sarcina nucleară. Creşte atracţia nucleului asupra electronilor de pe ultimul strat. Scade nr de electroni acceptaţi.
