CONCENTRAO DAS SOLUES CONCENTRAO QUANTIDADE DO SOLUTO QUANTIDADE














- Slides: 20

CONCENTRAÇÃO DAS SOLUÇÕES

CONCENTRAÇÃO: QUANTIDADE DO SOLUTO QUANTIDADE DA SOLUÇÃO OU QUANTIDADE DO SOLVENTE

QUANTIDADE PODE SER EXPRESSA EM: ¡ MASSA: g, Kg, mg, t. 1 Kg = 1. 000 g 1 g = 1. 000 mg. 1 t = 106 g = 1. 000 g

VOLUME: PODE SER EXPRESSO NAS UNIDADES: L, m. L, cm 3 , m 3 e outras. 1 L = 1. 000 m. L = 1. 000 cm 3 1 m 3 = 1. 000 L

QUANTIDADE DE MATÉRIA (UNIDADE: NÚMERO DE MOLS – n) massa da substância n= massa molar da substância

DEPENDENDO DAS UNIDADES DE QUANTIDADE QUE USAMOS, AS CONCENTRAÇÕES TERÃO NOMES DIFERENTES.

Dependendo das unidades de quantidade que usamos, as concentrações terão nomes diferentes. Concentração Comum (C) massa do soluto C= (g/L) volume da solução

CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA – MOLARIDADE (M). número de mol do soluto M= volume da solução em litros massa do soluto M= massa molar do soluto x V(L) da solução

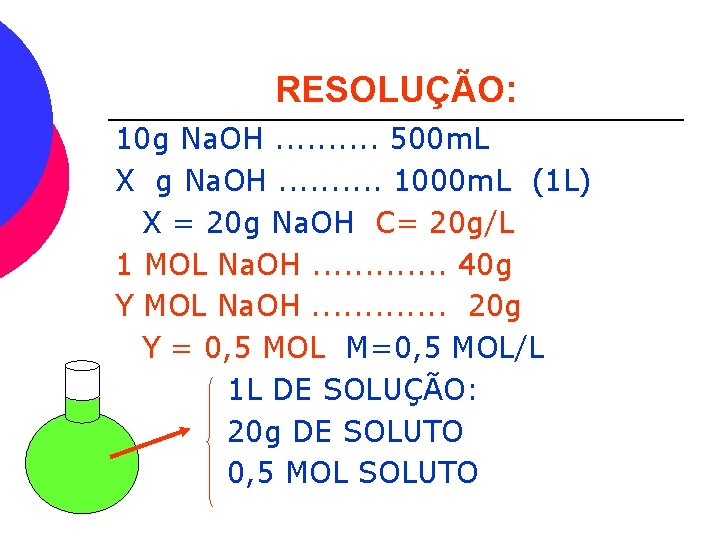
EXEMPLO ¡ EM UM BALÃO DE FUNDO REDONDO FORAM COLOCADOS 10 g DE Na. OH (40 g/MOL) E O VOLUME COMPLETADO COM ÁGUA ATÉ PERFAZER 500 m. L DE SOLUÇÃO. CALCULE A CONCENTRAÇÃO COMUM E A CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA.

RESOLUÇÃO: 10 g Na. OH. . 500 m. L X g Na. OH. . 1000 m. L (1 L) X = 20 g Na. OH C= 20 g/L 1 MOL Na. OH. . . 40 g Y MOL Na. OH. . . 20 g Y = 0, 5 MOL M=0, 5 MOL/L 1 L DE SOLUÇÃO: 20 g DE SOLUTO 0, 5 MOL SOLUTO

EM 1 L DE SOLUÇÃO, CASO EU DETERMINE. . . O NÚMERO DE MOL DO SOLUTO, EU SEI A CONCENTRAÇÃO EM QUANTIDADE DE MATÉRIA OU MOLARIDADE (MOL/L. ). . . A MASSA DO SOLUTO EM GRAMAS, EU SEI A - CONCENTRAÇÃO COMUM ( g/L ). . O NÚMERO DE EQUIVALENTES DO SOLUTO, (neq) - EU SEI A NORMALIDADE (em desuso).

PORCENTAGEM EM MASSA (P) MASSA DO SOLUTO P= X 100 MASSA DA SOLUÇÃO ADICIONAMOS 20 g DE Na. Cℓ EM 100 g DE ÁGUA. CALCULE P. 12 Og. . . . . 100% 20 g. . . . . X% X = 16, 7%

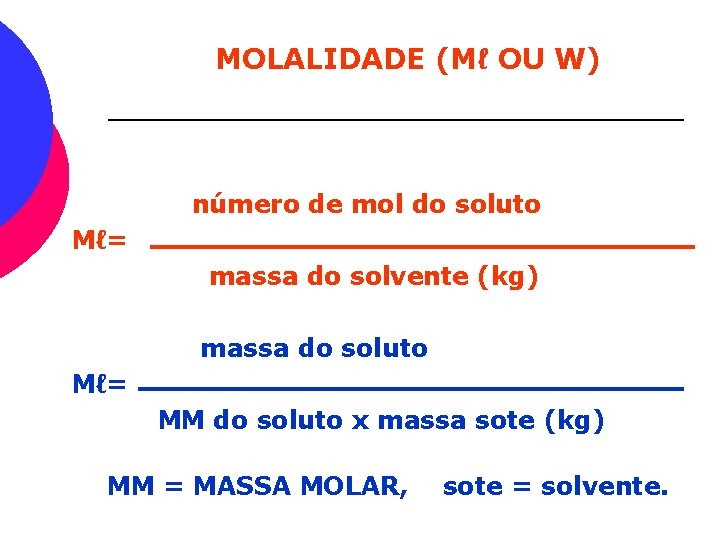
MOLALIDADE (Mℓ OU W) número de mol do soluto Mℓ= massa do solvente (kg) massa do soluto Mℓ= MM do soluto x massa sote (kg) MM = MASSA MOLAR, sote = solvente.

CASO EU SAIBA EM 1 Kg DE SOLVENTE, O NÚMERO DE MOLS DO SOLUTO, EU SEI A MOLALIDADE. CASO EU SAIBA A MASSA DO SOLUTO EM 100 g DE SOLUÇÃO, EU SEI A PORCENTAGEM EM MASSA (P). P/100 = TÍTULO -τ.

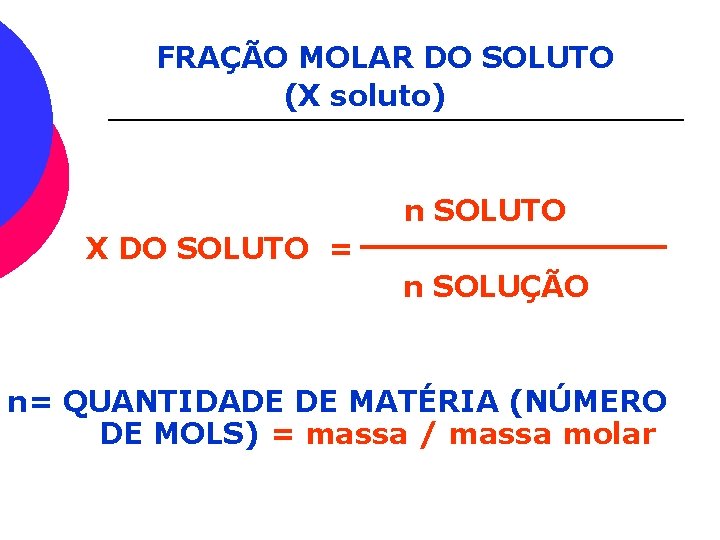
FRAÇÃO MOLAR DO SOLUTO (X soluto) n SOLUTO X DO SOLUTO = n SOLUÇÃO n= QUANTIDADE DE MATÉRIA (NÚMERO DE MOLS) = massa / massa molar

EXEMPLO: DISSOLVEU-SE 1 Og DE Na. OH(40 g/MOL) EM 90 g DE ÁGUA (18 g/mol). CALCULE A FRAÇÃO MOLAR DO SOLUTO. RESOLUÇÃO: Cálculo de n: n. Na. OH=10 g/ 40 g/MOL = 0, 25 mol n H 2 O = 90 g/18 g/MOL = 5 mol Cálculo de X: X Na. OH = 0, 25 mol / (0, 25+5)mol X Na. OH = 0, 0476

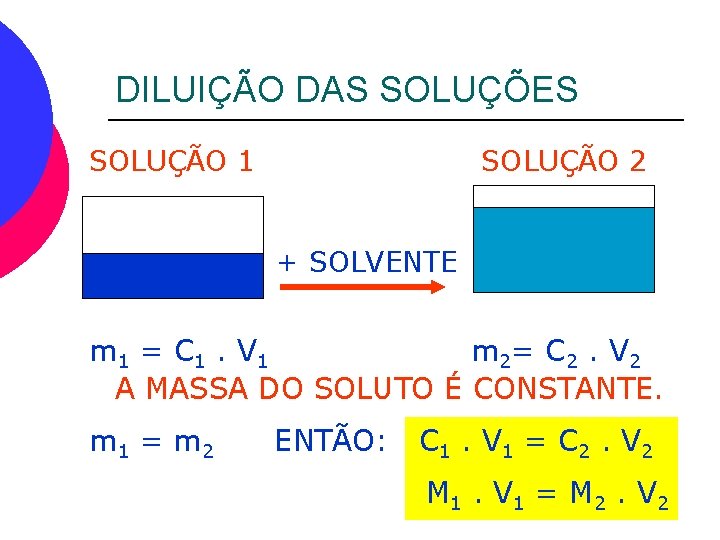
DILUIÇÃO DAS SOLUÇÕES SOLUÇÃO 1 SOLUÇÃO 2 + SOLVENTE m 1 = C 1. V 1 m 2= C 2. V 2 A MASSA DO SOLUTO É CONSTANTE. m 1 = m 2 ENTÃO: C 1. V 1 = C 2. V 2 M 1. V 1 = M 2. V 2

MISTURA DE SOLUÇÕES DE MESMO SOLUTO: SOMAMOS AS QUANTIDADES DO SOLUTO SOLUÇÃO 1 + SOLUÇÃO 2 = SOLUÇÃO 3 + = m 1 = C 1. V 1 m 2 = C 2. V 2 m 3 = C 3. V 3 m 1 + m 2 = m 3 C 1. V 1 + C 2. V 2 = C 3. V 3 M 1. V 1 + M 2. V 2 = M 3. V 3

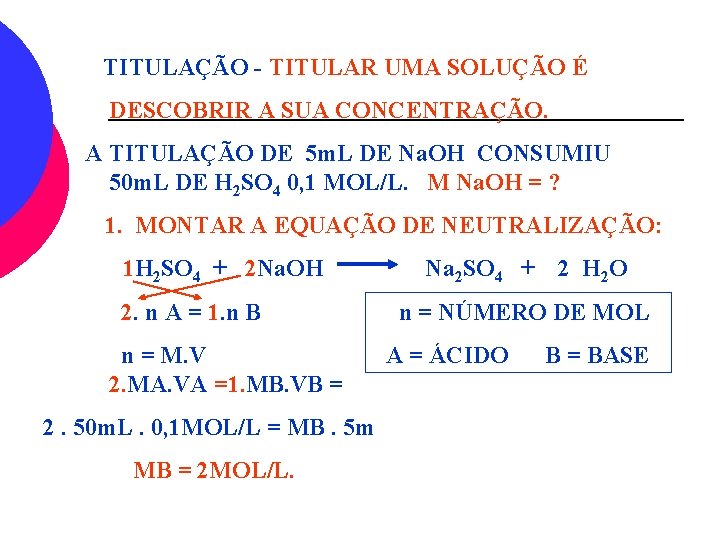
TITULAÇÃO - TITULAR UMA SOLUÇÃO É DESCOBRIR A SUA CONCENTRAÇÃO. A TITULAÇÃO DE 5 m. L DE Na. OH CONSUMIU 50 m. L DE H 2 SO 4 0, 1 MOL/L. M Na. OH = ? 1. MONTAR A EQUAÇÃO DE NEUTRALIZAÇÃO: 1 H 2 SO 4 + 2 Na. OH 2. n A = 1. n B n = M. V 2. MA. VA =1. MB. VB = 2. 50 m. L. 0, 1 MOL/L = MB. 5 m MB = 2 MOL/L. Na 2 SO 4 + 2 H 2 O n = NÚMERO DE MOL A = ÁCIDO B = BASE

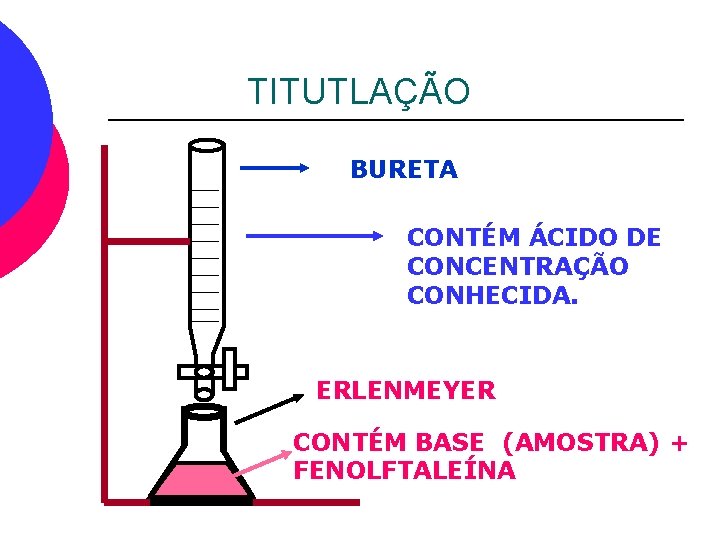
TITUTLAÇÃO BURETA CONTÉM ÁCIDO DE CONCENTRAÇÃO CONHECIDA. ERLENMEYER CONTÉM BASE (AMOSTRA) + FENOLFTALEÍNA