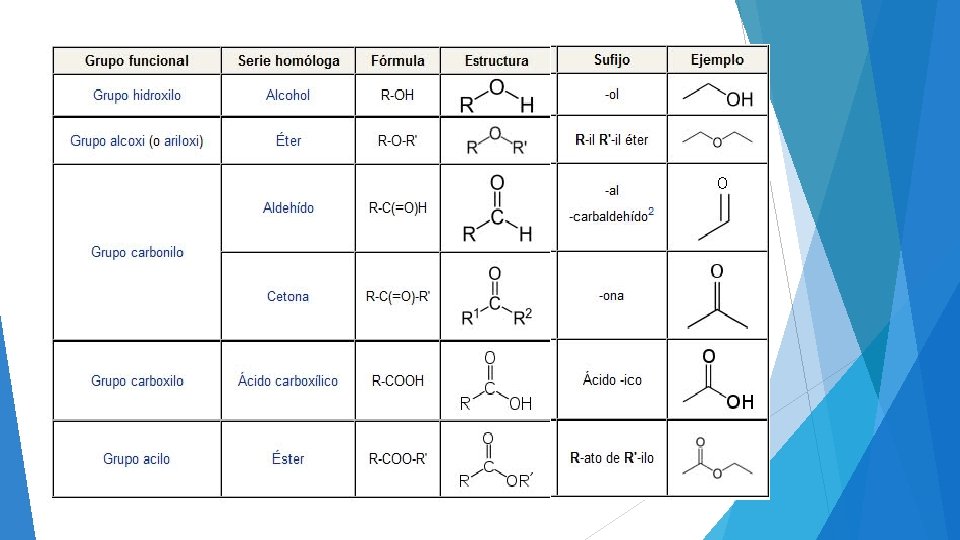
Compuestos Orgnicos Oxigenados y Nitrogenados Alcoholes y Fenoles






- Slides: 20

Compuestos Orgánicos Oxigenados y Nitrogenados. • Alcoholes y Fenoles • Aldehídos y Cetonas • Ácidos Carboxílicos y Ésteres. • Aminas y Amidas. Química 18 -102016.


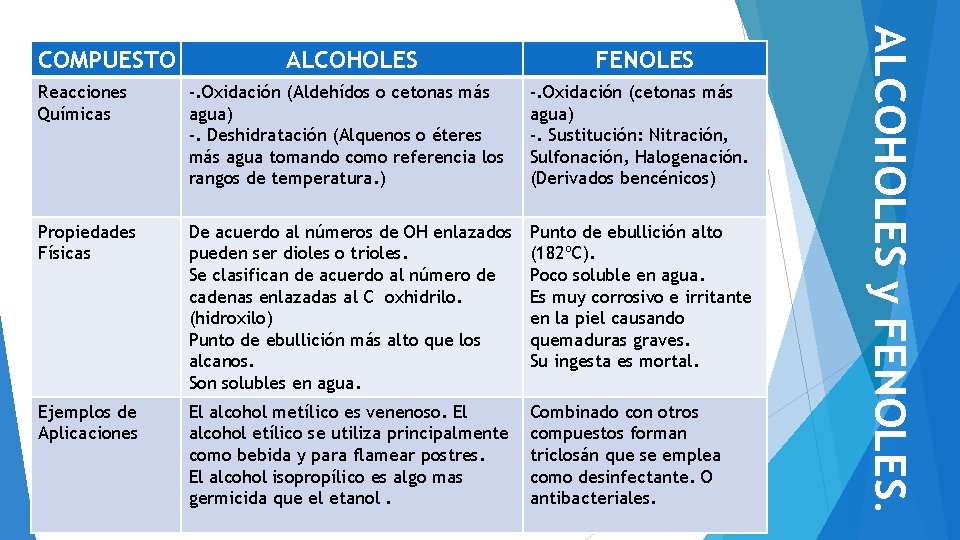
ALCOHOLES FENOLES Reacciones Químicas -. Oxidación (Aldehídos o cetonas más agua) -. Deshidratación (Alquenos o éteres más agua tomando como referencia los rangos de temperatura. ) -. Oxidación (cetonas más agua) -. Sustitución: Nitración, Sulfonación, Halogenación. (Derivados bencénicos) Propiedades Físicas De acuerdo al números de OH enlazados pueden ser dioles o trioles. Se clasifican de acuerdo al número de cadenas enlazadas al C oxhidrilo. (hidroxilo) Punto de ebullición más alto que los alcanos. Son solubles en agua. Punto de ebullición alto (182ºC). Poco soluble en agua. Es muy corrosivo e irritante en la piel causando quemaduras graves. Su ingesta es mortal. Ejemplos de Aplicaciones El alcohol metílico es venenoso. El alcohol etílico se utiliza principalmente como bebida y para flamear postres. El alcohol isopropílico es algo mas germicida que el etanol. Combinado con otros compuestos forman triclosán que se emplea como desinfectante. O antibacteriales. ALCOHOLES y FENOLES. COMPUESTO

PROPIEDADES NOMENCLATURA Es un átomo de oxígeno que une mediante enlaces sencillos a dos átomos de carbono que forman grupos alquilos o aromáticos. Presentan isomería estructural con los alcoholes obteniendo la misma fórmula molecular. Se empleaba éter Se pueden usar en etílico como orden alfabético anestésico, los nombres bloqueando las alquilos de las señales de cadenas seguidos conciencia del de la función éter. cerebro, pérdida de memoria e El grupo con menos insensibilidad al carbonos se dolor. nombra como función alcoxi Existen otros no seguida del radical inflamables como del alcano con más forano, etrano y carbonos. pentrano. Su grupo funcional se representa por : • R-O-R` • Ar-O-Ar Pueden ser inflamables como el éter etílico. Pueden formar puentes de hidrògeno por lo cual es soluble en agua. APLICACIONES ÉTERES DEFINICIÓN

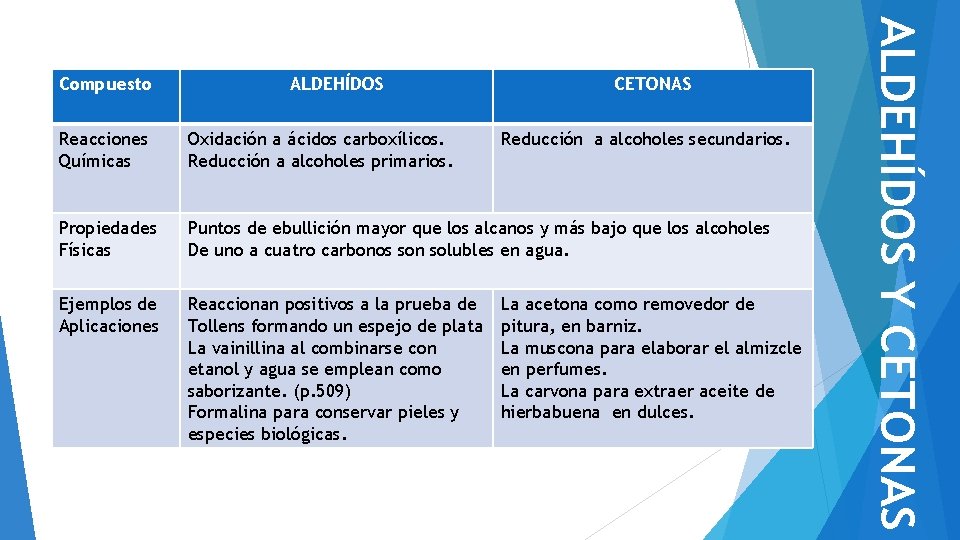
ALDEHÍDOS CETONAS Reacciones Químicas Oxidación a ácidos carboxílicos. Reducción a alcoholes primarios. Reducción a alcoholes secundarios. Propiedades Físicas Puntos de ebullición mayor que los alcanos y más bajo que los alcoholes De uno a cuatro carbonos son solubles en agua. Ejemplos de Aplicaciones Reaccionan positivos a la prueba de Tollens formando un espejo de plata La vainillina al combinarse con etanol y agua se emplean como saborizante. (p. 509) Formalina para conservar pieles y especies biológicas. La acetona como removedor de pitura, en barniz. La muscona para elaborar el almizcle en perfumes. La carvona para extraer aceite de hierbabuena en dulces. ALDEHÍDOS Y CETONAS Compuesto

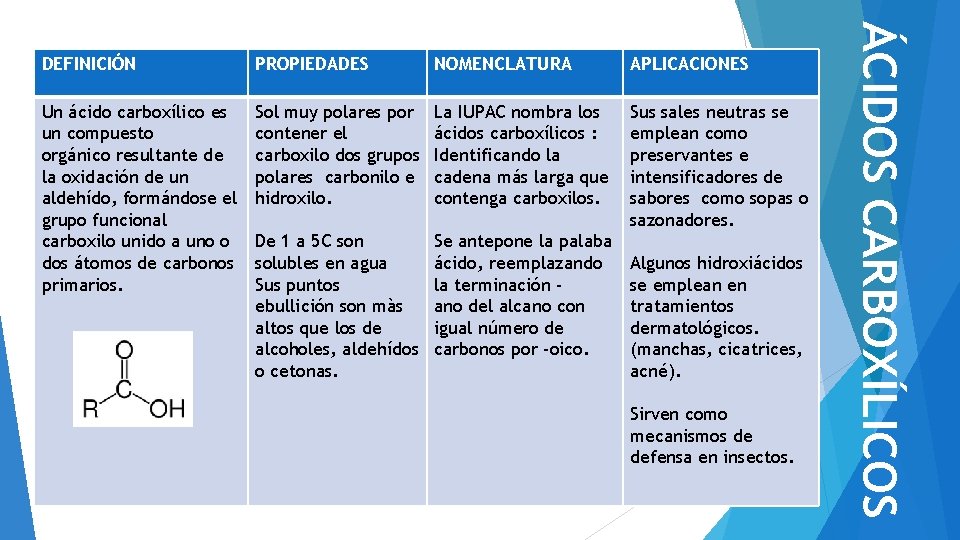
PROPIEDADES NOMENCLATURA APLICACIONES Un ácido carboxílico es un compuesto orgánico resultante de la oxidación de un aldehído, formándose el grupo funcional carboxilo unido a uno o dos átomos de carbonos primarios. Sol muy polares por contener el carboxilo dos grupos polares carbonilo e hidroxilo. La IUPAC nombra los ácidos carboxílicos : Identificando la cadena más larga que contenga carboxilos. Sus sales neutras se emplean como preservantes e intensificadores de sabores como sopas o sazonadores. De 1 a 5 C son solubles en agua Sus puntos ebullición son màs altos que los de alcoholes, aldehídos o cetonas. Se antepone la palaba ácido, reemplazando la terminación ano del alcano con igual número de carbonos por -oico. Algunos hidroxiácidos se emplean en tratamientos dermatológicos. (manchas, cicatrices, acné). Sirven como mecanismos de defensa en insectos. ÁCIDOS CARBOXÍLICOS DEFINICIÓN

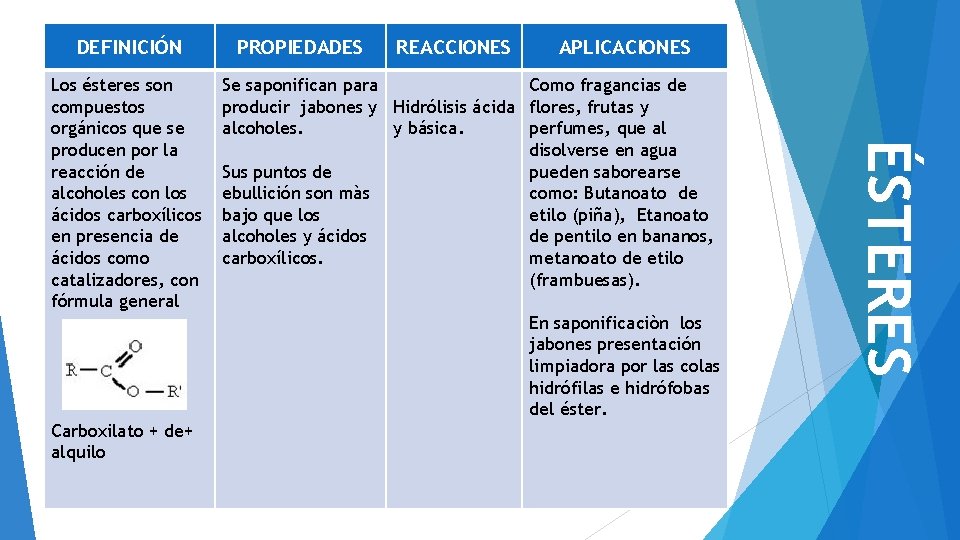
DEFINICIÓN REACCIONES APLICACIONES Se saponifican para Como fragancias de producir jabones y Hidrólisis ácida flores, frutas y alcoholes. y básica. perfumes, que al disolverse en agua Sus puntos de pueden saborearse ebullición son màs como: Butanoato de bajo que los etilo (piña), Etanoato alcoholes y ácidos de pentilo en bananos, carboxílicos. metanoato de etilo (frambuesas). En saponificaciòn los jabones presentación limpiadora por las colas hidrófilas e hidrófobas del éster. Carboxilato + de+ alquilo ÉSTERES Los ésteres son compuestos orgánicos que se producen por la reacción de alcoholes con los ácidos carboxílicos en presencia de ácidos como catalizadores, con fórmula general PROPIEDADES

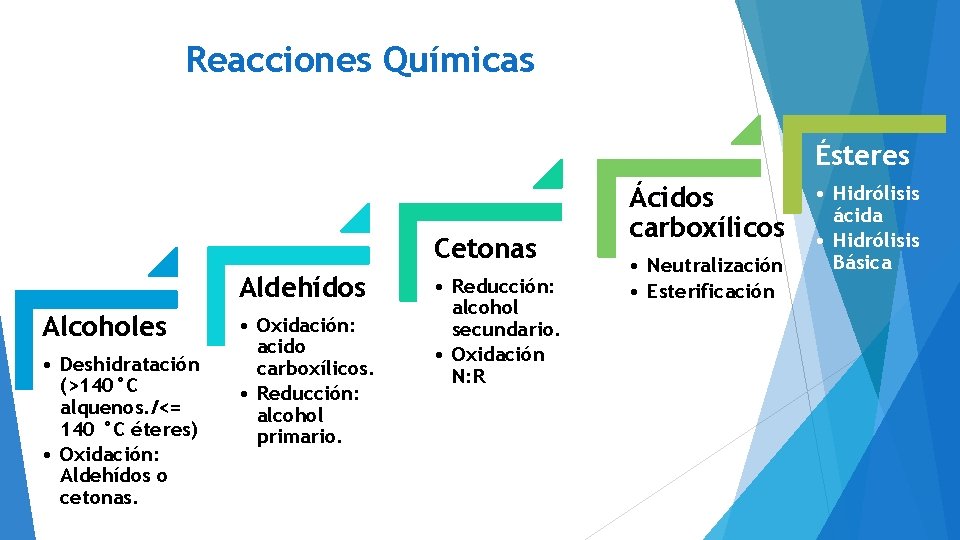
Reacciones Químicas Ésteres Cetonas Aldehídos Alcoholes • Deshidratación (>140°C alquenos. /<= 140 °C éteres) • Oxidación: Aldehídos o cetonas. • Oxidación: acido carboxílicos. • Reducción: alcohol primario. • Reducción: alcohol secundario. • Oxidación N: R Ácidos carboxílicos • Neutralización • Esterificación • Hidrólisis ácida • Hidrólisis Básica

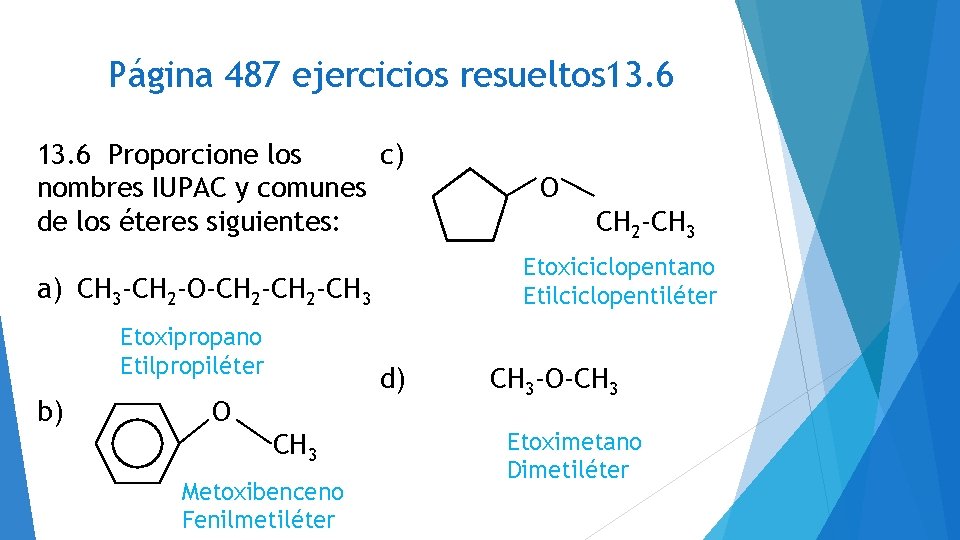
Página 487 ejercicios resueltos 13. 6 Proporcione los c) nombres IUPAC y comunes de los éteres siguientes: b) d) O CH 3 Metoxibenceno Fenilmetiléter CH 2 -CH 3 Etoxiciclopentano Etilciclopentiléter a) CH 3 -CH 2 -O-CH 2 -CH 3 Etoxipropano Etilpropiléter O CH 3 -O-CH 3 Etoximetano Dimetiléter

Página 487 ejercicios resueltos 13. 8 Dibuje la fórmula estructural e cada uno de los siguientes compuestos: a) Dietil éter CH 3 -CH 2 -O-CH 2 -CH 3 b) Difenil éter c) Etoxi ciclohexano -CH 2 -CH 3 O-CH 3 d) 2 -metoxi-2, 3 -dimetil butano CH 3 -C-CH-CH 3 e) 2, 3 -dimetoxipentano CH 3 -CH-CH-CH 2 -CH 3 O-CH 3

Página 518 ejercicios propuestos 14. 20 -Dibuje la fórmula semicondensada para el producto de oxidación de los compuestos: Acetaldehído CH 3 -CH 2 -CHO b) 3 - metil butanona c) Ciclohexano d) 3 -metil butanal a) [O] CH 3 -CH 2 -COOH

Página 518 ejercicios propuestos 14. 24 -Dibuje la fórmula semicondensada para el producto de reducción al agregar hidrógeno en presencia de níquel : a) Etil propilcetona CH 3 -CH 2 -CO-CH 2 -CH 3 H 2 Ni Formaldehído CH 2 O Cl H c) 3 -cloro pentanal CH 3 -CH 2 -CHO Ni H d) 2 -pentanona CH 3 -CH 2 -CO-CH 2 -CH 3 Ni b) 2 2 H 2 Ni

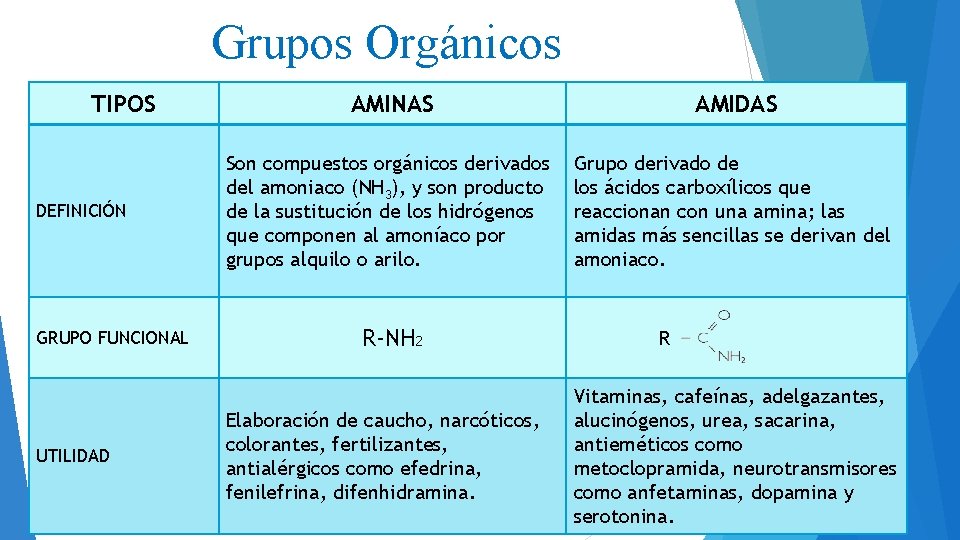
TIPOS DEFINICIÓN GRUPO FUNCIONAL UTILIDAD Grupos Orgánicos AMINAS Nitrogenados AMIDAS Son compuestos orgánicos derivados del amoniaco (NH 3), y son producto de la sustitución de los hidrógenos que componen al amoníaco por grupos alquilo o arilo. Grupo derivado de los ácidos carboxílicos que reaccionan con una amina; las amidas más sencillas se derivan del amoniaco. R-NH 2 Elaboración de caucho, narcóticos, colorantes, fertilizantes, antialérgicos como efedrina, fenilefrina, difenhidramina. R Vitaminas, cafeínas, adelgazantes, alucinógenos, urea, sacarina, antieméticos como metoclopramida, neurotransmisores como anfetaminas, dopamina y serotonina.


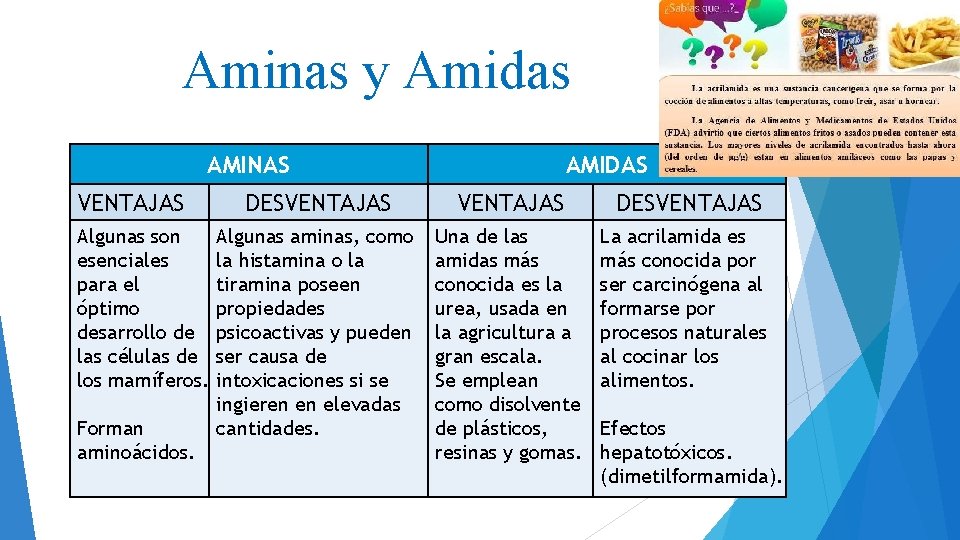
Aminas y Amidas AMINAS VENTAJAS Algunas son esenciales para el óptimo desarrollo de las células de los mamíferos. Forman aminoácidos. AMIDAS DESVENTAJAS Algunas aminas, como la histamina o la tiramina poseen propiedades psicoactivas y pueden ser causa de intoxicaciones si se ingieren en elevadas cantidades. Una de las amidas más conocida es la urea, usada en la agricultura a gran escala. Se emplean como disolvente de plásticos, resinas y gomas. La acrilamida es más conocida por ser carcinógena al formarse por procesos naturales al cocinar los alimentos. Efectos hepatotóxicos. (dimetilformamida).

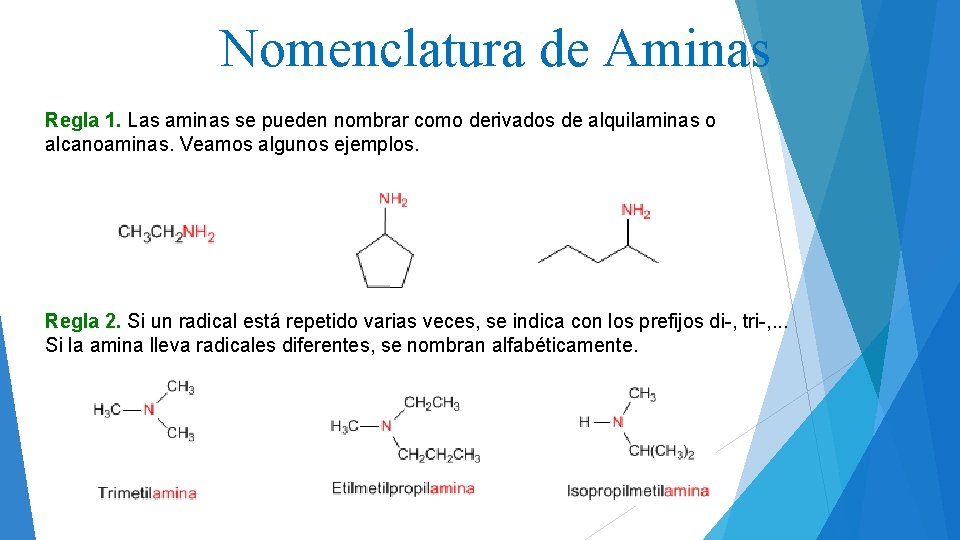
Nomenclatura de Aminas Regla 1. Las aminas se pueden nombrar como derivados de alquilaminas o alcanoaminas. Veamos algunos ejemplos. Regla 2. Si un radical está repetido varias veces, se indica con los prefijos di-, tri-, . . . Si la amina lleva radicales diferentes, se nombran alfabéticamente.

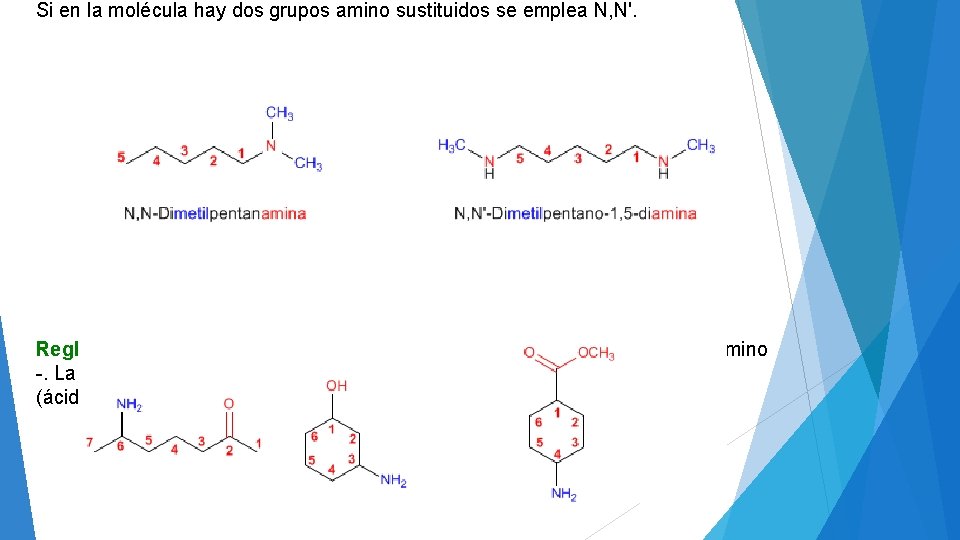
Si en la molécula hay dos grupos amino sustituidos se emplea N, N'. Regla 4. Cuando la amina no es el grupo funcional pasa a nombrarse como amino -. La mayor parte de los grupos funcionales tienen prioridad sobre la amina (ácidos y derivados, carbonilos, alcoholes).

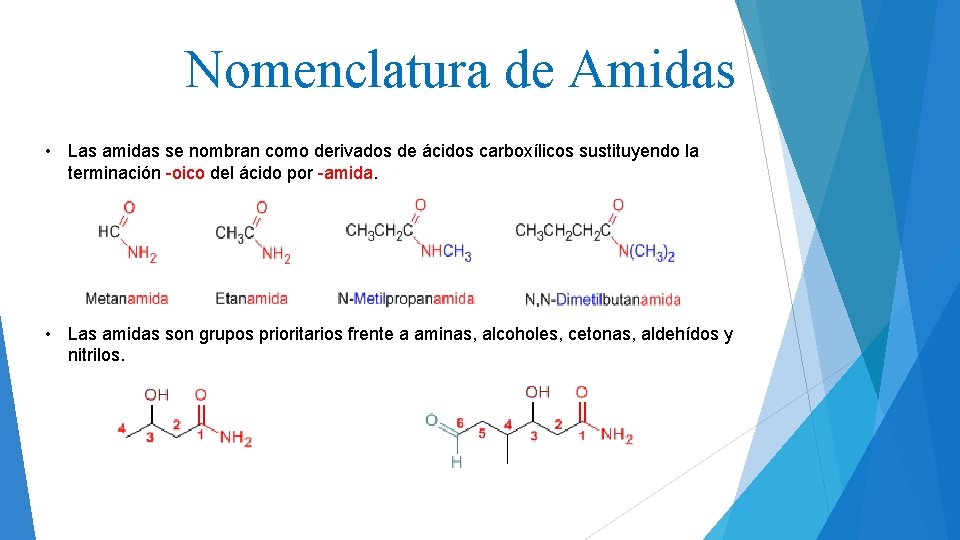
Nomenclatura de Amidas • Las amidas se nombran como derivados de ácidos carboxílicos sustituyendo la terminación -oico del ácido por -amida. • Las amidas son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos y nitrilos.

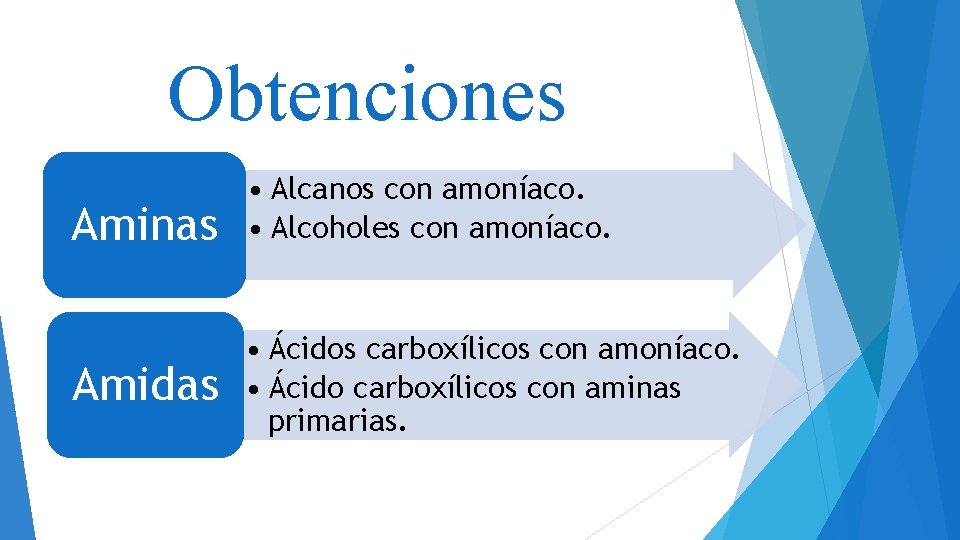
Obtenciones Aminas Amidas • Alcanos con amoníaco. • Alcoholes con amoníaco. • Ácidos carboxílicos con amoníaco. • Ácido carboxílicos con aminas primarias.

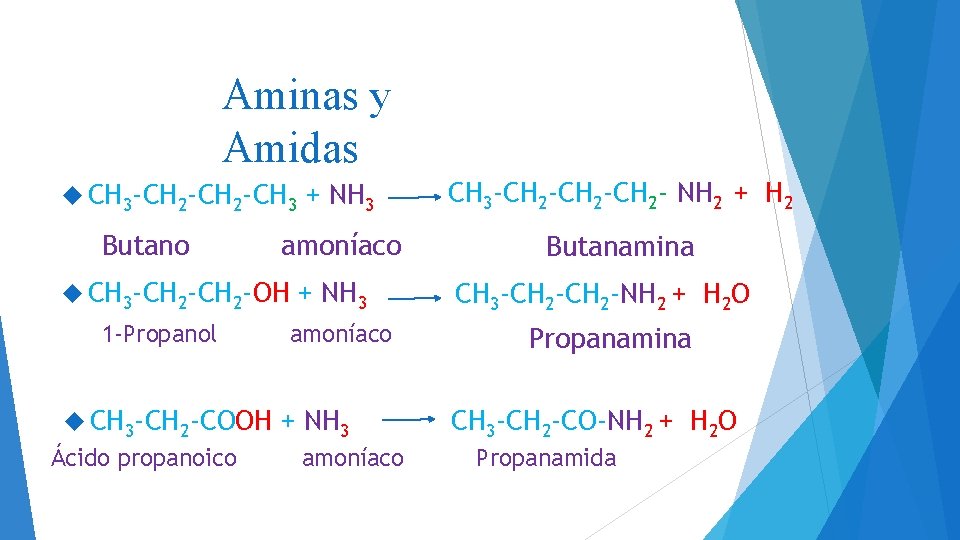
Aminas y Amidas + NH 3 CH 3 -CH 2 -CH 2 - NH 2 + H 2 amoníaco Butanamina CH 3 -CH 2 -CH 3 Butano CH 3 -CH 2 -OH 1 -Propanol CH 3 -CH 2 -COOH Ácido propanoico + NH 3 amoníaco CH 3 -CH 2 -NH 2 + H 2 O Propanamina CH 3 -CH 2 -CO-NH 2 + H 2 O Propanamida