COMPUESTOS NITROGENADOS AMINAS Son compuestos nitrogenados derivados del


































- Slides: 39

COMPUESTOS NITROGENADOS. AMINAS: Son compuestos nitrogenados derivados del amoniaco.

• Los compuestos de nitrógeno se encuentran en : aminoácidos, proteínas, material genético (ADN, ARN), hormonas, vitaminas y neurotransmisores

IMPORTANCIA: • El grupo amino de los aminoácidos tienen importancia en la formación de péptidos y proteínas.

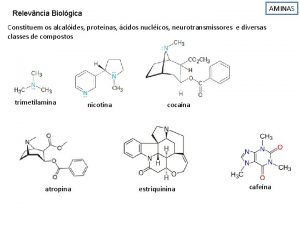
• Producen efectos fisiológicos muy variados : Estimulación del sistema nervioso central (Nicotina), anfetaminas

• La benzocaína, tetracaína, xilocaína, procaína son anestésicos locales tipo amina.

• Los barbitúricos deprimen la actividad del SNC (compuestos con acción hipnótica y sedante) tienen grupo amino

• Los alcaloides son bases ó alcalis que contienen nitrógeno. El nitrógeno en la mayoría de alcaloides se encuentra en anillos heterocíclicos.

• Algunos provocan parálisis, analgésicos (Morfina), tranquilizantes, algunos elevan la presión sanguínea mientras que otros la disminuyen, etc.

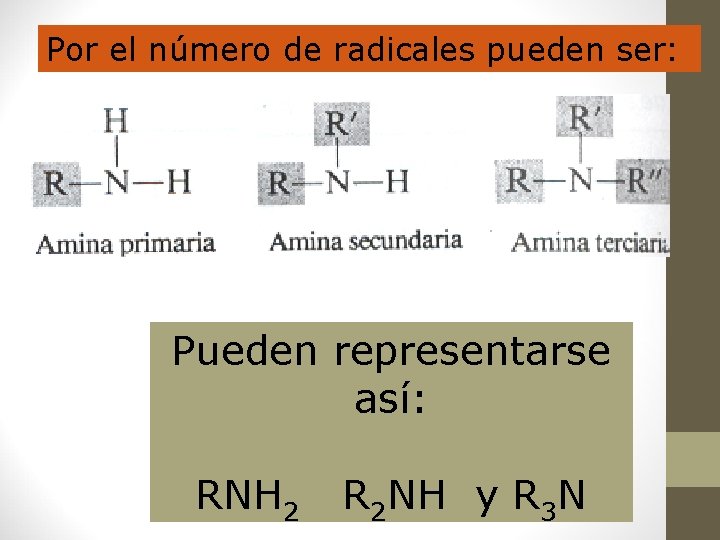
Por el número de radicales pueden ser: Pueden representarse así: RNH 2 R 2 NH y R 3 N

Estructura Nombre R-NH 2 Aminas primarias R-NH-R' Aminas secundarias RNR'R'' Aminas terciarias

NOMENCLATURA: Común: • Se nombran especificando los grupos alquilo y añadiendo el sufijo AMINA. • Cuando hay grupos idénticos se usa di o tri.

• Cuando hay grupos distintos se mencionan en orden alfabetico: CH 3 NHCH 2 CH 3 etilmetilamina Ej. Haga la estructura de la butilamina, dimetilamina, Etilmetilpropilamina

UIQPA: • Identifique y numere la cadena más larga dando prioridad al grupo amina • Coloque la posición del grupo amino

• • Designe y ubique todos los demás grupos con prefijos. Ej. Haga la estructura de la 2 - butanamina, 3 -metil-1 pentanamina

• En el caso de encontrarse un grupo –OH o un grupo carbonilo o carboxilo, el grupo amino se nombra como un sustituyente. Ej. Haga la estructura del 2 -aminopropanal

• La amina aromática base es la ANILINA • Ej. Haga la estructura de la 2 -Bromoanilina

PROPIEDADES FISICAS: • Las aminas más pequeñas son similares al amoníaco en cuanto a basicidad y otras propiedades.

PROPIEDADES FISICAS: • Son moderadamente polares; sus puntos de ebullición son mayores a los de los alcanos pero inferiores a los de los alcoholes.

PROPIEDADES FISICAS: • Las aminas primarias y secundarias forman puentes de hidrógeno entre sí y con el agua.

PROPIEDADES FISICAS: • Las aminas terciarias no forman puentes de hidrógeno entre ellas, pero sí con el agua, su punto de ebullición es menor que las primarias y secundarias de peso molecular semejante

PROPIEDADES FISICAS: • El punto de ebullición y de fusión aumenta a medida que aumenta el peso molecular

PROPIEDADES FISICAS: • Algunos de los productos de la putrefacción son diaminoalcanos y tienen olores muy desagradables y su nombre se debe a su procedencia.

• Ej: NH 2(CH 2)4 NH 2 putrescina • NH 2(CH 2)5 NH 2 cadaverina

PROPIEDADES FISICAS: • Las aminas más pequeñas son solubles. • Mientras más carbonos tienen pierden solubilidad.

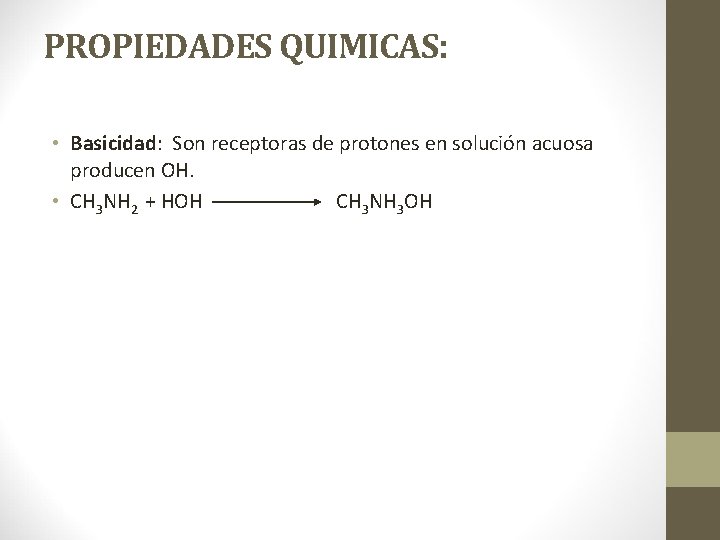
PROPIEDADES QUIMICAS: • Basicidad: Son receptoras de protones en solución acuosa producen OH. • CH 3 NH 2 + HOH CH 3 NH 3 OH

Formación de sales: • Tienen capacidad de formar sales al reaccionar con los ácidos. • CH 3 CH 2 NH 2 +HCl CH 3 CH 2 NH 3 Cl Cloruro de etilamonio

• CH 3 NH 2 +HNO 3 CH 3 NO 3 Nitrato de metil amonio • Las sales son sólidos inodoros, no volátiles, solubles en agua, insolubles en compuestos orgánicos.

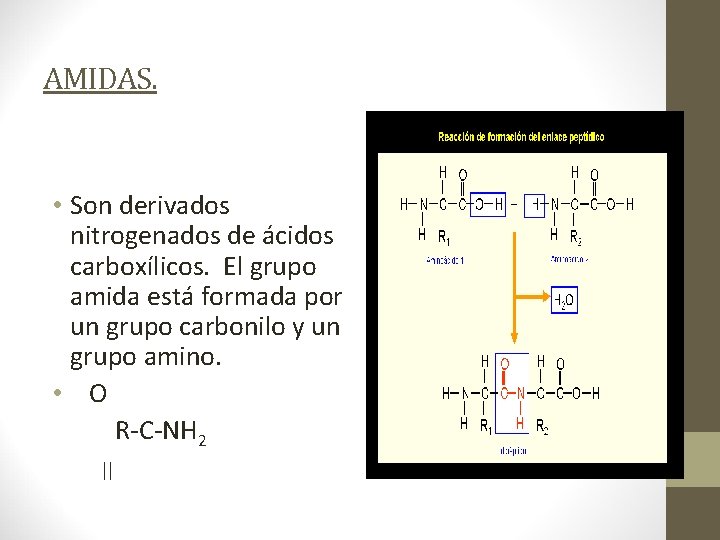
AMIDAS. • Son derivados nitrogenados de ácidos carboxílicos. El grupo amida está formada por un grupo carbonilo y un grupo amino. • O R-C-NH 2

• Las amidas se pueden preparar haciendo reaccionar un ácido carboxílico con amoniaco o una amina. • R-COOH + RNH 2 R-CONHR + H 2 O

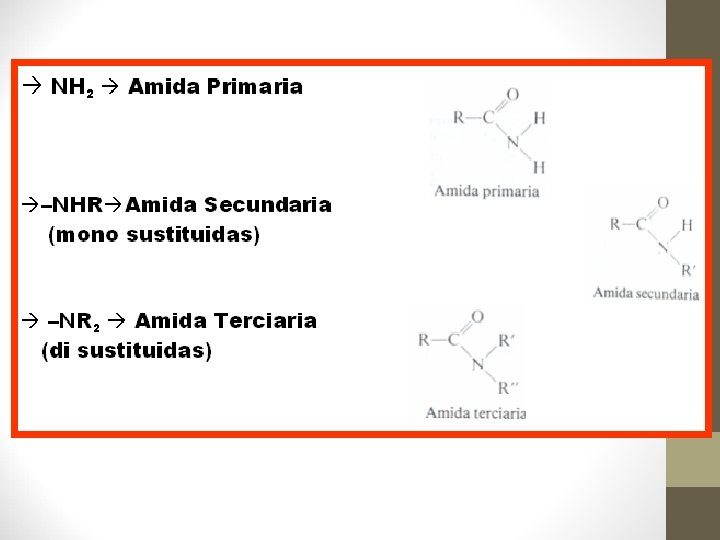
Cuando el nitrógeno de la función amida está unido a: • Dos hidrógenos la amida es primaria • Un hidrógeno y a un radical alquilo (R), la amida es secundaria • Dos radicales alquilo la amida es terciaria PRIMARIA SECUNDARIA TERCIARIA


• • • La sustitución del OH por NH 2 amida primaria Ej. R-CO-NH 2 CH 3 -CO-NH 2 Acetamida ó etanamida

• • Sustitución del -OH por –NHR amida secundaria. Ej. R-CO-N-RH CH 3 CH 2 -CONH-CH 2 CH 3 IUPAC: N-etilpropanamida COMUN: N-etilpropionamida

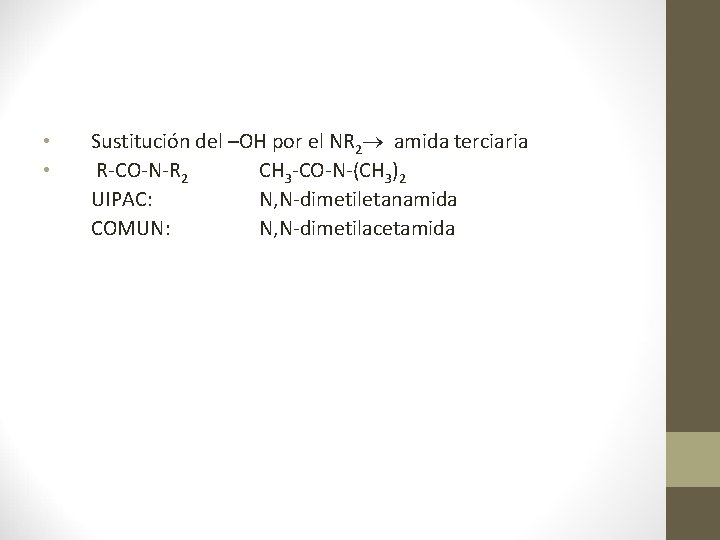
• • Sustitución del –OH por el NR 2 amida terciaria R-CO-N-R 2 CH 3 -CO-N-(CH 3)2 UIPAC: N, N-dimetiletanamida COMUN: N, N-dimetilacetamida


• El enlace amida es muy estable y se encuentra en las proteínas, nylon y otros polímeros industriales.

PROPIEDADES FÍSICAS: • Las amidas que tienen un sustituyente o ninguno, son capaces de formar puentes de hidrógeno entre sí, por consiguiente tienen altos puntos de fusión y ebullición

PROPIEDADES FÍSICAS: • Las amidas disustituídas no pueden formar puentes de hidrógeno entre sí por lo que tienen puntos de ebullición y fusión más bajos.

• La actividad antibacteriana de las sulfamidas • Algunos medicamentos antidiabéticos son sulfonamidas como: carbutamida, tolbutamida y sulfonamidas
 Grupo funcional nitrogenado
Grupo funcional nitrogenado Rhizobium simbiosis
Rhizobium simbiosis Diferencia entre compuestos oxigenados y nitrogenados
Diferencia entre compuestos oxigenados y nitrogenados Ejemplos de isomeros
Ejemplos de isomeros Propanonitrilo grupo funcional
Propanonitrilo grupo funcional Indicaciones de levosimendan
Indicaciones de levosimendan Propiedades de los hidrocarburos aromáticos
Propiedades de los hidrocarburos aromáticos Lipidos clasificacion
Lipidos clasificacion Aminas terciarias ejemplos
Aminas terciarias ejemplos Grupo funcional nitrilo
Grupo funcional nitrilo Infrarrojo
Infrarrojo Etilfenilamina
Etilfenilamina Espectro ir
Espectro ir Aminas vasoactivas ejemplos
Aminas vasoactivas ejemplos Factor activador de plaquetas
Factor activador de plaquetas Receptores colinergicos
Receptores colinergicos Aminas biogenas neurotransmisores
Aminas biogenas neurotransmisores Fenildimetilamina
Fenildimetilamina Aminas
Aminas Propil dimetil amina
Propil dimetil amina Alonso formula aminas
Alonso formula aminas Gamas de norepinefrina
Gamas de norepinefrina Hidrilisis
Hidrilisis Relevncia
Relevncia Analgsicos
Analgsicos Producto mayoritario
Producto mayoritario Condensacion
Condensacion ácido 4-hidroxi-3-metilpentanoico
ácido 4-hidroxi-3-metilpentanoico Derivados de la vasicina
Derivados de la vasicina Lipídios derivados
Lipídios derivados Lipideos simples
Lipideos simples Lipídios derivados
Lipídios derivados Quinta semana de embarazo embriologia
Quinta semana de embarazo embriologia Hidrolisis de acidos carboxilicos
Hidrolisis de acidos carboxilicos Cyberpunk y sus derivados
Cyberpunk y sus derivados Instrumentos financieros derivados
Instrumentos financieros derivados Papa canchán
Papa canchán Derivados de gesto
Derivados de gesto Adjetivo de pensamiento
Adjetivo de pensamiento Derivada de paz
Derivada de paz