compostos qumicos inorgnicos COMPOSTOS QUMICOS Substancias formadas por

compostos químicos (inorgánicos)

COMPOSTOS QUÍMICOS • Substancias formadas por varios elementos cunha composición fixa. • Os átomos diferentes elementos únense entre sí polos electróns da última capa. • Están formados por moléculas ou ións con enlaces estables. • Os seus compoñentes non se poden separar por procesos físicos. • Represéntanse por unha fórmula química. MOLÉCULA DE AUGA A auga é un composto formado por partículas (átomos) de dous elementos unidos entre sí: o osíxeno (O) e o hidróxeno (H). H 2 O Nunha pinga de auga hai trillóns de moléculas.
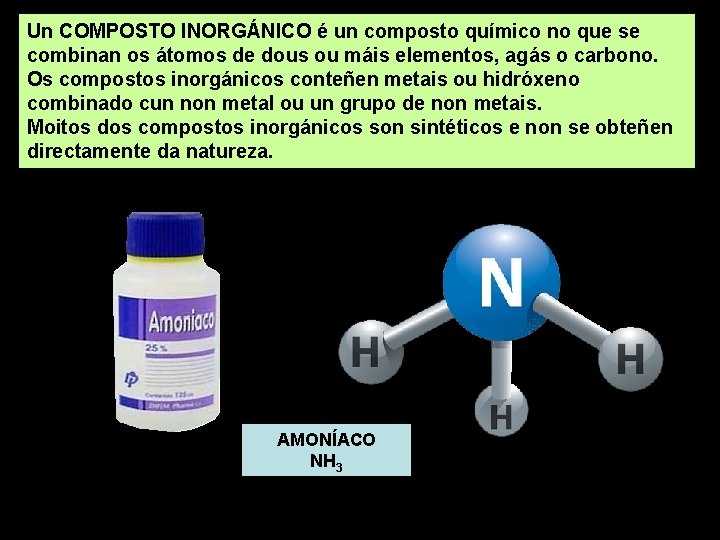
Un COMPOSTO INORGÁNICO é un composto químico no que se combinan os átomos de dous ou máis elementos, agás o carbono. Os compostos inorgánicos conteñen metais ou hidróxeno combinado cun non metal ou un grupo de non metais. Moitos dos compostos inorgánicos son sintéticos e non se obteñen directamente da natureza. AMONÍACO NH 3
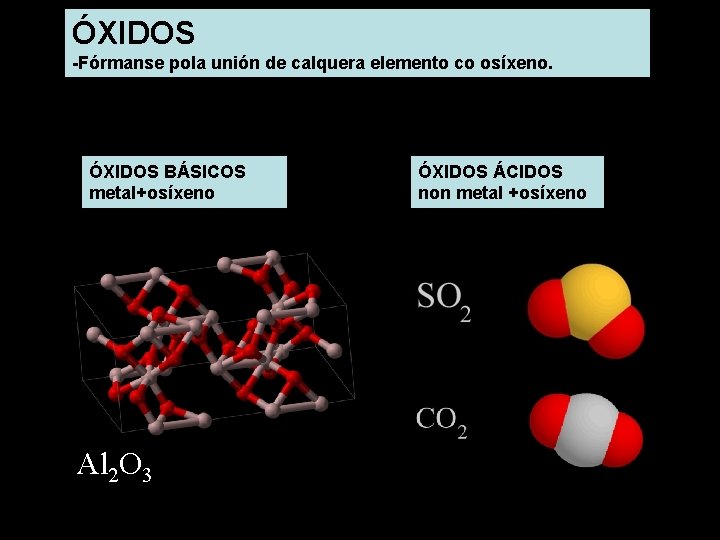
ÓXIDOS -Fórmanse pola unión de calquera elemento co osíxeno. ÓXIDOS BÁSICOS metal+osíxeno Óxidos de ferro Al 2 O 3 ÓXIDOS ÁCIDOS non metal +osíxeno

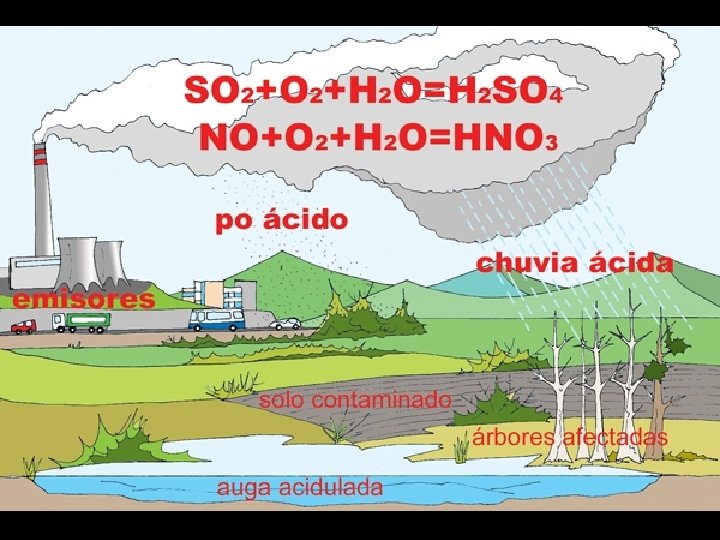
-As reaccións de oxidación máis comúns son as combustións nas que se forman óxidos e se desprende calor.

ÓXIDO DE XOFRE DIÓXIDO DE XOFRE, ANHÍDRIDO SULFUROSO FÓRMULA: SO 2 GRUPO: óxido ácido PROPIEDADES Estado físico: gas Punto de fusión: -75 ºC Punto de ebulición: -10 ºC Densidade: 1, 4 Incoloro, olor forte e irritante. ONDE SE ATOPA Prodúcese ao queimarse o xofre nos volcáns ou como residuo das combustións de hidrocarburos. COMO SE OBTÉN Combustión do xofre ou dos sulfuros (pirita, wurtzita, blenda, galena. . . ) USOS -fabricación de ácido sulfúrico -desinfección dos recipientes de viño -conservante e antioxidante na industria alimentaria (E 220) CURIOSIDADES Cada ano emítense grandes cantidade de óxidos de xofre á atmosfera polos vehículos, e as industrias queiman combustibles fósiles (en especial carbón) É o principal causante da chuvia ácida. En contacto coa auga da desinfectando cubas nunha adega

zonas voncánicas en Islandia e Os Açores

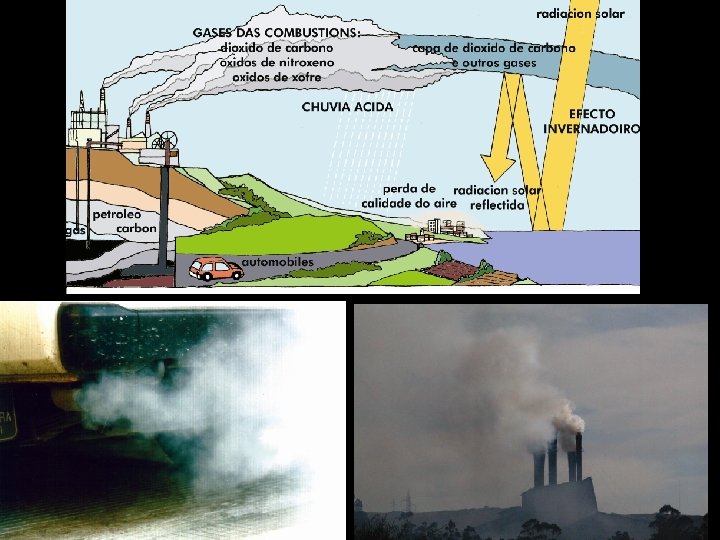
DIÓXIDO DE CARBONO GAS CARBÓNICO, ANHÍDRIDO CARBÓNICO FÓRMULA: CO 2 GRUPO: óxido ácido PROPIEDADES Estado físico: gas Punto de fusión: -78 ºC Punto de ebulición: -57 ºC Densidade: 0, 0016 Inodoro, incoloro e insípido. ONDE SE ATOPA Na atmosfera COMO SE OBTÉN Orixínase nas combustións da materia orgánica USOS -axente extintor -bebidas gasosas -industria láctea (callado de lácteos) -neutralización de resíduos alcalinos -refrixeración, xeo seco, efectos especiais no cine e espectáculos -disolvente para fluídos supercríticos -axente estractante CURIOSIDADES É fundamental para a nutrición dos vexetais que o absorben do aire na fotosíntese. Na atmosfera forma unha capa que impide a perda de calor (efecto invernadeiro).
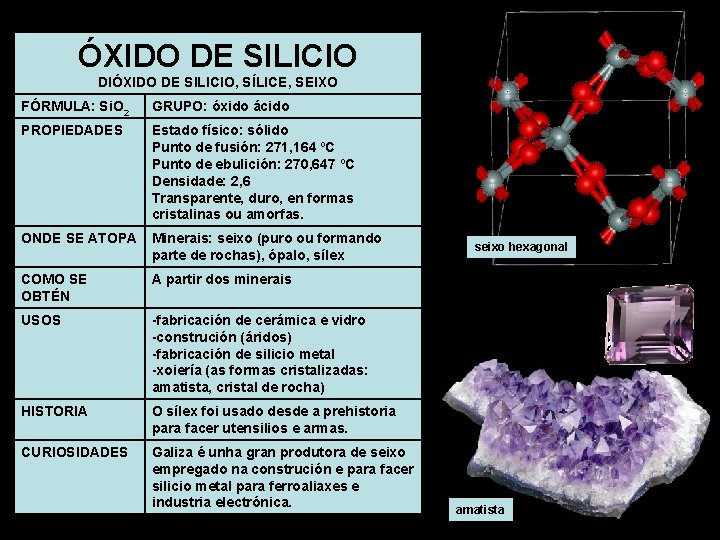
ÓXIDO DE SILICIO DIÓXIDO DE SILICIO, SÍLICE, SEIXO FÓRMULA: Si. O 2 GRUPO: óxido ácido PROPIEDADES Estado físico: sólido Punto de fusión: 271, 164 ºC Punto de ebulición: 270, 647 ºC Densidade: 2, 6 Transparente, duro, en formas cristalinas ou amorfas. ONDE SE ATOPA Minerais: seixo (puro ou formando parte de rochas), ópalo, sílex COMO SE OBTÉN A partir dos minerais USOS -fabricación de cerámica e vidro -construción (áridos) -fabricación de silicio metal -xoiería (as formas cristalizadas: amatista, cristal de rocha) HISTORIA O sílex foi usado desde a prehistoria para facer utensilios e armas. CURIOSIDADES Galiza é unha gran produtora de seixo empregado na construción e para facer silicio metal para ferroaliaxes e industria electrónica. seixo hexagonal amatista

hematite ÓXIDO FÉRRICO ORÍN FÓRMULA: Fe 2 O 3 GRUPO: óxido básico PROPIEDADES Estado físico: sólido Punto de fusión: 1. 565 ºC Densidade: 5, 2 Cor castaña-vermella. ONDE SE ATOPA Nos minerais: hematite Habitualmente forma capas sobre os obxectos de ferro COMO SE OBTÉN Minas de hematite USOS -pigmentos -soporte de almacenamento magnético en audio e informática HISTORIA Foi usado como pigmento desde a prehistoria CURIOSIDADES Fórmase cando se expón o ferro á acción do osíxeno. Altera as propiedades do metal, polo que se intenta evitar a súa formación de moitas maneiras. Pinturas nas covas de Lascaux


ÓXIDO DE ALUMINIO ALÚMINA, CORINDÓN, ESMERIL FÓRMULA: Al 2 O 3 GRUPO: óxido básico PROPIEDADES Estado físico: sólido Punto de fusión: 2. 72 ºC Punto de ebulición: 2. 980 ºC Densidade: 3, 94 Duro, forma cristais exagonais moi finos. ONDE SE ATOPA Minerais bauxita, corindón COMO SE OBTÉN A partir da bauxita polo proceso Bayer: lavado, pulverizado, disolución en sosa cáustica, precipitado e calcinado. USOS -extración do aluminio -illante térmico nas cubas electrolíticas -illante térmico e eléctrico -secado do aire comprimido -odontoloxía -pedra de muíños para esmaltes cerámicos -cromatografía -corindón: como abrasivo, en xoiería (rubí, zafiro), obxectos decorativos CURIOSIDADES A fina capa de óxido de aluminio que se deposita sobre o metal é a responsable da súa resistencia á intemperie.

Corindón: óxido de aluminio cristalizado con diferentes impurezas: incoloro, branco, pardo, violeta, verde, amarelo, azul, vermello. Rubí Zafiro
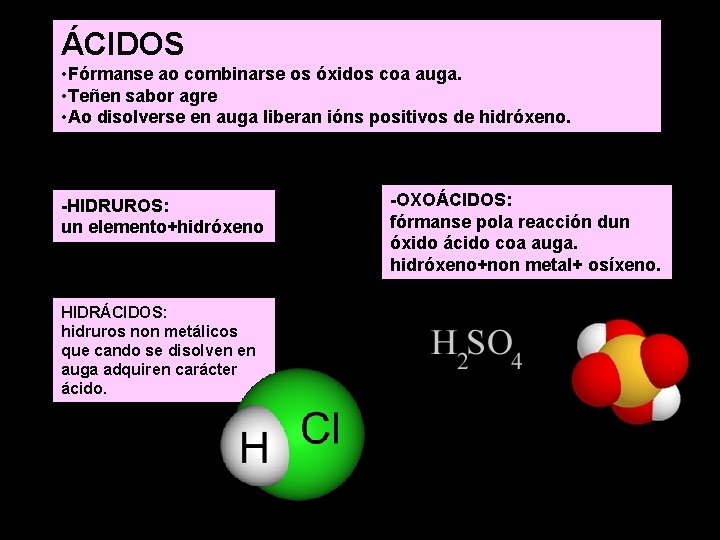
ÁCIDOS • Fórmanse ao combinarse os óxidos coa auga. • Teñen sabor agre • Ao disolverse en auga liberan ións positivos de hidróxeno. -HIDRUROS: un elemento+hidróxeno HIDRÁCIDOS: hidruros non metálicos que cando se disolven en auga adquiren carácter ácido. -OXOÁCIDOS: fórmanse pola reacción dun óxido ácido coa auga. hidróxeno+non metal+ osíxeno.

ÁCIDO CLORHÍDRICO HIDRURO DE CLORO, SALFUMÁN FÓRMULA: HCl GRUPO: ácido hidrácido PROPIEDADES Estado físico: líquido Punto de fusión: -26 ºC Punto de ebulición: 48 ºC Incoloro ou lixeiramente amarelo, de olor picante, corrosivo ONDE SE ATOPA Volcáns, COMO SE OBTÉN No laboratorio por reacción de ácido sulfúrico e sal. Na industria química do cloro a partir do sal, na cloración de substancias orgánicas. . . USOS -desinfectante -obtención de hidróxeno -limpadores (auga forte), disolucións de 10 a 12% -reactivo químico -tratamento de metais -curtido de coiros -desincrustante para eliminar resíduos de calcarías -produción de xelatinas HISTORIA Obtido por primeira vez por Jabir ibn Hayyan (Geber), arredor do 800, mesturando sal común con ácido sulfúrico. CURIOSIDADES Presente nosos xugos gástricos (3%) Jabir ibn Hayyan

ÁCIDO SULFÚRICO ACEITE DE VITRIOLO FÓRMULA: H 2 SO 4 GRUPO: ácidos (oxoácido) PROPIEDADES Estado físico: líquido Punto de fusión: 10 ºC Punto de ebulición: 337 ºC Densidade: 1, 8 Incoloro, denso. Mestúrase coa auga violentamente desprendendo moita calor. É moi corrosivo porque tende a apoderarse da auga dos tecidos producindo fortes queimaduras. ONDE SE ATOPA En zonas volcánicas COMO SE OBTÉN Oxidando o óxido de xofre e disolvéndoo en auga. USOS -industria de fertilizantes -industria petroquímica -tratamento do aceiro -pigmentos -extracción de metais non ferrrosos -explosivos -deterxentes -plásticos -febras. . . HISTORIA Descuberto por Jabir ibn Hayyan (Geber), arredor do 800 CURIOSIDADES A chuvia ácida é auga mesturada con ácido sulfúrico que se forma ao reaccionar o óxido de xofre co vapor de auga da atmosfera.

ÁCIDO NÍTRICO FÓRMULA: HNO 3 GRUPO: ácidos (oxoácido) PROPIEDADES Estado físico: líquido Punto de fusión: -42 ºC Punto de ebulición: 83 ºC Densidade: 1, 5 Incoloro ou lixeiramente amarelo, visgento. Moi corrosivo. Ataca á maioría dos metais. COMO SE OBTÉN Mesturando anhídrido nítrico con auga. A nivel industrial mediante a síntese do amoníaco e osíxeno. USOS -explosivos (nitroglicerina, TNT) -fertilizantes -reactivo de laboratorio -metalurxia -grabado de metais (augaforte) HISTORIA Os alquimistas chamábanlle auga forte. CURIOSIDADES A súa mestura con ácido clorhídrico forma a auga rexia Grabado á augaforte de Goya
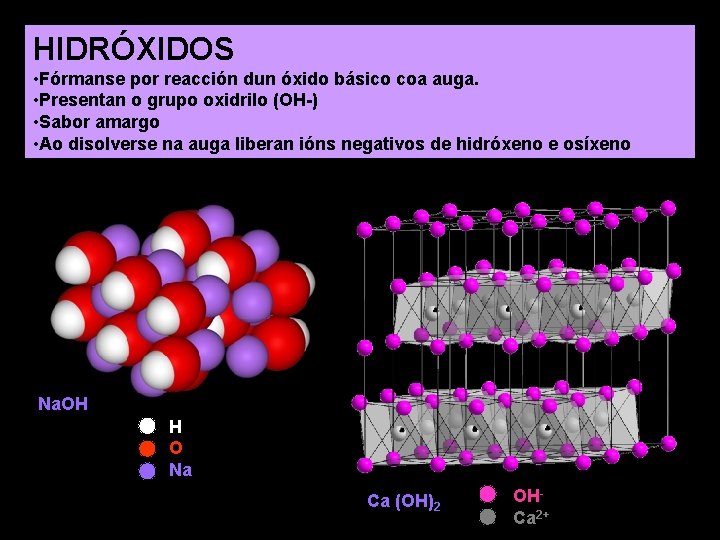
HIDRÓXIDOS • Fórmanse por reacción dun óxido básico coa auga. • Presentan o grupo oxidrilo (OH-) • Sabor amargo • Ao disolverse na auga liberan ións negativos de hidróxeno e osíxeno Na. OH H O Na Ca (OH)2 OHCa 2+

HIDRÓXIDO DE SODIO SOSA CAÚSTICA FÓRMULA: Na. OH GRUPO: hidróxidos PROPIEDADES Estado físico: sólido Punto de fusión: 323 ºC Punto de ebulición: 1. 390 ºC Densidade: 2, 1 Cor branca, cristalino, absorbe auga con facilidade. Altamente corrosivo. Ataca os tecidos seres vivos. COMO SE OBTÉN Electrolise de salmoira USOS -produtos de limpeza -papel -tecidos -industria petroleira -pinturas -galvanoplastia CURIOSIDADES Pode producir queimaduras graves por contacto e inxestión. H O Na

HIDRÓXIDO DE CALCIO CAL MORTO, CAL APAGADO FÓRMULA: Ca (OH)2 GRUPO: hidróxidos PROPIEDADES Estado físico: sólido Punto de fusión: 512 ºC (descomponse) Densidade: 2, 2 Cor branca. Se se quenta a 512 ºC descomponse en óxido de calcio e auga. COMO SE OBTÉN A partir da reacción do óxido de cal (cal vivo) coa auga. USOS -construción (morteiro, xeso) -floculante para o tratamento de augas residuais -corrección de terreos ácidos -reactivo químico -industria petroleira -bebidas carbonatadas -mediciña -pinturas -endodoncia CURIOSIDADES Resulta tóxico por inxestión e contacto. o óxido de calcio (cal vivo) reacciona coa auga para converterse en hidróxido de calcio (cal apagado)
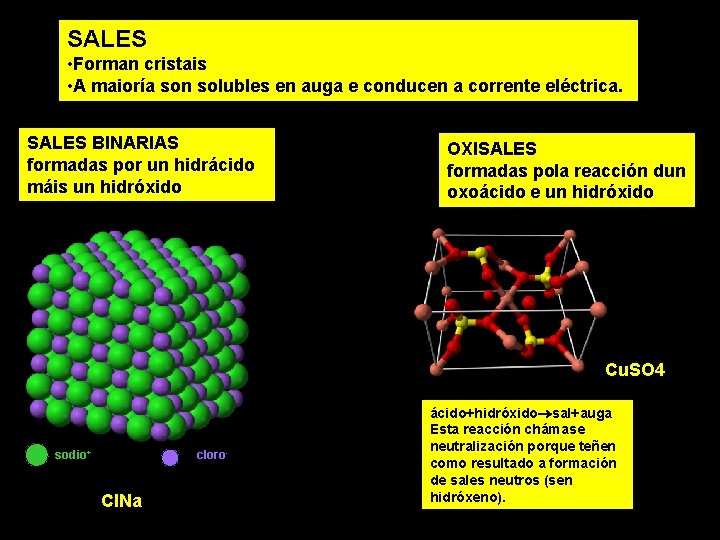
SALES • Forman cristais • A maioría son solubles en auga e conducen a corrente eléctrica. SALES BINARIAS formadas por un hidrácido máis un hidróxido OXISALES formadas pola reacción dun oxoácido e un hidróxido Cu. SO 4 sodio+ cloro- Cl. Na ácido+hidróxido sal+auga Esta reacción chámase neutralización porque teñen como resultado a formación de sales neutros (sen hidróxeno).

CLORURO DE SODIO SAL COMÚN FÓRMULA: Cl. Na GRUPO: sal binaria PROPIEDADES Estado físico: sólido Punto de fusión: 801 ºC Punto de ebulición: 1. 413 ºC Densidade: 2, 16 Incoloro, transparentes, de sabor salgado. Cristaliza en formas cúbicas, Soluble en auga. Mellora a condutividade eléctrica da auga. ONDE SE ATOPA No mar, en minerais: halita, silvina, carnalita. . . É un dos compostos máis abundantes da natureza. A auga do mar contén 35 kg/l. COMO SE OBTÉN -Extracción en minas -Evaporación da auga do mar en saíñas. USOS -conservante alimentario, saborizante -industria química: fabricación do ácido clorhídrico, sosa, cloro. . . HISTORIA Coñécese desde a antigüidade e foi desde sempre obxecto de comercio. Os fenicios comezaron a explotación de saíñas na Península Ibérica. En Galicia houbo saíñas no Salnés, Vilaboa. . . CURIOSIDADES Acción no ser humano: mantén a presión entre o interior e o exterior das células sodio+ cloro- halita

Saíñas en Aveiro (Portugal)

SULFATO DE COBRE SULFATO CÚPRICO FÓRMULA: Cu. SO 4 GRUPO: sales (oxisal) PROPIEDADES Estado físico: sólido Punto de fusión: 109, 85 ºC Punto de ebulición: 649, 85 ºC Densidade: 3, 6 A forma anhidra é un pó de cor verde ou gris-branco. A forma hidratada e azul brillante (Cu. SO 4· 5 H 2 O) ONDE SE ATOPA A forma anhidra: calcocianita Forma hidratada: cancalntita COMO SE OBTÉN Pola acción do ácido sulfúrico co óxido de cobre ou o carbonato de cobre. USOS -tratamento de augas (alguicida) -fertilizantes -pesticidas -tratamento do coiro -pigmentos -baterías eléctricas -galvanizados -industria do petróleo e do caucho CURIOSIDADES Toxico por inxestión

Sulfatando as viñas

CARBONATO DE CALCIO FÓRMULA: Ca. CO 3 GRUPO: sales (oxisal) PROPIEDADES Estado físico: sólido Punto de fusión: 825 º C (calcita) 1. 339 (aragonito) Densidade: 2, 7 (calcita) Po de cor branca. ONDE SE ATOPA Minerais: calcita, aragonito. Rochas: calcarias, mármore, travestino. Forma parte dos esqueletos e caparazóns do seres vivos, dos ovos. . . COMO SE OBTÉN A partir dos minerais e rochas USOS -mediciña: suplemento de calcio, antiácido, axente absorbente -fabricación de cemento, vidro. . . -correción da acedume dos solos CURIOSIDADES calcita Moitas rochas calcárias formáronse por acumulación e cementación de esqueletos e caparazóns de seres vivos. mármore


NITRATO DE SODIO NITRATO DE CHILE, SALITRE FÓRMULA: Na. NO 3 GRUPO: sales PROPIEDADES Estado físico: sólido Punto de fusión: 308 ºC Punto de ebulición: 380 ºC Densidade: 2, 26 Inoloro, moi oxidante. Ao queimarse xera osíxeno polo que pode arder debaixo da auga. ONDE SE ATOPA Xacementos de salitre (Chile) COMO SE OBTÉN Neutralización de bases de carbono con ácido nítrico. USOS -fertilizante -obtención do cromo -conservante na industria alimentaria (E 251), especialmente para a carne -aditivo para o cemento -pólvora negra -lume que arde CURIOSIDADES Prevén o botulismo

FOSFATOS DE SODIO FÓRMULA: FOSFATO MONOSÓDICO: Na. H 2 PO 4 FOSFATOS DISÓDICO: Na 2 HPO 4 FOSFATO TRISÓDICO: Na 3 PO 4 GRUPO: sales PROPIEDADES Estado físico: sólidos ONDE SE ATOPA Rochas fosfóricas: apatita Forman parte de osos e dentes dos seres vivos COMO SE OBTEÑEN A partir dos minerais USOS -industria alimentaria: aditivos estabilizantes (E 399). Empréganse na carne para diminuir a perda de auga. -elaboración de queixos -reguladores de acidez -Industria textil -tintorería -fertilizantes -mediciña CURIOSIDADES Esenciales para o funcionamento do organismo. O seu exceso no medio ambiente produce eutrofización das augas.

Explotación de guano en Perú. O guano (acumulación de excrementos de aves mariñas) é unha fonte de fosfatos e outros minerais usados como fertilizantes

SILICATOS GRUPO: sales PROPIEDADES ONDE SE ATOPA Sales do ácido silícico. Compostos por silicio e osíxeno acompañados de aluminio, ferro, magnesio, calcio. . . En numerosos minerais e rochas. Constitúen máis do 95% da codia terrestre. Feldespatos, micas, arxilas, circón, olivino, granate, turmalina, berilo, piroxenos, talco, caolinita. . . COMO SE OBTEÑEN Extración de minas USOS -xoias e arte: circón, granate, turmalina, esmeralda, -cerámicas e vidro: caolinita, sílice, feldespatos, arxila, amatista. . . -construción e decoración: arxila, seixo afumado ágata sílex

A area das praias é unha mestura de varios silicatos, sobre todo seixo e mica

MONTAXE: Adela Leiro FOTOS: Adela Leiro, Francisco Leiro, Internet, DEBUXOS: Mon Daporta Cambados 2012
- Slides: 35