Comparaison INNTI vs INNTI ENCORE EFV vs RPV






- Slides: 11

Comparaison INNTI vs INNTI § ENCORE § EFV vs RPV – ECHO-THRIVE – STAR § EFV vs ETR – SENSE § DOR vs EFV – DRIVE-AHEAD

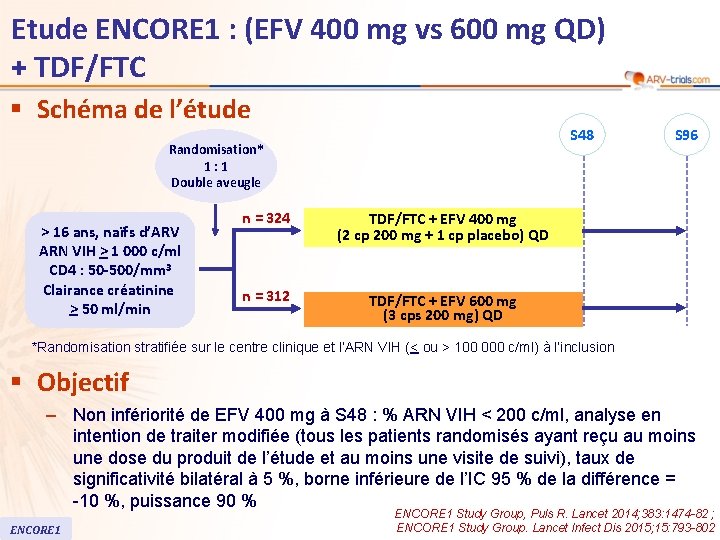
Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC § Schéma de l’étude S 48 Randomisation* 1: 1 Double aveugle > 16 ans, naïfs d’ARV ARN VIH > 1 000 c/ml CD 4 : 50 -500/mm 3 Clairance créatinine > 50 ml/min n = 324 TDF/FTC + EFV 400 mg (2 cp 200 mg + 1 cp placebo) QD n = 312 TDF/FTC + EFV 600 mg (3 cps 200 mg) QD S 96 *Randomisation stratifiée sur le centre clinique et l’ARN VIH (< ou > 100 000 c/ml) à l’inclusion § Objectif – Non infériorité de EFV 400 mg à S 48 : % ARN VIH < 200 c/ml, analyse en intention de traiter modifiée (tous les patients randomisés ayant reçu au moins une dose du produit de l’étude et au moins une visite de suivi), taux de significativité bilatéral à 5 %, borne inférieure de l’IC 95 % de la différence = -10 %, puissance 90 % ENCORE 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82 ; ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

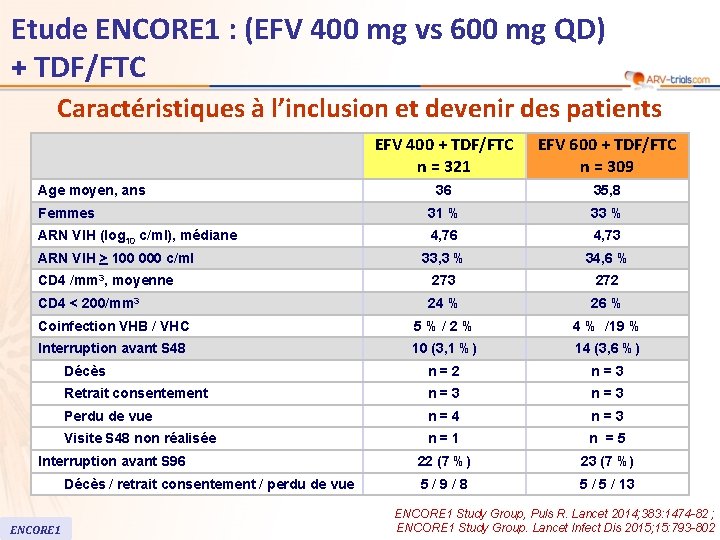
Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC Caractéristiques à l’inclusion et devenir des patients EFV 400 + TDF/FTC n = 321 EFV 600 + TDF/FTC n = 309 36 35, 8 Femmes 31 % 33 % ARN VIH (log 10 c/ml), médiane 4, 76 4, 73 33, 3 % 34, 6 % 273 272 24 % 26 % Coinfection VHB / VHC 5%/2% 4 % /19 % Interruption avant S 48 10 (3, 1 %) 14 (3, 6 %) Décès n=2 n=3 Retrait consentement n=3 Perdu de vue n=4 n=3 Visite S 48 non réalisée n=1 n =5 22 (7 %) 23 (7 %) 5/9/8 5 / 13 Age moyen, ans ARN VIH > 100 000 c/ml CD 4 /mm 3, moyenne CD 4 < 200/mm 3 Interruption avant S 96 Décès / retrait consentement / perdu de vue ENCORE 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82 ; ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

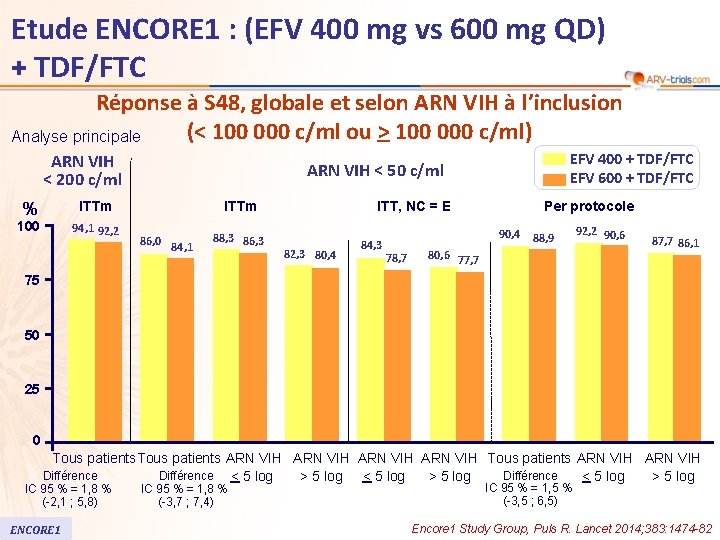
Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC Réponse à S 48, globale et selon ARN VIH à l’inclusion (< 100 000 c/ml ou > 100 000 c/ml) Analyse principale ARN VIH < 200 c/ml ARN VIH < 50 c/ml ITTm % 100 94, 1 92, 2 EFV 400 + TDF/FTC EFV 600 + TDF/FTC ITTm 86, 0 84, 1 88, 3 86, 3 ITT, NC = E 82, 3 80, 4 84, 3 Per protocole 90, 4 78, 7 88, 9 80, 6 77, 7 92, 2 90, 6 87, 7 86, 1 75 50 25 0 Tous patients ARN VIH Tous patients ARN VIH Différence < 5 log > 5 log IC 95 % = 1, 8 % (-2, 1 ; 5, 8) ENCORE 1 IC 95 % = 1, 8 % (-3, 7 ; 7, 4) IC 95 % = 1, 5 % (-3, 5 ; 6, 5) Encore 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82

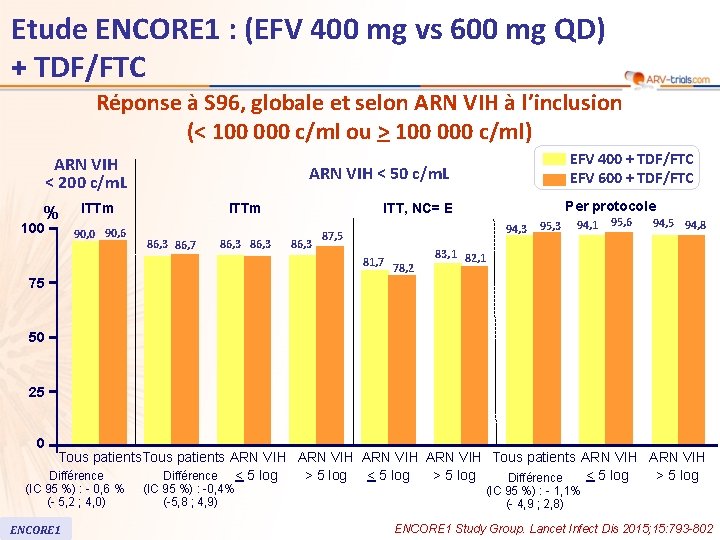
Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC Réponse à S 96, globale et selon ARN VIH à l’inclusion (< 100 000 c/ml ou > 100 000 c/ml) ARN VIH < 200 c/m. L % 100 ARN VIH < 50 c/m. L ITTm 90, 0 90, 6 EFV 400 + TDF/FTC EFV 600 + TDF/FTC ITTm 86, 3 86, 7 86, 3 Per protocole ITT, NC= E 86, 3 94, 3 87, 5 81, 7 78, 2 95, 3 94, 1 95, 6 94, 5 94, 8 83, 1 82, 1 75 50 25 0 Tous patients ARN VIH Tous patients ARN VIH > 5 log < 5 log > 5 log Différence < 5 log Différence (IC 95 %) : - 0, 6 % (- 5, 2 ; 4, 0) ENCORE 1 (IC 95 %) : -0, 4% (-5, 8 ; 4, 9) (IC 95 %) : - 1, 1% (- 4, 9 ; 2, 8) ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC § Augmentation moyenne des CD 4 à S 96 – + 235/mm 3 dans le groupe EFV 400 – + 209/mm 3 dans le groupe EFV 600 (p = 0, 018) § Pas de différence entre les 2 groupes dans les modifications moyennes du – Pourcentage des CD 4 – Compte de CD 8 – Compte de lymphocytes totaux § A S 96, – Les modifications du score de dépression (DASS-21), de l’anxiété, et du stress (score Z) n’étaient pas différentes entre les 2 groupes ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC Evénements indésirables à S 48 p EFV 400 + TDF/FTC EFV 600 + TDF/FTC Patients avec événements indésirables 89, 1 % 88, 4 % Grade 1 Grade 2 Grade 3 Grade 4 EIG, n (%) Liés au traitement Evénements indésirables liés ou probablement liés au traitement, n (%) 72, 9 % 22, 5 % 4, 1 % 0, 4 % 23 (7, 1 %) n=3 73, 1% 21, 5% 5, 0 % 0, 4 % 22 (7, 1 %) n=4 118 (36, 8 %) 146 (47, 2 %) 0, 008 Interruption pour EI lié au traitement n = 6 (1, 9 %) n = 18 (5, 8 %) 0, 01 45 % n = 231 n = 13 n = 68 n = 62 n=1 51 % n = 272 n = 105 n = 78 n=0 NS Evénements indésirables d’intérêt Neuro-psychiatriques Système nerveux central Psychiatriques Rash Gastro-intestinaux Hépatotoxicité ENCORE 1 Encore 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82

Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC § Autres données de tolérance à S 48 – A S 48, interruption EFV : 26 (8 %) pour EFV 400 vs 34 (11 %) pour EFV 600 – Fréquence des EIG similaire dans les 2 groupes – Pas de différence entre les 2 groupes en termes de qualité de vie, dépression, anxiété et stress, et des symptômes attribués à EFV – Pas de différence significative entre EFV 400 et EFV 600 dans la modification entre l’inclusion et S 48 pour la plupart des paramètres biologiques, sauf : • Neutrophiles • Modification moyenne clairance créatinine : + 1, 29 vs - 2, 17 ml/min • Augmentation moyenne phosphatase alcaline : + 26 vs + 33 UI/l § A S 96 – Seule différence significative entre les 2 groupes : modification moyenne des phosphatases alcalines : + 21 vs + 27 U/L (p = 0, 046) ENCORE 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82 ; ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

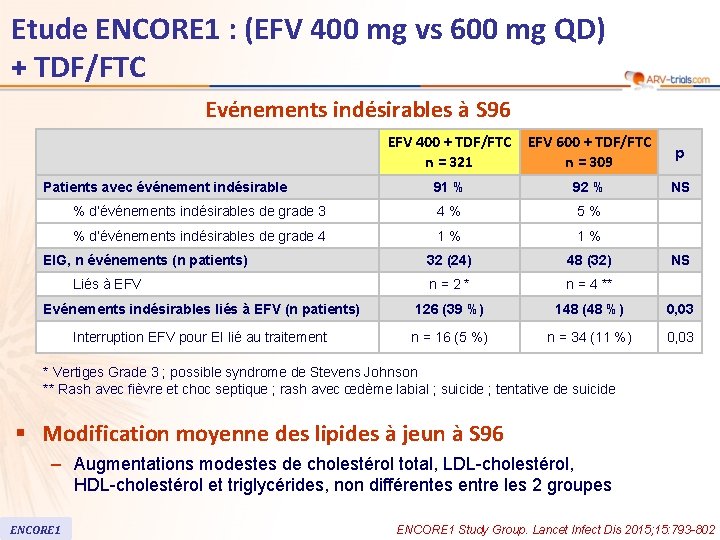
Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC Evénements indésirables à S 96 EFV 400 + TDF/FTC n = 321 EFV 600 + TDF/FTC n = 309 p 91 % 92 % NS % d’événements indésirables de grade 3 4% 5% % d’événements indésirables de grade 4 1% 1% 32 (24) 48 (32) n=2* n = 4 ** Evénements indésirables liés à EFV (n patients) 126 (39 %) 148 (48 %) 0, 03 Interruption EFV pour EI lié au traitement n = 16 (5 %) n = 34 (11 %) 0, 03 Patients avec événement indésirable EIG, n événements (n patients) Liés à EFV NS * Vertiges Grade 3 ; possible syndrome de Stevens Johnson ** Rash avec fièvre et choc septique ; rash avec œdème labial ; suicide ; tentative de suicide § Modification moyenne des lipides à jeun à S 96 – Augmentations modestes de cholestérol total, LDL-cholestérol, HDL-cholestérol et triglycérides, non différentes entre les 2 groupes ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC § Réponse virologique si résistance aux INNTI à l’inclusion – 570 patients avec génotype à l’inclusion : résistance à INNTI, n = 18 • 10 randomisés sous EFV 400 – 6 avec ARN VIH < 50 c/ml à S 96 (tous sous EFV) – 4 en échec à S 96 (3/4 sous EFV, 1/4 avec également résistance initiale à FTC) • 8 randomisés sous EFV 600 – 7 avec ARN VIH < 50 c/ml à S 96 (6/7 sous EFV) – 1 en échec à S 96 (pas sous EFV) Echecs virologiques* Test de résistance disponible, N Résistance INNTI, N EFV 400 + TDF/FTC n = 321 EFV 600 + TDF/FTC n = 309 10 13 2 3 * 2 ARN VIH consécutifs > 500 c/ml Parmi les 36 échecs virologiques, 5 avaient une résistance à l’inclusion aux INNTI et 8 n’étaient pas amplifiables ; 23 génotypes pouvaient être interprétés ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802

Etude ENCORE 1 : (EFV 400 mg vs 600 mg QD) + TDF/FTC § Conclusion – Une dose réduite à 400 mg d’EFV QD est non inférieure à la dose standard de 600 mg QD, en association avec TDF/FTC après 96 semaines de traitement chez les adultes VIH en 1ère ligne – Globalement, la fréquence des événements indésirables et des arrêts de traitement ne différaient pas entre les deux groupes – Cependant, les événements indésirables liés au traitement et les arrêts pour événement indésirable étaient plus fréquents avec EFV 600 que 400 mg – La qualité de vie, un statut émotionnel négatif, et les effets indésirables liés à EFV, basés sur un questionnaire spécifique, ne différaient pas entre EFV 600 et 400 mg QD – Ces données offrent la possibilité de réduire les coûts de traitement et de modifier le modèle de prise en charge associé à l’utilisation d’EFV (prudence en cas d’utilisation de rifampicine) ENCORE 1 Study Group, Puls R. Lancet 2014; 383: 1474 -82 ; ENCORE 1 Study Group. Lancet Infect Dis 2015; 15: 793 -802