Cmo determinar el nmero de oxidacin Introduccin Comenzamos














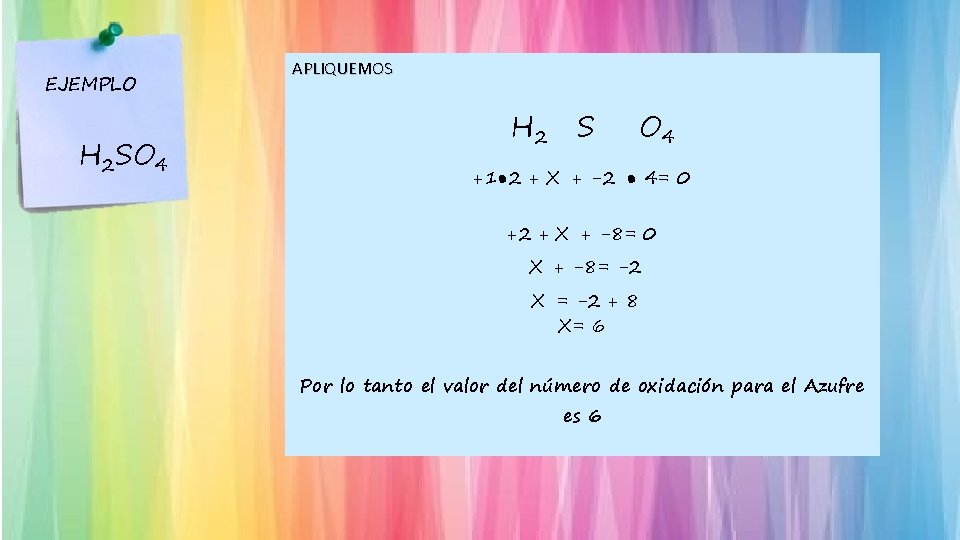

- Slides: 16

¿Cómo determinar el número de oxidación?

Introducción Comenzamos un nuevo tema “REDOX” y para ir de lleno a éste vamos a partir por una “previa” llamada el Número de Oxidación. Esta fase es primordial para poder desarrollar las próximas sesiones, nos detendremos a verlo pues es algo mecánico pero que se basa en una serie de reglas, las que para efectos de nuestra realidad las explicaremos de forma muy práctica y sencilla. Como siempre puedes recurrir a nuestros canales de comunicación para exponer tus dudas y pedir alternativas a esta explicación.

¿Qué es el número de oxidación? Es un número que se asigna a cada elemento químico y representa la cantidad de electrones que puede ganar o perder electrones. Puede ir de números positivos a negativos, regularmente entre -7 a +7

¿Cómo puedo saber el número de oxidación? Las reglas nos indican algunos números de oxidación que podemos saber predeterminadamente, pero hay otros que tendremos que descubrirlos con una ecuación matemática muy sencilla a partir de las mismas reglas, porque un elemento químico puede tener diferentes números de oxidación. Un elemento se comporta de maneras distintas dependiendo de que otro elemento lo acompañe, por ello no siempre se tiene el mismo valor.

Resumen de las reglas 1. Cuando un elemento se encuentra en estado puro (no formando compuestos) su número de oxidación es 0 Ejemplo de cuando valdrían cero Potasio Oxígeno Helio Fósforo K O 2 He P 4

Resumen de las reglas 2. Si el elemento posee una carga su número de oxidación adquiere el valor de esa carga Ejemplos Valor N. O Fe+2 Al +3 H+ S-2 Cl - +2 +3 +1 -2 -1

Resumen de las reglas 3. El valor el Número de oxidación para el OXÍGENO es -2, excepto en algunos casos que veremos más adelante. 4. El valor el Número de oxidación para el HIDRÓGENO es +1, excepto en algunos casos que veremos más adelante. 5. El valor de un elemento que esté dentro de un compuesto que contenga Hidrógeno y oxígeno puedes sacarlo por “CÁLCULO” ¿QUÉEEEEEEE? AVANZA!

EJEMPLO 1 HCl Por regla sabemos que el hidrógeno vale +1, por ende ya tenemos un valor. Pero, ¿qué valor posee el cloro? Vamos a realizar un cálculo sencillo, pensaremos que Cl es una incógnita ( pues lo es) , contemplaremos el valor del hidrógeno y como no posee cargas diremos que todos esos valores son iguales a cero. Realizaremos el cálculo como una ecuación. mira! HCl +1 + x = 0 X = -1 +0 X= -1 Por lo tanto el valor del número de oxidación para el cloro es -1

EJEMPLO 2 NH 3 Por regla sabemos que el hidrógeno vale +1, por ende ya tenemos un valor. Pero, ¿qué valor posee el nitrógeno? Vamos a realizar un cálculo sencillo, pensaremos que N es una incógnita ( pues lo es) , contemplaremos el valor del hidrógeno, pero además en este caso consideraremos que hay 3 de estos átomos (multiplicaremos por ese número) y como no posee cargas diremos que todos esos valores son iguales a cero. mira! N H 3 X + +1 ● 3 = 0 X+3=0 X = -3 Por lo tanto el valor del número de oxidación para el nitrógeno es -3

EJEMPLO 3 CO 2 Por regla sabemos que el OXÍGENO vale -2, por ende ya tenemos un valor. Pero, ¿qué valor posee el CARBONO? Vamos a realizar un cálculo sencillo, pensaremos que C es una incógnita ( pues lo es) , contemplaremos el valor del OXÍGENO, pero además en este caso consideraremos que hay 2 de estos átomos (multiplicaremos por ese número) y como no posee cargas diremos que todos esos valores son iguales a cero. mira! C O 2 X + -2 ● 2 = 0 X + -4 = 0 X -4= 0 X= 4 Por lo tanto el valor del número de oxidación para el CARBONO es +4

Resumen de las reglas 6. Si el compuesto tiene una carga, en vez de igualar a cero el cálculo lo vamos a igualar a esa carga… Qué? Esto si que no entiendo!!! Pues anda a la siguiente diapositiva…

EJEMPLO NH 4+ Esto es igual a lo anterior, sólo que ya no será igual a cero si no igual a la carga N H 4+ X + +1 ● 4 = +1 X + 4= +1 X = -4 +1 X = -3 Por lo tanto el valor del número de oxidación para el Nitrógeno es -3

EJEMPLO SO 4 -2 Y ESTO? SO 4 -2 X + -2● 4 = -2 X + -8= -2 X = 8 -2 X=6 Por lo tanto el valor del número de oxidación para el Azufre es 6

Resumen de las reglas 7. Si hay oxígeno e hidrógeno en el compuesto pues haremos similar a lo anterior, es algo así como mezclar todos los ejemplos anteriores. MIRA EL EJEMPLO!
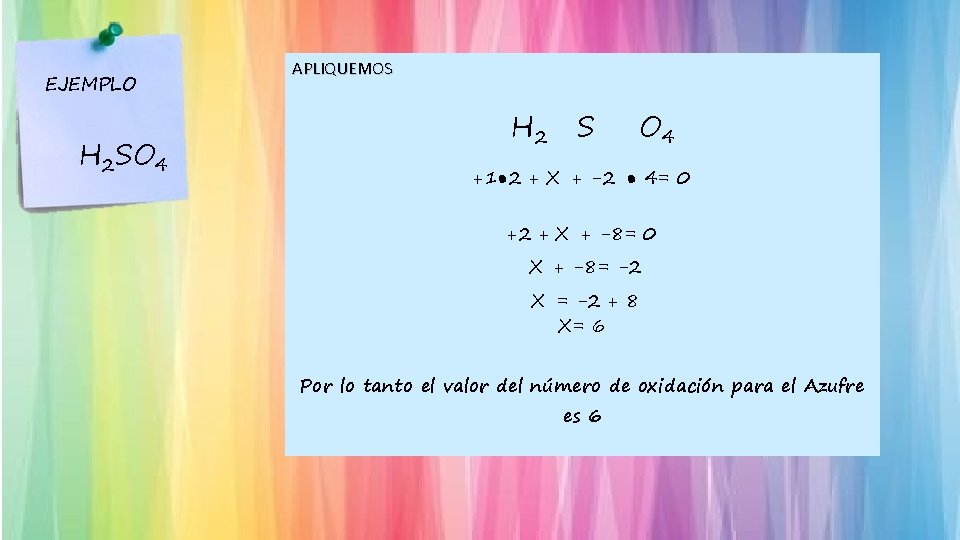
EJEMPLO H 2 SO 4 APLIQUEMOS H 2 S O 4 +1● 2 + X + -2 ● 4= 0 +2 + X + -8= 0 X + -8= -2 X = -2 + 8 X= 6 Por lo tanto el valor del número de oxidación para el Azufre es 6

Ahora te toca aplicar las reglas, ve a la guía y calcula números de oxidación