CM 2 Molcule non isol Effet de lenvironnement












- Slides: 23

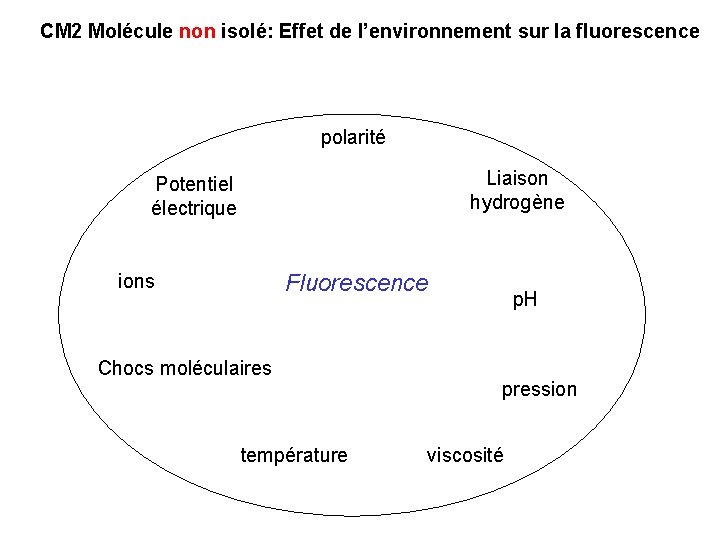
CM 2 Molécule non isolé: Effet de l’environnement sur la fluorescence polarité Liaison hydrogène Potentiel électrique Fluorescence ions Chocs moléculaires température p. H pression viscosité

Q. Pourquoi la fluorescence est sensible l’environnement? Réponse: L’absorption de lumière =un phénomène rapide (10 -15 s), les spectres d’absorption sont peu sensibles au phénomène de diffusion et à la dynamique moléculaire. Seul l’environnement immédiatement adjacent aux chromophores peut affecter les spectres d’absorption. la fluorescence =phénomène plus lent (temps de vie typique = 10 ns), l’environnement pouvant influer sur le spectre d’émission de fluorescence est plus large.

Q. Quelles situations où diminution de l’ intensité de fluorescence If ? If ≈ 2, 3 ff. Io. ε. C. l Réponse: tout phénomène qui diminue ε, ff Ou diminution de la concentration c en fluorophore X : If ≈ 2, 3 ff. Io. ε. C. l (Io = intensité lumineuse incidente) Rappels: - Coefficient d’extinction ou absorbance spécifique e : Reflète la probabilité d’absorption d’une molécule - brillance = ε. f

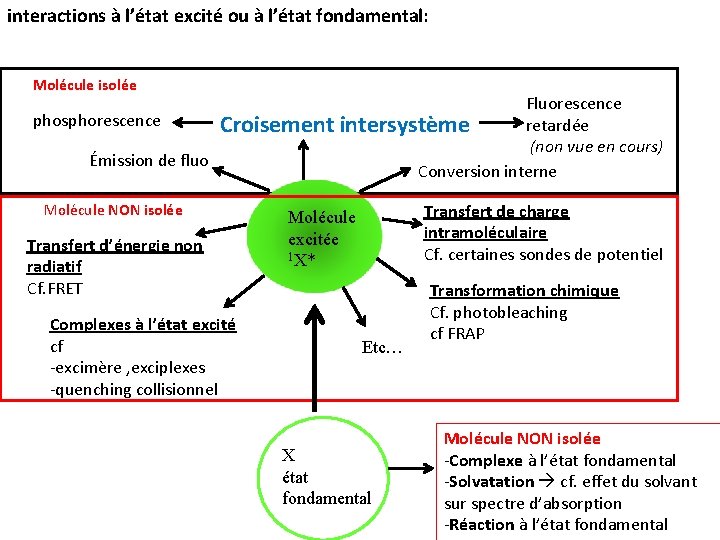
interactions à l’état excité ou à l’état fondamental: Molécule isolée Fluorescence phosphorescence retardée Croisement intersystème (non vue en cours) Émission de fluo Conversion interne Molécule NON isolée Transfert d’énergie non radiatif Cf. FRET Complexes à l’état excité cf -excimère , exciplexes -quenching collisionnel Transfert de charge intramoléculaire Cf. certaines sondes de potentiel Molécule excitée 1 X* Etc… X état fondamental Transformation chimique Cf. photobleaching cf FRAP Molécule NON isolée -Complexe à l’état fondamental -Solvatation cf. effet du solvant sur spectre d’absorption -Réaction à l’état fondamental

I. FRET = Förster resonance energy transfer ou fluorescence resonance energy transfer (aussi connu sous terme resonance energy transfer (RET) ou electronic energy transfer (EET)) = Méchanisme décrivant le transfert d’énérgie entre deux chromophores « A donor chromophore, intially in its electronic excited state, may transfer energy to an acceptor chromophore (in close proximity, typically <10 nm) through nonradiative dipole coupling. This mechanism is termed "Förster resonance energy transfer" and is named after the German scientist. When both chromophores are fluorescent, the term "fluorescence resonance energy transfer" is often used instead, although the energy is not actually transferred by fluorescence. In order to avoid an erroneous interpretation of the phenomenon that (even when occurring between two fluorescent chromophores) is always a nonradiative transfer of energy, the name "Förster resonance energy transfer" is preferred to "fluorescence resonance energy transfer" - although the latter enjoys common usage in scientific literature. » Ne pas confondre avec un processus de transfert d’énergie radiatif

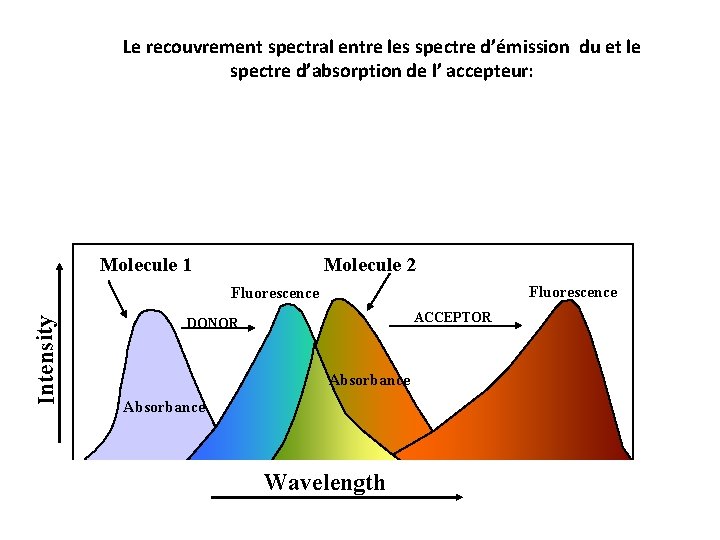
Le recouvrement spectral entre les spectre d’émission du et le spectre d’absorption de l’ accepteur: Molecule 1 Molecule 2 Fluorescence Intensity Fluorescence ACCEPTOR DONOR Absorbance Wavelength

FRET= Transfert d’énergie entre le donneur et l’accepteur NON radiatif car cela ne se fait PAS par échange de photon: Ne pas confondre avec un processus de transfert d’énergie radiatif

L’efficacité de transfert de FRET (E) =rendement quantique de la transition par transfert d’ energie, i. e. la fraction d’énergie transférée lors de l’événement par nombre d’ événements d’excitation du donneur: Retenir que l’efficacité E du FRET dépend de trois paramètres : 1. la distance r entre le donneur et l’accepteur E= 1 (1+ r/R 0)6 avec R 0 = distance de Förster distance de cette paire doneur - accepteur pour lequel E = 50%. 2. Le recouvrement spectral entre les spectre d’émission du et le spectre d’absorption de l’ accepteur 3. L’orienation relative des moments dipôlaires d’émission du donneur et d’absorption de l’ accepteur.

Deux grandes familles de techniques basées sur le FRET : 1/ celles fondées sur la mesure de la quantité de fluorescence transférée entre un donneur et un accepteur (FRET proprement dit) 2/ celles fondées sur la mesure du déclin de fluorescence du donneur ou de l’accepteur (FLIM, fluorescence lifetime imaging microscopy). Exemples d’applications: - interactions intermoléculaires (récepteur-ligand) OU intramoléculaires (repliement de l’ADN, structure quaternaire d’une protéine)/ séquençage de l’ADN -Utilisations de variants de GFP qui servent de bio-capteurs d’ions ou de molécules à doser (AMPc, par exemple) directement dans une cellule unique.

Exemple de FRET intramoléculaire Ordre de grandeur: ≈70 Å selon la géométrie des molécules et du système d’observation

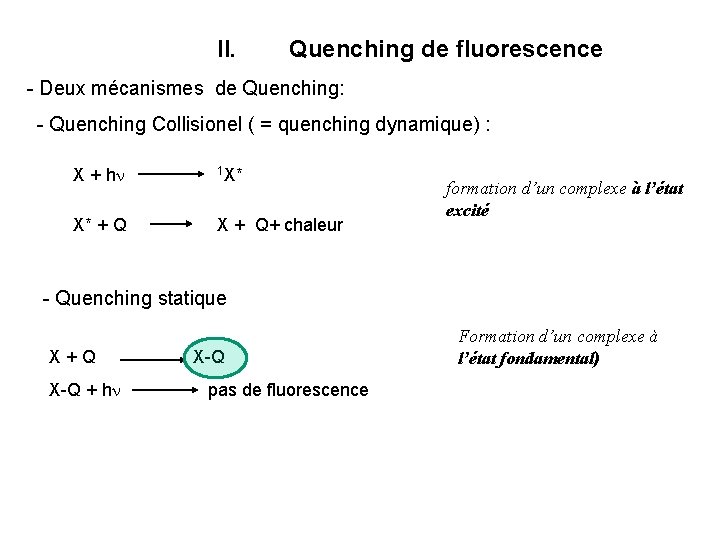
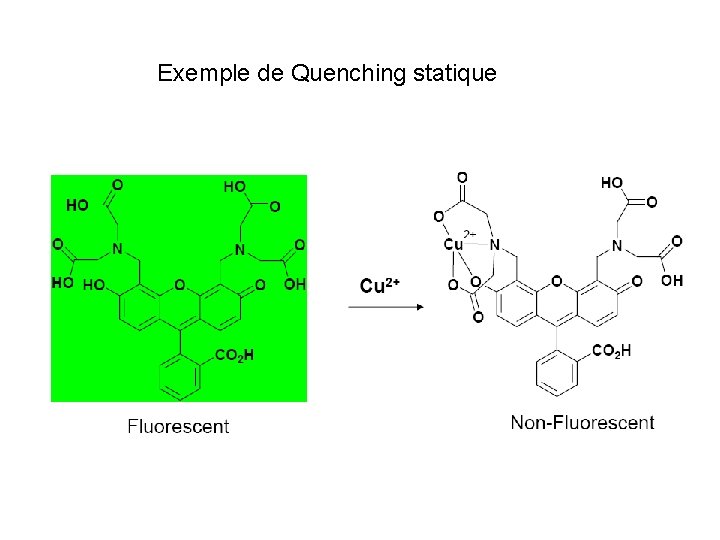
II. Quenching de fluorescence - Deux mécanismes de Quenching: - Quenching Collisionel ( = quenching dynamique) : X + hn X* + Q 1 X* X + Q+ chaleur formation d’un complexe à l’état excité - Quenching statique X + Q X-Q + hn pas de fluorescence Formation d’un complexe à l’état fondamental)

Exemples de quenching collisionel (dynamique) L’oxygène moléculaire (3 O 2 ) quenche la majorité des fluorophores Les Amines quenchent les hydrocarbones aromatiques Méchanisme (exemple: A = Anthracène): Méchanisme : X + hn 1 X* + 3 O 3 X* 2 1 X* X + hn 1 A* 3 X* + 1 O 2 1 A* + R [A- +NR 3] X + chaleur 3 N [A- +NR 3] A + R 3 N + chaleur Autres quenchers: a) Composés avec des atomes lourds (l 3 CCH 2 OH: facilite l’ISC vers l’état triplet) b) Les accepteurs d’electrons (Cu 2+, Mn 2+, NO 3 -): acceptent un electron de X*) etc…

Exemple de Quenching statique

(diapo pas au programme du parcours bio) Equation de Stern-Volmer F 0/F = 1 + kd [Q] équation valable pour les deux catégories de quenching (statique et collisionel) Higher temperature; La Comparaison de l’efficacité de quenching à deux températures différentes permet d’identifier quel catégorie de quenching est en jeu: F 0/F Collisional quenching Higher temperature; À haute température Static quenching -la vitesse de diffusion augmente Le quenching collisionel est plus efficace - le complexe formé entre le fluorophore et le quencher est déstabilisé [Q], mole/L Le quenching statique est moins efficace F 0 = intensité de fluorescence lorsque fluorophore seul F= intensité de fluorescence en présence de Q

III. Influence du p. H sur la fluorescence La protonation ou la déprotonation de groupes fonctionnels modifient de nombreux fluorophores, -Soit au niveau de leur rendement quantique Applications: sonde de p. H -Soit au niveau des spectres d’excitation ou d’émission. IV. Polarité La polarité peut jouer sur l’absorption (e et l exc) Mais aussi au niveau de la fluo sur l em de fluorescence et If:

V. Photobleaching et fading (cf cours sur problèmes rencontrés en microscopie) Comment limiter le photoblanchiment ou le « fading » ? « photobleaching » (photoblanchiment) =destruction irréversible d’un fluorochrome excité par la lumière en présence d’oxygène. «fading » = diminution de fluorescence sur une longue période sans nécessairement d’excitation lumineuse (simple oxydation) 1/ Utiliser des « quenchers » pour réduire la concentration d’oxygène: -Agents anti-oxydants: DABCO (1, 4 -diazabicyclo[2. 2. 2]octane) ou parapenylene diamine -utiliser des milieux de montage avec anti-fading 2/ Atténuer l’intensité lumineuse excitatrice 3/Augmenter la vitesse de balayage en microscopie confocale ou diminuer le temps d’illumination en microscopie plein champ (obturateur rapide, temps d’exposition diminué, rapidité del’acquisition en Z… 4/ quantum dot

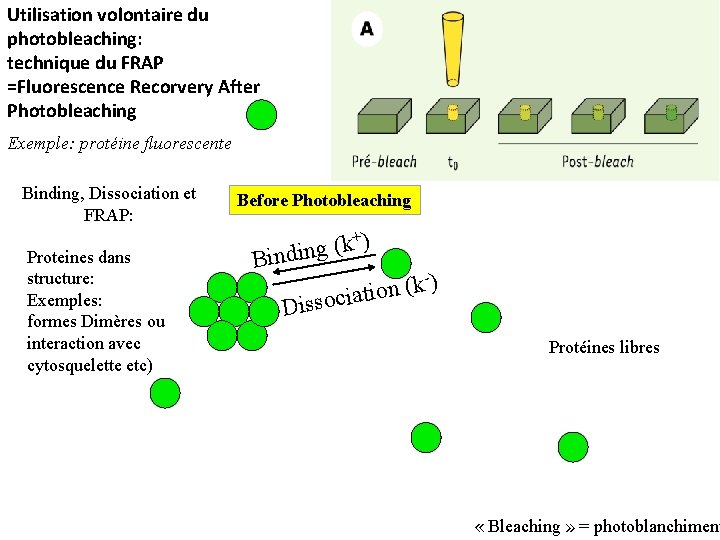
Utilisation volontaire du photobleaching: technique du FRAP =Fluorescence Recorvery After Photobleaching Exemple: protéine fluorescente Binding, Dissociation et FRAP: Proteines dans structure: Exemples: formes Dimères ou interaction avec cytosquelette etc) Before Photobleaching +) k ( Binding -) k ( ciation Disso Protéines libres « Bleaching » = photoblanchiment

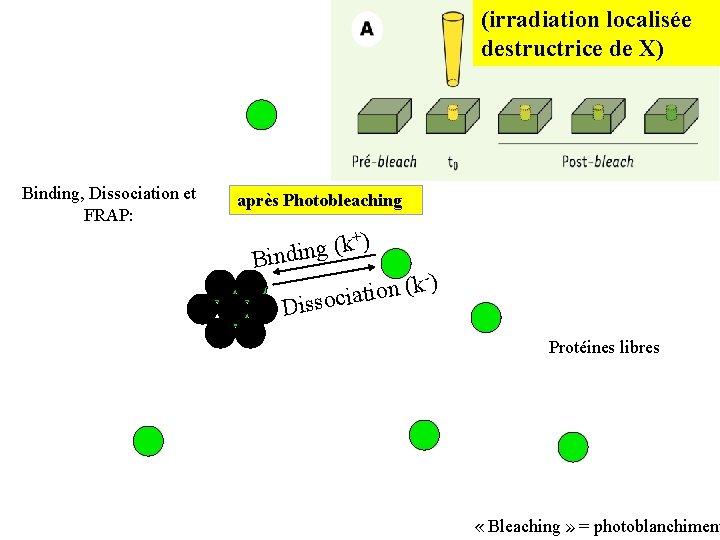
(irradiation localisée destructrice de X) Binding, Dissociation et FRAP: après Photobleaching +) k ( Binding -) k ( ciation Disso Protéines libres « Bleaching » = photoblanchiment

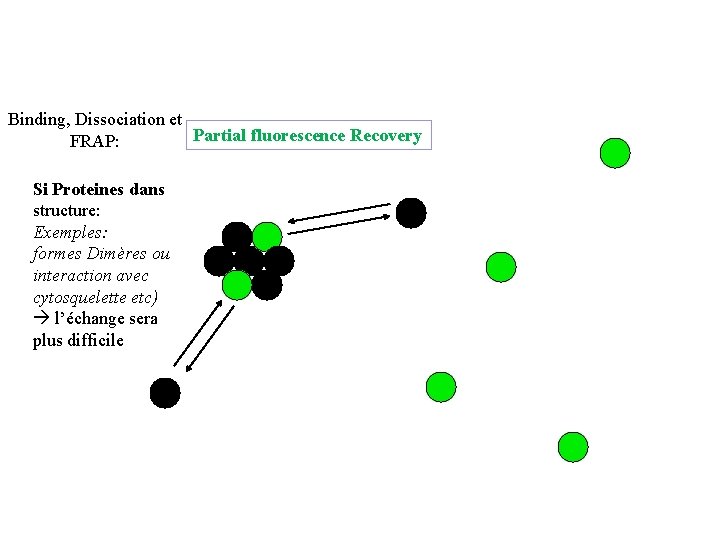
Binding, Dissociation et Partial fluorescence Recovery FRAP: Si Proteines dans structure: Exemples: formes Dimères ou interaction avec cytosquelette etc) l’échange sera plus difficile

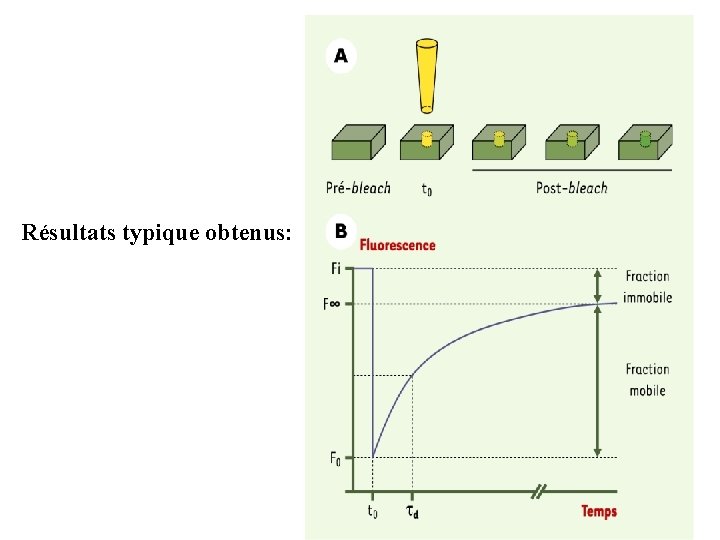
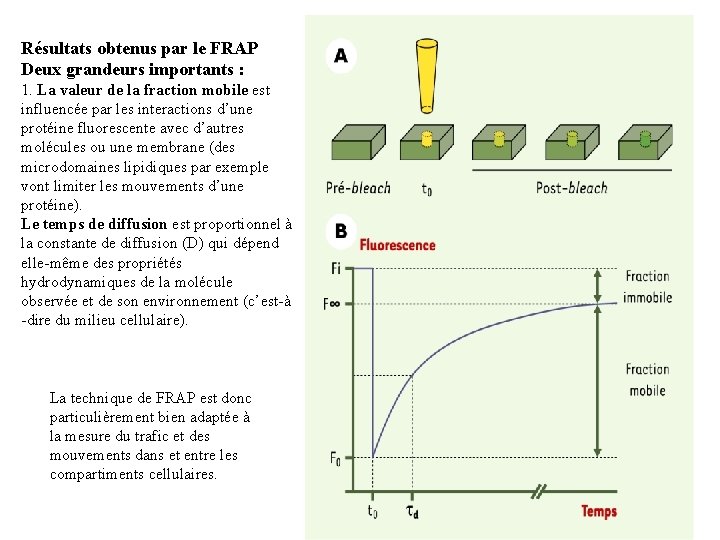
Résultats typique obtenus:

Résultats obtenus par le FRAP Deux grandeurs importants : 1. La valeur de la fraction mobile est influencée par les interactions d’une protéine fluorescente avec d’autres molécules ou une membrane (des microdomaines lipidiques par exemple vont limiter les mouvements d’une protéine). Le temps de diffusion est proportionnel à la constante de diffusion (D) qui dépend elle-même des propriétés hydrodynamiques de la molécule observée et de son environnement (c’est-à -dire du milieu cellulaire). La technique de FRAP est donc particulièrement bien adaptée à la mesure du trafic et des mouvements dans et entre les compartiments cellulaires.


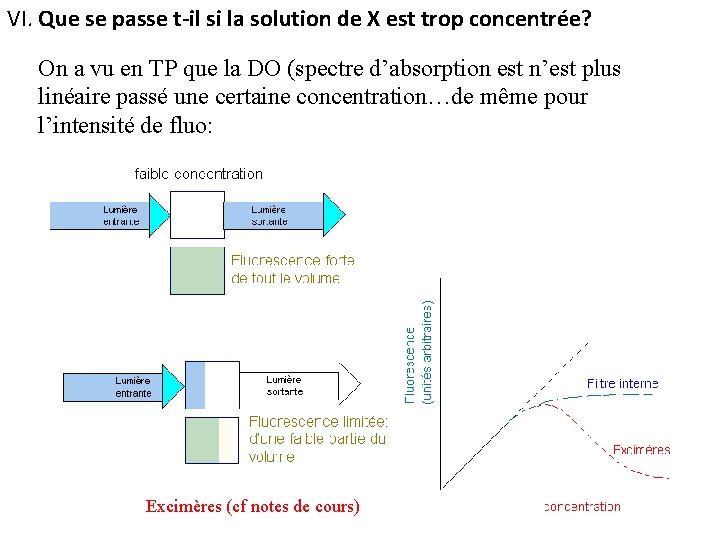
VI. Que se passe t-il si la solution de X est trop concentrée? On a vu en TP que la DO (spectre d’absorption est n’est plus linéaire passé une certaine concentration…de même pour l’intensité de fluo: Excimères (cf notes de cours)