Clculo de la osmolaridad en tejidos vegetales Completar




- Slides: 6

Cálculo de la osmolaridad en tejidos vegetales Completar las actividades y planear el experimento

Definición La Osmosis se produce debido a que los solutos pueden formar uniones con las moléculas de agua. Los solutos, tales como la glucosa, iones de sodio, potasio o cloruros, son osmóticamente activos y se los utiliza en experimentos de osmosis. La osmolaridad de una solución es debida a la concentración total de solutos activos en la misma. Se define como: número de osmomoles (Osm) de soluto en 1 litro de solución. La unidad de medición es: osmoles (Osm) o miliosmoles (m. Osm). La osmolaridad normal de un tejido humano es de 300 m. Osm Si se sumerge células o un tejido en una solución de igual osmolaridad que el tejido o las células, la solución es isotónica, si es mayor es hipertónica y si es menor es hipotónica.

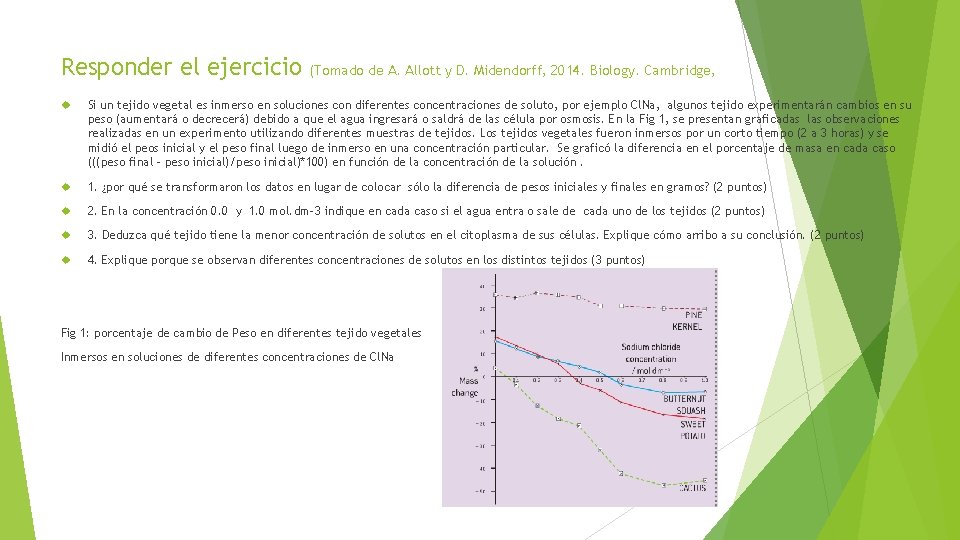
Responder el ejercicio (Tomado de A. Allott y D. Midendorff, 2014. Biology. Cambridge, Si un tejido vegetal es inmerso en soluciones con diferentes concentraciones de soluto, por ejemplo Cl. Na, algunos tejido experimentarán cambios en su peso (aumentará o decrecerá) debido a que el agua ingresará o saldrá de las célula por osmosis. En la Fig 1, se presentan graficadas las observaciones realizadas en un experimento utilizando diferentes muestras de tejidos. Los tejidos vegetales fueron inmersos por un corto tiempo (2 a 3 horas) y se midió el peos inicial y el peso final luego de inmerso en una concentración particular. Se graficó la diferencia en el porcentaje de masa en cada caso (((peso final – peso inicial)/peso inicial)*100) en función de la concentración de la solución. 1. ¿por qué se transformaron los datos en lugar de colocar sólo la diferencia de pesos iniciales y finales en gramos? (2 puntos) 2. En la concentración 0. 0 y 1. 0 mol. dm-3 indique en cada caso si el agua entra o sale de cada uno de los tejidos (2 puntos) 3. Deduzca qué tejido tiene la menor concentración de solutos en el citoplasma de sus células. Explique cómo arribo a su conclusión. (2 puntos) 4. Explique porque se observan diferentes concentraciones de solutos en los distintos tejidos (3 puntos) Fig 1: porcentaje de cambio de Peso en diferentes tejido vegetales Inmersos en soluciones de diferentes concentraciones de Cl. Na

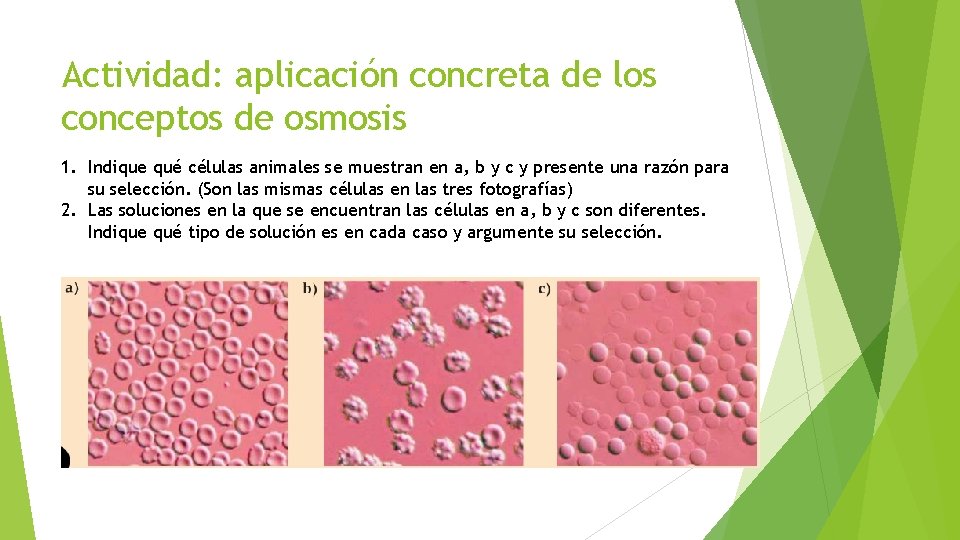
Actividad: aplicación concreta de los conceptos de osmosis 1. Indique qué células animales se muestran en a, b y c y presente una razón para su selección. (Son las mismas células en las tres fotografías) 2. Las soluciones en la que se encuentran las células en a, b y c son diferentes. Indique qué tipo de solución es en cada caso y argumente su selección.

Medición experimental Tomando el ejemplo de la Fig 1 diseñe su propio experimento utilizando tejido vegetales consistencia, tales como papa, batata, zanahoria. Planteo una pregunta de investigación, hipótesis, variables (dependiente, independiente y de control). Pienso cuidadosamente en la variables que tengo que mantener controladas y en qué método utilizar para que permanezcan sin alterar durante el experimento. Ejemplo: para utilizar trozos de vegetales similares en tamaño y forma en la diferentes réplicas usar un sacabocados del mismo diámetro en cada caso. Escribo los materiales y métodos. Sugiero que te respondas estas preguntas: ¿Qué puedo hacer para ver si existen cambios luego de la inmersión en las diferentes soluciones? ¿Qué variables mediría? ¿Qué instrumentos utilizaría? Presento los resultados: ¿Cómo puedo presentar gráficamente mis resultados? ¿Cómo presentaría mis datos en una tabla? ¿Cómo explicaría mis resultados? A qué se deben los cambios? Investigar datos obtenido en la bibliografía sobre la concentración normal de solutos en el tejido que investigaste. Compará tus resultados y discutí las semejanza o diferencias analizando los errores Mirá las siguiente diapo para realizar la soluciones

Obtención de las soluciones de Cl. Na con diferentes concentraciones molares La concentración 0. 1 M, nos indica que tenemos 0. 1 moles de Na. Cl en 1000 ml de solución (1 L). Si nosotros queremos preparar 100 ml o 100 cm 3 de esta solución, tendremos, 1000 ml……. . 0. 1 moles de Na. Cl 100 ml………X= 0. 01 moles de Na. Cl Concentración Cant de solución Molar (M) a preparar (ml) 0 100 Es decir que para preparar 100 ml de solución necesitaremos 0. 01 moles de sal. 0, 1 100 Si ahora queremos calcular la masa en gramos a la que equivalen estos 0. 01 moles, 0, 2 100 1 mol de Na. Cl…………. . 58, 4 g ( ver peso atómico en tabla periódica Na: 23 + Cl: 35, 4) 0, 3 100 0. 01 mol de Na. Cl……. . X= 0, 58 g/mol 0, 4 100 0, 5 100 0, 6 100 Otra forma de expresar las concentraciones es en %m/v que es la masa de soluto por cada 100 ml de solución. En este caso en 100 ml de solución tenemos 0. 58 gramos de Na. Cl, por ende, la solución 0, 1 M de Nacl, es 0. 58 %m/v. Completar la tabla para saber cuántos gramos de cloruro de sodio hay que disolver en 100 ml de agua para preparar las soluciones experimentales. Si decidieras utilizar sacarosa en lugar de sal ¿cuántos gramos necesitarías para preparar cada solución? Gramos de Na. Cl (g ± 0, 01 g ) % m/v (% ± 0, 01 %)