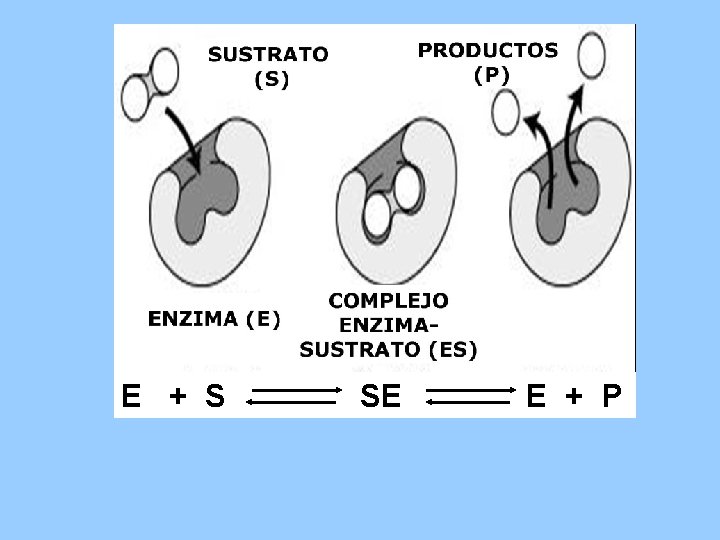
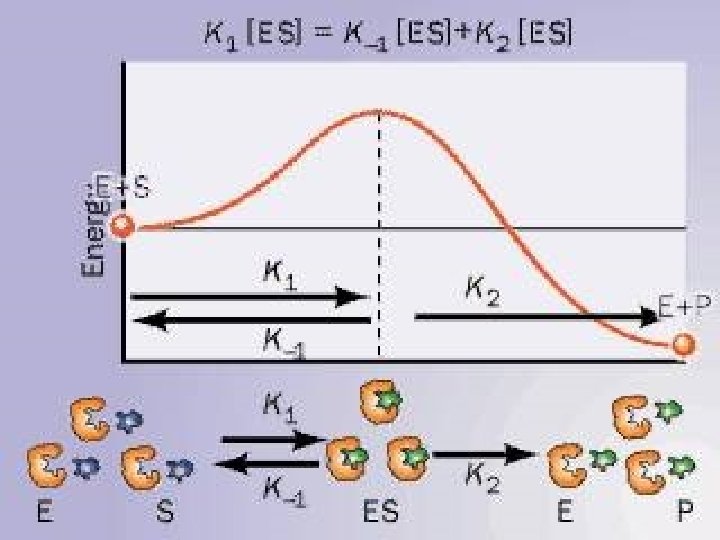
CINTICA ENZIMTICA E S SE E P Protenas


![ECUACIÓN DE MICHAELIS-MENTEN Vo = V max [S] Km + [S] ECUACIÓN DE MICHAELIS-MENTEN Vo = V max [S] Km + [S]](https://slidetodoc.com/presentation_image_h/b0c643d9b3fa5f4bfdc92e211223ef0e/image-14.jpg)



![Gráfica de Eadie-Hofstee Vmax Vo V max KM Vo [S] Gráfica de Eadie-Hofstee Vmax Vo V max KM Vo [S]](https://slidetodoc.com/presentation_image_h/b0c643d9b3fa5f4bfdc92e211223ef0e/image-30.jpg)






- Slides: 48

CINÉTICA ENZIMÁTICA

E + S SE E + P

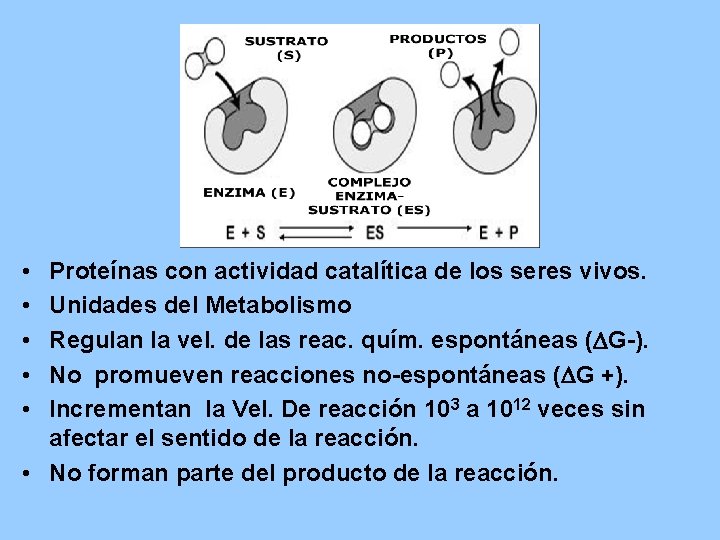
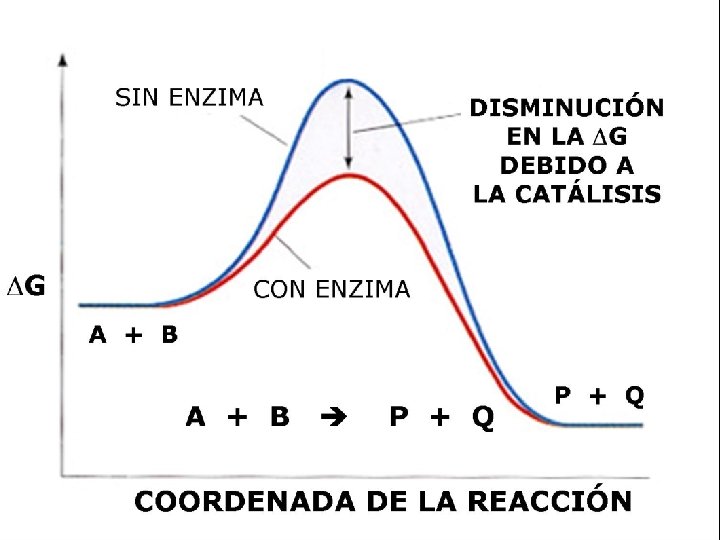
• • • Proteínas con actividad catalítica de los seres vivos. Unidades del Metabolismo Regulan la vel. de las reac. quím. espontáneas (DG-). No promueven reacciones no-espontáneas (DG +). Incrementan la Vel. De reacción 103 a 1012 veces sin afectar el sentido de la reacción. • No forman parte del producto de la reacción.

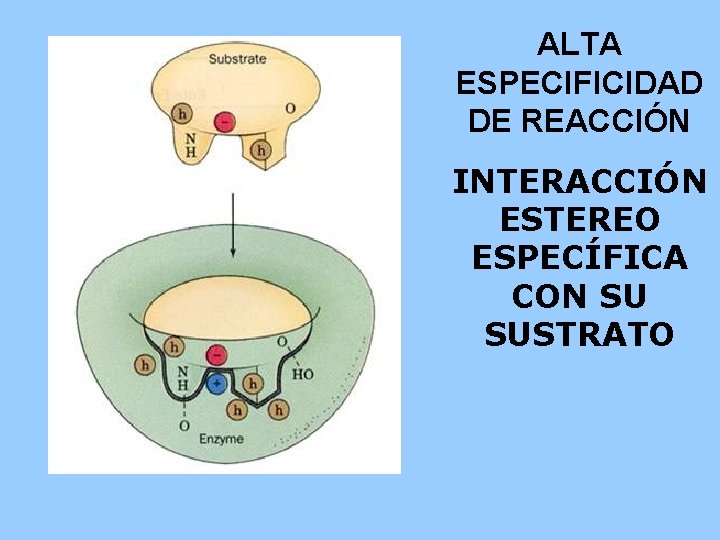
PROPIEDADES GENERALES • AUMENTAN LA VELOCIDAD DE REACCIÓN – De 106 to 1012 veces vs sin enzima. – Aún más rápido que los catalizadores químicos. • CONDICIONES DE REACCIÓN – Temperatura 25 -40 o. C (algunas hasta 75 o. C) – p. H neutro (5 -9), la mayoría 6. 5 – 7. 5 – Presión atmosférica normal • CAPACIDAD DE REGULACIÓN – – – Por concentración de sustrato Por concentración de enzima Por inhibidores competitivos (semejantes al sustrato) Por inhibidores no competitivos (modificación covalente de la enzima) Por regulación alostérica • ALTA ESPECIFICIDAD DE REACCIÓN – Interacción estereoespecífica con el sustrato – No hay productos colaterales

ALTA ESPECIFICIDAD DE REACCIÓN INTERACCIÓN ESTEREO ESPECÍFICA CON SU SUSTRATO

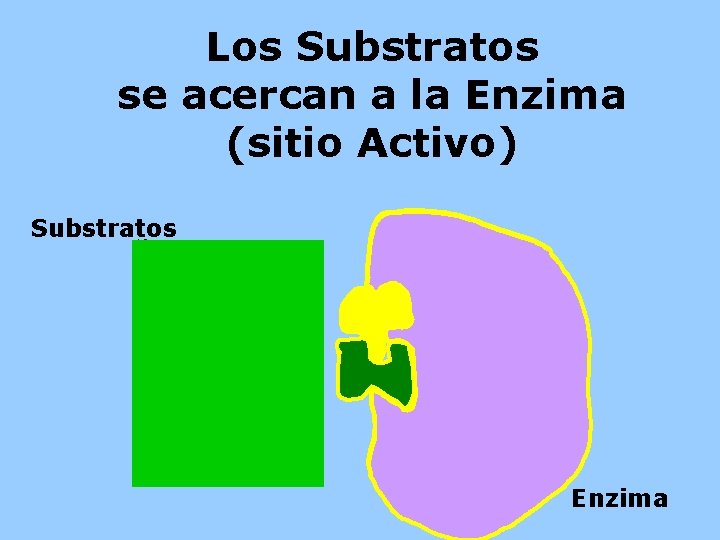
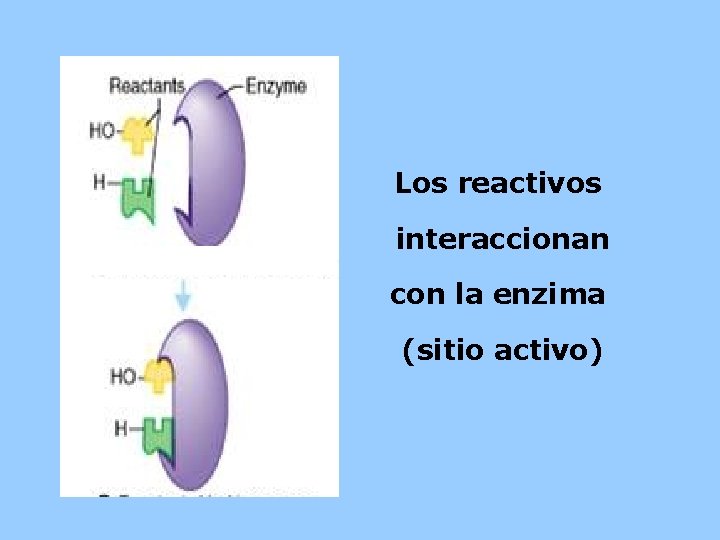
Los Substratos se acercan a la Enzima (sitio Activo) Substratos HO- HEnzima

Los reactivos interaccionan con la enzima (sitio activo)

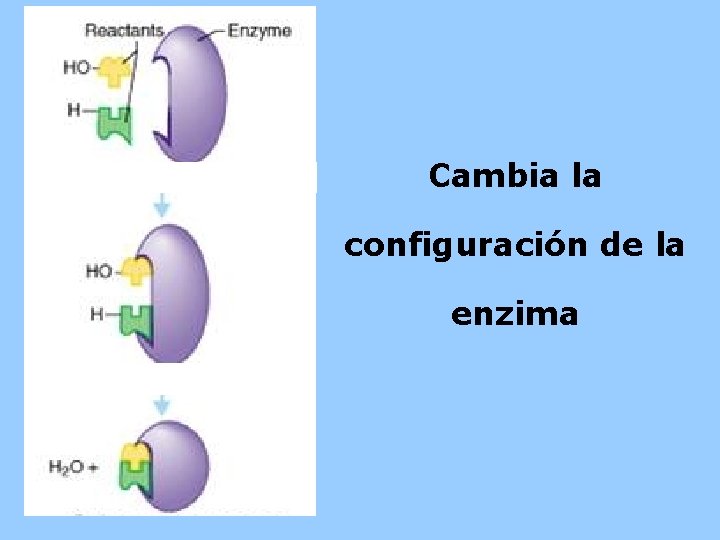
Cambia la configuración de la enzima

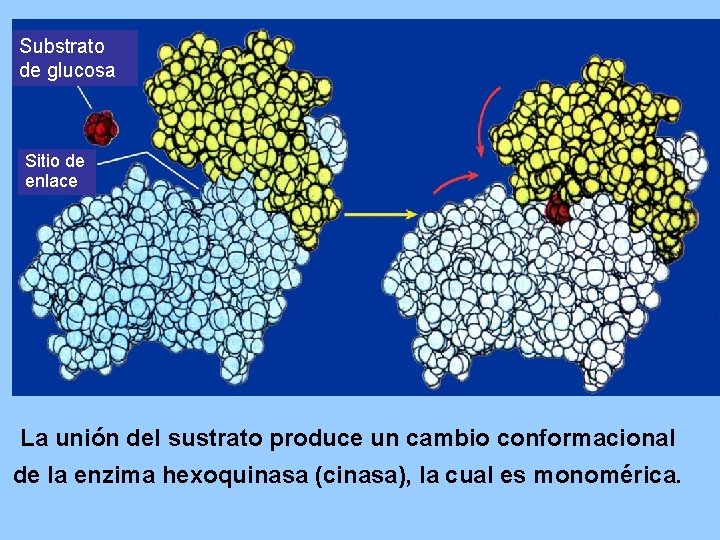
Substrato de glucosa Sitio de enlace La unión del sustrato produce un cambio conformacional de la enzima hexoquinasa (cinasa), la cual es monomérica.

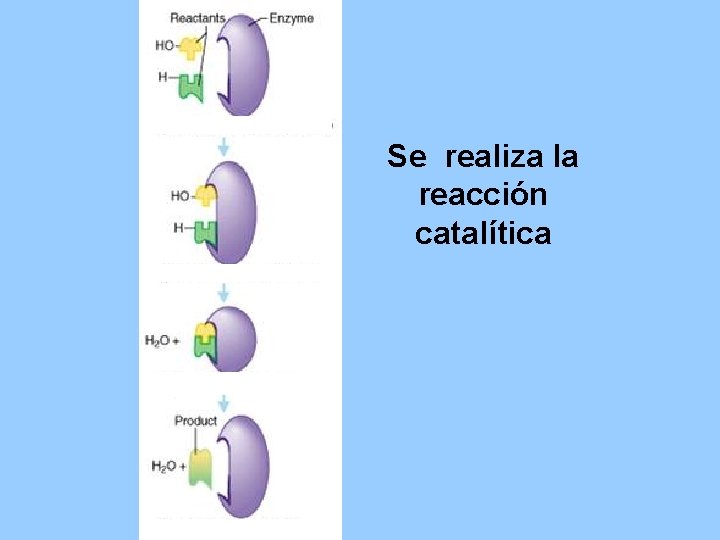
Se realiza la reacción catalítica



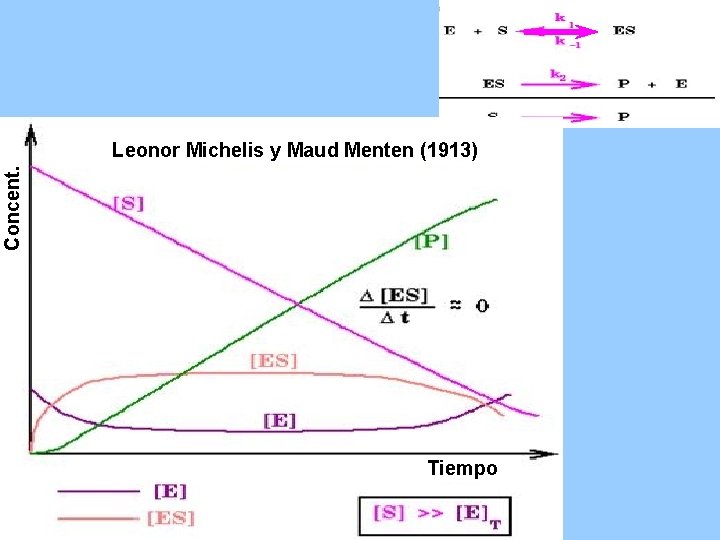
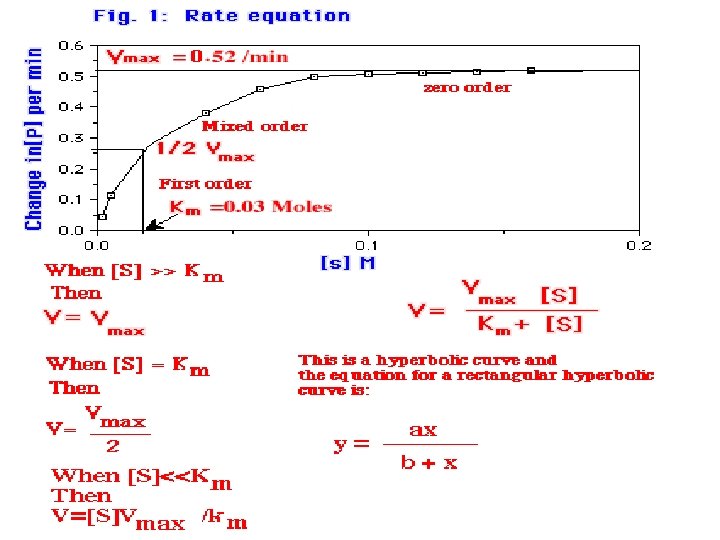
Concent. Leonor Michelis y Maud Menten (1913) Tiempo
![ECUACIÓN DE MICHAELISMENTEN Vo V max S Km S ECUACIÓN DE MICHAELIS-MENTEN Vo = V max [S] Km + [S]](https://slidetodoc.com/presentation_image_h/b0c643d9b3fa5f4bfdc92e211223ef0e/image-14.jpg)
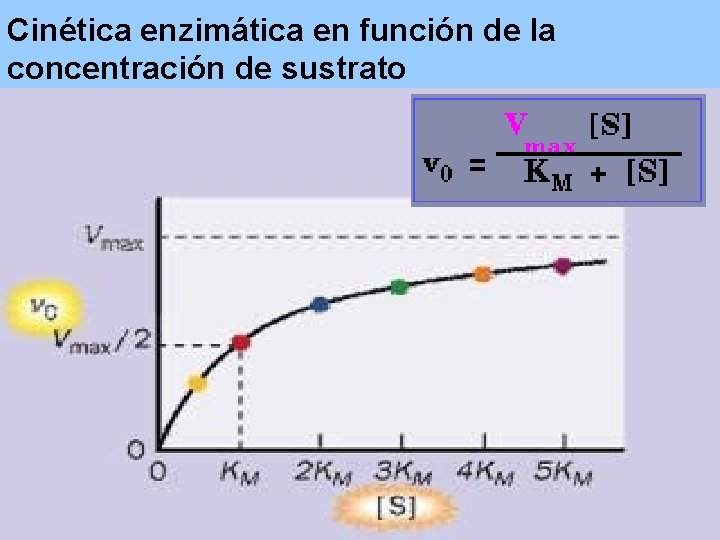
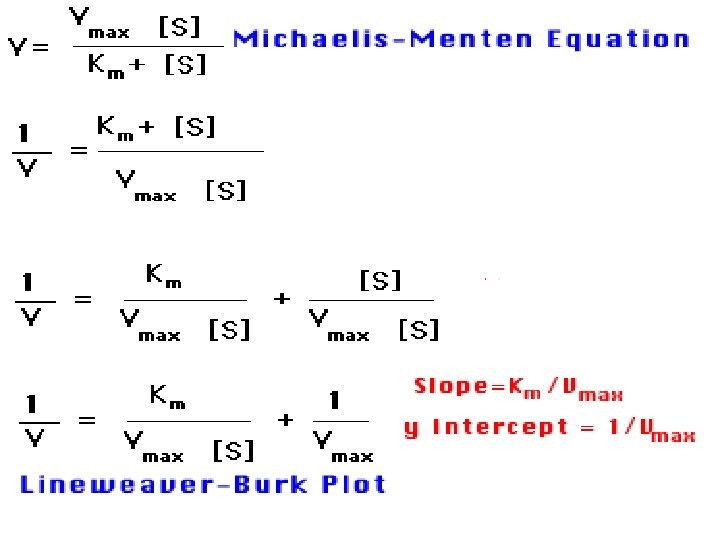
ECUACIÓN DE MICHAELIS-MENTEN Vo = V max [S] Km + [S]

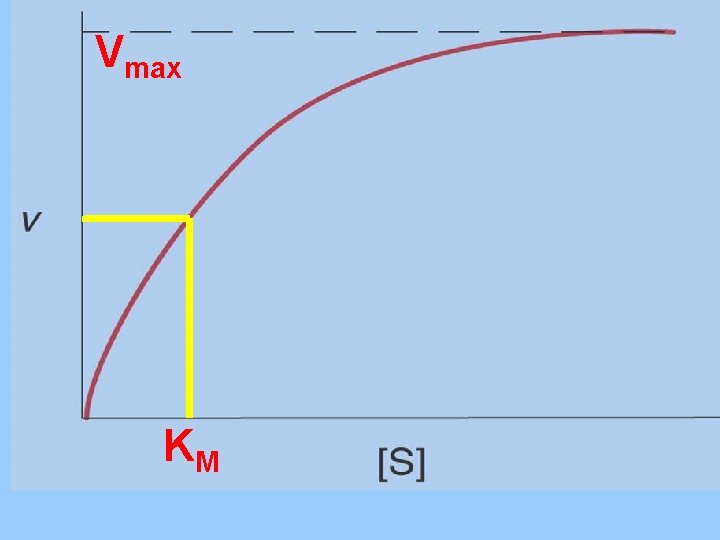
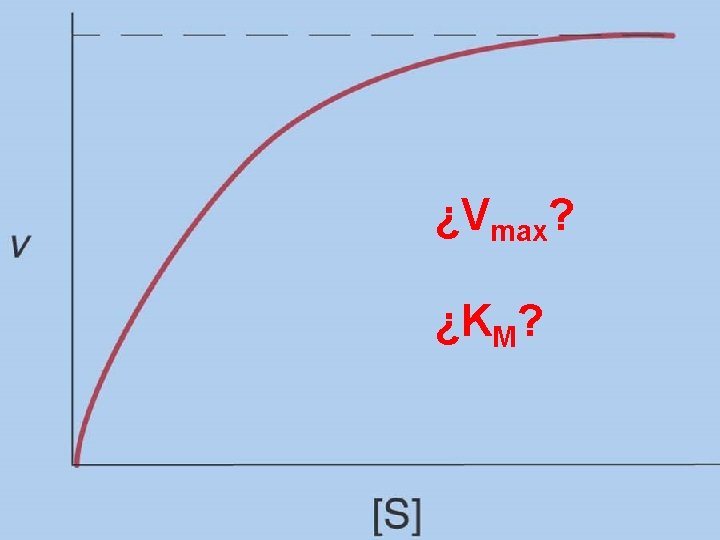
Cinética enzimática en función de la concentración de sustrato

Vmax KM


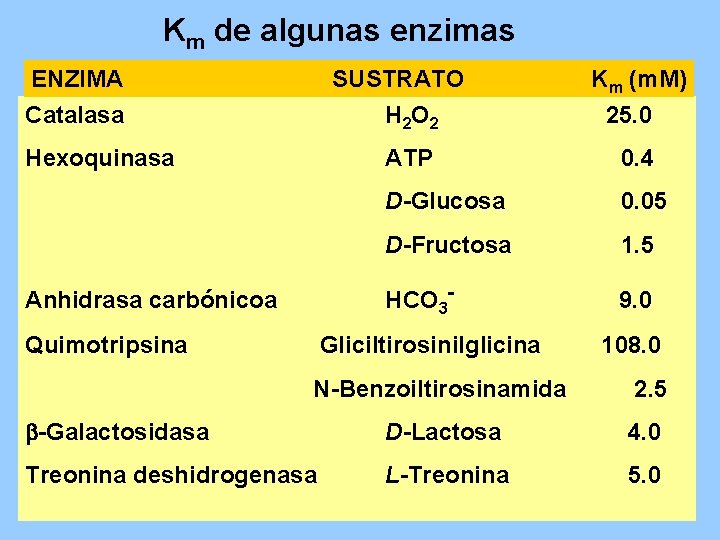
Km de algunas enzimas ENZIMA SUSTRATO Km (m. M) Catalasa H 2 O 2 25. 0 Hexoquinasa ATP 0. 4 D-Glucosa 0. 05 D-Fructosa 1. 5 Anhidrasa carbónicoa HCO 3 - 9. 0 Quimotripsina Gliciltirosinilglicina 108. 0 N-Benzoiltirosinamida 2. 5 -Galactosidasa D-Lactosa 4. 0 Treonina deshidrogenasa L-Treonina 5. 0

La KM es un parámetro de Actividad Enzimática • La KM es inversamente proporcional con la actividad de la enzima. • Valor de KM grande, baja actividad • Valor de KM pequeño, alta activida

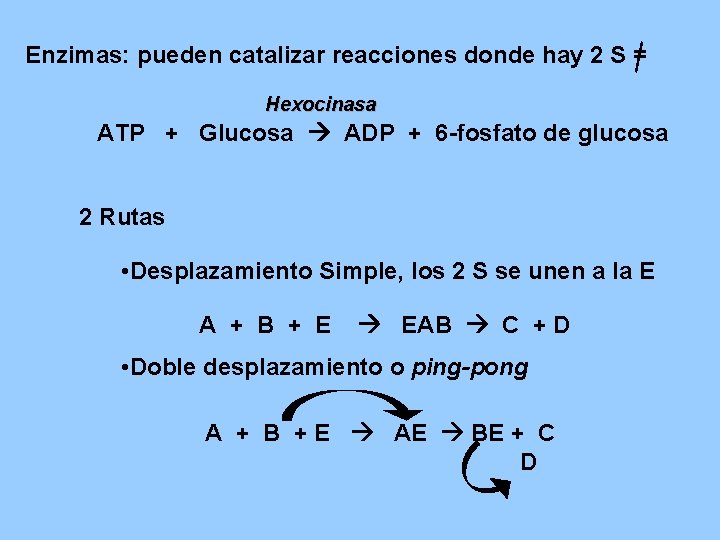
Enzimas: pueden catalizar reacciones donde hay 2 S = Hexocinasa ATP + Glucosa ADP + 6 -fosfato de glucosa 2 Rutas • Desplazamiento Simple, los 2 S se unen a la E A + B + E EAB C + D • Doble desplazamiento o ping-pong A + B + E AE BE + C D

Determinación Cuantitativa de la Cinética Enzimática 1. La reacción global 2. Procedimeinto analítico para determinar el. S que desaparece o el P que aparece 3. Sí el E requiere Cofactores (iónes o coenzimas) 4. La dependencia de la actividad enzimática con la [S] o se la KM del S. 5. El p. H óptimo 6. Un intervalo de temperatura en la que la E es estable y muestra actividad elevada.

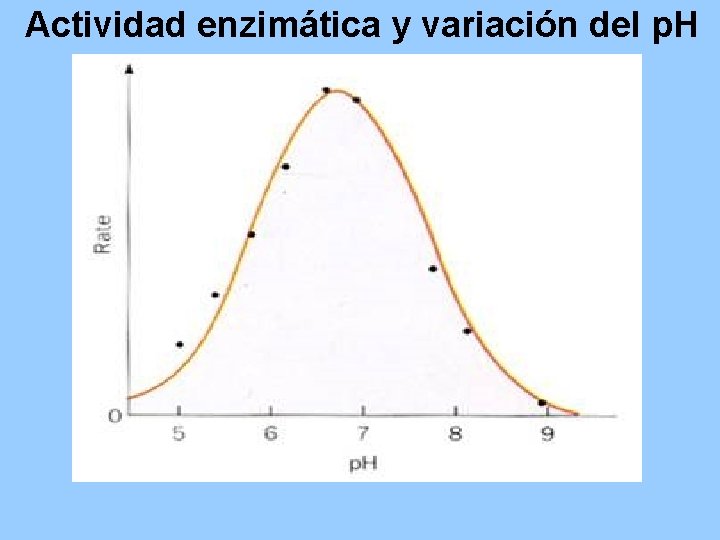
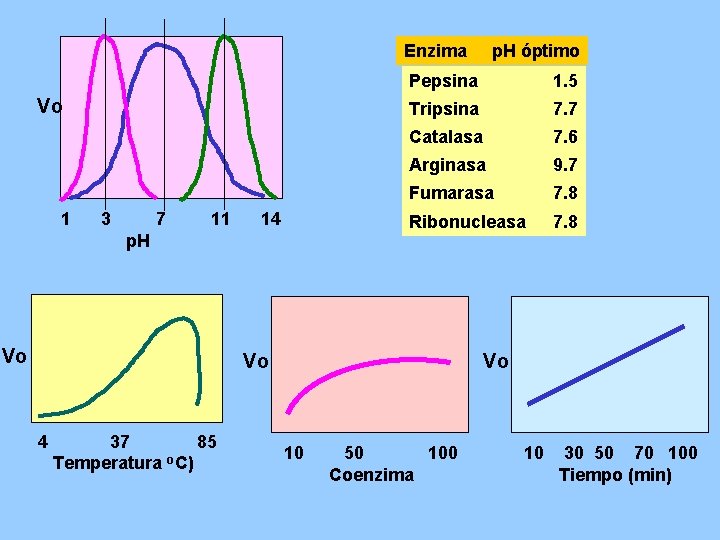
Actividad enzimática y variación del p. H

Enzima p. H óptimo Vo 1 3 7 11 14 p. H Vo Pepsina 1. 5 Tripsina 7. 7 Catalasa 7. 6 Arginasa 9. 7 Fumarasa 7. 8 Ribonucleasa 7. 8 Vo 4 37 85 Temperatura o. C) Vo 10 50 100 Coenzima 10 30 50 70 100 Tiempo (min)

1. 0 Unidad de Actividad Enzimática (U): La cantidad que transforma 1. 0 mmol (10 -6 M) de S /min, a 25 0 C, en las condiciones de medida óptima. Actividad específica: Es el no. de U de una E / mg de proteína. Es decir: una medida de la pureza de la E. Al purificarla, el valor llega a un máximo y es estable. Número de recambio No. de moléculas de S transformadas /unidad de tiempo, por una molécula de E ( o por un solo sitio catalítico) Enzima No. de Recambio Anhidrasa carbónica B-Amilasa B-Galactosidasa Fosfoglucomutasa 36 000 1 000 12 000 1 240

¿Vmax? ¿KM?




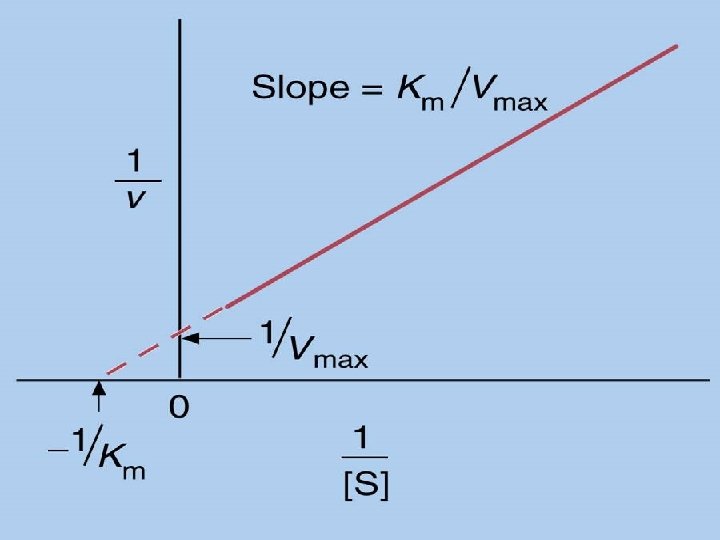
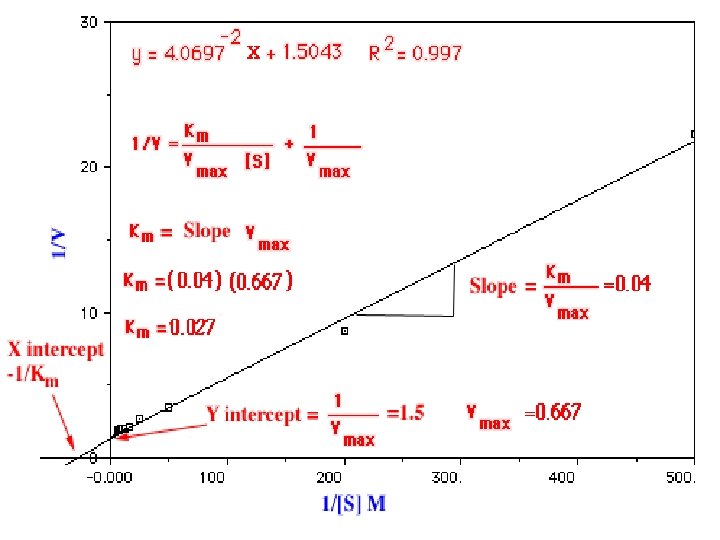
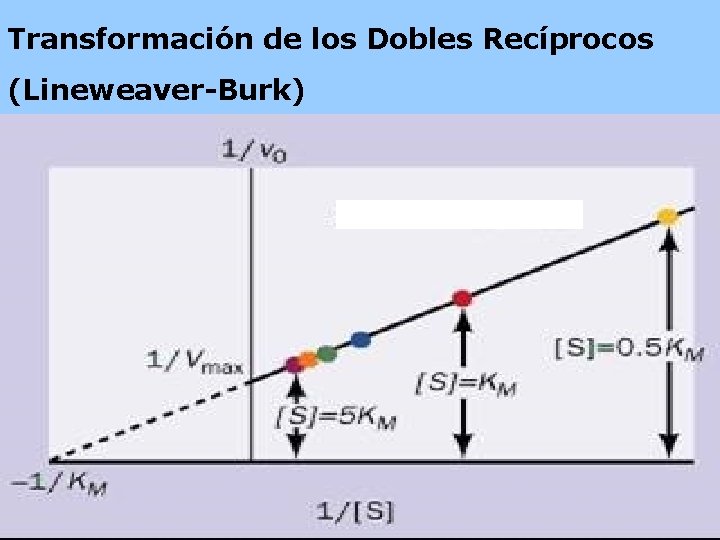
Transformación de los Dobles Recíprocos (Lineweaver-Burk) pendiente
![Gráfica de EadieHofstee Vmax Vo V max KM Vo S Gráfica de Eadie-Hofstee Vmax Vo V max KM Vo [S]](https://slidetodoc.com/presentation_image_h/b0c643d9b3fa5f4bfdc92e211223ef0e/image-30.jpg)
Gráfica de Eadie-Hofstee Vmax Vo V max KM Vo [S]

Cuando: Vo= Vmax Todos los sitios activos están ocupados y no hay moléculas de E libre. KM= [S] Sí. . . ½ Vmax KM representa la cantidad de sustrato necesaria para fijarse a la mitad de la E disponible y producir la mitad de la Vmax KM representa la concentración del sustrato en una célula

Inhibidores Reactivos químicos específicos que pueden inhibir a la mayor parte de las enzimas. Irreversibles INHIBIDORES Reversibles

Inhibidor Irreversible • Inhibición permanente • Unión irreversible por medio de enlaces covalentes. • Modificaciones químicas de los gps. catalíticos. • Modificada la enzima, está siempre inhibida. Para distinguirlo de los reversible se someten a diálisis y si no se separan enzima e inhibidor, éste es permanente.

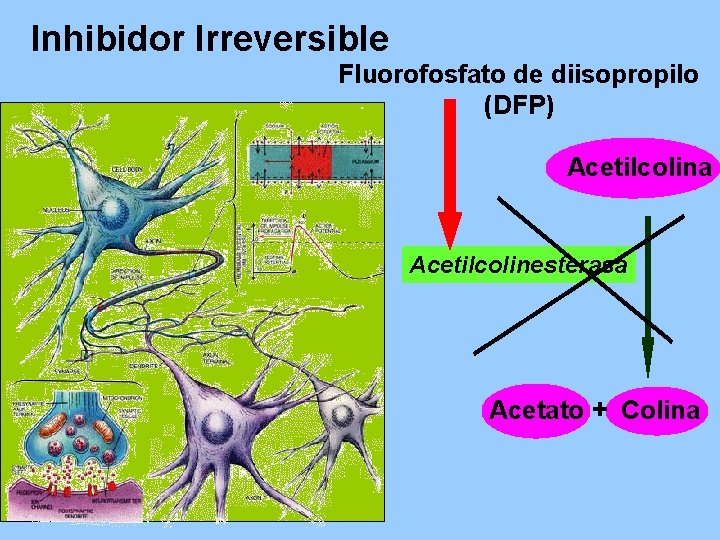
Inhibidor Irreversible Fluorofosfato de diisopropilo (DFP) Acetilcolina Acetilcolinesterasa Acetato + Colina

Inhibidor Irreversible Fluorofosfato de diisopropilo (DFP) Acetilcolinesterasa Tripsina Elastasa Fosfoglucomutasa Cocoonasa (larvas de gusanos de seda Malatión

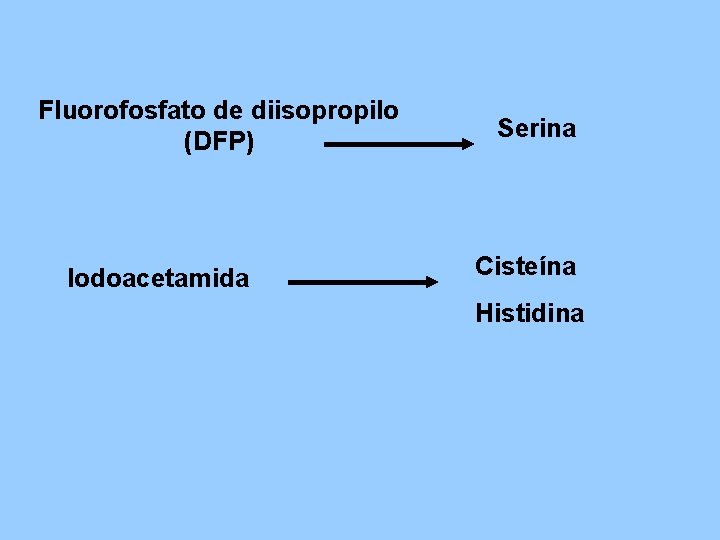
Fluorofosfato de diisopropilo (DFP) Iodoacetamida Serina Cisteína Histidina

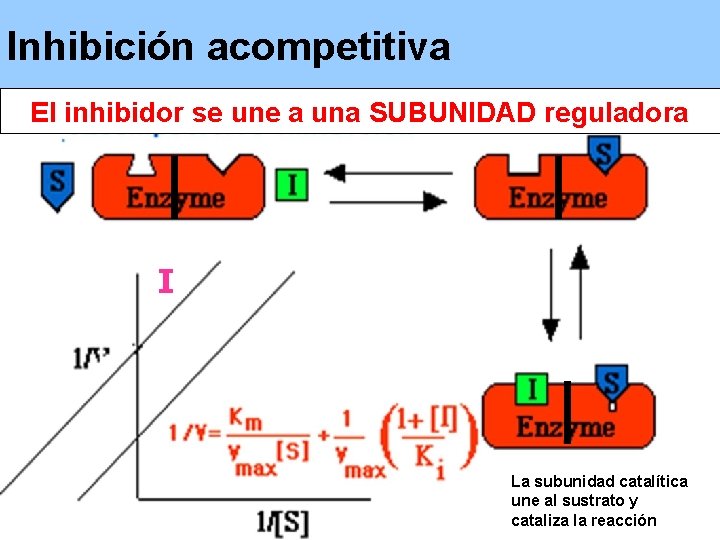
Inhibidor Reversible • La unión del inhibidor y la enzima es reversible. • Al quitar el inhibidor del medio, se recupera la actividad. Hay 3 tipos: Competitiva No Competitiva Acompetitiva (Alostérica)

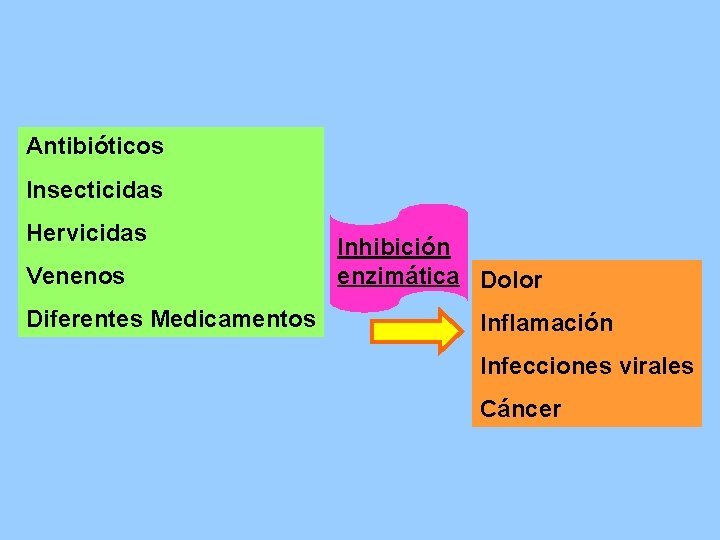
Antibióticos Insecticidas Hervicidas Venenos Diferentes Medicamentos Inhibición enzimática Dolor Inflamación Infecciones virales Cáncer

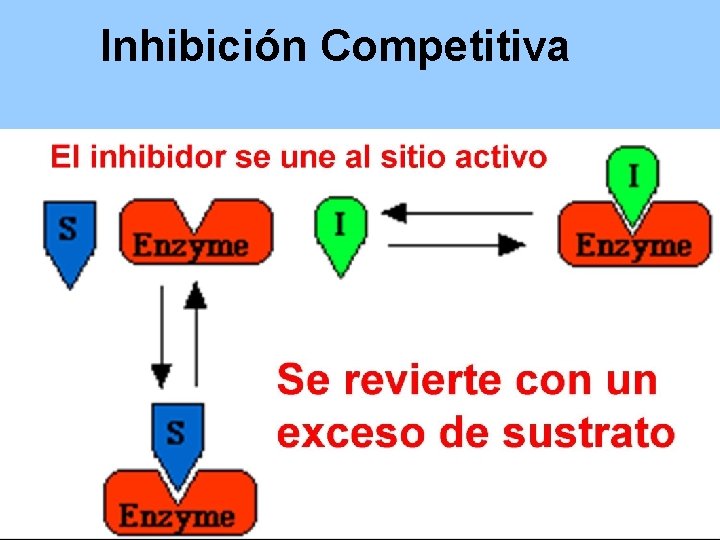
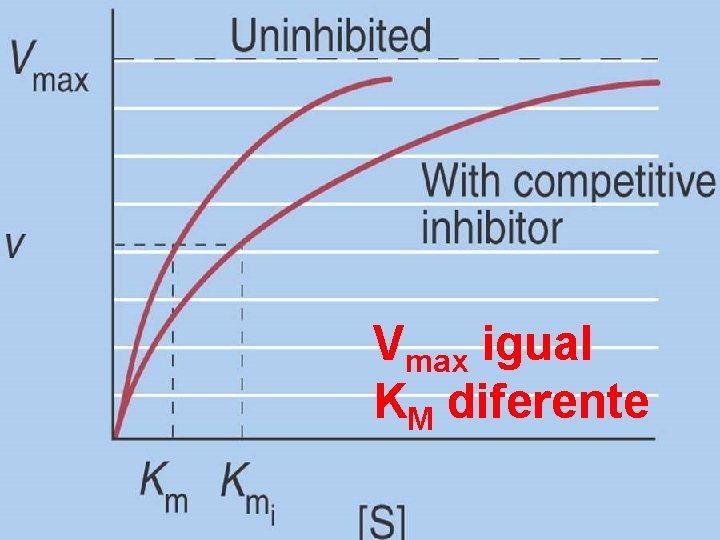
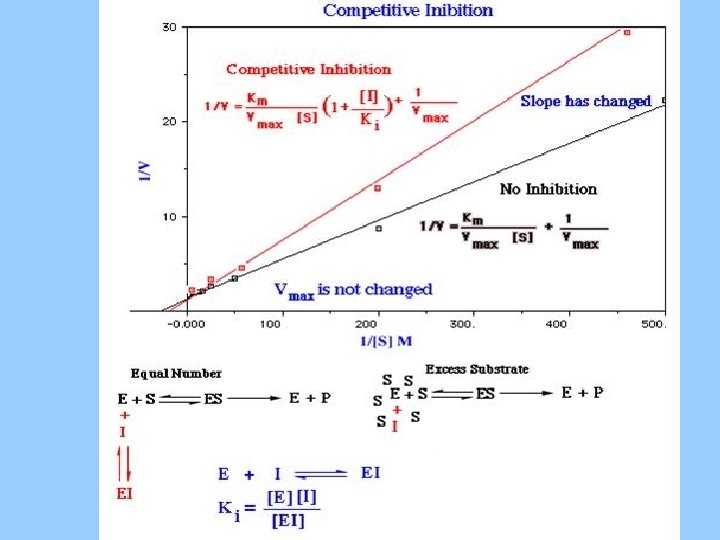
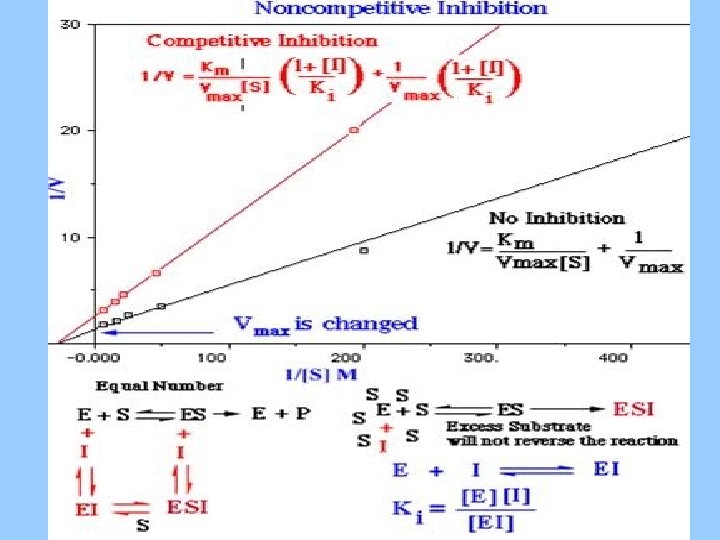
Inhibición Competitiva

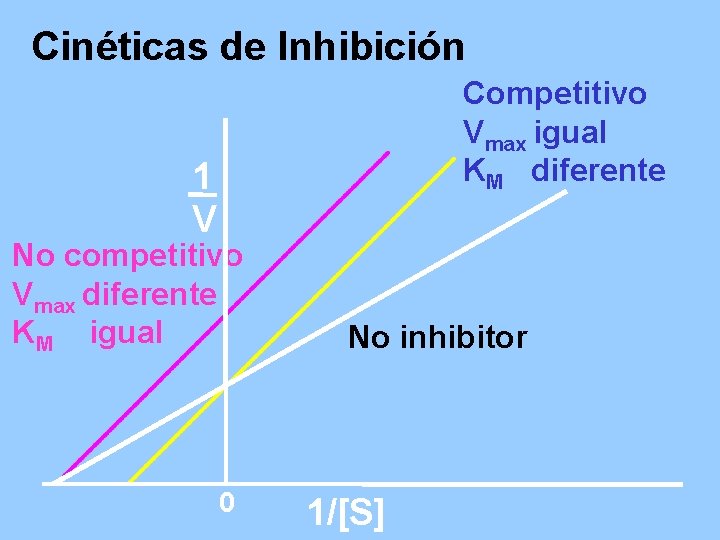
Vmax igual KM diferente


Inhibidores Competitivos Malonato Deshidrogenasa del ácido succínico Sulfas Infecciones microbianas Antihipertensores: Captopril y Enalopril Alopurinol Controla la gota Fluoruracilo Cáncer

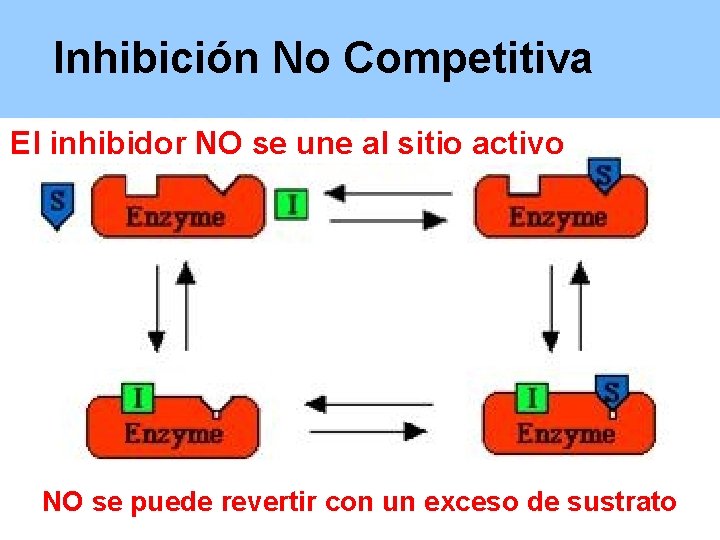
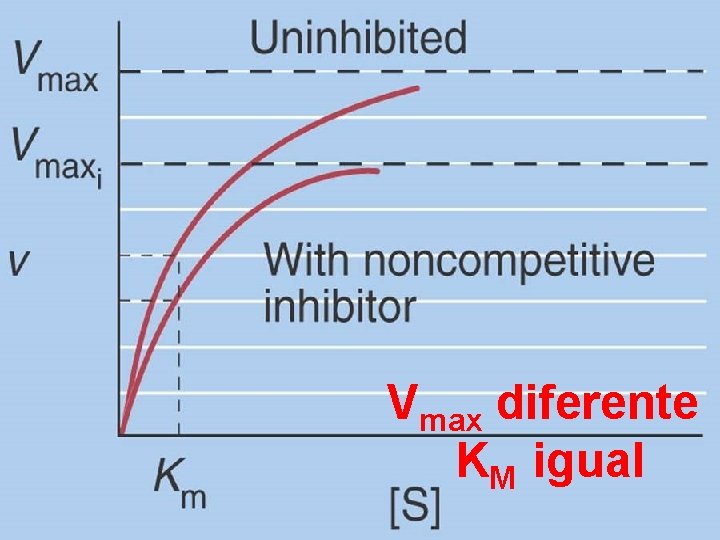
Inhibición No Competitiva El inhibidor NO se une al sitio activo NO se puede revertir con un exceso de sustrato

Vmax diferente KM igual


Cinéticas de Inhibición Competitivo Vmax igual KM diferente 1 V No competitivo Vmax diferente KM igual 0 No inhibitor 1/[S]

Inhibición acompetitiva El inhibidor se une a una SUBUNIDAD reguladora I La subunidad catalítica une al sustrato y cataliza la reacción
