Cincias da Natureza e suas Tecnologias Qumica Ensino

























- Slides: 26

Ciências da Natureza e suas Tecnologias – Química Ensino Médio, 1ª Série Função Ácido

QUÍMICA, 1° ANO Função ácido Imagem: Photo by Scott Bauer. / Agricultural Research Service - USA / Public Domain. Você já deve ter ouvido falar que vegetais amarelos e vermelhos possuem vitamina C, que é um ácido.

Características dos Ácidos • Quando estão na solução aquosa, os ácidos se ionizam, isto é, dão origem a íons, produzindo como cátion H+ ; * Em solução aquosa, os ácidos conduzem eletricidade. Isso ocorre porque os ácidos se desdobram em íons; * Os ácidos têm sabor azedo. O limão, o vinagre, o tamarindo contêm ácidos; é por isso que eles são azedos;

Características dos Ácidos • Os ácidos reagem com as bases formando sais e água; • Essa reação é conhecida como Reação de Neutralização. Imagem: Pearson Scott Foresman / Public Domain.

Classificação dos Ácidos * Monácidos - Liberam um íon H+ por molécula: HCl, HNO 3, HCl. O 4, etc; * Diácidos - Liberam dois íons H+ por molécula: H 2 S, H 2 CO 3, H 2 SO 4, etc; * Triácidos - Liberam três íons H+ por molécula: H 3 BO 3, H 3 PO 4, H 3 SO 4, etc;

Classificação dos Ácidos Algumas formigas liberam ácido fórmico. Imagem: (a) GNU Free Documentation License e (b) Steve Jurvetson / Creative Commons Attribution 2. 0 Generic. • Tetrácidos - Liberam quatro íons H+ por molécula: H 4 P 2 O 7, H 4 Si. O 4, etc.

Quanto à presença de oxigênio: * Hidrácidos, sem oxigênio (fórmula geral: Hn. A); * Oxiácidos, com oxigênio (formula geral: Hn. AO) Fixos: H 2 SO 4, H 3 PO 4, H 3 BO 3, H 3 PO 3.

Quanto à volatilidade p. H = 12 p. H = 11 p. H = 9 p. H = 7 p. H = 6 p. H = 5 p. H = 3 p. H = 1 * Voláteis: HCl, HBr, HI, H 2 S, HCN, HNO 3, entre outros; * Fixos: H 2 SO 4, H 3 PO 4, H 3 BO 3, H 3 PO 3.

Quanto à força N é o número de moléculas que foram ionizadas pelo número total de moléculas. Força: • Forte: Grau de ionização acima de 50% (HCl, HBr, HI); • Semiforte ou Moderado: Grau de ionização de 5% a 50% (HF); • Fraco: Grau de ionização abaixo de 4% (os demais).

Quanto ao número de grupos funcionais (H+) *Monopróticos: são ácidos que liberam apenas dois H+ em solução aquosa e só têm um hidrogênio em sua estrutura, ex. : HCl; *Dipróticos: liberam dois H+ em solução aquosa e só têm três hidrogênios em sua estrutura, ex. : H 2 Cr 2 O 7, H 2 Mn. O 4, H 2 S; *Tripróticos: liberam três H+ em solução aquosa e só quatro hidrogênios em sua estrutura, ex. : H 3 PO 2, H 3 PO 3.

Quanto ao grau de hidratação * Orto: Ácido hidratado: H 3 PO 4 (Fosfórico); * Meta: Ácido menos uma molécula de água H 3 PO 4 - H 2 O = HPO 3 (Metafosfórico); * Piro: 2 ácidos menos uma molécula de água 2 H 3 PO 4 - H 2 O = H 4 P 2 O 7 (Pirofosfórico).

Usos no dia a dia * Ácido acético (CH 3 COOH): encontrado no vinagre; * Ácido cítrico: encontrado em fruta, ex: laranja, limão; * Ácido sulfúrico (H 2 SO 4): encontrado em bateria de carros; * Ácido fosfórico (H 3 PO 4): os sais (fosfatos e superfosfatos) derivados deste ácido têm grande aplicação como fertilizantes na agricultura).

Imagem: Spiff / Public Domain. Usos no dia a dia * Ácido carbônico (H 2 CO 3) (1): as águas e refrigerantes gaseificados têm seu diferencial (mais refrescante) graças a este ácido. Ele é formado na reação do gás carbônico com a água CO 2 + H 2 O → H 2 CO 3

Nomenclatura dos Ácidos * Hidráxidos: Ácidos sem oxigênio na molécula Ácido. . . . ídrico nome do elemento Os nomes dos hidrácidos são formados acrescentandose a terminação ídrico às primeiras letras do nome do elemento químico. Exemplos: HCl – ácido clorídrico; HBr – ácido bromídrico; HI – ácido iodídrico.

oxiácidos Ácidos com oxigênio na molécula: Ácido + prefixo (se necessário) + elemento central + sufixo De acordo com o elemento central (o primeiro é o hidrogênio e o terceiro é o oxigênio), temos o prefixo OSO para o menor NOx (Número de Oxidação) e ICO para o maior NOx: Ex: -Ácido nitroso: (HNO 2) - nitrogênio (N) com NOx = +3; - Ácido nítrico: (HNO 3) - nitrogênio (N) com NOx = +5; - Ácido sulforoso: (H 2 SO 3) - enxofre (S) com NOx = +4; -Ácido sulfúrico: (H 2 SO 4) - enxofre (S) com NOx = +6.

EXERCÍCIO Hidrácidos NOMENCLATURA DOS ÁCIDOS • O nome é feito com a terminação ÍDRICO Ácido + nome do ânion + ídrico • HCl – ácido clorídrico; • HI- ácido iodídrico; • H 2 S- ácido sulfídrico; • HCN - ácido cianídrico; • HBr – ácido bromídrico; • HF - ácido fluorídrico.

EXERCÍCIOS Oxiácidos Quando o elemento forma apenas um oxiácidos, usa-se a terminação ICO: • Ácido + nome do elemento + ICO; • H 2 CO 3 – ácido carbônico; • H 3 BO 3 – ácido bórico.

EXERCÍCIOS Oxiácidos Quando o elemento forma dois oxiácidos: Ácido + nome do elemento + ICO ( nox maior) + OSO ( nox menor) • HNO 3 – ácido nítrico; • HNO 2 – ácido nitroso; • H 2 SO 4 – ácido sulfúrico; • H 2 SO 3 – ácido sulfuroso.

EXERCÍCIOS Oxiácidos -Quando o elemento forma três ou quatro oxiácidos: ácido PER + ICO ácido + OSO ácido. HIPO + OSO • • HCl. O 4 – ácido perclórico; HCl. O 3 – ácido clórico; HCl. O 2 –ácido cloroso; HCl. O – ácido hipocloroso.

PRINCIPAIS ÁCIDOS, E SUAS APLICAÇÕES E CARACTERÍSTICAS. Ácido fluorídrico (HF) • Nas condições ambientes, é um gás incolor que tem a características de corroer o vidro, quando em solução aquosa (2). Observe nos vidros de um carro uma numeração, esta é feita com esse tipo de ácido. Imagem: http: //www. flickr. com/people/foshie/ Creative Commons Attribution 2. 0 Generic.

Ácido clorídrico (HCl) Imagem: U. S. Navy photo by Mass Communication Specialist 2 nd Class Jonathen E. Davis / Public Domain. PRINCIPAIS ÁCIDOS, E SUAS APLICAÇÕES E CARACTERÍSTICAS • O ácido clorídrico consiste no gás cloreto de hidrogênio, que é bastante solúvel e dissolvido em água. Quando impuro, é vendido no comércio com o nome de ácido muriático, sendo usado na limpeza de pisos e de superfícies metálicas, antes do processo de soldagem (3).

PRINCIPAIS ÁCIDOS, E SUAS APLICAÇÕES E CARACTERÍSTICAS Ácido sulfídrico (H 2 S) • É um gás venenoso, incolor, formado na putrefação de substâncias orgânicas naturais que contenham enxofre, sendo responsável, em grande parte, pelo cheiro de ovo podre. É encontrado em pequenas quantidades em algumas águas minerais (sulfurosas) (4). Imagem: Ben Mills / Public Domain.

PRINCIPAIS ÁCIDOS, E SUAS APLICAÇÕES E CARACTERÍSTICAS Imagem: Taman Renyah / Creative Commons Attribution 3. 0 Unported. Ácido cianídrico (HCN) • É o nome com que se indica uma solução aquosa do gás cianídrico, que é incolor, com cheiro característico de amêndoas amargas. Por ser muito venenoso, esse gás é utilizado nas execuções, em câmara de gás. Além disso, é encontrado em grande quantidade nas folhas de mandioca (5).

ATIVIDADES 1 - O ácido que é classificado como oxiácido, diácido e é formado por átomos de três elementos químicos diferentes e: • a) H 2 S b) H 4 P 2 O 7 c) HCN • d) H 2 SO 3 e) HNO 3

Atividade 2 - O vinagre tem caráter ácido, pois nele encontramos, predominantemente, o. . . • ácido sulfúrico. • ácido acético. • ácido carbônico. • ácido nítrico. • ácido sulfônico.

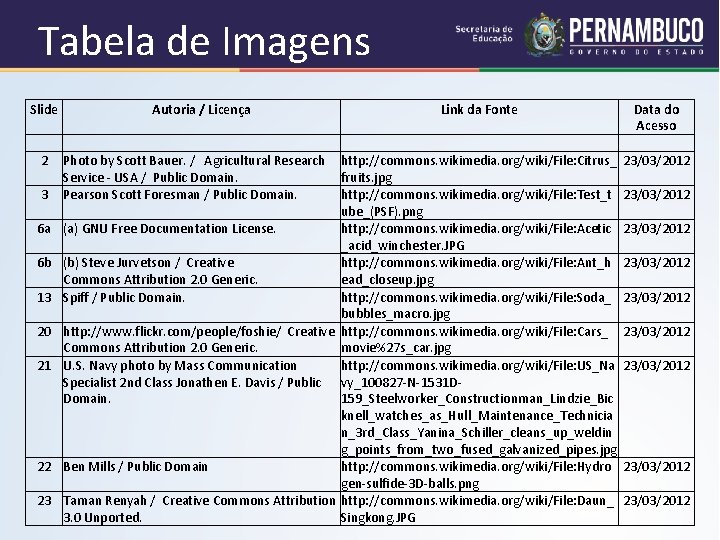
Tabela de Imagens Slide 2 3 6 a 6 b 13 20 21 22 23 Autoria / Licença Link da Fonte Data do Acesso Photo by Scott Bauer. / Agricultural Research http: //commons. wikimedia. org/wiki/File: Citrus_ 23/03/2012 Service - USA / Public Domain. fruits. jpg Pearson Scott Foresman / Public Domain. http: //commons. wikimedia. org/wiki/File: Test_t 23/03/2012 ube_(PSF). png (a) GNU Free Documentation License. http: //commons. wikimedia. org/wiki/File: Acetic 23/03/2012 _acid_winchester. JPG (b) Steve Jurvetson / Creative http: //commons. wikimedia. org/wiki/File: Ant_h 23/03/2012 Commons Attribution 2. 0 Generic. ead_closeup. jpg Spiff / Public Domain. http: //commons. wikimedia. org/wiki/File: Soda_ 23/03/2012 bubbles_macro. jpg http: //www. flickr. com/people/foshie/ Creative http: //commons. wikimedia. org/wiki/File: Cars_ 23/03/2012 Commons Attribution 2. 0 Generic. movie%27 s_car. jpg U. S. Navy photo by Mass Communication http: //commons. wikimedia. org/wiki/File: US_Na 23/03/2012 Specialist 2 nd Class Jonathen E. Davis / Public vy_100827 -N-1531 DDomain. 159_Steelworker_Constructionman_Lindzie_Bic knell_watches_as_Hull_Maintenance_Technicia n_3 rd_Class_Yanina_Schiller_cleans_up_weldin g_points_from_two_fused_galvanized_pipes. jpg Ben Mills / Public Domain http: //commons. wikimedia. org/wiki/File: Hydro 23/03/2012 gen-sulfide-3 D-balls. png Taman Renyah / Creative Commons Attribution http: //commons. wikimedia. org/wiki/File: Daun_ 23/03/2012 3. 0 Unported. Singkong. JPG
 Farmacos me too
Farmacos me too 4 tecnologias limpas
4 tecnologias limpas Novas tecnologias da comunicação aveiro
Novas tecnologias da comunicação aveiro Tecnologías al final del tubo ejemplos
Tecnologías al final del tubo ejemplos Nuevas tecnologias
Nuevas tecnologias Componentes de la infraestructura de ti
Componentes de la infraestructura de ti Natureza cordel
Natureza cordel Um pedacinho de terra perdido no mar
Um pedacinho de terra perdido no mar Nascimento da filosofia
Nascimento da filosofia Contrato social de thomas hobbes
Contrato social de thomas hobbes Replicação
Replicação Elementos naturais e elementos modificados
Elementos naturais e elementos modificados Verbos de estado
Verbos de estado Exemplo de parecer do avaliador externo preenchido
Exemplo de parecer do avaliador externo preenchido Sobre a natureza e especificidade da educação
Sobre a natureza e especificidade da educação Contrato social hobbes
Contrato social hobbes Estudo sobre a natureza do cristo
Estudo sobre a natureza do cristo Edgar morin o paradigma perdido
Edgar morin o paradigma perdido Ufpr 2017 os processos industriais nao imitam a natureza
Ufpr 2017 os processos industriais nao imitam a natureza Classificação dos materiais na natureza
Classificação dos materiais na natureza Constantes da natureza
Constantes da natureza Aonde nasceu o pintor e escultor lasar
Aonde nasceu o pintor e escultor lasar Poemas natureza
Poemas natureza União internacional para a conservação da natureza
União internacional para a conservação da natureza Meendinho cantiga de amigo
Meendinho cantiga de amigo Duplicacao
Duplicacao Imprima somente o necessario a natureza agradece
Imprima somente o necessario a natureza agradece


















































