Cincias da Natureza e suas Tecnologias Qumica Ensino
































- Slides: 33

Ciências da Natureza e suas Tecnologias - Química Ensino Médio, 2ª Série Mistura de gases

q. Materiais • • detergente; água; canudo ou arco para fazer as bolhas; glicerina (vendida em farmácias). Imagens: (a)Autor desconhecido/Disponibilizado por Xanthine Complex/Domínio Público; (b) Martin Meise/GNU Free Documentation License; (c) : Kristian Ovaska/Creative Commons - Atribuição - Partilha nos Mesmos Termos 2. 5 Genérica. QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Experimento: Bolhas de Sabão

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Experimento: Bolhas de Sabão q. Procedimento: Imagem : Andreas Hendrik/Public Domain. • misture bem a água com o detergente e a glicerina; • num local com pouca ventilação, faça a maior bolha de sabão que puder. A bolha formada contém gás carbônico (CO 2), cuja massa molar é 44 g/mol. Como a massa molar aparente do ar atmosférico é de 28, 96 g/mol, a bolha desce ao invés de subir.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Imagem : Peter Southwood/ Creative Commons Atribuição. Partilha nos Termos da Mesma Licença 3. 0 Unported. Nos cilindros de ar que os mergulhadores carregam, o gás oxigênio (O 2) é misturado com gás hélio (He). O ar atmosférico é uma mistura dos gases nitrogênio, N 2 (78%), oxigênio, O 2 (21%), e outros gases (1%), com predominância do argônio, Ar. Imagem : Omniii/GNU Free Documentation License. Misturas Gasosas

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Uma Mistura Gasosa p. A Os cilindros VA Gás A Contendo. . . p. B p. C VC VB Gás B TA Gás C TB n. A TC n. C Após serem misturados, submetidos a uma pressão, V ocupando um volume, numa temperatura, contendo um número de mols (quantidade de matéria), T Gás A Gás B Gás C num recipiente de volume V. . . e atingirem o equilíbrio térmico numa temperatura T, com quantidade de matéria nt = n A + n B + n C , possuem pressão final Pt, dada por Pt = p A + p B + p C

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Fique Atento! • Como os gases ideais não reagem entre si, a mistura irá se comportar como um gás único e obedecerá às mesmas leis que os gases isolados; • para uma mistura gasosa do tipo A + B + C; • poderemos aplicar a equação dos gases ideais: Pt. V = nt. R. T

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Fração Molar de um Gás A (x. A) • é a relação entre a quantidade de matéria de um gás A (n. A), por exemplo, e a quantidade de matéria total da mistura gasosa (nt): FIQUE ATENTO!! • a soma das frações molares numa mistura deve ser sempre igual a 1: x. A + x B + x C = 1 • atualmente, utilizamos o termo fração em quantidade de matéria em vez de fração molar.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Pressão Parcial • é a pressão que um gás exerceria se estivesse sozinho, ocupando o volume total da mistura e na mesma temperatura em que essa mistura se encontra; • lei das pressões parciais de Dalton: “a pressão total de uma mistura é a soma das pressões parciais dos gases”: Pt = p A + p B + p C • enunciando a Lei de Dalton de outra forma, podemos afirmar que “a pressão parcial de cada componente de uma mistura gasosa é proporcional à quantidade de matéria desse componente na mistura”: p. A = x. A. Pt

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Lei de Dalton, matematicamente • após a mistura dos gases e utilizando a equação dos gases ideais, temos Ø para um gás A: p. A. V = n. A. R. T Ø para a mistura: Pt. V = nt. R. T • dividindo as equações (Gás A/Mistura), temos: multiplicando meios pelos extremos obtemos A pressão parcial do gás A é proporcional à quantidade de matéria.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Imagem : Charles Turner/United States Public Domain John Dalton Nasceu em Eaglesfield (1766) e faleceu em Manchester (1844). §começou a ensinar aos 12 anos numa escola da seita Quaker; §em 1773, começou a lecionar Ciências em Manchester, num colégio presbiteriano; §estudando as condições climáticas, coletou cerca de 200 mil observações do tempo ao longo de sua vida; §concluiu que o magnetismo da Terra influenciava a formação das auroras boreais; §em 1794, Dalton descreveu cientificamente sua dificuldade para distinguir as cores – hoje chamada de daltonismo em sua homenagem; §elaborou a lei das pressões parciais estudando a atmosfera; §foi o primeiro a expressar claramente a chamada Lei das proporções definidas; §elaborou a Teoria Atômica em 1804; §recebeu o título de Doutor em 1832; §foi professor particular e de escolas por toda sua vida.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Imagem : Ackbahr/GNU Free Documentation License Pressões Parciais no Mergulho As pressões parciais dos gases oxigênio e nitrogênio devem ser controladas durante o mergulho. O sangue apresenta os gases oxigênio e nitrogênio dissolvidos, provenientes da respiração, principalmente. Uma pressão parcial do nitrogênio elevada provoca sintomas semelhantes a uma embriaguez, fazendo o mergulhador perder a noção da realidade. Uma pressão parcial do oxigênio acima de 1, 6 atm acelera o metabolismo a níveis perigosos. Por isso, utiliza-se uma mistura de oxigênio com gás hélio nos cilindros. Para saber mais sobre os efeitos da pressão durante o mergulho: http: //www. biofisica. xpg. com. br/Capitulo%201/efeitos%20 da%20 pressao%20 durante%20 o%20 mergulho. htm acesso em 02/07/2012.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Pressões Parciais e a calibragem dos Pneus Imagem : A. Viazemsky/Public Domain Supondo que os pneus do automóvel da figura sejam calibrados com uma pressão de 3, 0 atm, em Recife (cuja pressão atmosférica é 1, 0 atm) e que o ar seja formado por 79% de nitrogênio (N 2) e 21% de oxigênio (O 2), as pressões parciais dos gases serão: Gás nitrogênio (A): 79%. 3, 0 atm = 2, 19 atm Gás oxigênio (B): 21%. 3, 0 atm = 0, 63 atm Observe que, somando-se as pressões parciais dos gases, obtemos a pressão total no interior dos pneus: 2, 19 atm + 0, 63 atm = 3, 0 atm Confirmando-se, assim, a Lei de Dalton das pressões parciais: Pt = p A + p B Calibrar os pneus é importante para a segurança do automóvel e deve ser feito no horário da manhã! Lembremos que o ar inserido nos pneus também é uma mistura gasosa.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Seleção Brasileira e as Pressões Parciais Quando a Seleção Brasileira vai jogar em La Paz (Bolívia), cerca de 3. 700 m acima do nível do mar, os jogadores sentem muito o efeito da altitude. Estádio de futebol em La Paz, Bolívia Quanto maior a altitude, menor será a pressão atmosférica. Ao nível do mar (como em Recife), a pressão parcial do gás oxigênio dissolvido no sangue é de 0, 20 atm. Em La Paz, essa pressão parcial cai para 0, 12 atm. O corpo demora um tempo para se adaptar a essa nova pressão. Imagem : Henrry 104 1/Creative Commons Attribution. Share Alike 3. 0 Unported

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Volume Parcial • numa mistura gasosa, volume parcial de um gás é o volume ocupado por ele estando sozinho e submetido à pressão total e à temperatura da mistura; • lei de Amagat: O volume total de uma mistura gasosa é a soma dos volumes parciais de todos os gases componentes da mistura. V = V A + VB + VC Obs. : Emile Hilaire Amagat (1841 – 1915) , um físico francês: üinventou o manômetro hidráulico, que foi capaz de suportar até 3. 200 atmosferas; üem 1880 ele publicou sua Lei de Volumes Parciais; üfoi eleito membro da Academia Francesa de Ciências em 09 de junho de 1902; üAmagat é o nome da unidade de densidade numérica em sua homenagem.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas • • a Região Metropolitana do Recife atingiu a marca de 1 milhão de veículos em setembro de 2011. No início do mês, a frota de Pernambuco já tinha chegado a 2 milhões. Atualmente, o Estado tem emplacado entre 1. 000 e 1. 300 veículos por dia; uma das principais preocupações dos ambientalistas é a quantidade de gases poluentes emitida diariamente para a atmosfera; como o volume de ar na atmosfera é muito grande, costumam-se expressar as quantidades dos poluentes em ppm (partes por milhão) e ppb (partes por bilhão). Imagem: EPA / Public Domain. • Poluição do Ar FONTE: Adaptado de http: //jconlineblogs. ne 10. uol. com. br/deolhonotransito/2011/09/20/frota-da-regiao-metropolitana-do-recife-chega-a-1 -milhao-de-veiculos/ acesso em 05/07/2012. Concentrações de monóxido de carbono (CO) acima de 400 ppm no ar (400 partes de CO em 1 milhão de partes de ar, em L, por exemplo) são potencialmente mortais. Isso significa que, num ambiente de 1. 000 L, 400 m. L de CO serão suficientes para causar a morte.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Massa Molar Aparente de uma Mistura Gasosa • Sabemos que a massa total de uma mistura gasosa (mt) é igual à soma das massas de cada gás: mt = m. A + m. B + m. C; • e a quantidade de matéria total na mistura (nt) é a soma das quantidades de matéria de cada gás: nt = n. A + n. B + n. C ; • sendo temos que alternando as variáveis para um único gás • para uma mistura, temos Map = Massa aparente da mistura (em g/mol)

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Fique Atento! • Podemos calcular a massa molar aparente (Map. ) da mistura como a média ponderada das massas molares dos gases que compõem a mistura; • os “pesos” serão as frações molares dos gases (ou seus percentuais em volume); • ou ainda:

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Qual a massa molar aparente do ar atmosférico? q Como vimos anteriormente, o ar atmosférico é composto por uma mistura de 78% de gás nitrogênio (N 2), 21% de gás oxigênio (O 2) e 1% de gás argônio (Ar); q temos, então: • M(N 2) = 28 g/mol • M(O 2) = 32 g/mol • M(Ar) = 40 g/mol

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Os antigos dirigíveis eram inflados com gás hidrogênio (H 2), um gás muito inflamável. Atualmente usase o gás hélio (He). O princípio básico para fazer um dirigível voar é baseado no fato de o hidrogênio, 2 g/mol (ou hélio, 4 g/mol), ser mais leve que o ar. Última torre do Zeppelin do mundo, localizada em Recife. Os balões sobem porque a densidade do ar quente em seu interior é menor que a do ar atmosférico. Imagem : (A) NASA Ames Resarch Center (NASA-ARC)/Public Domain; (B) Lsouza 7 / Public Domain; (C) Björn Appel/GNU Free Documentation License; (D)Jdlong 0624/ Creative Commons Atribuição-Partilha nos Termos da Mesma Licença 3. 0 Unported.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Densidade gasosa • é a relação entre a massa molar aparente (Map. ) e o volume molar (Vm) da mistura gasosa: CNTP são as condições normais de temperatura e pressão (0°C e 1 atm). A unidade do volume molar é L/mol. Volume de 1 mol da mistura medido nas CNTP. • para condições diferentes das CNTP, deveremos utilizar a equação de Clapeyron: Para um único gás: Benoit Paul Émile Clapeyron (1799 — 1864) foi um engenheiro e físico francês. Imagem : AAAAA/Public Domain A unidade da densidade (d) é g/L.

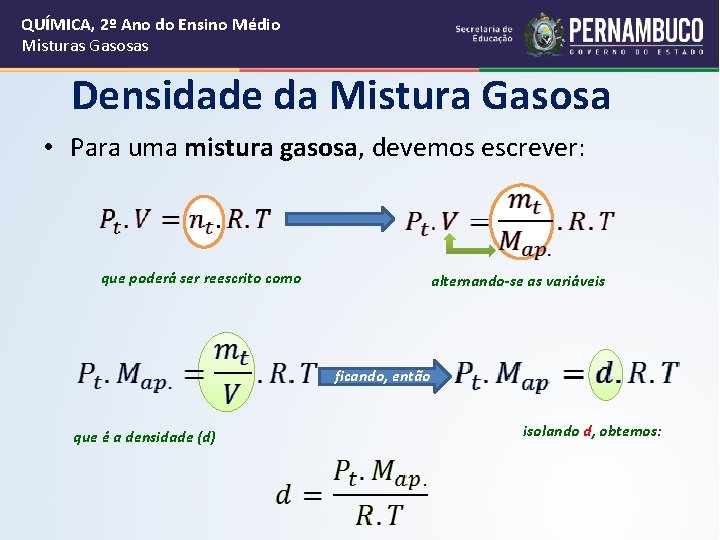
QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Densidade da Mistura Gasosa • Para uma mistura gasosa, devemos escrever: que poderá ser reescrito como alternando-se as variáveis ficando, então que é a densidade (d) isolando d, obtemos:

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Densidade Relativa • Considerando condições idênticas de temperatura e pressão, podemos dizer que a densidade relativa do gás A em relação ao gás B é o quociente entre as densidades absolutas de A e de B: Quanto maior a massa molar, maior será a densidade. Mas. . . obtemos

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Fique Ligado! • A densidade relativa (DA, B) não possui unidade; • a densidade relativa indica quantas vezes um gás é mais (ou menos) denso que outro gás; • as densidades dos gases são proporcionais às suas massas molares; • assim, reforçando: quanto maior a massa molar, mais denso será o gás.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Sentimos o cheiro de um perfume porque algumas moléculas passam para o estado gasoso, difundindo-se pelo ar. É a difusão do gás! Por que os balões de aniversário ficam murchos no dia seguinte? Embora o balão esteja bem amarrado, o gás acaba escapando pelos minúsculos orifícios existentes na borracha. É a efusão do gás! Imagem : Esther Simin/GNU Free Documentation License Imagem : shakko/Creative Commons Attribution. Share Alike 3. 0 Unported Efusão e Difusão

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Difusão Gasosa • Os gases se movimentam continuamente e com altas velocidades; • assim, os gases se misturam rapidamente, originando SEMPRE uma mistura homogênea; • difusão gasosa é o movimento espontâneo da dispersão de um gás sobre outro numa mistura gasosa; • em outras palavras, é a mistura espontânea dos gases entre si.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Fique Ligado! • Efusão gasosa ocorre quando um gás escapa através de um orifício; • percebemos a efusão gasosa quando balões de aniversário murcham no dia seguinte; • Lei de Graham das efusões gasosas: A velocidade de efusão é dada em L/min geralmente! • como velocidade de efusão de um gás e sua massa molar são inversamente proporcionais, concluímos que quanto maior for a massa molar, mais devagar o gás deverá escapar, demorando a difundir-se.

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas • nasceu em Glasgow (Escócia), em 1805, e faleceu em Londres (Inglaterra), em 1869; • estudou nas universidades de Edimburgo (Escócia) e de Glasgow. Ensinou Química em Glasgow e no University College London; • desde 1855 até sua morte, foi diretor da Real Fábrica de Moeda; • descobriu o método da diálise para separar os coloides das soluções. A hemodiálise é uma diálise que ocorre no sangue, utilizando-se uma membrana semipermeável artificial (filtro) no tratamento de pacientes com deficiências renais. Imagem : Autor desconhecido/Disponibilizado por Stanmar / Domínio Público Thomas Graham

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Aplicação no vestibular 1 q (UFSE) Dentre os gases abaixo, nas mesmas condições, o que se difunde mais rapidamente é: a) o monóxido de carbono. b) a amônia. c) o ozônio. d) o nitrogênio. e) o hidrogênio. • Dados: H = 1; C = 12; = 14; O = 16 Pela Lei de Graham, o gás que mais rapidamente irá se difundir será o que possuir menor massa molar!

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Cálculo das massas molares: q Monóxido de carbono (CO): M(CO) = 1. 12 + 1. 16 = 28 g/mol q Amônia (NH 3): M(NH 3) = 1. 14 + 3. 1 = 17 g/mol q Ozônio (O 3): M(O 3) = 3. 16 = 48 g/mol q Nitrogênio (N 2): M(N 2) = 2. 14 = 28 g/mol q Hidrogênio (H 2): M(H 2) = 2. 1 = 2 g/mol Como o gás hidrogênio possui a menor massa molar, concluímos que este irá se difundir mais rapidamente. A alternativa correta é LETRA E!

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Aplicação no vestibular 2 q (Covest) O ar é uma solução gasosa contendo 20%, aproximadamente, de oxigênio. Em um recipiente com 5 atmosferas de ar, qual a pressão parcial do oxigênio? a) 0, 2 ØDe acordo com a Lei de Dalton, temos: b) 0, 8 c) 1 d) 2 ü 20% representa a fração molar do gás oxigênio: x = 20% = 0, 20 e) 5 ü 5 atm é a pressão da mistura (pressão total): Pt = 5 atm üa pressão parcial do oxigênio será: p = 0, 20. 5 = 1 atm

QUÍMICA, 2º Ano do Ensino Médio Misturas Gasosas Curiosidade Seria possível alguém se amarrar em balões cheios com hélio e voar? O sacerdote brasileiro Adelir de Carli era conhecido por voar amarrado a balões de gás hélio e planejava bater o recorde de permanência no ar, mas saiu de sua rota por causa de condições climáticas adversas e acabou desaparecendo, sendo encontrado morto após mais de 2 meses de buscas. Leia mais em ühttp: //pt. wikipedia. org/wiki/Adelir_Ant%C 3%B 4 nio_de_Carli, acesso em 05/07/2012. ühttp: //www. iparaiba. com. br/noticias, 123764, 1, buscas+por+padre+que+sumi u+com+baloes+sao+encerradas. html, acesso em 03/07/2012.

Tabela de Imagens n° do direito da imagem como está ao lado da link do site onde se consegiu a informação Data do Acesso slide foto 2 A Autor desconhecido / Disponibilizado por http: //pt. wikipedia. org/wiki/Ficheiro: Drinking. Stra 24/08/2012 Xanthine Complex/Domínio Público ws. jpg 2 B Martin Meise / GNU Free Documentation http: //commons. wikimedia. org/wiki/File: Stirring_i 24/08/2012 License n_a_glass_of_Water. jpg? uselang=pt-br 2 C Kristian Ovaska / Creative Commons - http: //pt. wikipedia. org/wiki/Ficheiro: Fairy. Bottles. 24/08/2012 Atribuição - Partilha nos Mesmos Termos 2. 5 jpg Genérica 3 Andreas Hendrik / Public Domain http: //commons. wikimedia. org/wiki/File: Seifenbl 24/08/2012 asen. jpg 4 A Peter Southwood / Creative Commons http: //commons. wikimedia. org/wiki/File: Charging 24/08/2012 Atribuição-Partilha nos Termos da Mesma _a_spare_air_cylinder_PB 048172. jpg? uselang=pt. Licença 3. 0 Unported br 4 B Omniii / GNU Free Documentation License. http: //pt. wikipedia. org/wiki/Ficheiro: Skyshot. jpg 24/08/2012 10 Charles Turner / United States Public Domainhttp: //commons. wikimedia. org/wiki/File: John_Da 24/08/2012 lton_by_Charles_Turner. jpg 11 Ackbahr / GNU Free Documentation License http: //commons. wikimedia. org/wiki/File: Typical_ 24/08/2012 diver. jpg 12 A. Viazemsky / Public Domain http: //commons. wikimedia. org/wiki/File: Kwik 24/08/2012 Fit_3. jpg 13 Henrry 104 1/ Creative Commons Attribution http: //commons. wikimedia. org/wiki/File: Estadio. B 24/08/2012 -Share Alike 3. 0 Unported olivia. jpg

Tabela de Imagens n° do direito da imagem como está ao lado da link do site onde se consegiu a informação Data do Acesso slide foto 15 EPA / U. S. Environmental Protection Agency https: //commons. wikimedia. org/wiki/File: Diesel- 29/10/2012 /Public Domain smoke. jpg 19 A NASA Ames Resarch Center (NASA-ARC) / http: //commons. wikimedia. org/wiki/File: Zeppelin. 24/08/2012 Public Domain jpg? uselang=pt-br 19 B Lsouza 7 / Public Domain http: //commons. wikimedia. org/wiki/File: Torre_d 24/08/2012 o_Zeppelin_-_Jiquia_-_Recife. JPG? uselang=pt-br 19 C Björn Appel / GNU Free Documentation http: //commons. wikimedia. org/wiki/File: Ballon 24/08/2012 License flame 02. jpg? uselang=pt-br 19 D Jdlong 0624 / Creative Commons Atribuição- http: //commons. wikimedia. org/wiki/File: Ballon_G 24/08/2012 Partilha nos Termos da Mesma Licença 3. 0 low. jpg? uselang=pt-br Unported 20 AAAAA / Public Domain http: //commons. wikimedia. org/wiki/File: Benoit_C 24/08/2012 lapeyron. png 24 A shakko / Creative Commons Attributionhttp: //commons. wikimedia. org/wiki/File: Guerlain 24/08/2012 Share Alike 3. 0 Unported _-_Le_parfum_de_Champs. Elysees_(1904)_Tortue. jpg 24 B Esther Simin / GNU Free Documentation http: //commons. wikimedia. org/wiki/File: Baloon. j 24/08/2012 License pg 27 Autor desconhecido / Disponibilizado por http: //commons. wikimedia. org/wiki/File: Thomas_ 24/08/2012 Stanmar/Domínio Público Graham. jpg? uselang=pt-br
 Farmacos me too
Farmacos me too 4 tecnologias limpas
4 tecnologias limpas Novas tecnologias da comunicação aveiro
Novas tecnologias da comunicação aveiro Al final del tubo
Al final del tubo Nuevas tecnologias
Nuevas tecnologias Componentes de la infraestructura de ti
Componentes de la infraestructura de ti Natureza cordel
Natureza cordel Ilha da moça faceira
Ilha da moça faceira Mais que saber identificar a natureza
Mais que saber identificar a natureza Lipideos
Lipideos El contrato social hobbes
El contrato social hobbes Imagem de paisagem natural e modificada
Imagem de paisagem natural e modificada Relatorio auto avaliação docente
Relatorio auto avaliação docente Verbo de ação
Verbo de ação N
N Estado de natureza rousseau
Estado de natureza rousseau Estudo sobre a natureza do cristo
Estudo sobre a natureza do cristo Eu tô perdido
Eu tô perdido Ufpr 2017 os processos industriais nao imitam a natureza
Ufpr 2017 os processos industriais nao imitam a natureza Materiais solúveis e insolúveis na água
Materiais solúveis e insolúveis na água Constantes da natureza
Constantes da natureza Aonde nasceu o pintor e escultor lasar
Aonde nasceu o pintor e escultor lasar A cova da xabreira
A cova da xabreira União internacional para a conservação da natureza
União internacional para a conservação da natureza Sabedes tempo verbal
Sabedes tempo verbal Curso ciencias da natureza
Curso ciencias da natureza Imprima somente o necessario a natureza agradece
Imprima somente o necessario a natureza agradece Os cinco reinos
Os cinco reinos A natureza não dá saltos
A natureza não dá saltos Verbos estado ação e fenomeno da natureza
Verbos estado ação e fenomeno da natureza Simetrias na natureza
Simetrias na natureza Observação e descrição da natureza
Observação e descrição da natureza Paisagem transformada pela natureza
Paisagem transformada pela natureza Literatura barroca no brasil
Literatura barroca no brasil

























































