CIDOS E BASES Muitos produtos de consumo contm

ÁCIDOS E BASES Muitos produtos de consumo contêm ácidos e bases. sair

ÁCIDOS Pode reconhecer-se as soluções ácidas pelo sabor azedo, por produzirem efervescência com o calcário libertando-se um gás, o dióxido de carbono, ou por modificarem a cor de alguns indicadores. sair

ÁCIDOS As soluções ácidas contraem e endurecem o cabelo. sair

BASES ÁCIDOS As soluções das bases são amargas e geralmente escorregadias ao tacto. sair

BASES ÁCIDOS sair As soluções alcalinas suavizam e dão maior volume ao cabelo.

TEORIA DE ARRHENIUS Segundo Arrhenius, ácidos e bases dissociam-se em + H e OH , respectivamente. sair

TEORIA DE ARRHENIUS Ácido Substância que em solução aquosa origina íons H. sair
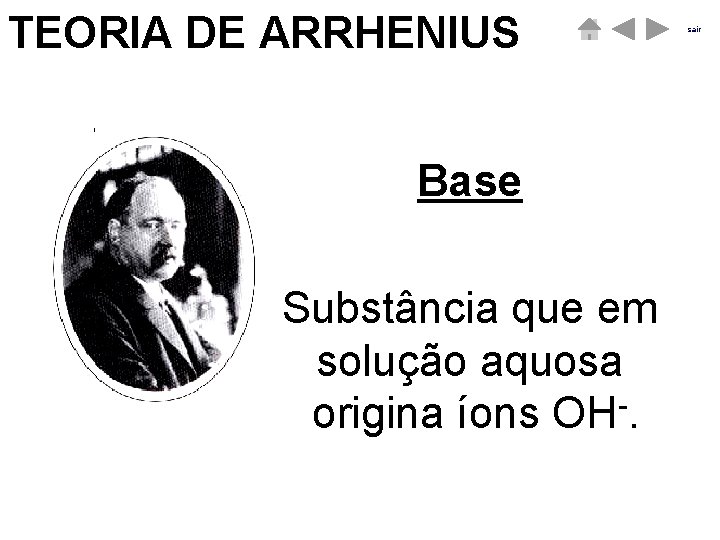
TEORIA DE ARRHENIUS Base Substância que em solução aquosa origina íons OH. sair

p. H sair É comum usar p. H para expressar a concentração molar do ião H +. p. H = - log H+

TEORIA DOS LOGARITMOS Em 1550, na Escócia, nasceu John Napier (ou Neper) de quem pouco se sabe, mas que ficou na história por ter inventado os logaritmos e que já quase no final da vida, em 1614, (provavelmente farto de multiplicações e divisões), inventou um instrumento que transformava operações em simples adições e subtrações: a esse instrumento atribui -se o nome de “Bastões de Napier” sair
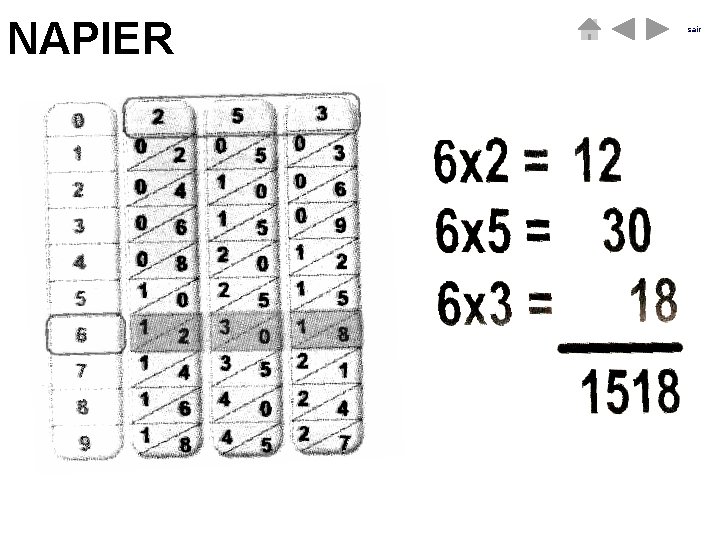
NAPIER sair

p. OH sair Procedimento idêntico é usado na expressão da concentração molar do ião OH-. p. OH = - log OH

TEORIA DE BRONSTED-LOWRY As definições de Arrhenius revelaram-se muito restritivas pois: - eram aplicáveis somente a soluções aquosas; - não incluíam todas as substâncias que apresentavam, na pratica, comportamento semelhante aos ácidos ou bases de Arrhenius. sair

TEORIA DE BRONSTED-LOWRY Por exemplo: NH 3 (aq) + H 2 O (l) NH 4 +(aq) + OH – (aq) não cabia na definição de Arrhenius, porque o NH 3 não contém grupos OH-. sair

TEORIA DE BRONSTED-LOWRY Ácido Substância doadora de íons H+ (próton) a uma base. sair

TEORIA DE BRONSTED-LOWRY Base Substância aceitadora de íons H+ (próton) a um ácido. sair

TEORIA DE BRONSTED-LOWRY As reações ácido-base também se designam por reações protolíticas, uma vez que há transferência de prótons (H+) do ácido para a base. sair

TEORIA DE BRONSTED-LOWRY O ácido e a base relacionados por transferência de um próton constituem um sistema designado por par ácido-base conjugados. Ácido 1 + Base 2 Ácido 2 + Base 1 sair

p. H sair É comum usar p. H para expressar a concentração molar do ião H 3 O+. p. H = - log H 3 O+

p. OH sair É comum usar p. OH para expressar a concentração molar do ião OH-. p. OH = - log OH

Escala de sorensen e p. H Alguns ácidos e bases são mais fortes do que outros. sair

Escala de sorensen e p. H sair

Escala de sorensen e p. H sair

Escala de sorensen e p. H A pele é ácida e o seu p. H pode variar entre 4, 5 e 6, dependendo da idade, do sexo e da parte do corpo que se considere. A acidez da pele constitui uma defesa contra microrganismos (fungos e bactérias). sair

Escala de sorensen e p. H Os cosméticos devem ter p. H próximo do da pele. A indicação ostentada por alguns cosméticos de «p. H neutro para a pele» pode não significar que o seu p. H seja igual a 7, até porque esse valor já seria demasiado alcalino para a pele. sair

Escala de sorensen e p. H As soluções de sabão são alcalinas. Quando a pele é lavada com sabão o seu p. H sobe, tornando-se alcalina durante 3 a 4 horas. Este fenômeno pode tornar-se irreversível se as lavagens forem frequentes, provocando danos especialmente em peles mais sensíveis. sair

Escala de sorensen e p. H Dadas duas soluções ácidas , é mais ácida a que tiver menor valor de p. H. Dadas duas soluções alcalinas , é mais alcalina a que tiver maior valor de p. H. sair

CONSTANTE DE ACIDEZ (Ka) HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) A - . H 3 O+ kc. H 2 O = ka Kc = HA . H 2 O Em soluções diluídas a quantidade de água é constante. sair
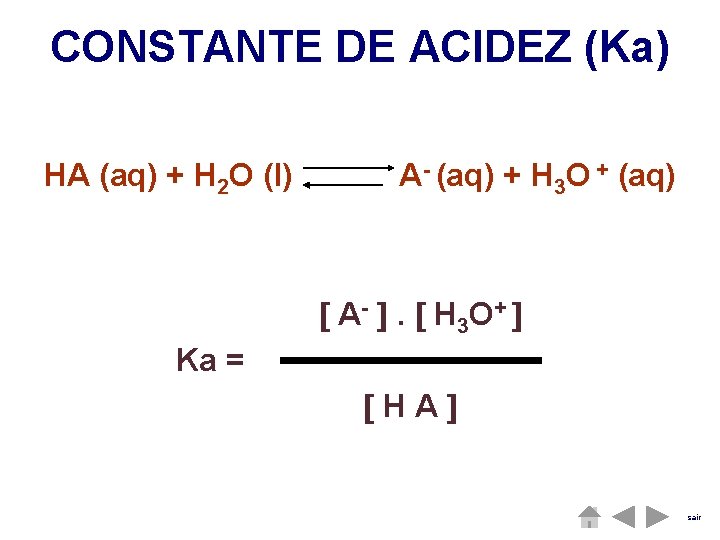
CONSTANTE DE ACIDEZ (Ka) HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) A - . H 3 O + Ka = HA sair

CONSTANTE DE ACIDEZ (Ka) A força de um ácido é dada pelo valor da constante de acidez. sair

CONSTANTE DE ACIDEZ (Ka) Quanto maior a constante de acidez mais forte é o ácido. sair

ÁCIDOS FORTES Os ácidos fortes apresentam ka > 1. sair

ÁCIDOS FORTES HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) Os ácidos fortes ionizam-se totalmente. sair

CONSTANTE DE BASICIDADE B (aq) + H 2 O (l) HB+ (aq) + OH - (aq) HB+ . OH- Kb = B Quanto maior kb, mais forte será a base. sair

BASES FORTES As bases fortes apresentam kb > 1. sair

BASES FORTES B (aq) + H 2 O (l) HB (aq) + HO - (aq) As bases fortes ionizam-se totalmente. sair

A ÁGUA Sendo a água o líquido mais abundante na natureza e o solvente mais usado no laboratório, merece uma referência especial. H 2 O (l) + H 2 O (l) H 3 O + (aq) + OH- (aq) Solvente anfiprótico ou anfotérico , porque pode funcionar como ácido e base. sair

A ÁGUA H 2 O (l) + H 2 O (l) H 3 O + (aq) + OH- (aq) Este equilíbrio é designado por autoionização da água. Kw = + H 3 O . OH sair
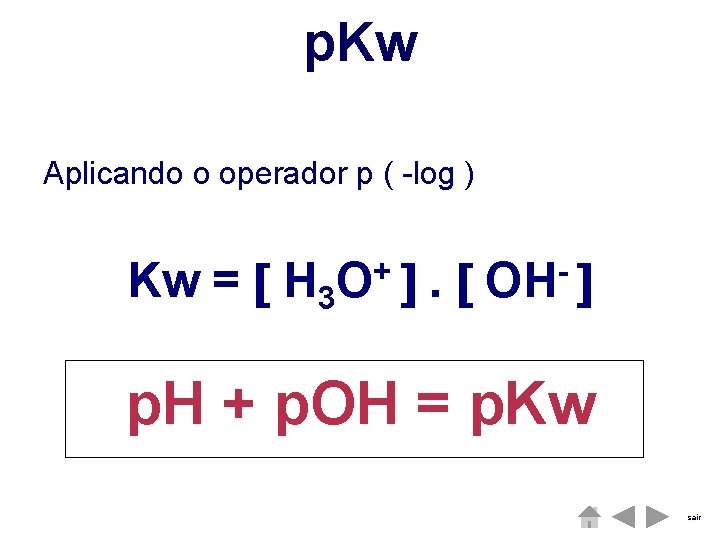
p. Kw Aplicando o operador p ( -log ) Kw = H 3 + O . OH p. H + p. OH = p. Kw sair

A ÁGUA H 2 O (l) + H 2 O (l) H 3 O + (aq) + OH- (aq) A 25º C , Kw = 1 x 10 -14. A ionização da molécula de água é endotérmica, o valor do produto iónico (Kw) aumenta com a temperatura. sair

RELAÇÃO ENTRE Ka e Kb HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) A- (aq) + H 2 O (l) HA (aq) + OH - (aq) Ka. Kb = Kw

RELAÇÃO ENTRE Ka e Kb Aplicando o operador p ( - log ) Ka. Kb = Kw p. Ka + p. Kb = p. Kw

p. H - SOLUÇÕES DE BASES FORTES A ionização de uma base forte é total : B (aq) + H 2 O (l) HB+ (aq) + OH - (aq) Como B = OH - ; p. OH = - log OH- vem : p. H = p. Kw - p. OH
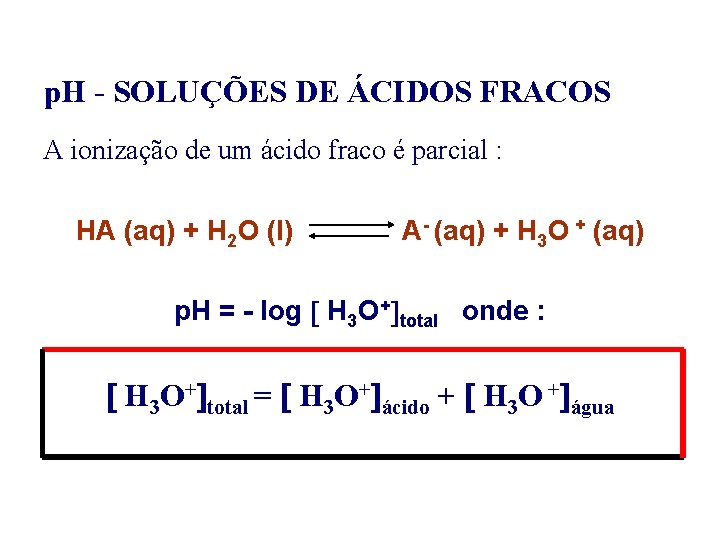
p. H - SOLUÇÕES DE ÁCIDOS FRACOS A ionização de um ácido fraco é parcial : HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) p. H = - log H 3 O+ total onde : H 3 O+ total = H 3 O+ ácido + H 3 O + água

p. H - SOLUÇÕES DE ÁCIDOS FRACOS Não entrando em linha de conta com a contribuição da auto-ionização da água, temos : H 3 O + 2 Ka = HA

GRAU DE IONIZAÇÃO Ácido – HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) Base – B (aq) + H 2 O (l) HB+ (aq) + OH - (aq)
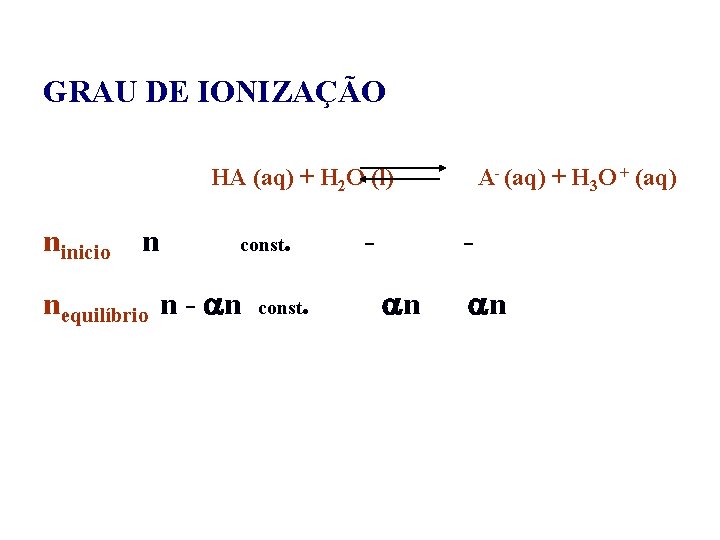
GRAU DE IONIZAÇÃO HA (aq) + H 2 O (l) ninicio n const nequilíbrio n - n . const . A- (aq) + H 3 O + (aq) n n
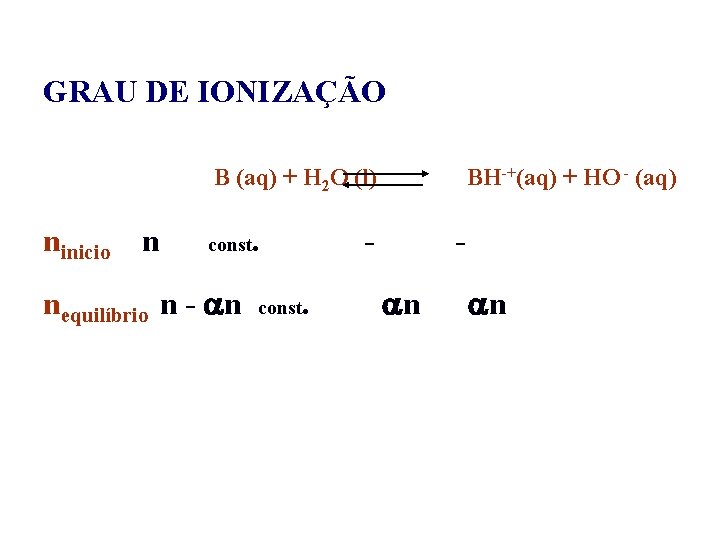
GRAU DE IONIZAÇÃO B (aq) + H 2 O (l) ninicio n const nequilíbrio n - n . const BH-+(aq) + HO - (aq) . n n
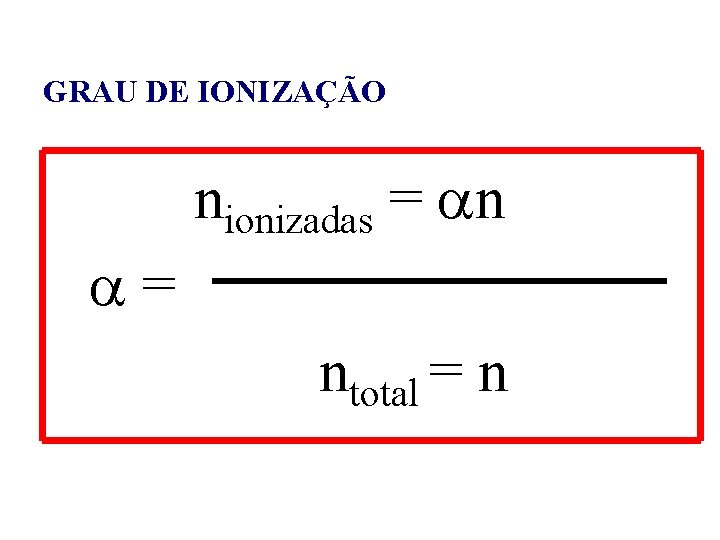
GRAU DE IONIZAÇÃO nionizadas = ntotal = n

GRAU DE IONIZAÇÃO HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) 2 . HA Ka = 1 -

reações ÁCIDO-BASE Antes de fazer quaisquer culturas é importante determinar o p. H do solo. Se for demasiado ácido para a cultura em causa, espalha-se , por exemplo, calcário em pó, que tem um comportamento básico. sair
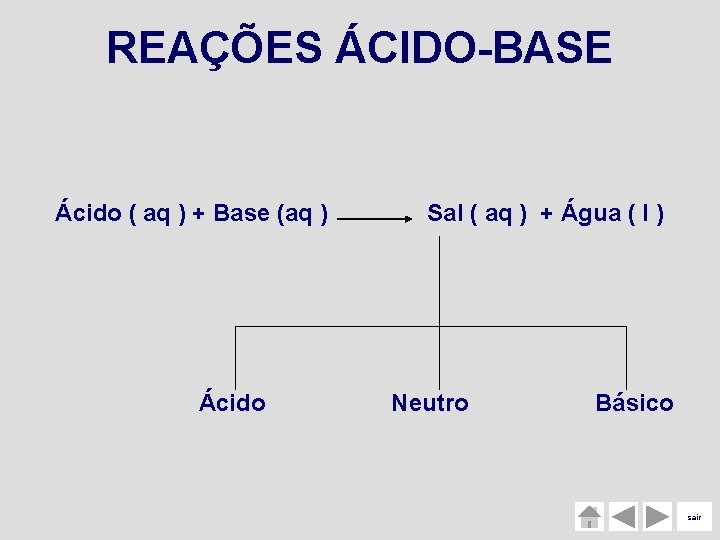
REAÇÕES ÁCIDO-BASE Ácido ( aq ) + Base (aq ) Ácido Sal ( aq ) + Água ( l ) Neutro Básico sair

reações ÁCIDO-BASE Há flores como as hortênsias que são azuis em terreno mais ácido e cor-de-rosa em terreno menos ácido. sair

REAÇÕES ÁCIDO-BASE sair A água da chuva é ligeiramente ácida devido à dissolução de dióxido de carbono atmosférico, que dá origem ao ácido carbónico. CO 2 + H 2 O H 2 CO 3

reações ÁCIDO-BASE O ácido ataca a pedra calcária de muitas construções, dissolvendo-a. sair

reações ÁCIDO-BASE A azia, designação atribuída ao excesso de suco gástrico (HCl), pode ser combatida com um antiácido. Os antiácidos neutralizam o HCl em excesso no estômago. sair

REAÇÕES ÁCIDO-BASE Dissolução em água de um dos vários remédios para combater a acidez do estômago. sair

REAÇÕES ÁCIDO-BASE A picadela da abelha ou da urtiga resulta do ácido deixado na pele, cujo efeito pode ser atenuado ou eliminado por uma solução alcalina. sair

CARÁTER QUÍMICO DAS SOLUÇÕES O caráter químico das soluções pode ser: - ácido ; H 3 O+ > OH- - neutro ; H 3 O+ = OH- - básico ; OH- > H 3 O+ sair

CARÁTER QUÍMICO DAS SOLUÇÕES As espécies químicas envolvidas em reações de protólise podem classificar-se: - ácidas; - básicas; - anfipróticas ; - neutras. sair

CARÁTER QUÍMICO DAS SOLUÇÕES Ácidas – as espécies químicas que em solução só podem ceder prótons; HNO 3 ; HCl ; H 2 SO 4 ; CH 3 COOH ; etc sair

CARÁTER QUÍMICO DAS SOLUÇÕES Básicas – as espécies químicas que em solução só aceitam prótons; NH 3 ; CH 3 COO - ; CO 3 2 - ; OH- ; etc sair

CARÁTER QUÍMICO DAS SOLUÇÕES Anfipróticas – as espécies químicas que em solução tanto podem ceder como captar prótons, HSO 4 - ; HCO 3 - ; HS - ; etc sair

CARÁTER QUÍMICO DAS SOLUÇÕES Neutras – as espécies químicas que em solução não tendem nem a captar nem a ceder prótons, como por exemplo , os catíons dos grupos 1 e 2; Na+ ; K+ ; Ca 2+ ; Mg 2+ e as partículas conjugadas de ácidos ou bases muito fortes; Cl- ; NO 3 - ; SO 4 2 - ; etc sair

p. H - SOLUÇÕES DE ÁCIDOS FORTES A ionização de um ácido forte é total : HA (aq) + H 2 O (l) A- (aq) + H 3 O + (aq) Como HA = H 3 O + então: p. H = -log H 3 O + = -log HA

TITULAÇÕES ÁCIDO-BASE sair
TITULAÇÕES ÁCIDO-BASE sair
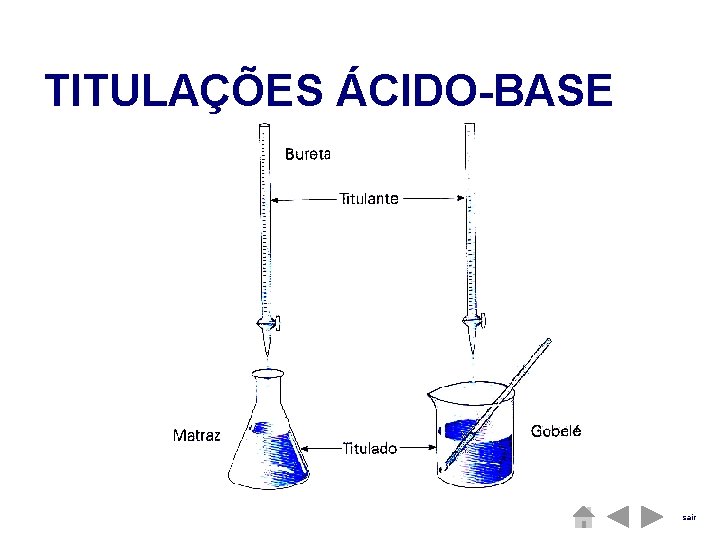
TITULAÇÕES ÁCIDO-BASE sair

TITULAÇÕES ÁCIDO-BASE Uma das aplicações mais correntes de reações ácido-base é a determinação da concentração de um ácido ( ou de uma base ) por reacção com uma base ( ou ácido ) de concentração conhecida.

TITULAÇÕES ÁCIDO-BASE A reacção processa-se enquanto houver excesso de ácido ( ou de base ) , ou seja , até que sejam adicionadas quantidades equivalentes das duas soluções ; atinge-se nessa altura o ponto de equivalência.

PONTO DE EQUIVALÊNCIA O número de moles de um ácido equivalente ao número de moles de uma base só depende da estequiometria da reacção.
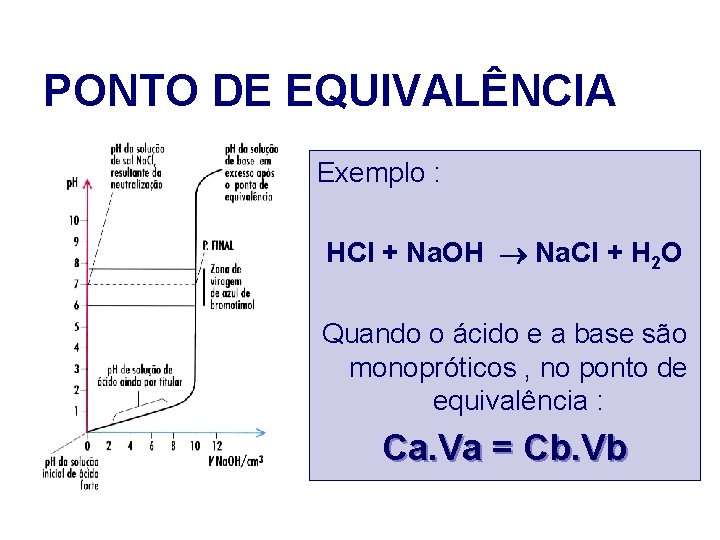
PONTO DE EQUIVALÊNCIA Exemplo : HCl + Na. OH Na. Cl + H 2 O Quando o ácido e a base são monopróticos , no ponto de equivalência : Ca. Va = Cb. Vb
PONTO DE EQUIVALÊNCIA Exemplo : 2 HCl + Ca(OH)2 Ca. Cl 2 + 2 H 2 O Quando o ácido é monoprótico e a base é diprótica , no ponto de equivalência : Ca. Va = 2 Cb. Vb

PONTO DE EQUIVALÊNCIA Exemplo : H 2 SO 4 + 2 Na. OH Na 2 SO 4 + 2 H 2 O Quando o ácido é diprótico e a base é monoprótica , no ponto de equivalência : 2 Ca. Va = Cb. Vb
TITULAÇÕES ÁCIDO-BASE Ácido forte-base forte TITULAÇÕES Ácido forte-base fraca Ácido fraco-base forte
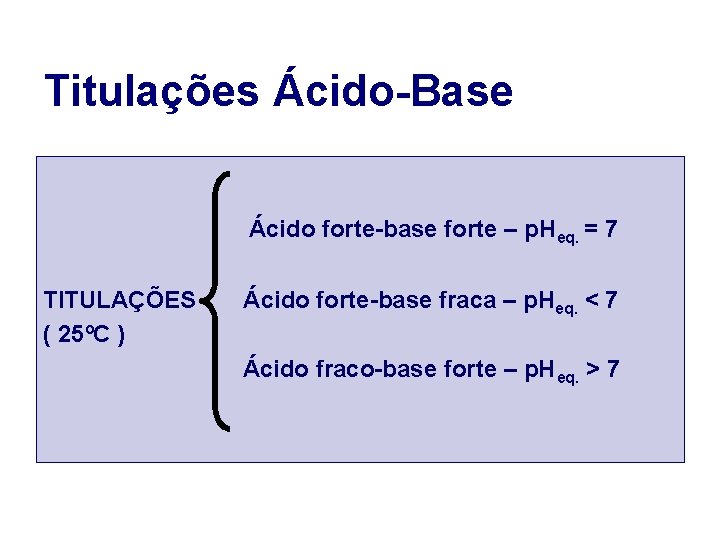
Titulações Ácido-Base Ácido forte-base forte – p. Heq. = 7 TITULAÇÕES Ácido forte-base fraca – p. Heq. < 7 ( 25ºC ) Ácido fraco-base forte – p. H eq. > 7

ÁCIDO FORTE-BASE FORTE Junto do ponto de equivalência , a variação de p. H é muito acentuada , de modo que , por adição dum pequeno volume , obtém-se uma variação de algumas unidades.
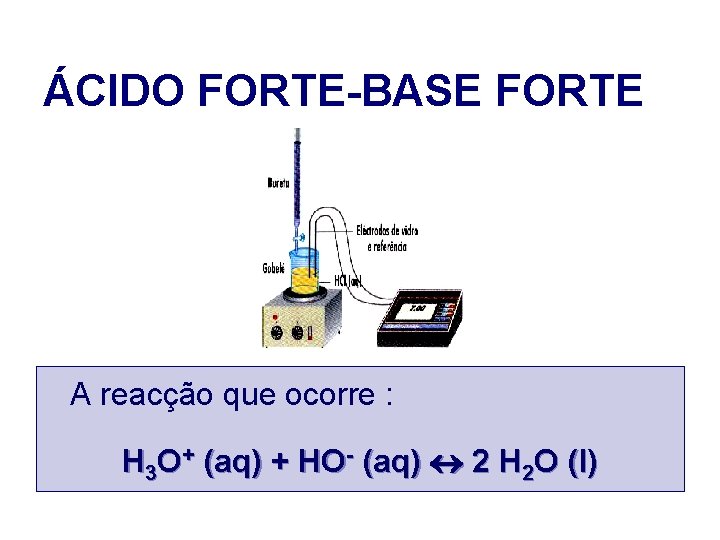
ÁCIDO FORTE-BASE FORTE A reacção que ocorre : H 3 O+ (aq) + HO- (aq) 2 H 2 O (l)
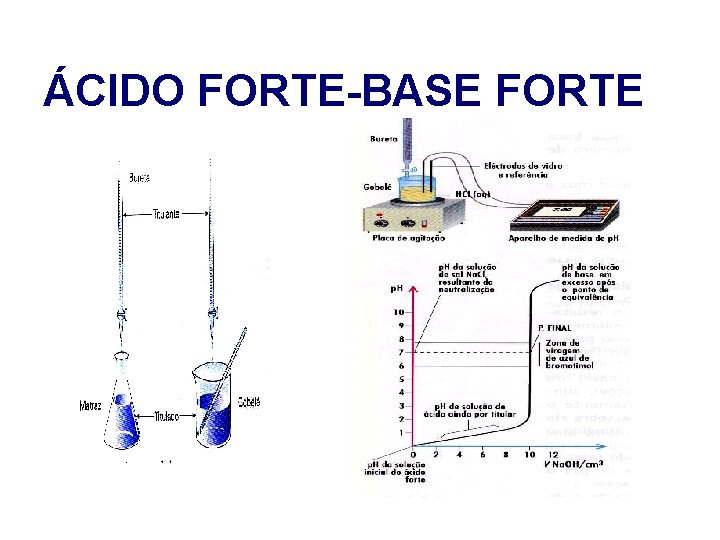
ÁCIDO FORTE-BASE FORTE
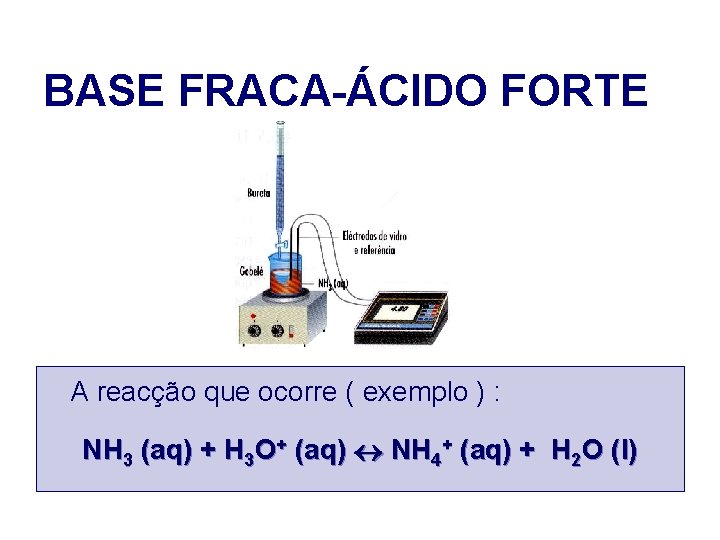
BASE FRACA-ÁCIDO FORTE A reacção que ocorre ( exemplo ) : NH 3 (aq) + H 3 O+ (aq) NH 4+ (aq) + H 2 O (l)
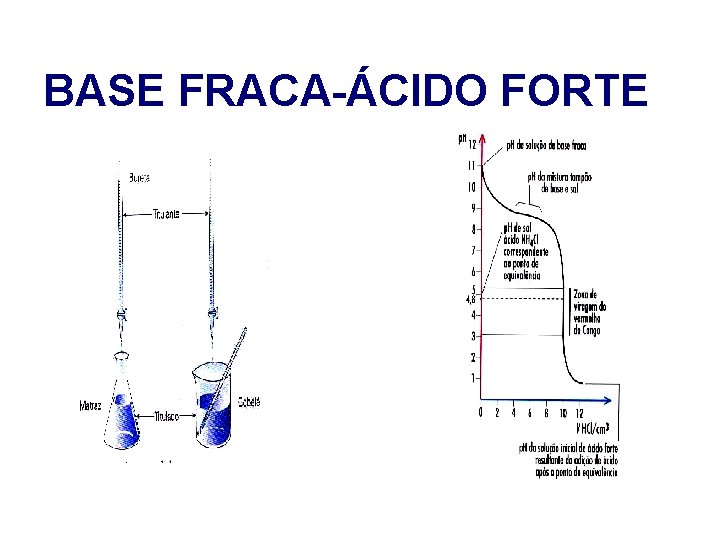
BASE FRACA-ÁCIDO FORTE
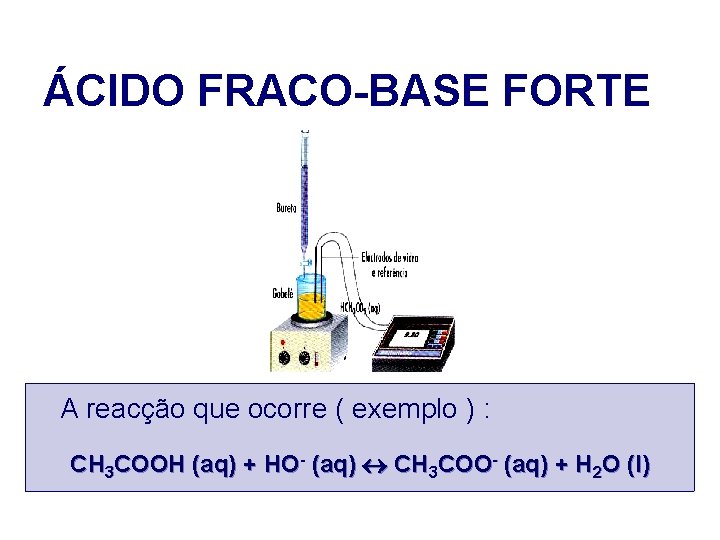
ÁCIDO FRACO-BASE FORTE A reacção que ocorre ( exemplo ) : CH 3 COOH (aq) + HO- (aq) CH 3 COO- (aq) + H 2 O (l)
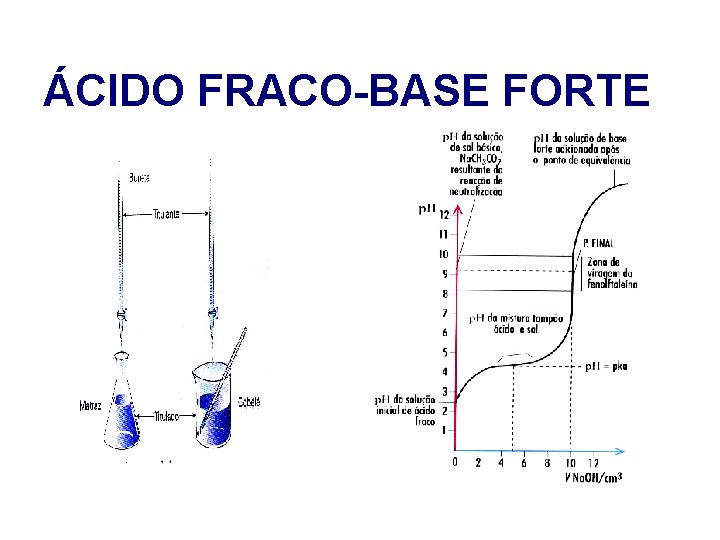
ÁCIDO FRACO-BASE FORTE

TITULAÇÕES TERMOMÉTRICAS O aumento de temperatura verificado à medida que se adiciona o ácido à base , ou vice-versa , atinge o valor máximo quando ácido e base estão nas proporções estequiométricas . Isto permite realizar as chamada titulações termométricas.

INDICADORES Um indicador de ácido-base pode ser definido como um sistema ácido-base em que as cores da forma ácido e base são diferentes.
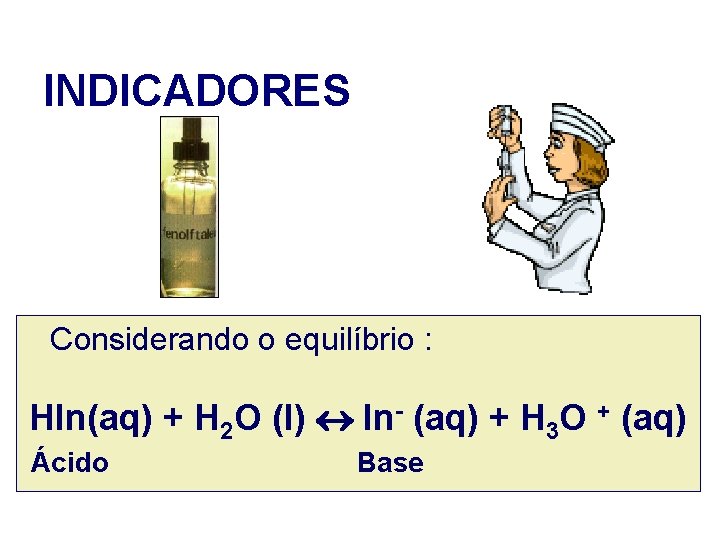
INDICADORES Considerando o equilíbrio : HIn(aq) + H 2 O (l) In- (aq) + H 3 O + (aq) Ácido Base
![INDICADORES p. H = p. KIndicador + log [In-] / [HIn] INDICADORES p. H = p. KIndicador + log [In-] / [HIn]](http://slidetodoc.com/presentation_image/8938e811cce9ea8676c9d3d28eaa60a9/image-87.jpg)
INDICADORES p. H = p. KIndicador + log [In-] / [HIn]
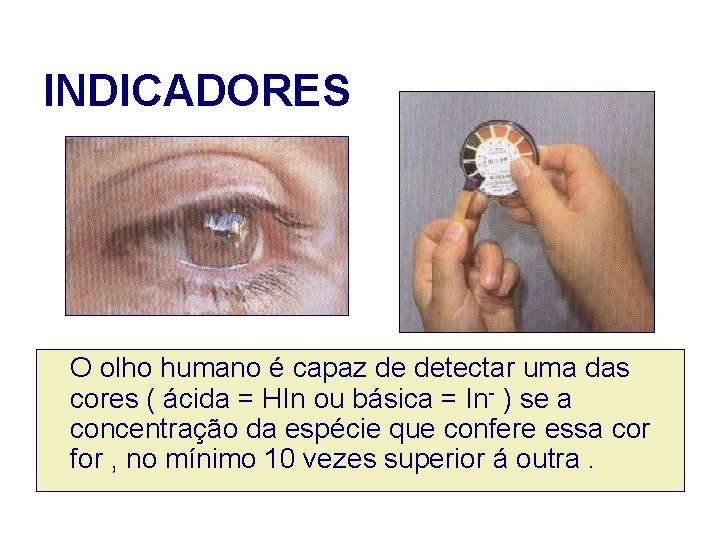
INDICADORES O olho humano é capaz de detectar uma das cores ( ácida = HIn ou básica = In- ) se a concentração da espécie que confere essa cor for , no mínimo 10 vezes superior á outra.
![INDICADORES [HIn] > 10 [In- ] - cor predominante - ÁCIDA [HIn] > [In INDICADORES [HIn] > 10 [In- ] - cor predominante - ÁCIDA [HIn] > [In](http://slidetodoc.com/presentation_image/8938e811cce9ea8676c9d3d28eaa60a9/image-89.jpg)
INDICADORES [HIn] > 10 [In- ] - cor predominante - ÁCIDA [HIn] > [In -] / 10 - cor predominante – BÁSICA
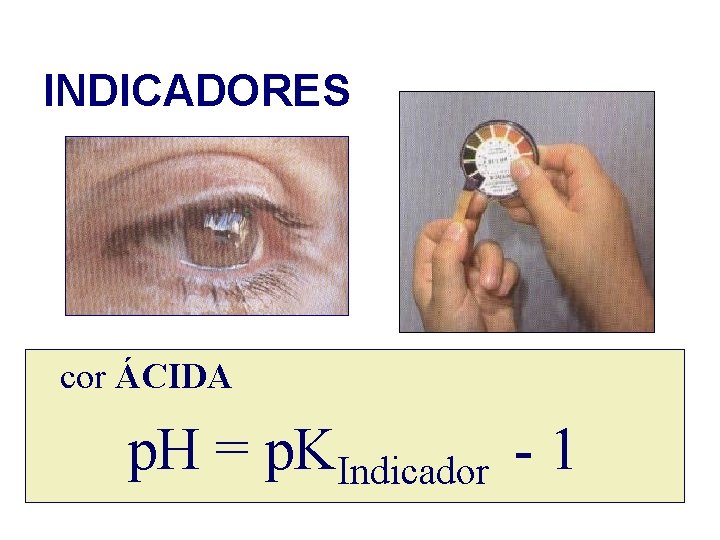
INDICADORES cor ÁCIDA p. H = p. KIndicador - 1
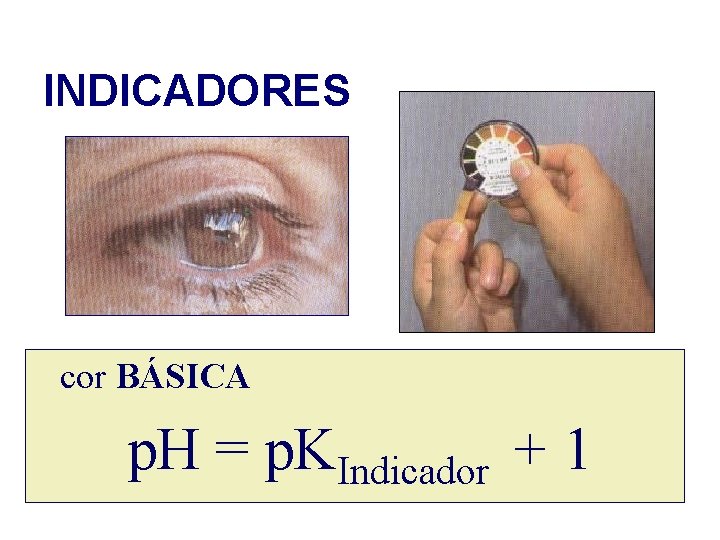
INDICADORES cor BÁSICA p. H = p. KIndicador + 1

INDICADORES ( Fenolftaleína ) As soluções alcalinas mudam para carmim a solução incolor de fenolftaleína.

INDICADORES ( Tintura azul de tornesol ) As soluções ácidas mudam para vermelho a cor azul do tornesol.

INDICADORES ( Indicador Universal ) É uma mistura de vários indicadores, uns naturais outros sintéticos. Apresenta uma grande variedade de cores consoante a acidez ou basicidade da solução. sair
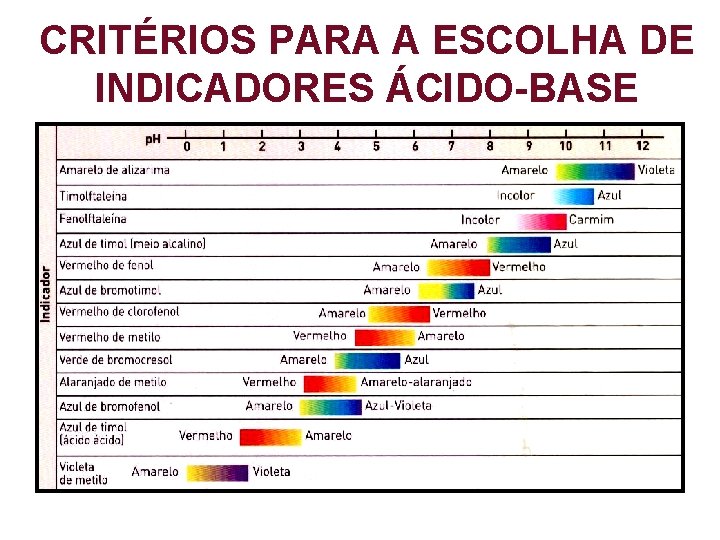
CRITÉRIOS PARA A ESCOLHA DE INDICADORES ÁCIDO-BASE
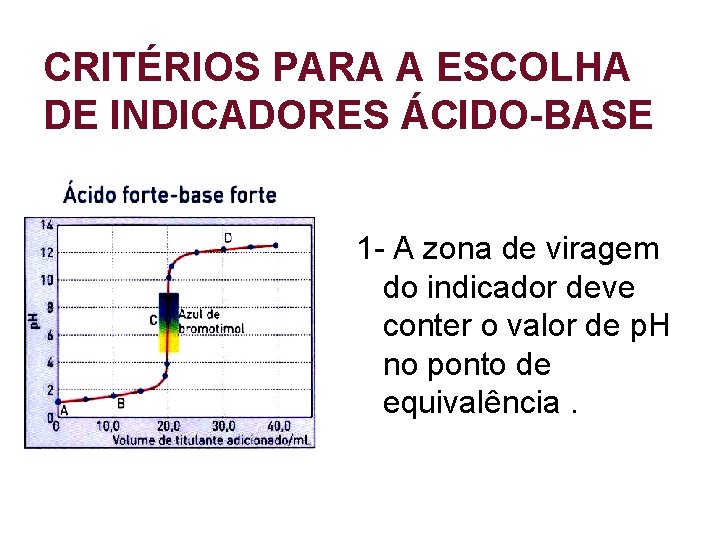
CRITÉRIOS PARA A ESCOLHA DE INDICADORES ÁCIDO-BASE 1 - A zona de viragem do indicador deve conter o valor de p. H no ponto de equivalência.
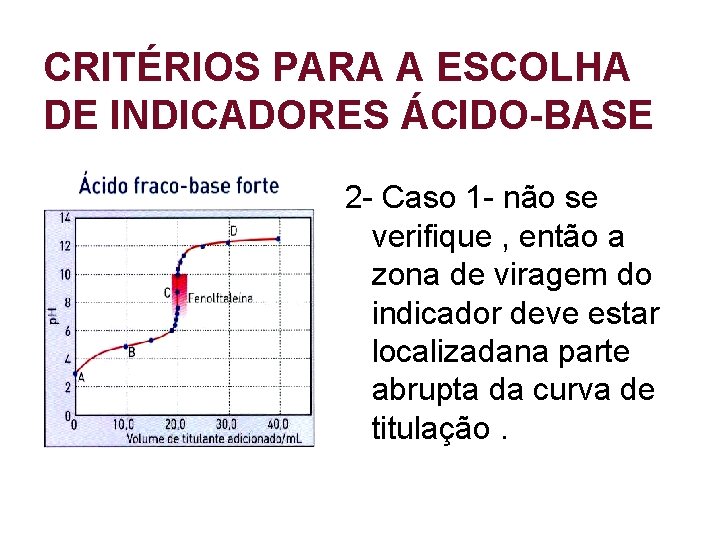
CRITÉRIOS PARA A ESCOLHA DE INDICADORES ÁCIDO-BASE 2 - Caso 1 - não se verifique , então a zona de viragem do indicador deve estar localizadana parte abrupta da curva de titulação.
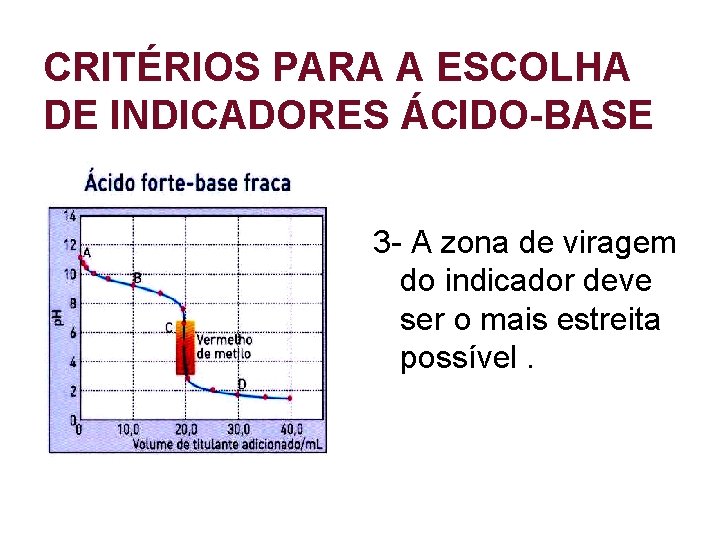
CRITÉRIOS PARA A ESCOLHA DE INDICADORES ÁCIDO-BASE 3 - A zona de viragem do indicador deve ser o mais estreita possível.
SOLUÇÕES TAMPÃO O p. H das lágrimas é mantido em 7, 4 graças a uma solução tampão de proteínas. sair
SOLUÇÕES TAMPÃO Soluções cujo p. H se mantém praticamente invariável face à adição de pequenas quantidades de ácido ou de base. sair

SOLUÇÕES TAMPÃO É uma solução que contém um ácido mais a sua base conjugada , em concentrações aproximadamente iguais. sair
![SOLUÇÕES TAMPÃO p. H = p. Ka + log [Base] / [Ácido] sair SOLUÇÕES TAMPÃO p. H = p. Ka + log [Base] / [Ácido] sair](http://slidetodoc.com/presentation_image/8938e811cce9ea8676c9d3d28eaa60a9/image-102.jpg)
SOLUÇÕES TAMPÃO p. H = p. Ka + log [Base] / [Ácido] sair
![SOLUÇÕES TAMPÃO Teremos melhor efeito tampão quando: [Ácido ] = [Base] sair SOLUÇÕES TAMPÃO Teremos melhor efeito tampão quando: [Ácido ] = [Base] sair](http://slidetodoc.com/presentation_image/8938e811cce9ea8676c9d3d28eaa60a9/image-103.jpg)
SOLUÇÕES TAMPÃO Teremos melhor efeito tampão quando: [Ácido ] = [Base] sair

This work is licensed under a Creative Commons Attribution 2. 5 License. ALEXANDRE CARVALHO 104
- Slides: 104