Ciclo termico Ciclo termico trasformazione ciclica nella quale




- Slides: 12

Ciclo termico “Ciclo termico”: trasformazione ciclica nella quale il sistema termodinamico che compie il ciclo fornisce lavoro assorbendo complessivamente calore da sorgenti di calore (“serbatoi”) esterni al sistema essendo cioè: Se il sistema è un fluido le cui trasformazioni sono descritte nel piano (p, V) , il lavoro è rappresentato dall’ area compresa nella curva chiusa rappresentativa del ciclo: p Wciclo=Qciclo > 0 V Si definisce il “rendimento” di un ciclo termico la quantità: U. Gasparini, Fisica I 1

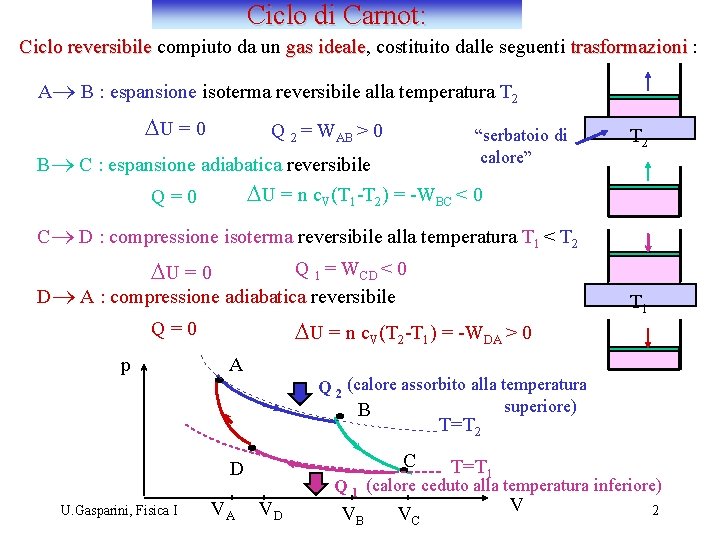
Ciclo di Carnot: Ciclo reversibile compiuto da un gas ideale, ideale costituito dalle seguenti trasformazioni : A® B : espansione isoterma reversibile alla temperatura T 2 DU = 0 Q 2 = WAB > 0 “serbatoio di calore” B® C : espansione adiabatica reversibile DU = n c. V(T 1 -T 2) = -WBC < 0 Q=0 T 2 C® D : compressione isoterma reversibile alla temperatura T 1 < T 2 DU = 0 Q 1 = WCD < 0 D® A : compressione adiabatica reversibile DU = n c. V(T 2 -T 1) = -WDA > 0 Q=0 p A T 1 Q 2 (calore assorbito alla temperatura superiore) B T=T 2 C D U. Gasparini, Fisica I VA VD T=T 1 Q 1 (calore ceduto alla temperatura inferiore) VB VC V 2

p Calori scambiati nel ciclo di Carnot : A Q 2 D VA B Q 1 VD VB T=T 2 C VC T=T 1 Dall’equazione della adiabatica reversibile di un gas ideale: Þ V

Rendimento del ciclo di Carnot Il rendimento di un ciclo termico è : Þ Þ Per il ciclo di Carnot: Il rendimento di un ciclo di Carnot dipende unicamente dalle temperature T 1 e T 2 tra le quali avviene il ciclo: non dipende dal tipo di gas impiegato, nè dall’intervallo di pressioni e volumi considerato: T=T 2 p Q 2 Q’ 2 T=T 1 W’ W U. Gasparini, Fisica I Q 1 Q’ 1 V 4

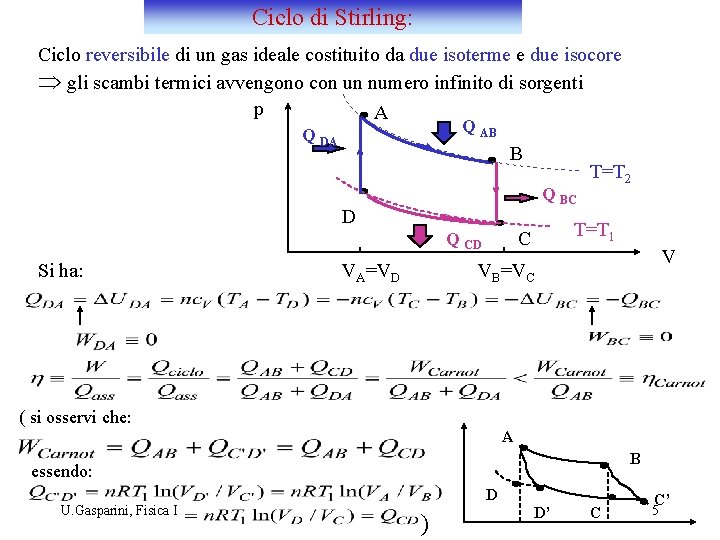
Ciclo di Stirling: Ciclo reversibile di un gas ideale costituito da due isoterme e due isocore Þ gli scambi termici avvengono con un numero infinito di sorgenti p A Q AB Q DA B Q BC D Si ha: VA=VD T=T 1 C Q CD T=T 2 V VB=VC ( si osservi che: A B essendo: U. Gasparini, Fisica I D ) D’ C C’ 5

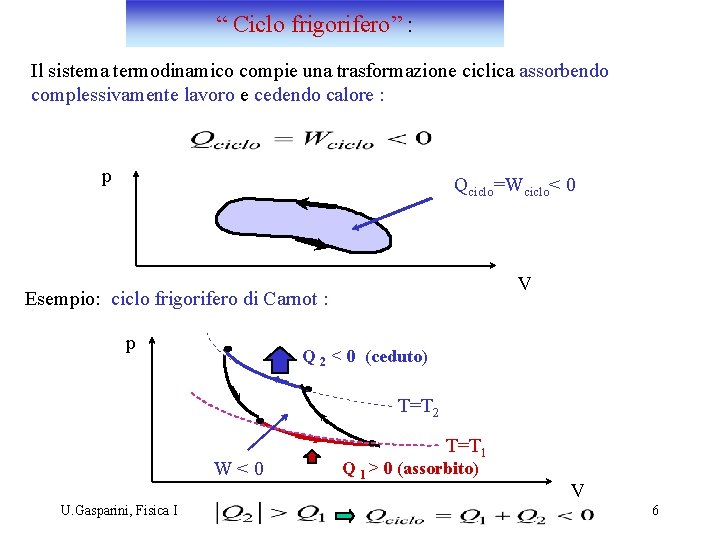
“ Ciclo frigorifero” : Il sistema termodinamico compie una trasformazione ciclica assorbendo complessivamente lavoro e cedendo calore : p Qciclo=Wciclo< 0 V Esempio: ciclo frigorifero di Carnot : p Q 2 < 0 (ceduto) T=T 2 W<0 U. Gasparini, Fisica I T=T 1 Q 1 > 0 (assorbito) V 6

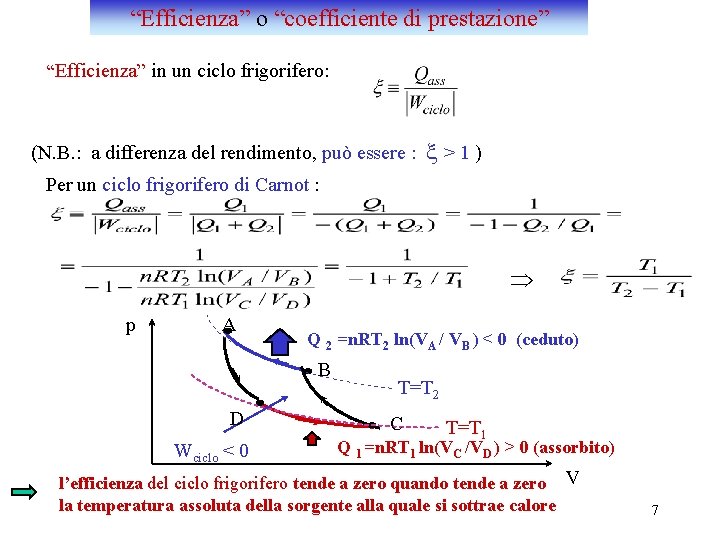
“Efficienza” o “coefficiente di prestazione” “Efficienza” in un ciclo frigorifero: (N. B. : a differenza del rendimento, può essere : x>1) Per un ciclo frigorifero di Carnot : Þ p A Q 2 =n. RT 2 ln(VA / VB ) < 0 (ceduto) B D Wciclo < 0 T=T 2 C T=T 1 Q 1 =n. RT 1 ln(VC /VD ) > 0 (assorbito) l’efficienza del ciclo frigorifero tende a zero quando tende a zero V la temperatura assoluta della sorgente alla quale si sottrae calore 7

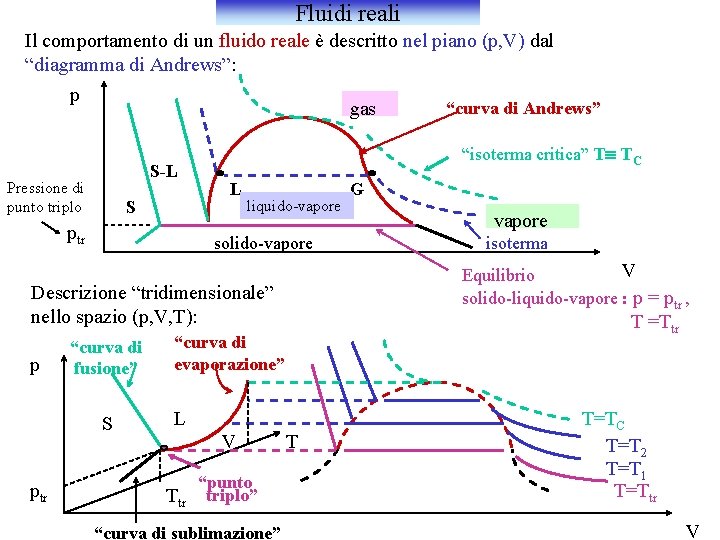
Fluidi reali Il comportamento di un fluido reale è descritto nel piano (p, V) dal “diagramma di Andrews”: p gas S-L Pressione di punto triplo S ptr “isoterma critica” Tº TC L liquido-vapore solido-vapore p S ptr L Ttr “punto triplo” “curva di sublimazione” vapore isoterma T =Ttr “curva di evaporazione” V G V Equilibrio solido-liquido-vapore : p = ptr , Descrizione “tridimensionale” nello spazio (p, V, T): “curva di fusione” “curva di Andrews” T T=TC T=T 2 T=T 1 T=Ttr V

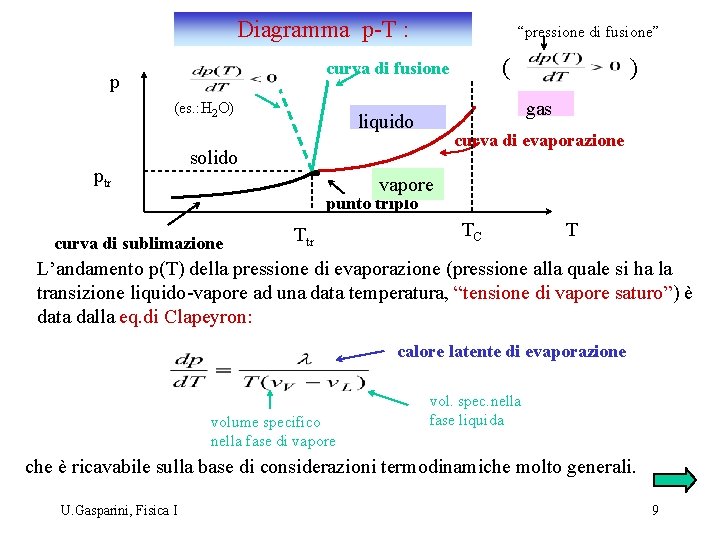
Diagramma p-T : “pressione di fusione” ( curva di fusione p (es. : H 2 O) ptr ) gas liquido curva di evaporazione solido vapore punto triplo curva di sublimazione Ttr TC T L’andamento p(T) della pressione di evaporazione (pressione alla quale si ha la transizione liquido-vapore ad una data temperatura, “tensione di vapore saturo”) è data dalla eq. di Clapeyron: calore latente di evaporazione volume specifico nella fase di vapore vol. spec. nella fase liquida che è ricavabile sulla base di considerazioni termodinamiche molto generali. U. Gasparini, Fisica I 9

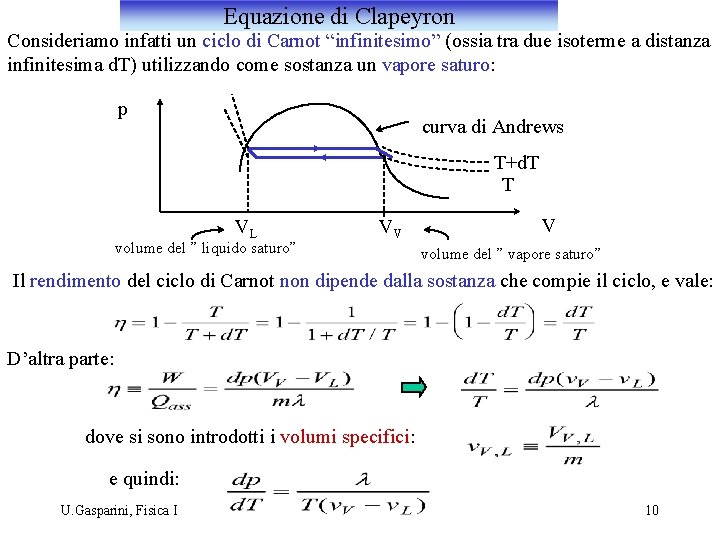
Equazione di Clapeyron Consideriamo infatti un ciclo di Carnot “infinitesimo” (ossia tra due isoterme a distanza infinitesima d. T) utilizzando come sostanza un vapore saturo: p curva di Andrews T+d. T T VL volume del ” liquido saturo” VV V volume del ” vapore saturo” Il rendimento del ciclo di Carnot non dipende dalla sostanza che compie il ciclo, e vale: D’altra parte: dove si sono introdotti i volumi specifici: e quindi: U. Gasparini, Fisica I 10

Trasformazioni di fase L’eq. di Clapeyron è inoltre valida per una generica trasf. di fase 1® 2 : calore latente della trasf. Per trasf. L ® V e S ® V è sempre: e ( ossia, per le densità: ) Þ (le curve p(T) di evaporazione e di sublimazione nal piano (p, T) hanno sempre pendenza positiva ; cfr. slide nr. 9) Per trasf. S ® L si possono avere diversi comportamenti: - per la maggioranza delle sostanze : Þ vi sono però importanti eccezioni, come l’acqua : Þ U. Gasparini, Fisica I (il ghiaccio galleggia) 11

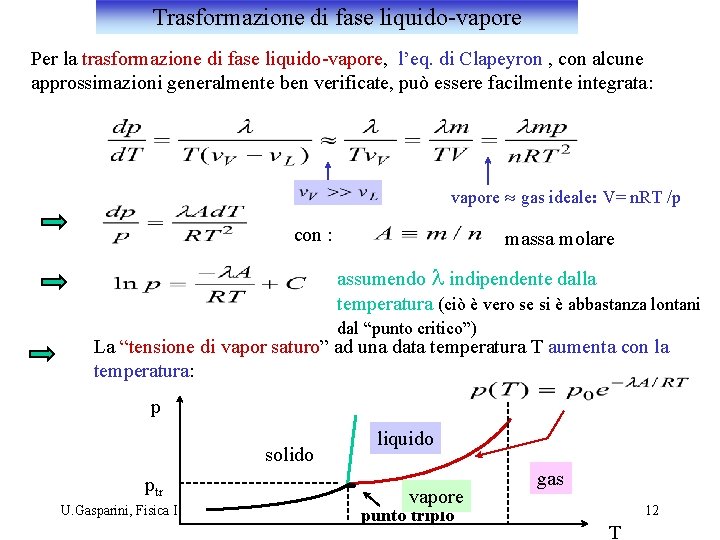
Trasformazione di fase liquido-vapore Per la trasformazione di fase liquido-vapore, l’eq. di Clapeyron , con alcune approssimazioni generalmente ben verificate, può essere facilmente integrata: vapore » gas ideale: V= n. RT /p con : massa molare assumendo l indipendente dalla temperatura (ciò è vero se si è abbastanza lontani dal “punto critico”) La “tensione di vapor saturo” ad una data temperatura T aumenta con la temperatura: p solido ptr U. Gasparini, Fisica I liquido vapore punto triplo gas 12 T
 Un motore termico compie una trasformazione ciclica
Un motore termico compie una trasformazione ciclica Aggettivi esclamativi e interrogativi
Aggettivi esclamativi e interrogativi Ejemplos de epimeros
Ejemplos de epimeros Fruttosio piranosico
Fruttosio piranosico Maltosa lineal
Maltosa lineal Ariosto contesto storico
Ariosto contesto storico Uma maquina termica ciclica recebe 5000 j de calor
Uma maquina termica ciclica recebe 5000 j de calor Irlanda forma
Irlanda forma Quale personaggio è il centro della bibbia
Quale personaggio è il centro della bibbia Giovanni verga corrente letteraria
Giovanni verga corrente letteraria Ciclica
Ciclica Aggettivi interrogativi ed esclamativi scuola primaria
Aggettivi interrogativi ed esclamativi scuola primaria Fruttosio struttura ciclica
Fruttosio struttura ciclica