Choque e Sepsis VERSO ORIGINAL Alan L Davis















































- Slides: 57

Choque e Sepsis VERSÃO ORIGINAL: Alan L Davis*, M. D. , M. P. H, FAAP. FCCM Director, Division of Pediatric Critical Care Goryeb Children’s Hospital Atlantic Health System *With special thanks to Lou De. Nicola, M. D. for allowing inclusion of a number of his slides from his excellent lecture on Shock. VERSÃO PORTUGUESA: Teresa Caldeira, MD. José Carvalho, MD. Unidade de Cuidados Intensivos Pediátricos Hospital de S. João – Porto Portugal

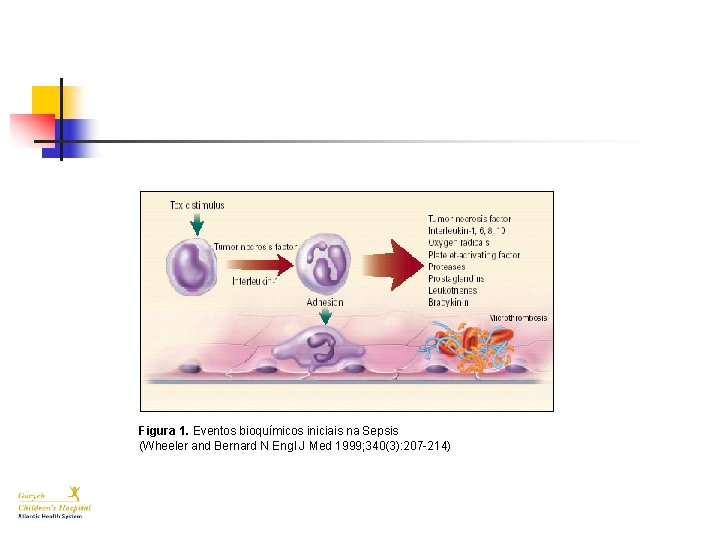
Figura 1. Eventos bioquímicos iniciais na Sepsis (Wheeler and Bernard N Engl J Med 1999; 340(3): 207 -214)

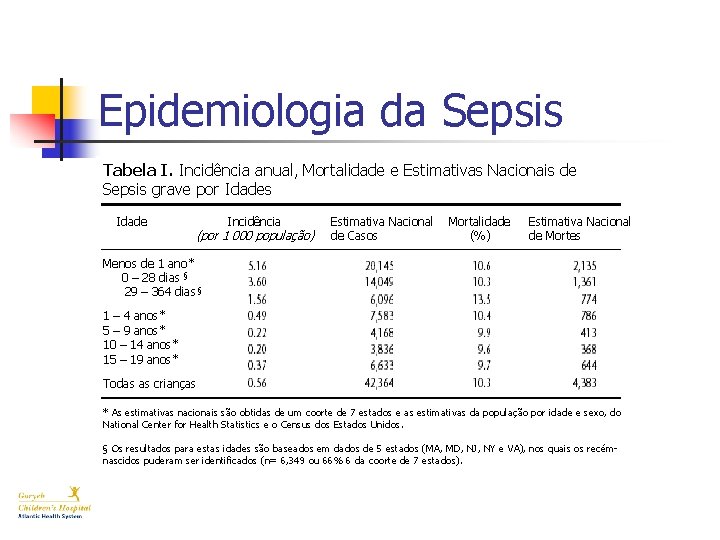
Epidemiologia da Sepsis Tabela I. Incidência anual, Mortalidade e Estimativas Nacionais de Sepsis grave por Idades Idade Incidência (por 1 000 população) Estimativa Nacional de Casos Mortalidade (%) Estimativa Nacional de Mortes Menos de 1 ano* 0 – 28§ dias § § 29 – 364 § dias 1 – 4 anos* 5 – 9 anos* 10 – 14 anos* 15 – 19 anos* Todas as crianças * As estimativas nacionais são obtidas de um coorte de 7 estados e as estimativas da população por idade e sexo, do National Center for Health Statistics e o Census dos Estados Unidos. § Os resultados para estas idades são baseados em dados de 5 estados (MA, MD, NJ, NY e VA), nos quais os recémnascidos puderam ser identificados (n= 6, 349 ou 66% 6 da coorte de 7 estados).

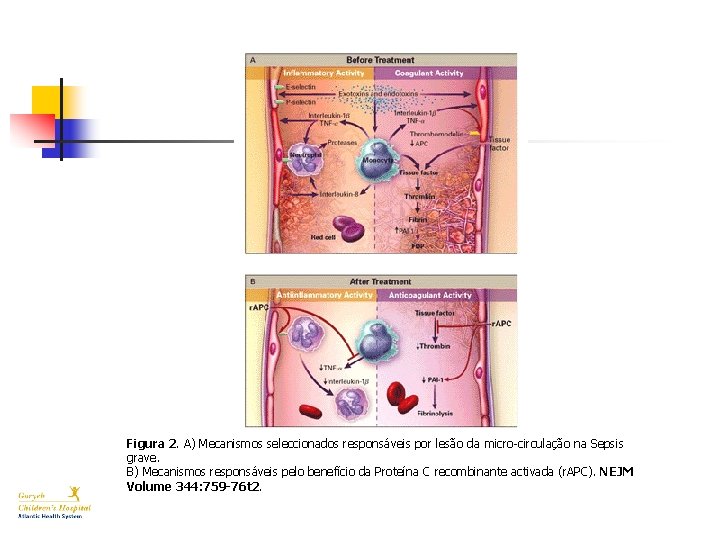
Figura 2. A) Mecanismos seleccionados responsáveis por lesão da micro-circulação na Sepsis grave. B) Mecanismos responsáveis pelo benefício da Proteína C recombinante activada (r. APC). NEJM Volume 344: 759 -76 t 2.

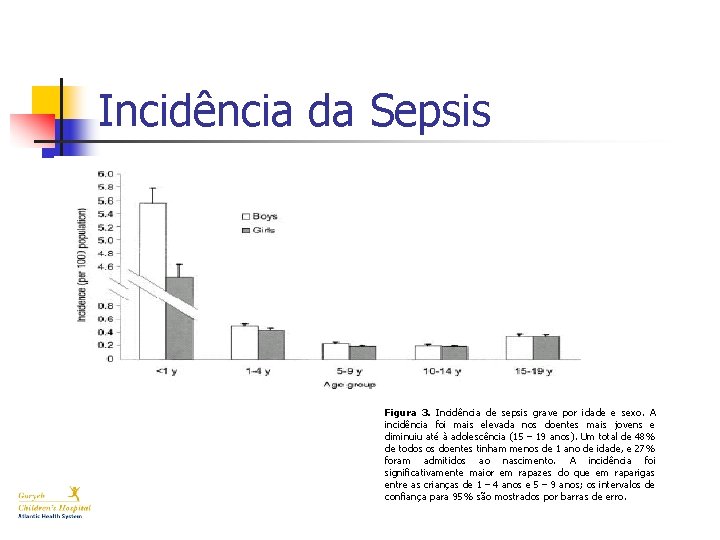
Incidência da Sepsis Figura 3. Incidência de sepsis grave por idade e sexo. A incidência foi mais elevada nos doentes mais jovens e diminuiu até à adolescência (15 – 19 anos). Um total de 48% de todos os doentes tinham menos de 1 ano de idade, e 27% foram admitidos ao nascimento. A incidência foi significativamente maior em rapazes do que em raparigas entre as crianças de 1 – 4 anos e 5 – 9 anos; os intervalos de confiança para 95% são mostrados por barras de erro.

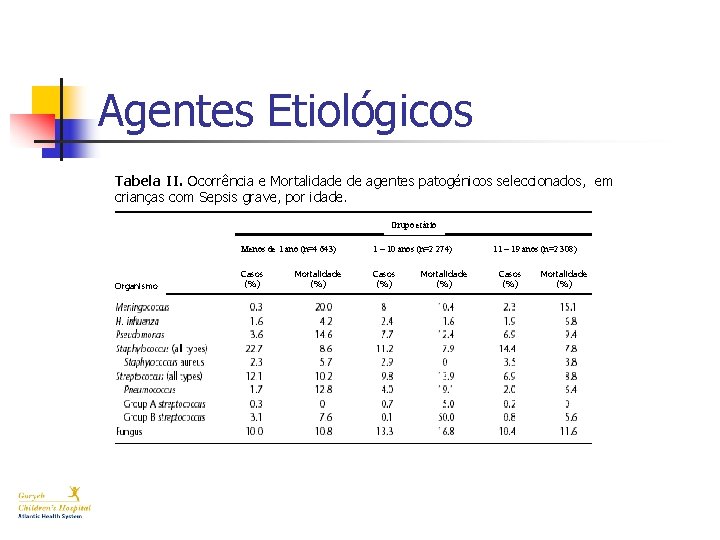
Agentes Etiológicos Tabela II. Ocorrência e Mortalidade de agentes patogénicos seleccionados, em crianças com Sepsis grave, por idade. Grupo etário Organismo Menos de 1 ano (n=4 643) 1 – 10 anos (n=2 274) Casos (%) Mortalidade (%) 11 – 19 anos (n=2 308) Casos (%) Mortalidade (%)

Definição de Choque n n Uma situação em que a perfusão tecidular é incapaz de responder às necessidades. O choque não é definido pela pressão arterial.

Divisão Clássica do Choque n n n Hipovolémico – diminuição do volume circulante. Cardiogénico – falência de “bomba”. Distributivo – volume insuficiente para o espaço disponível.

Fases do Choque n Compensado – n Descompensado – n Função de órgãos vitais mantida. Pressão arterial permanece normal. Perfusão micro-vascular torna-se marginal. Deterioração da função orgânica e celular. Surge hipotensão. Irreversível

O Circuito n “Tubos” distensíveis = artérias & veias n n n capacidade (volume total do circuito) resistência (contribui para a pressão arterial e o trabalho da “bomba”) bomba = coração n n contractilidade volume

Fornecimento e Necessidades n n n Necessidades: oxigénio e substratos necessários para assegurar o metabolismo aeróbio. Fornecimento: entrega de oxigénio (relacionado com o fluxo e conteúdo de oxigénio) e de substratos (p. e. glucose) Choque = Necessidades > Fornecimento

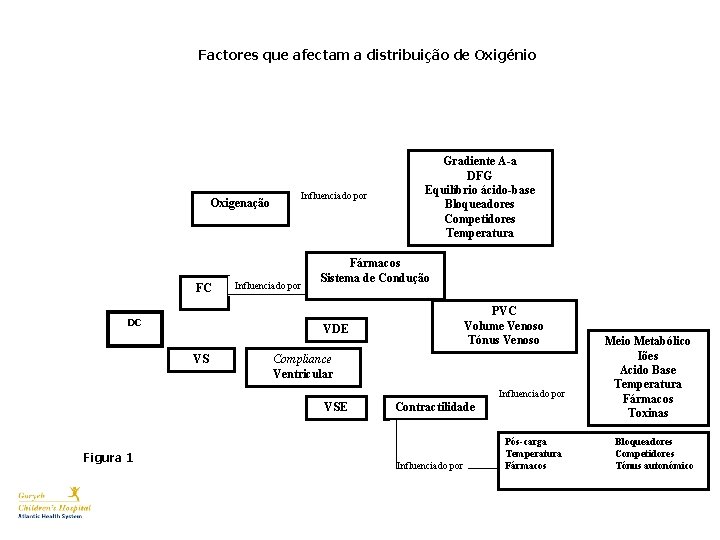
Factores que afectam a distribuição de Oxigénio Oxigenação FC DC Influenciado por Gradiente A-a DFG Equilíbrio ácido-base Bloqueadores Competidores Temperatura Fármacos Sistema de Condução PVC Volume Venoso Tónus Venoso VDE VS Compliance Ventricular Influenciado por VSE Figura 1 Contractilidade Influenciado por Pós-carga Temperatura Fármacos Meio Metabólico Iões Acido Base Temperatura Fármacos Toxinas Bloqueadores Competidores Tónus autonómico

Mecanismos Compensatórios n Barorreceptores – n Localizados no arco aórtico e seio carotídeo, são estimulados pela TA média elevada e assim excitam centros cardio-inibitórios provocando vasodilatação, diminuição da TA, FC e DC. A hipotensão irá terminar a estimulação, originando vasoconstrição e aumento da FC, TA e DC. Quimiorreceptores – Activados pela acidose celular, resultam em vasoconstrição e estimulação respiratória.

Mecanismos Compensatórios n Sistema Renina-angiotensina n n A diminuição da perfusão renal leva a secreção de Renina. Esta é convertida em Angiotensina II levando à vasoconstrição e libertação de Aldosterona. A Aldosterona leva a reabsorção de sódio e água. Respostas Humorais n n (cont. ) Libertação de catecolaminas originando o aumento da contractilidade e vasoconstrição. Auto-transfusão n Reabsorção de liquido intersticial.

Resposta Hemodinâmica à Hemorragia Resistência Vascular 100 % de Controlo Pressão Arterial Débito Cardíaco 25% 50% % Perdas Plasmáticas

Apresentação Clínica n n n O diagnóstico precoce requer um elevado grau de suspeita. O diagnóstico é feito através do exame físico, com especial atenção à perfusão periférica. Hipotensão é um sinal tardio e préterminal.

Avaliação Inicial: Exame Físico n n Neurológico: Nível de consciência flutuante, fontanela deprimida. Pele e extremidades: frias, pálidas, marmoreadas, cianosadas, aumento do tempo de preenchimento capilar, pulsos fracos, hipotonia. Cárdio-pulmonar: Hiperpneia, taquicardia. Renal: Diurese baixa, urina concentrada.

Tipos de Choque n Hipovolémico n n Hemorragia Perdas de Soro/Plasma Fármacos Distributivo n n Anafilático Neurogénico Séptico Cardiogénico n n Obstructivo n n Miocárdico Disritmia Cardiopatia canal dependente Pneumotórax, Tamponamento cardíaco, Dissecção da aorta Dissociativo n n Calor, monóxido de carbono, intoxicação por cianeto. Endócrino

Diagnóstico Diferencial do Choque n n A classificação etiológica pode ser difícil. O tratamento imediato é fundamental. A hipovolémia, absoluta ou relativa, está habitualmente presente. O tamanho da silhueta cardíaca na radiografia de tórax pode ser usado como estimativa da necessidade de reposição de volume.

Choque Hipovolémico n História compatível com perda de volume n n diarreia hemorragia vómitos perda de peso

Choque Cardiogénico n História frequentemente mais insidiosa n n n Sem perdas de volume significativas Tosse Atraso do crescimento ou dificuldades na alimentação Fadiga Febre baixa História ocasionalmente mais directa n Traumatismo torácico fechado

Choque Distributivo n História de n n Febre elevada, arrepios (sepsis) Cirurgia abdominal major (3º espaço) Lesão cranio-encefálica ou medular (perda de tónus vascular) Outras agressões sistémicas significativas (pancreatite, toxinas, etc)

Fases do Choque n Compensado n n Mantém-se o equilíbrio entre o fornecimento e as necessidades dos órgãos vitais, através de mecanismos protectores fisiológicos. Descompensado n Os mecanismos protectores são inadequados, pelo que a necessidade excede o fornecimento aos órgãos vitais.

Reconhecimento n Choque descompensado n n n Frio, aspecto marmoreado, oligo-anúria, refractário. Inicio de lesão secundária de órgãos. Choque Compensado n n Reconhecimento mais importante embora mais difícil. Reconhecimento e tratamento pode prevenir a lesão orgânica secundária.

Sinais Precoces n História da doença n A história natural da doença pode permitir a antecipação de potencial choque.

Sinais Precoces n Diminuição da perfusão periférica n n Mãos e pés frios com braços e pernas quentes Aumento do tempo de preenchimento capilar Diminuição dos pulsos periféricos Pele fria com hipertermia central

Sinais Precoces n Mecanismos Compensatórios n n n Aumento da frequência cardíaca Aumento da frequência respiratória ou alteração do padrão respiratório Concentração da urina

Sepsis n n Resposta sistémica à infecção Temp. >38ºC ou < 36ºC FC>90 bpm Relacionado com idade: n n n 1 m >180 12 m >170 5 A >150 10 A >130 FR>20 ciclos/min ou Pa. CO 2 <32 Leucócitos >12, 000 ou <4000, ou >10% de formas imaturas

Sepsis Grave n n Sepsis associada a disfunção de órgão, hipoperfusão ou hipotensão. Hipoperfusão pode incluir acidose láctica, oligúria ou alteração do estado de consciência.

Choque Séptico n n Sepsis com hipotensão, apesar de reanimação volémica adequada, e anomalias da perfusão incluindo acidose láctica, oligúria ou alteração do estado de consciência. Doentes medicados com vasopressores ou agentes inotrópicos podem não estar hipotensos na altura das avaliações.

Etiologia n n n Predominantemente Bactérias: normalmente Gram (-). As bactérias Gram (+) e os vírus também podem produzir o síndrome. Ocorre mais frequentemente em indivíduos imunocomprometidos (imunodeprimidos, RN e lactentes) mas pode afectar qualquer um (p. e. meningococemia)

Patogénese 1 n n As alterações sistémicas mais importantes ocorrem não como resultado directo das bactérias mas como resultado da resposta do hospedeiro à infecção. Endotoxina n n provoca lesão endotelial directa activa mediadores inflamatórios

Patogénese 2 n Vasodilatação, aumento da permeabilidade vascular n + activação de PMN n n n Produz metabolitos do acido araquidónico, proteases, radicais livres de oxigénio. Estes produtos podem causar lesão celular directa. Diminuição da utilização do oxigénio pela célula

Fisiopatologia 1 n Fase precoce n Choque “quente” ou Hiperdinâmico n n O maior problema é a diminuição do metabolismo celular de oxigénio, levando a disfunção celular e metabolismo anaeróbico. A vasodilatação produz RVS baixas, baixa TA diastólica, preenchimento capilar imediato, venodilatação com diminuição da pré-carga e taquicardia compensadora.

Fisiopatologia 2 n n O metabolismo anaeróbico leva a acidose metabólica com alcalose respiratória compensadora e taquipneia. Frequentemente ocorrem alterações discretas do estado de consciência (alteração da função do órgão por diminuição da oxigenação? ).

Fase tardia n Choque “frio” ou Hipodinâmico n Disfunção cardíaca /choque cardiogénico n n n factor depressor do miocárdio Vasoconstrição e perfusão tecidular gravemente diminuídas. Diminuição grave da distribuição e utilização do oxigénio com acidose metabólica marcada.

Tratamento n Objectivo principal: optimizar a distribuição de oxigénio aos tecidos n na sepsis a VO 2 parece ser linearmente relacionada com DO 2. Nas fases iniciais com vasodilatação e aumento da permeabilidade vascular, é essencial a administração vigorosa de líquidos. É comum administrar 50 -80 m. L/kg nas primeiras 2 -3 horas.

Abordagem - Expansão de Volume n n n Optimizar a pré-carga SF ou Lactato de Ringer Excepto na insuficiência miocárdica, usar 1020 m. L/kg cada 2 -10 minutos. Aos 40 -60 m. L/kg reavaliar e considerar: perdas em curso, isquemia intestinal e supra -renal, choque obstrutivo. Fazer radiografia de tórax. Considerar colóide. Fluidoterapia adicional deve ser guiada por resposta clínica, dados laboratoriais, possivelmente PVC e radiografia de tórax.

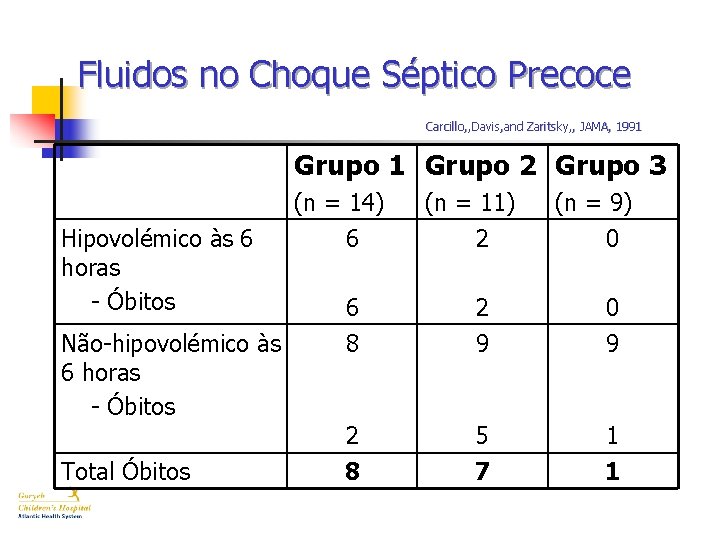
Fluidos no Choque Séptico Precoce Carcillo, , Davis, and Zaritsky, , JAMA, 1991 n Revisão Retrospectiva de 34 doentes pediátricos com choque séptico com culturas (+), entre 19821989. n Hipovolémia determinada pela pressão de encravamento capilar pulmonar e hipotensão. n No total os doentes receberam 33 m. L/kg na 1ª hora e 95 m. L/kg nas primeiras 6 horas. n Três grupos: – – – 1: receberam até 20 cc/kg na 1ª hora 2: receberam 20 -40 cc/kg na 1ª hora 3: receberam mais de 40 cc/kg na 1ª hora n Sem diferença no SDRA entre os 3 grupos.

Fluidos no Choque Séptico Precoce Carcillo, , Davis, and Zaritsky, , JAMA, 1991 Grupo 2 Grupo 3 Hipovolémico às 6 horas - Óbitos Não-hipovolémico às 6 horas - Óbitos Total Óbitos (n = 14) 6 (n = 11) 2 (n = 9) 0 6 8 2 9 0 9 2 5 1 8 7 1

Abordagem – Inotrópicos 1 n n A ausência de história de perda de líquidos, a presença de doença cardíaca prévia, hepatomegalia, crepitações, cardiomegalia e a incapacidade de melhorar a perfusão apesar de uma oxigenação, ventilação, expansão volémica e frequência cardíaca adequadas sugere um componente cardiogénico ou distributivo. Antes da introdução de inotrópicos, devem ser estabelecidos os objectivos da terapêutica e os critérios para monitorizar o resultado final.

Abordagem - Inotrópicos 2 n Adrenalina n n 0, 05 -1, 5 g/kg/min aumenta FC, RVS, contractilidade. Objectivos: TA adequada; taquicardia aceitável. n Dopamina n n Noradrenalina n n n 0, 05 -1, 0 g/kg/min Aumenta RVS Objectivo: TA adequada n 2 -20 g/kg/min Doses baixas, aumentam o fluxo circulatório renal e esplâncnico, e a contractilidade. Doses maiores aumentam a FC e as RVS. Objectivos: Melhoria da perfusão, TA, diurese.

Abordagem - Inotrópicos 3 n Dobutamina n n n 1 -20 g/kg/min aumenta contractilidade, pode reduzir RVS, RVP. Objectivos: Melhoria da perfusão, pode diminuir a TA. n Prostaglandina E-1 n n 0, 05 -0, 1 g/kg/min Mantém a patência do canal arterial.

Atitudes I n n A administração de líquidos é monitorizada pela frequência cardíaca, perfusão periférica, débito urinário (DU) e, por último, pela TA. Continuar com bólus de líquidos até serem restauradas a perfusão e o DU, ou surgir congestão pulmonar. n Na dúvida, perfundir rapidamente!

Atitudes II n Uso de inotrópicos ou vasopressores n n Existem vários níveis de depressão miocárdica. Se normotenso com diminuição da perfusão periférica e auscultação pulmonar limpa n n volume, considerar monitorização da PVC Se normotenso com diminuição da perfusão periférica mas com congestão pulmonar ou ritmo de galope n n Iniciar suporte inotrópico com dobutamina Monitorizar a PVC; considerar cateter Swan Ganz

n Se surge hipotensão n n n Continuar a administração vigorosa de líquidos A adrenalina, com potente efeito inotrópico e vasoconstrictor, pode preservar a pressão de perfusão para os órgãos vitais. Ponderar noradrenalina ou vasopressina. Efeitos vasoconstritores potentes podem aumentar as RVS, com consequente aumento do trabalho do miocárdio. Deve-se efectuar monitorização hemodinâmica invasiva.

n Manter o hematócrito em valores adequados para optimizar a capacidade de transporte de oxigénio com um aumento mínimo da viscosidade sanguínea (que resulta na diminuição do fluxo capilar) n A distribuição total de oxigénio é igual ao débito cardíaco vezes a capacidade de transporte arterial de oxigénio DO 2 = DC X Ca. O 2

Princípios Gerais para o Tratamento Entubação, ventilação mecânica n Manter temperatura corporal normal n Providenciar sedação n Corrigir a anemia n

Novas Terapêuticas n Corticóides (de novo) n Teste rápido de estimulação com corticotrofina n n n Pico 60 minutos <18 mg/d. L diagnóstico de insuficiência adrenal. Choque refractário a Líquidos/Vasopressores Drotrecogin alfa (Xigris/ Proteína C Activada) n n Sepsis grave em adultos Seguro nas crianças (*) estudos posteriores a esta apresentação levaram à revisão desta afirmação

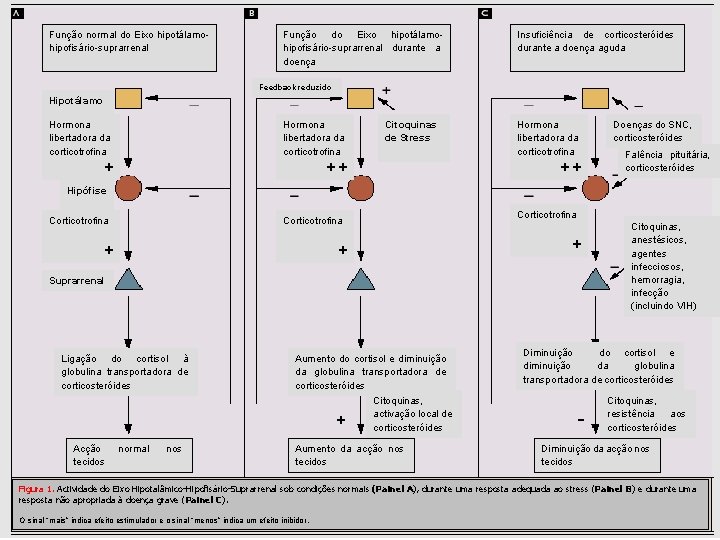
Função normal do Eixo hipotálamohipofisário-suprarrenal Função do Eixo hipotálamohipofisário-suprarrenal durante a doença Insuficiência de corticosteróides durante a doença aguda Feedback reduzido Hipotálamo Hormona libertadora da corticotrofina + ++ Citoquinas de Stress Hormona libertadora da corticotrofina ++ Doenças do SNC, corticosteróides Falência pituitária, corticosteróides Hipófise Corticotrofina + + + Suprarrenal Ligação do cortisol à globulina transportadora de corticosteróides Aumento do cortisol e diminuição da globulina transportadora de corticosteróides + Acção tecidos normal nos Citoquinas, activação local de corticosteróides Aumento da acção nos tecidos Citoquinas, anestésicos, agentes infecciosos, hemorragia, infecção (incluindo VIH) Diminuição do cortisol e diminuição da globulina transportadora de corticosteróides - Citoquinas, resistência aos corticosteróides Diminuição da acção nos tecidos Figura 1. Actividade do Eixo Hipotalâmico-Hipofisário-Suprarrenal sob condições normais (Painel A), durante uma resposta adequada ao stress (Painel B) e durante uma resposta não apropriada à doença grave (Painel C). O sinal “mais” indica efeito estimulador e o sinal “menos” indica um efeito inibidor.

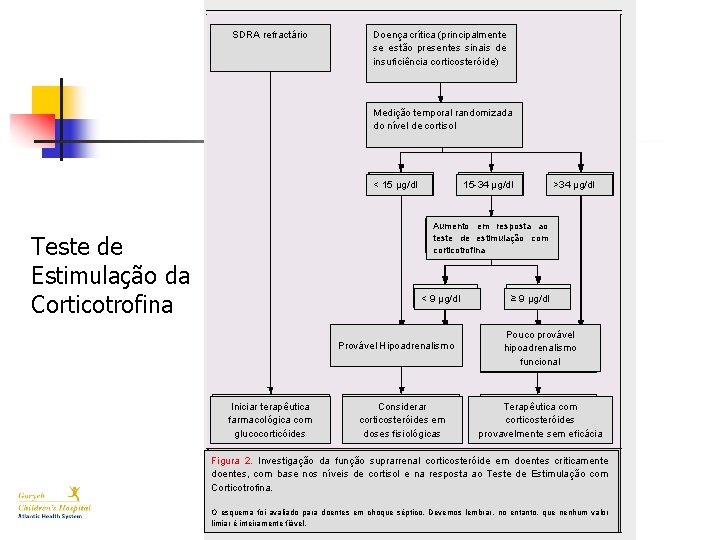
SDRA refractário Doença crítica (principalmente se estão presentes sinais de insuficiência corticosteróide) Medição temporal randomizada do nível de cortisol < 15 µg/dl 15 -34 µg/dl >34 µg/dl Aumento em resposta ao teste de estimulação com corticotrofina Teste de Estimulação da Corticotrofina < 9 µg/dl Provável Hipoadrenalismo Iniciar terapêutica farmacológica com glucocorticóides Considerar corticosteróides em doses fisiológicas ≥ 9 µg/dl Pouco provável hipoadrenalismo funcional Terapêutica com corticosteróides provavelmente sem eficácia Figura 2. Investigação da função suprarrenal corticosteróide em doentes criticamente doentes, com base nos níveis de cortisol e na resposta ao Teste de Estimulação com Corticotrofina. O esquema foi avaliado para doentes em choque séptico. Devemos lembrar, no entanto, que nenhum valor limiar é inteiramente fiável.

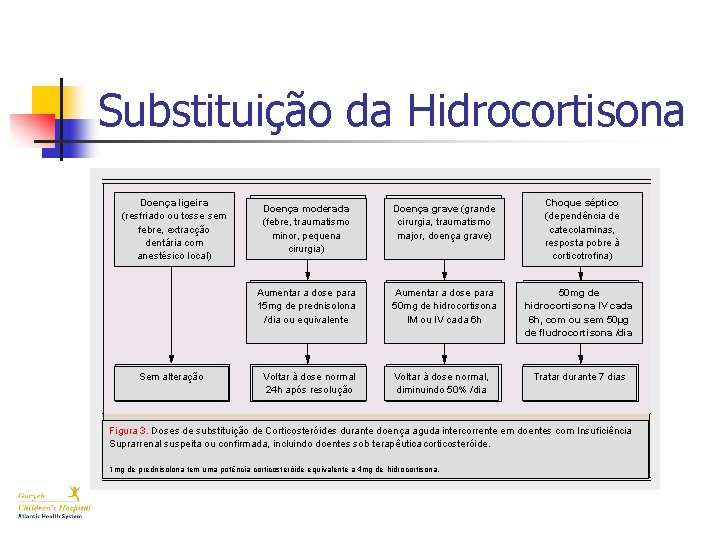
Substituição da Hidrocortisona Doença ligeira (resfriado ou tosse sem febre, extracção dentária com anestésico local) Sem alteração Choque séptico (dependência de catecolaminas, resposta pobre à corticotrofina) Doença moderada (febre, traumatismo minor, pequena cirurgia) Doença grave (grande cirurgia, traumatismo major, doença grave) Aumentar a dose para 15 mg de prednisolona /dia ou equivalente Aumentar a dose para 50 mg de hidrocortisona IM ou IV cada 6 h 50 mg de hidrocortisona IV cada 6 h, com ou sem 50µg de fludrocortisona /dia Voltar à dose normal 24 h após resolução Voltar à dose normal, diminuindo 50% /dia Tratar durante 7 dias Figura 3. Doses de substituição de Corticosteróides durante doença aguda intercorrente em doentes com Insuficiência Suprarrenal suspeita ou confirmada, incluindo doentes sob terapêutica corticosteróide. 1 mg de prednisolona tem uma potência corticosteróide equivalente a 4 mg de hidrocortisona.

Proteína C Activada -1 n Diminuí a inflamação n n Inibe a produção de citoquinas próinflamatórias (p. e. IL-1, IL-6). Previne a coagulação por inactivação dos factores Va e VIIIa, e inibindo a produção de trombina.

Proteína C Activada -2 n n n Promove a fibrinólise inibindo o TAF (factor activador da trombina). Activação do inibidor da fibrinólise activável pela trombina. Suprime o inibidor do activador do Plasminogénio 1 (PAI-1), isto permite que o t. PA actue.

Proteína C Activada/PROWESS n n n Estudo controlado duplamente-cego com placebo, randomizado, sobre a Proteína C Activada na sepsis grave. 1690 doentes Taxa de mortalidade no grupo Placebo de 30, 8% Taxa de mortalidade no grupo Tratamento de 24, 7% Redução do risco relativo de morte de 19, 4%

PROWESS n n Incidência de complicações hemorrágicas foi maior no grupo tratamento 3, 5 vs. 2, 0 % Dados de Sobrevida: todas as causas de morte nos primeiros 28 dias do estudo.

Estudo Pediátrico n n n 83 doentes Farmacocinética semelhante Doses similares 24 mcg/kg/hr 80% dos doentes pediátricos tinham défice de Proteína C. Mortalidade de 10, 8% (exp) vs. 9, 6% Utilidade na Meningococemia? ?