CHNG VI AMIN v Amin l dn xut







- Slides: 15

CHƯƠNG VI AMIN v Amin là dẫn xuất của NH 3 khi thay thế các nguyên tử hidro trong NH 3 bằng các gốc hidrocarbon v Tùy vào số lượng hidro được thay thế, người ta chia amin làm 3 loại : Amin bậc 1 Amin bậc 2 Amin bậc 3


III. Điều chế : 1. Ankyl hóa NH 3 và các amin + NH 3, to RNH 2 + NH 4 X Amin bậc 1 có thể tiếp tục bị ankyl hóa để cho amin bậc 2, bậc 3: + + NH 3, to R 2 NH + NH 4 X R 3 N + NH 4 X

v Rất khó dừng ở phản ứng đầu vì càng về sau N càng có hoạt tính cao nên thường thu được hỗn hợp sản phẩm. Muốn thu được sản phẩm đơn ankyl hóa phải dùng dư NH 3. v Aryl halogenua phản ứng khó khăn, phải thực hiện phản ứng ở nhiệt độ cao, áp suất cao. C 6 H 5 Cl + 2 NH 3 340 o. C 340 atm C 6 H 5 NH 2 + NH 4 Cl

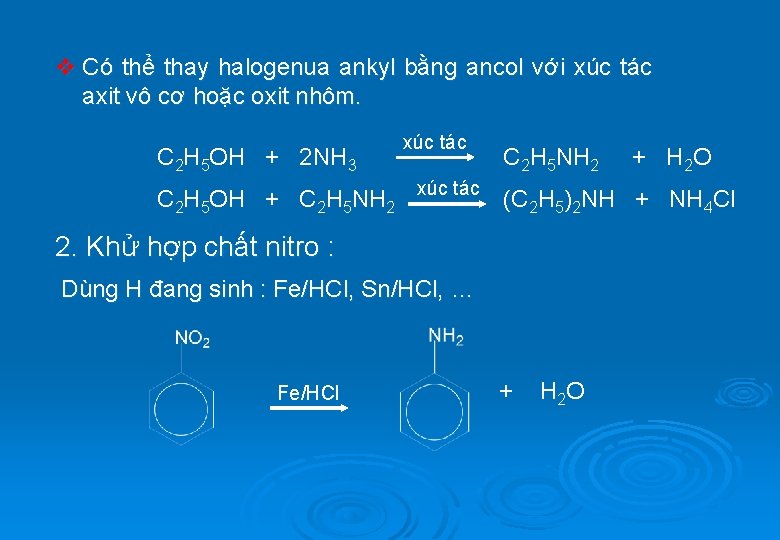
v Có thể thay halogenua ankyl bằng ancol với xúc tác axit vô cơ hoặc oxit nhôm. C 2 H 5 OH + 2 NH 3 xúc tác C 2 H 5 NH 2 + H 2 O C 2 H 5 OH + C 2 H 5 NH 2 xúc tác (C 2 H 5)2 NH + NH 4 Cl 2. Khử hợp chất nitro : Dùng H đang sinh : Fe/HCl, Sn/HCl, … Fe/HCl + H 2 O

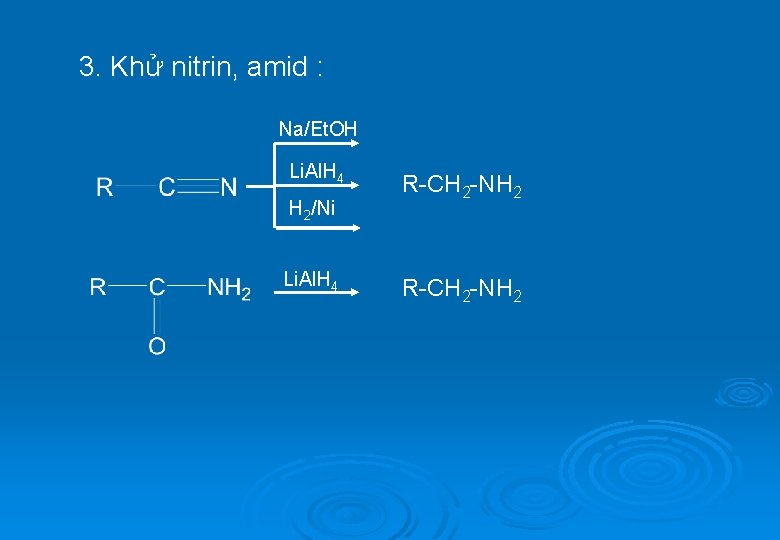
3. Khử nitrin, amid : Na/Et. OH Li. Al. H 4 H 2/Ni Li. Al. H 4 R-CH 2 -NH 2

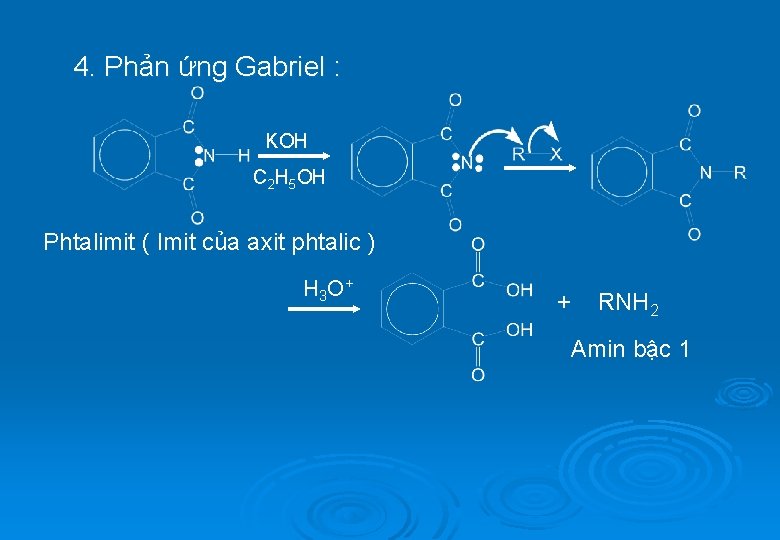
4. Phản ứng Gabriel : KOH C 2 H 5 OH Phtalimit ( Imit của axit phtalic ) H 3 O + + RNH 2 Amin bậc 1

IV. Tính chất hóa học : 1. Tính bazơ : v Nguyên nhân tính bazơ của các amin là do cặp electron tự do trên nitơ. Các nhóm đẩy electron làm tăng mật độ electron tự do trên nitơ nên làm tăng tính bazơ; ngược lại các nhóm hút làm giảm tính bazơ v Như vậy tính bazơ: bậc 2 > bậc 1 > amin thơm. Riêng amin bậc 3 tính bazơ kém bậc 2 do hiệu ứng cản trở không gian. v Amin phản ứng với axit cho ra muối amoni tan trong nước. Người ta lợi dụng điều này để tách amin ra khỏi hỗn hợp với những chất khác. + HCl

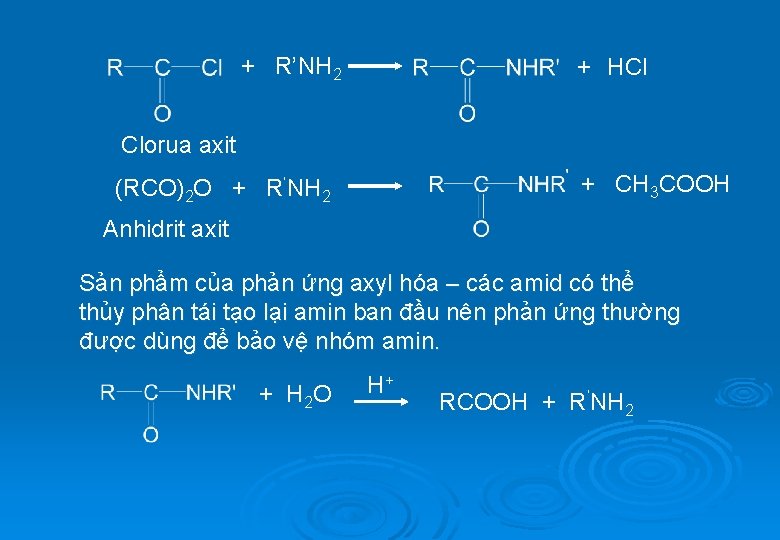
2. Phản ứng ankyl hóa (xem lại phần điều chế) : RNH 2 + R’X RNHR’ + R ’X RNHR’ + HX RNR’ 2 + HX 3. Phản ứng axyl hóa : Khi tác dụng với axit carboxylic, anhidrit axit hoặc clorua axit, một hidro nối với nitơ của amin có thể bị thay thế bởi nhóm axyl RCO+ R’NH 2 Axit carboxylic to + H 2 O

+ R’NH 2 + HCl Clorua axit + CH 3 COOH (RCO)2 O + R’NH 2 Anhidrit axit Sản phẩm của phản ứng axyl hóa – các amid có thể thủy phân tái tạo lại amin ban đầu nên phản ứng thường được dùng để bảo vệ nhóm amin. + H 2 O H+ RCOOH + R’NH 2

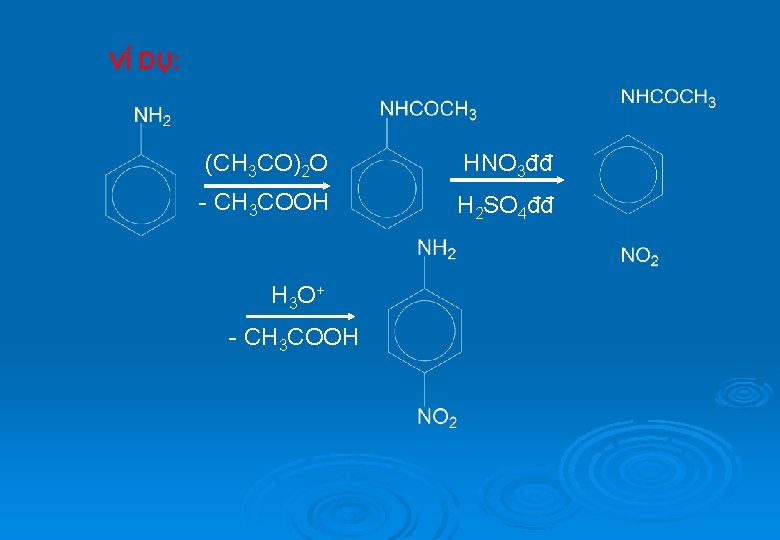
VÍ DỤ: (CH 3 CO)2 O HNO 3đđ - CH 3 COOH H 2 SO 4đđ H 3 O + - CH 3 COOH

4. Phản ứng với axit nitro HNO 2 : HNO 2 rất kém bền ở nhiệt độ thường nên phải tạo ra bằng cách cho muối (Na. NO 2, KNO 2) phản ứng với axit vô cơ mạnh ở nhiệt độ thấp 0 -5 o. C. Na. NO 2 + HCl → HNO 2 + Na. Cl v Với amin bậc 1: q Amin no bậc 1 : RNH 2 + HNO 2 ROH + N 2 + H 2 O q Amin thơm bậc I : + Na. NO 2 + 2 HCl 0 o C – 5 o C Điazo hóa + Na. Cl + 2 H 2 O Phenildiazoclorua

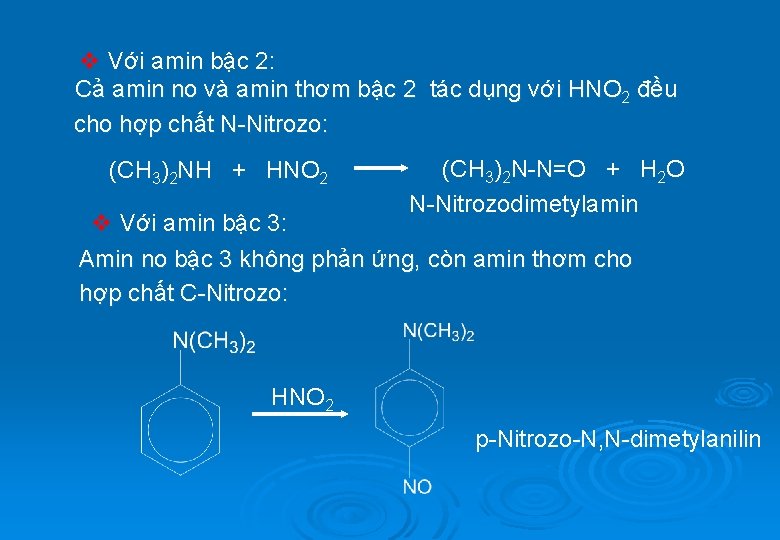
v Với amin bậc 2: Cả amin no và amin thơm bậc 2 tác dụng với HNO 2 đều cho hợp chất N-Nitrozo: (CH 3)2 NH + HNO 2 (CH 3)2 N-N=O + H 2 O N-Nitrozodimetylamin v Với amin bậc 3: Amin no bậc 3 không phản ứng, còn amin thơm cho hợp chất C-Nitrozo: HNO 2 p-Nitrozo-N, N-dimetylanilin

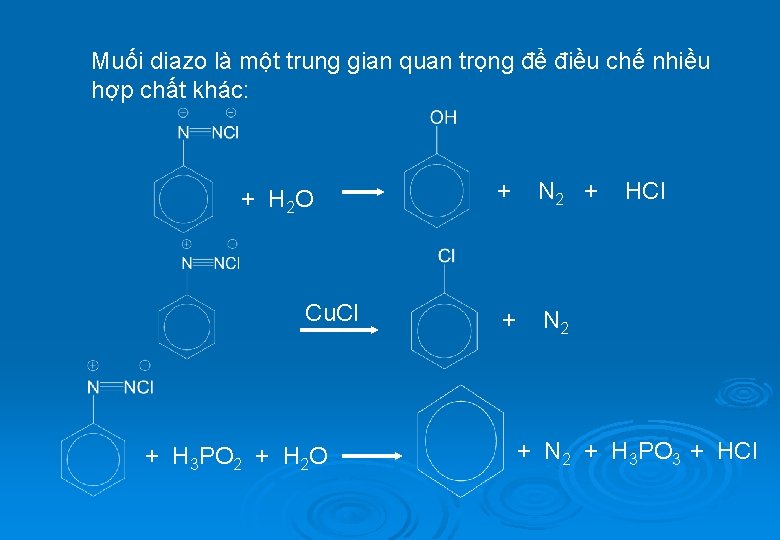
Muối diazo là một trung gian quan trọng để điều chế nhiều hợp chất khác: + H 2 O Cu. Cl + H 3 PO 2 + H 2 O + N 2 + + N 2 HCl + N 2 + H 3 PO 3 + HCl

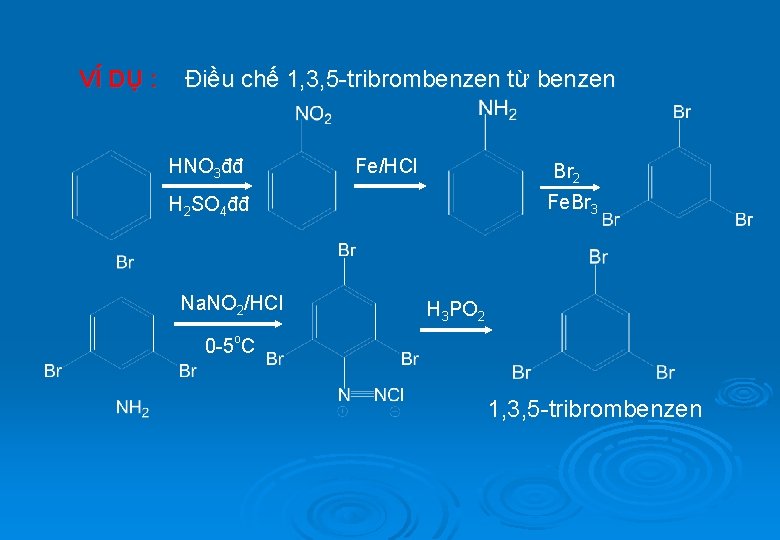
VÍ DỤ : Điều chế 1, 3, 5 -tribrombenzen từ benzen HNO 3đđ Fe/HCl Br 2 Fe. Br 3 H 2 SO 4đđ Na. NO 2/HCl H 3 PO 2 0 -5 o. C 1, 3, 5 -tribrombenzen
 Chng finance
Chng finance Nader amin-salehi
Nader amin-salehi Amin rashidi
Amin rashidi Kotransmiter
Kotransmiter Obat yang mengandung gugus amina
Obat yang mengandung gugus amina Pak amir membeli beras di pasar termasuk kegiatan
Pak amir membeli beras di pasar termasuk kegiatan Amin hossein rahimi
Amin hossein rahimi Amin alipour
Amin alipour Veziküler amin pompası
Veziküler amin pompası Raptor
Raptor Propanoik asit
Propanoik asit Dato ir abdul hak md amin
Dato ir abdul hak md amin Php my amin
Php my amin Project management processes
Project management processes U ime oca sina i svetog duha
U ime oca sina i svetog duha Amin azad
Amin azad