CHNG 6 THERMOCHEMISTRY NHIT HO HC I CC






















![Nhiệt dung riêng (tỉ nhiệt) [cal/g. độ] hay [J/g. độ] Nhiệt dung mol – Nhiệt dung riêng (tỉ nhiệt) [cal/g. độ] hay [J/g. độ] Nhiệt dung mol –](https://slidetodoc.com/presentation_image_h/cf1e046cbbeb50fee4e04c9df5eb92dd/image-27.jpg)

































- Slides: 69

CHƯƠNG 6 THERMOCHEMISTRY NHIỆT HOÁ HỌC

I. CÁC KHÁI NIỆM CƠ BẢN 1. Khái niệm về nhiệt động lực học và nhiệt động hóa học 2. Một số khái niệm cần thiết

Khái niệm về nhiệt động lực học và nhiệt động hóa học a. Nhiệt động lực học Nguyên lý I- nếu trong quá trình nào đó có một dạng năng lượng mất đi thì thay cho nó phải có một dạng năng lượng khác xuất hiện với lượng tương đương nghiêm nghặt. Nguyên lý 2 - nhiệt không thể chuyển từ vật thể nguội hơn sang vật thể nóng hơn.


b. Nhiệt động hóa học Ø Tính hiệu ứng nhiệt của phản ứng Ø Dự đoán chiều hướng diễn ra của quá trình hóa học Ø Hiệu suất của phản ứng Ø Điều kiện cân bằng và các yếu tố bên ngoài ảnh hưởng đến cân bằng.

NHẬN XÉT Chỉ cần biết trạng thái đầu và cuối của hệ và điều kiện bên ngoài có ảnh hưởng đến quá trình có thể dự đoán chiều hướng và mức độ diễn ra của quá trình trước khi biết rõ cơ chế phản ứng.

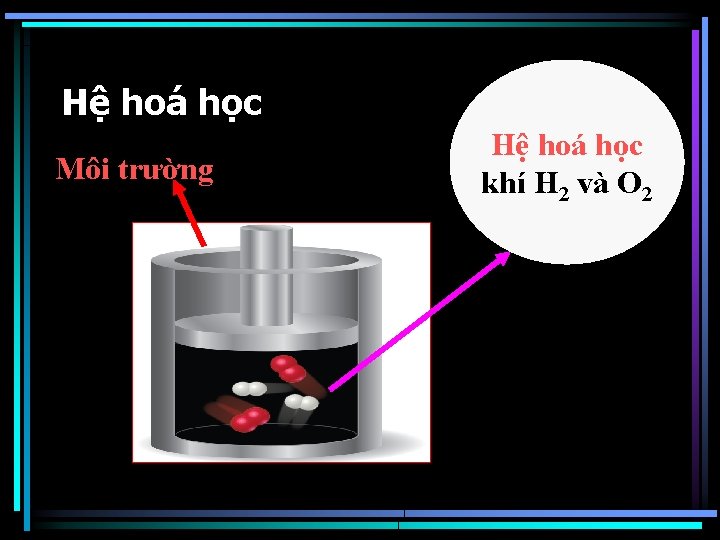
2. Một số khái niệm cần thiết a. Hệ hóa học b. Pha c. Trạng thái và quá trình d. Các hàm nhiệt động

Hệ hoá học Môi trường Hệ hoá học khí H 2 và O 2


Hệ đoạn nhiệt - không trao đổi chất và nhiệt. - Có thể trao đổi công Hệ đồng thể - không có bề mặt phân chia Hệ đồng nhất- thành phần tính chất như nhau Hệ dị thể- có bề mặt phân chia

Pha Ø Là tập hợp những phần đồng thể của hệ Ø Giống nhau về thành phần hóa học và tính chất hóa lý. Ø Được phân cách với các pha khác bởi bề mặt phân chia pha. Ø Hệ 1 pha: hệ đồng thể Ø Hệ nhiều pha: hệ dị thể

ØThông số trạng thái Thông số dung độ - là thông số tỷ lệ với lượng chất như : thể tích, khối lượng, năng lượng… Có tính chất cộng. Thông số cường độ- không phụ thuộc lượng chất như: nhiệt độ, áp suất. . Th số dung độ/ th số dung độ = th số cường độ

Ø Trạng thái của hệ Ví dụ : 1 lít dd HCl 0, 1 M ; 250 C. Các thông số trạng thái được liên hệ với nhau bằng pt trạng thái Ví dụ : Khí lý tưởng PV = n. RT →P=n. RT/V Dung dịch m = V. d

Hàm trạng thái • Là hàm của các thông số trạng thái • Hàm trạng thái phụ thuộc vào trạng thái của hệ • Các thông số trạng thái có thể là hàm trạng thái nhưng cũng có thể là biến số trạng thái

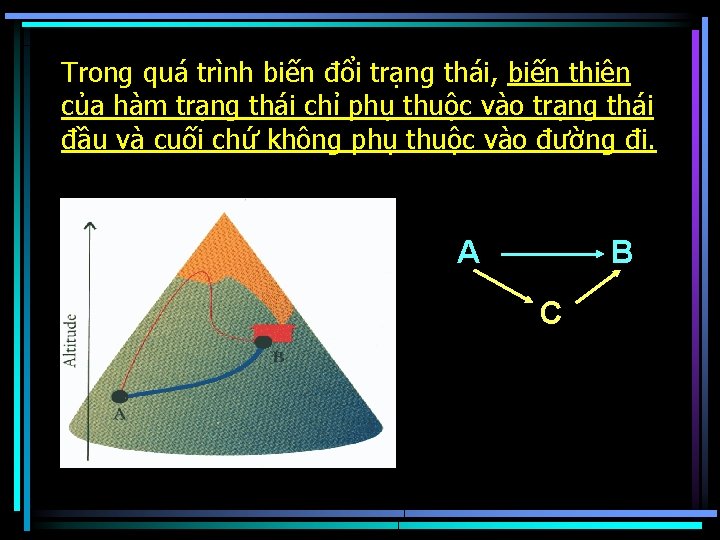
Trong quá trình biến đổi trạng thái, biến thiên của hàm trạng thái chỉ phụ thuộc vào trạng thái đầu và cuối chứ không phụ thuộc vào đường đi. A B C

ØMột biến thiên hữu hạn từ trạng thái 1 đến trạng thái 2 : 1(Z 1) → 2 (Z 2) Z = Z 2 –Z 1 ØMột biến thiên vô cùng bé : d. Z hay Z ØTrong một chu trình : Z =0

TRẠNG THÁI CHUẨN (0) • Áp suất chuẩn 1 atm. • Nhiệt độ tuỳ ý, thường chọn ở 250 C • Chất rắn, lỏng - ở dạng nguyên chất, bền ở 1 atm nhiệt độ T. • Khí – khí nguyên chất, bền nhất hoặc thường gặp, Pkhí =1 atm • Dung dịch C=1 mol/l

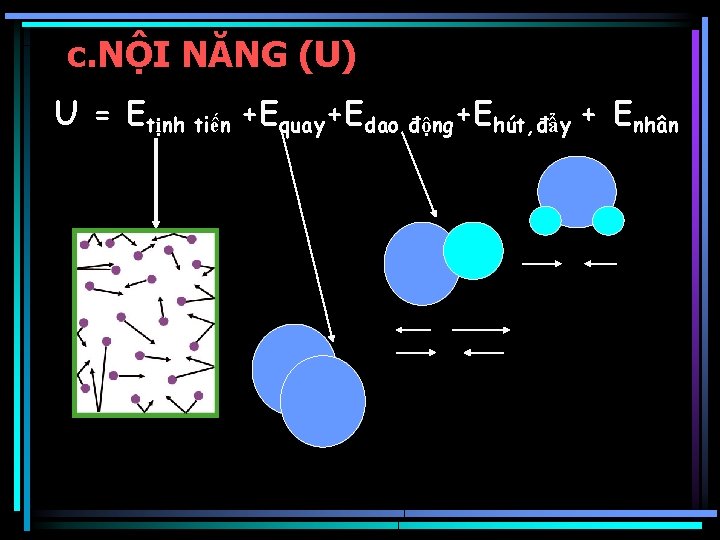
c. NỘI NĂNG (U) U = Etịnh tiến +Equay+Edao động+Ehút, đẩy + Enhân

• Không xác định chính xác nội năng U • Theo nhiệt động học, trong quá trình biến đổi trạng thái chỉ cần xác định U • Nội năng phụ thuộc vào : bản chất, lượng chất, nhiệt độ, áp suất, thể tích… • Nội năng của khí lý tưởng chỉ phụ thuộc vào nhiệt độ U=f(T) • Nội năng là hàm trạng thái, là thông số dung độ.

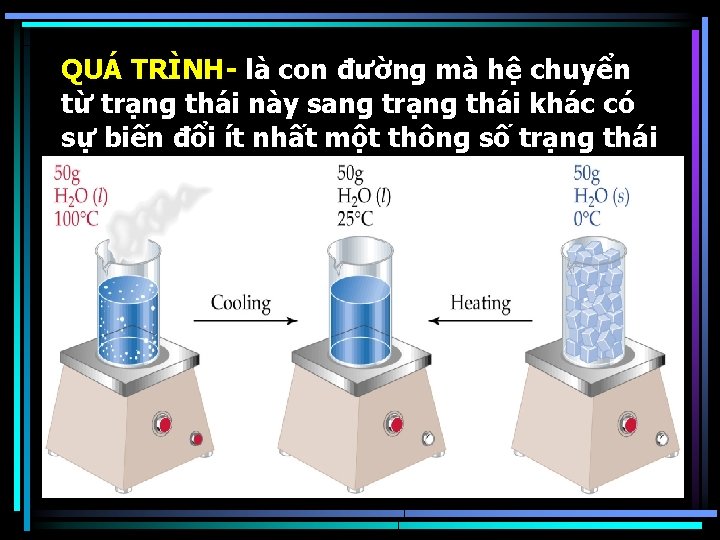
QUÁ TRÌNH- là con đường mà hệ chuyển từ trạng thái này sang trạng thái khác có sự biến đổi ít nhất một thông số trạng thái

Quá trình đẳng tích V=0 Quá trình đẳng áp P=0 Quá trình đẳng nhiệt T= 0 Quá trình đoạn nhiệt – không trao đổi nhiệt nhưng có thể trao đổi công. Quá trình vi phân – quá trình các thông số trạng thái biến đổi vô cùng nhỏ.

Nhiệt và công là hai hình thức trao đổi năng lượng của hệ với môi trường. Nhiệt và công chỉ xuất hiện trong quá trình biến đổi trạng thái của hệ nên là hàm của quá trình, phụ thuộc vào cách tiến hành quá trình. Trong biến đổi vô cùng bé , nhiệt và công mà hệ trao đổi được viết là Q và A Trong biến đổi hữu hạn :

• Nhiệt là thước đo sự chuyển động nhiệt hỗn loạn của các tiểu phân. • Công là thước đo sự chuyển động có trật tự có hướng của các tiểu phân trong trường lực.

Qui ước về dấu của nhiệt và công

NHIỆT ĐỘ • Thang nhiệt độ Celsius (0 C) ký hiệu t • Thang nhiệt độ Kelvin (K) ký hiệu T T(K) = t (0 C) + 273, 15

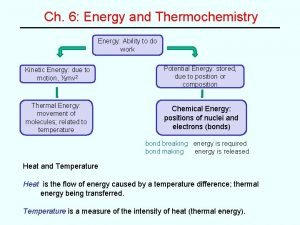
NHIỆT DUNG (C) – là nhiệt lượng cần dùng để nâng nhiệt độ một chất lên một độ. (không có phản ứng hoá học, không có biến đổi pha, không có sự thay đổi thành phần của hệ )
![Nhiệt dung riêng tỉ nhiệt calg độ hay Jg độ Nhiệt dung mol Nhiệt dung riêng (tỉ nhiệt) [cal/g. độ] hay [J/g. độ] Nhiệt dung mol –](https://slidetodoc.com/presentation_image_h/cf1e046cbbeb50fee4e04c9df5eb92dd/image-27.jpg)
Nhiệt dung riêng (tỉ nhiệt) [cal/g. độ] hay [J/g. độ] Nhiệt dung mol – [cal/mol. độ] hay [J/mol. độ] Nhiệt dung mol đẳng áp Cp ; Cp=a 1+b 1. T+ c 1. T 2… Nhiệt dung mol đẳng tích Cv; Cv=a 2+b 2. T+ c 2. T 2. . Cp và Cv là hàm trạng thái. Nhiệt dung [cal/độ] hay [J/độ]

CÔNG • Công dãn nở A=Png. d. V • Công điện A=E. dq • Công bề mặt A=. d. S

Phản ứng đẳng áp, đẳng nhiệt ( O 2 khí lý tưởng ) Đẳng áp

QUÁ TRÌNH THUẬN NGHỊCH Là qt có thể tiến hành theo hai chiều ngược nhau, các trạng thái trung gian giống nhau, không gây nên biến đổi gì trong hệ cũng như môi trường. QUÁ TRÌNH BẤT THUẬN NGHỊCH – Là các qt không thoả mãn các điều kiện trên. Quá trình có ma sát đều là qt bất thuận nghịch Các qt tự xảy ra trong tự nhiên đều là qt bất thuận nghịch.

Quá trình khuếch tán của khí là quá trình bất thuận nghịch Tự phát Không tự phát

Tính chất của quá trình thuận nghịch • Xảy ra với tốc độ vô cùng chậm, có thể xem là một dãy liên tục các trạng thái cân bằng nối tiếp nhau. • Công hệ sinh trong quá trình thuận nghịch là cực đại chỉ phụ thuộc vào trạng thái đầu và cuối. Tính thuận nghịch là một thuộc tính của quá trình cân bằng.

Các quá trình được xem gần như quá trình thuận nghịch : • Quá trình chuyển pha ở đúng điều kiện nhiệt độ và áp suất chuyển pha. • Quá trình tăng hay giảm nhiệt độ vô cùng chậm. • Quá trình dãn nở đẳng nhiệt vô cùng chậm của khí lý tưởng. • Phản ứng hoá học diễn ra ở gần với điều kiện cân bằng.

II. NGUYÊN LÝ I CỦA NHIỆT ĐỘNG LỰC HỌC VÀ HIỆU ỨNG NHIỆT 1. Nguyên lý I của nhiệt động lực học và các đại lượng nhiệt động 2. Hiệu ứng nhiệt của các quá trình hóa học và phương trình nhiệt hóa học 3. Định luật Hess và các hệ quả

NGUYÊN LÝ I CỦA NHIỆT ĐỘNG HỌC Q, A, A’ (U 1) Trạng thái 1 Trạng thái 2 (U 2) Q = U + At = U + A’ U = U 2 - U 1 A’ công có ích (công điện, . . . ) ( A’ 0) A công dãn nở

Quá trình đẳng tích , d. V=0 → A=0 Qv –A’= U Không có pư hoá học A’=0 → Qv= U Qv - nhiệt đẳng tích Có pưhh A’ 0 → Qv –A’ = U Qv –A’ hiệu ứng nhiệt đẳng tích Hiệu ứng nhiệt của phản ứng ở đk đẳng tích bằng biến thiên nội năng của hệ.

Quá trình đẳng áp P= const→ A = P (V 2 -V 1) QP – A’ = (U 2 – U 1) + P(V 2 – V 1) Qp – A’ = (U 2 + PV 2) – (U 1 + PV 1) Entanpi H = U + PV Qp –A’ = H 2 – H 1= H Không có pưhh A’=0 QP = H , Qp là nhiệt đẳng áp Có pưhh A’ 0 Qp –A’ = H (Qp-A’ ) gọi là hiệu ứng nhiệt đẳng áp Hiệu ứng nhiệt của phản ứng ở đk đẳng áp bằng biến thiên entanpi của hệ.

Enthalpy là hàm trạng thái , thông số dung độ. • Đa số các phản ứng hoá học thường được tiến hành ở đk áp suất không đổi nên hiệu ứng nhiệt của phản ứng được xác định bằng H của phản ứng.


Nhiệt dung đẳng áp , nhiệt dung đẳng tích

2. Hiệu ứng nhiệt của các quá trình hóa học và phương trình nhiệt hóa a. Hiệu ứng nhiệt của các quá trình hóa học b. Phương trình nhiệt hóa c. Nhiệt tạo thành và nhiệt đốt cháy

Hiệu ứng nhiệt của các quá trình hóa học Ø Là lượng nhiệt Q mà hệ thu vào hay phát ra trong qúa trình hóa học. Quá trình đẳng áp Qp = H Pư toả nhiệt Pư thu nhiệt H = (H)sản phẩm - (H)chất đầu

Quan hệ giữa H và U trong quá trình đẳng áp , đẳng nhiệt • H = U + P. V • Phản ứng chỉ có chất rắn, chất lỏng V 0 nên H U • Phản ứng có chất khí P. V = n. R. T (xem khí là khí lý tưởng) H = U + n. R. T n = (số mol khí)sp - (số mol khí)cđ tính trong phương trình phản ứng

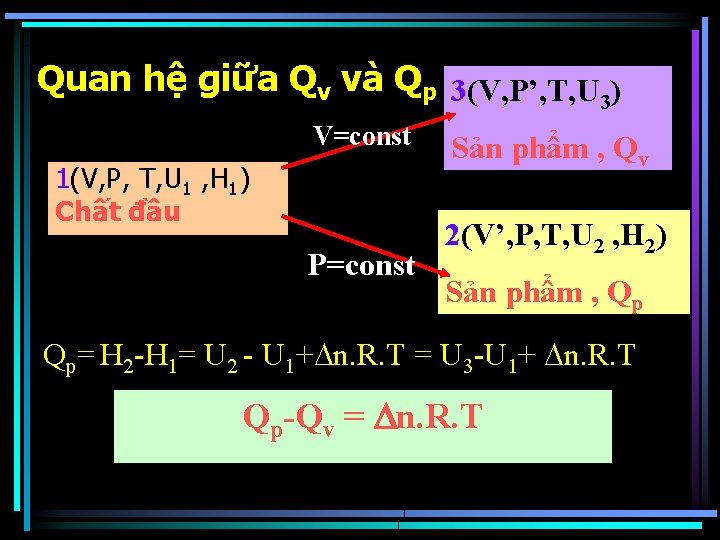
Quan hệ giữa Qv và Qp 3(V, P’, T, U 3) V=const 1(V, P, T, U 1 , H 1) Chất đầu P=const Sản phẩm , Qv 2(V’, P, T, U 2 , H 2) Sản phẩm , Qp Qp= H 2 -H 1= U 2 - U 1+ n. R. T = U 3 -U 1+ n. R. T Qp-Qv = n. R. T

So sánh nhiệt phản ứng Qp và Qv 2 CO(k) + O 2 (k) = 2 CO 2(k) QP = H = -566 k. J Qv = U = ? Qp-Qv = n. R. T P V = n. R. T= (-1). (8, 314). 298. 10 -3 = -2, 5 k. J Qv = Qp - P V= -563. 5 k. J

Phương trình nhiệt hóa học 2 C(gr) + 2 O 2(k) = 2 CO 2(k) ; H 0298= -787, 02 k. J Đây là pư toả nhiệt. Ø H được tính với giả thiết : pư xảy ra hoàn toàn , chất đầu và sản phẩm theo lượng hợp thức và trạng thái vật lý tương ứng với pư. Nhiệt độ có thể biến đổi trong quá trình pư nhưng mọi tính toán được thực hiện khi nhiệt độ cuối bằng nhiệt độ đầu.

Trong điều kiện bình thường (nhiệt độ thấp), phản ứng tỏa nhiệt ( H < 0) là phản ứng có khả năng tự xảy ra. Ø Hiệu ứng nhiệt tiêu chuẩn : H 0 T • Áp suất chuẩn 1 atm • Nhiệt độ T tuỳ ý, thường chọn ở 250 C • Chất đầu và sản phẩm ở trạng thái chuẩn và cùng nhiệt độ.

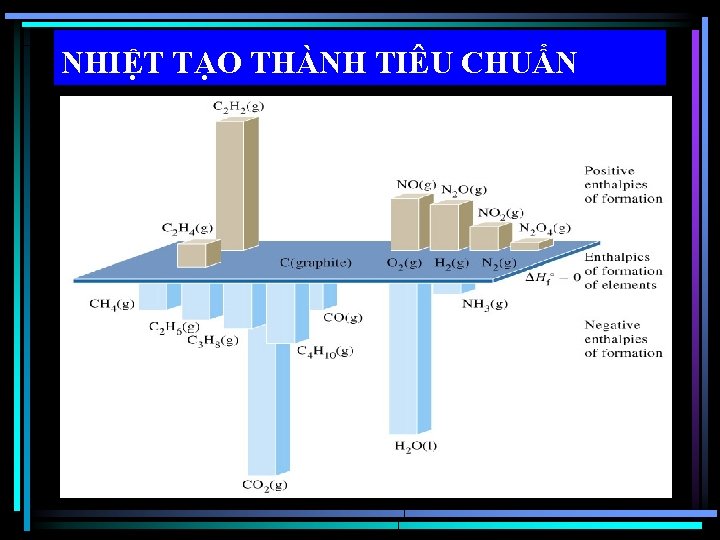
Nhiệt tạo thành là hiệu ứng nhiệt của phản ứng tạo thành 1 mol chất từ các đơn chất ứng với trạng thái tự do bền nhất trong những điều kiện đã cho về áp suất và nhiệt độ. Ở điều kiện chuẩn, nhiệt tạo thành tiêu chuẩn ký hiệu ( H 0298)tt Các đơn chất bền ở đk chuẩn như: Cl 2(k); H 2(k); O 2(k); N 2(k); Br 2(lỏng); I 2(r); C(gr) ( H 0298)tt của các đơn chất bền ở đk chuẩn = 0 ( H 0298 )tt của ion H+. n. H 2 O =0

Nhiệt tạo thành tiêu chuẩn, Hf° (k. J/mol) CO(g) -111 CH 4(g) -74. 8 Ag+(aq) 106 CO 2(g) -394 C 2 H 4(g) 52 Na+(aq) -240 H 2 O(l) -286 C 2 H 6(g) -85 NO 3 -(aq) -207 NH 3(g) -46 CH 3 OH(g) -201 C 6 H 12 O 6(s) -1260 N 2 H 4(g) 95. 4 C 2 H 5 OH(l) -278 Ag. Cl(s) -127 HCl(g) -92 C 6 H 6(l) 49 Na 2 CO 3(s) -1131 Phản ứng phân huỷ là phản ứng nghịch của pư tạo thành.

NHIỆT TẠO THÀNH TIÊU CHUẨN

Nhiệt đốt cháy là hiệu ứng nhiệt của phản ứng đốt cháy 1 mol chất bằng khí oxy tạo thành các oxyt cao bền ở đk phản ứng. C 2 H 4(k)+ 3 O 2(k) → 2 CO 2(k) + 2 H 2 O(l) ( H 0298)đc =-1411 k. J/mol Ký hiệu - nhiệt đốt cháy tiêu chuẩn ( H 0298)đc Đơn vị - [kcal/mol] hay [k. J/mol]

Nhiệt đốt cháy tiêu chuẩn của khí CO 2 và nước lỏng được qui ước bằng không Nhiệt tạo thành nguyên tử là hiệu ứng nhiệt của pư tạo thành 1 mol hợp chất ở trạng thái khí từ các nguyên tử cũng ở trạng thái khí. Hiệu ứng nhiệt của quá trình hoà tan là hiệu ứng nhiệt của quá trình hoà tan 1 mol chất tan nên chịu ảnh hưởng lớn đến lượng và bản chất của dung môi. Khi lượng dung môi đủ lớn thì Hht không phụ thuộc vào dung môi.

3. Định luật Hess và các hệ quả a. Định luật Hess b. Các hệ quả

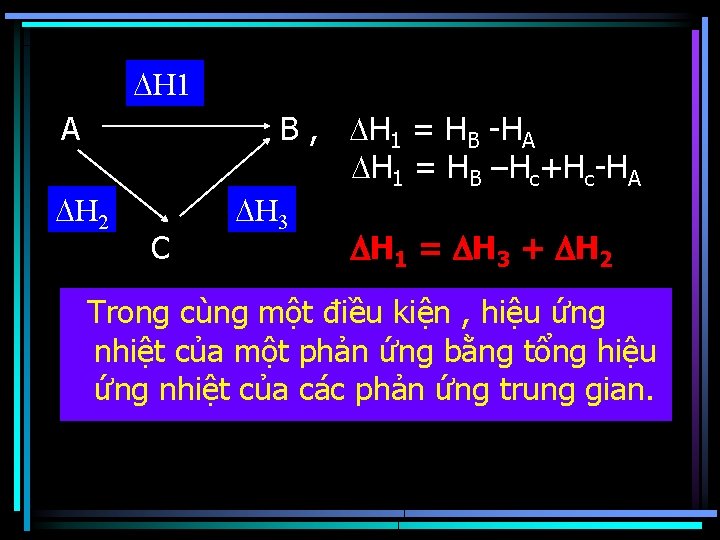
Định luật Hess Hiệu ứng nhiệt của phản ứng hóa học ở điều kiện đẳng áp hoặc đẳng tích chỉ phụ thuộc vào bản chất và trạng thái của các chất đầu và sản phẩm cuối chứ không phụ thuộc vào đường đi của quá trình, nghĩa là không phụ thuộc vào số lượng và đặc điểm của các chất giai đoạn trung gian.

H 1 B , H 1 = HB -HA H 1 = HB –Hc+Hc-HA A H 2 C H 3 H 1 = H 3 + H 2 Trong cùng một điều kiện , hiệu ứng nhiệt của một phản ứng bằng tổng hiệu ứng nhiệt của các phản ứng trung gian.

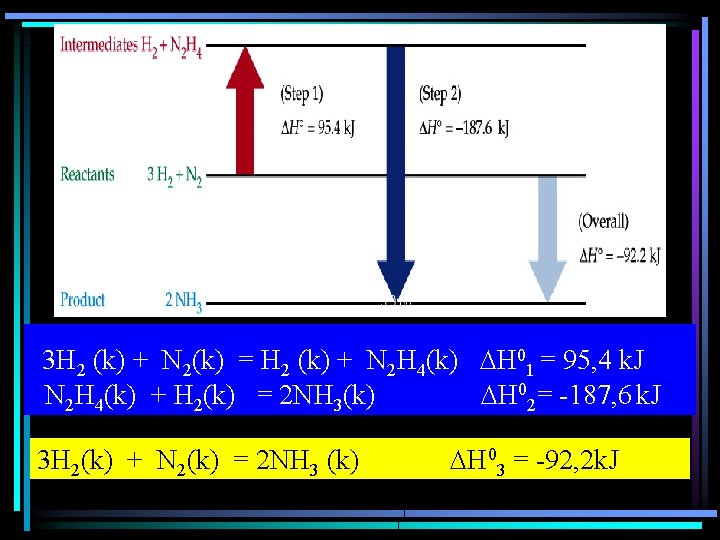
3 H 2 (k) + N 2(k) = H 2 (k) + N 2 H 4(k) H 01 = 95, 4 k. J N 2 H 4(k) + H 2(k) = 2 NH 3(k) H 02= -187, 6 k. J 3 H 2(k) + N 2(k) = 2 NH 3 (k) H 03 = -92, 2 k. J

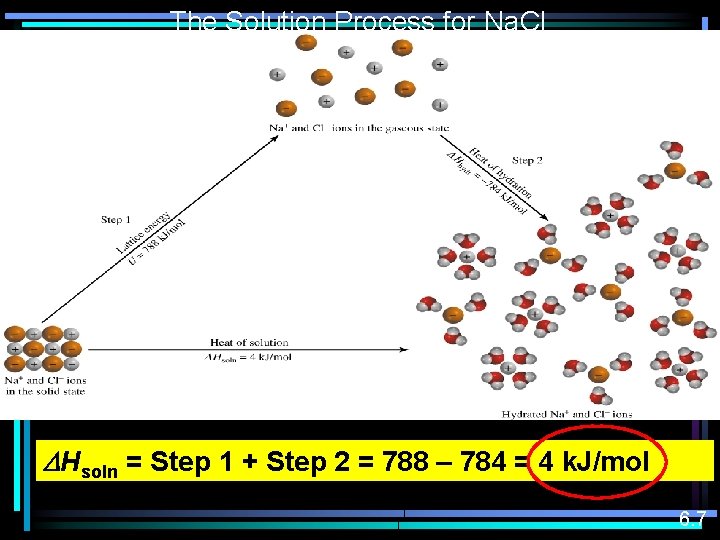
The Solution Process for Na. Cl DHsoln = Step 1 + Step 2 = 788 – 784 = 4 k. J/mol 6. 7

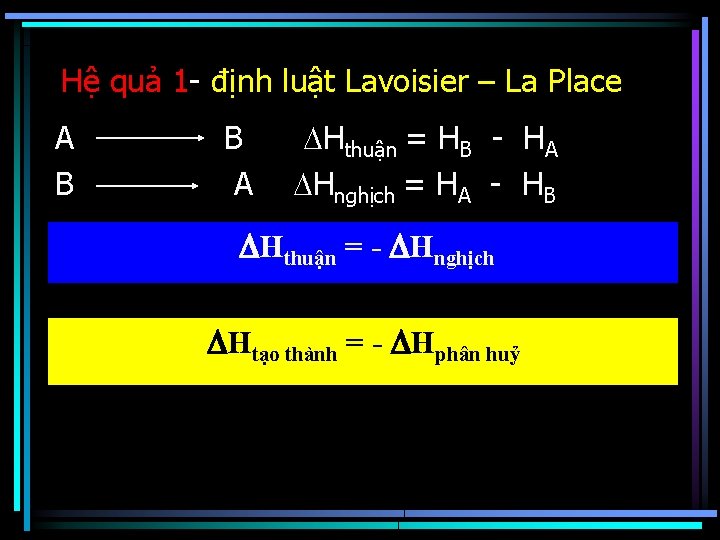
Hệ quả 1 - định luật Lavoisier – La Place A B B A Hthuận = HB - HA Hnghịch = HA - HB Hthuận = - Hnghịch Htạo thành = - Hphân huỷ

Hệ qủa 2. Chu trình Born - Haber Na. Cl (r) Um= ? ? ? -( H 0298)tt Na. Cl Na(r) + 1/2 Cl 2(k) ( H 0298)th Na Na+(k) + Cl-(k) I 1 Na FCl Na (k) + Cl (k) 1/2( H 0298)pl Cl 2 Um= -( H 0298)tt Na. Cl + ( H 0298)th Na+1/2 ( H 0298)pl. Cl 2 + I 1 Na + FCl


a. A + b. B = c. C + d. D ; H°pư = [c H°tt (C) + d H°tt (D)] – [a H°tt (A) + b H°tt (B)] CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (l) H° = ( H°tt CO 2 + 2 H°tt H 2 O) ( H°tt CH 4 + 2 H°tt O 2) = (-394 + 2 x -286) – (-75 + 0) = (-1066) – (-75) = -891 k. J/mol

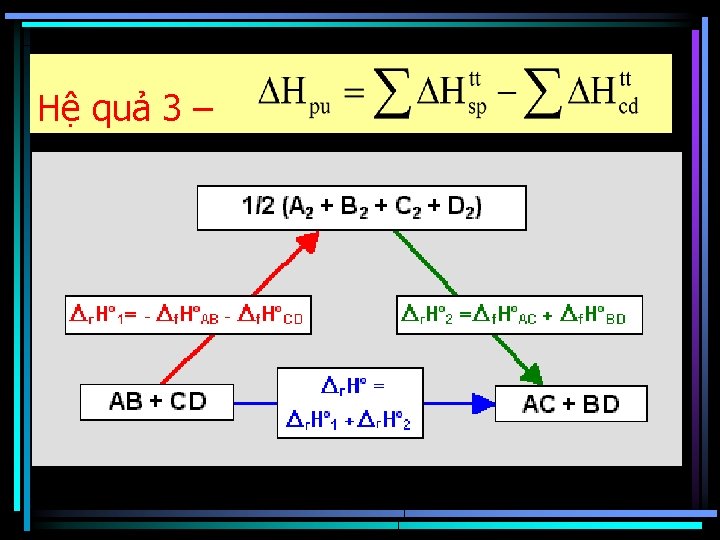
Hệ quả 4 C(gr) + ½ O 2(k) = CO(k) H 0298 = ? C(gr) + O 2(k) = CO 2(k) , ( H 0298)đc = - 393. 5 k. J/mol CO 2(k) = CO(k) + ½O 2(k), - ( H 0298)đc = +283. 0 k. J/mol C(gr) + ½ O 2(k) = CO(k) H 0298 = ( H 0298)đc. C - ( H 0298)đc CO=-110, 5 k. J


Hệ quả 5 - Hpư = (Elk)cđ - (Elk)sp Hpư = (Elk)đứt - (Elk)tt H-H(k) + Cl-Cl(k) Elk. H 2 Elk. Cl 2 H 0298 = ? → 2 H-Cl(k) -2 Elk. HCl 2 H(k) + 2 Cl(k) H 0298 = [Elk(H 2 )+Elk(Cl 2)] – [2 Elk(HCl)] Các chất trong phản ứng ở trạng thái khí


Calculate H° (in kilojoules) for: C 2 H 4 ( g ) + H 2 O ( g ) C 2 H 5 OH (g) H = D (Bonds Broken) – D (Bonds Formed) = (H-O + C=C) - (H-C + C-O + C-C) =

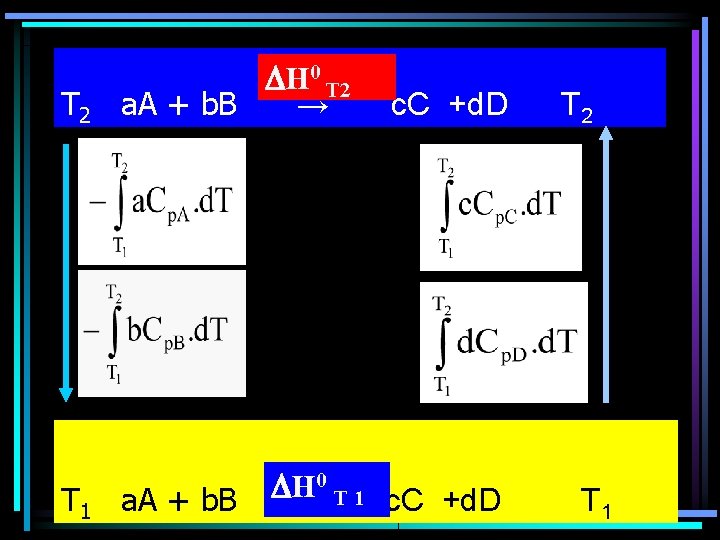
T 2 H 0 T 2 a. A + b. B → T 1 a. A + b. B c. C +d. D H 0→T 1 c. C +d. D T 2 T 1

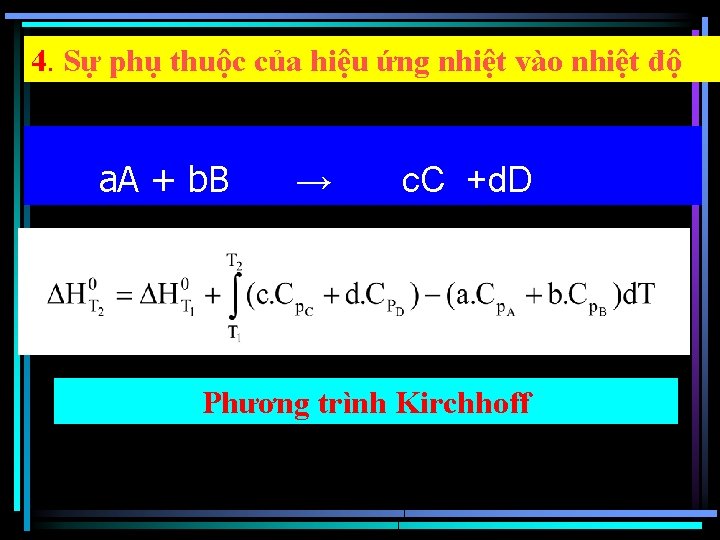
4. Sự phụ thuộc của hiệu ứng nhiệt vào nhiệt độ a. A + b. B → c. C +d. D Phương trình Kirchhoff

Phương trình Kirchhoff , khi Cp f(T) H thay đổi theo nhiệt độ không nhiều
 Chng finance
Chng finance Kirchhoff's law enthalpy example
Kirchhoff's law enthalpy example Thermochemistry equations
Thermochemistry equations Hess law constant heat summation
Hess law constant heat summation How to calculate the heat absorbed
How to calculate the heat absorbed Nn
Nn Thermochemistry
Thermochemistry Ilmu kimia yang mempelajari tentang kalor / panas adalah
Ilmu kimia yang mempelajari tentang kalor / panas adalah Thermodynamics ap chemistry
Thermodynamics ap chemistry Specific heat chem worksheet 16-1
Specific heat chem worksheet 16-1 Thermochemistry clipart
Thermochemistry clipart Chapter 17 thermochemistry practice problems
Chapter 17 thermochemistry practice problems Thermochemistry intro and joule conversions
Thermochemistry intro and joule conversions Energy diagram thermochemistry
Energy diagram thermochemistry Science form 3 chapter 5 exercise with answers
Science form 3 chapter 5 exercise with answers Chapter 17 thermochemistry
Chapter 17 thermochemistry Symbolic border one pager
Symbolic border one pager Thermochemistry
Thermochemistry Thermochemistry notes
Thermochemistry notes Why are chemists interested in studying thermochemistry?
Why are chemists interested in studying thermochemistry? Thermochemistry review
Thermochemistry review Thermochemistry concepts
Thermochemistry concepts What is thermochemistry
What is thermochemistry Ap chem unit 7
Ap chem unit 7 Chemistry semester 2 review unit 12 thermochemistry
Chemistry semester 2 review unit 12 thermochemistry Thermochemistry is the study of
Thermochemistry is the study of Thermochemistry
Thermochemistry Thermochemistry is concerned with the
Thermochemistry is concerned with the Study of energy and its transformations
Study of energy and its transformations Thermochemical equation examples
Thermochemical equation examples Thermochemistry equations
Thermochemistry equations Thermochemistry gaussian
Thermochemistry gaussian Chapter 6 thermochemistry
Chapter 6 thermochemistry Bomb calorimetry equation
Bomb calorimetry equation What is thermochemistry
What is thermochemistry Ap chemistry unit 9
Ap chemistry unit 9 Thermochemistry is the study of *
Thermochemistry is the study of * Thermochemistry is concerned with the study of
Thermochemistry is concerned with the study of Thermochemistry
Thermochemistry Thermochemistry is concerned with the study of
Thermochemistry is concerned with the study of Thermochemistry exam review
Thermochemistry exam review Kinetic energy thermochemistry
Kinetic energy thermochemistry Chapter 17 thermochemistry answer key
Chapter 17 thermochemistry answer key Thermochemistry cartoon
Thermochemistry cartoon Thermochemistry equations
Thermochemistry equations Chapter 17 thermochemistry
Chapter 17 thermochemistry Gibbs free energy unit
Gibbs free energy unit Thermochemistry video
Thermochemistry video Quiz 2: heat flow and technology
Quiz 2: heat flow and technology Thermochemistry is study of
Thermochemistry is study of General chemistry thermochemistry
General chemistry thermochemistry