CHNG 6 NHIET ONG LC HOA HOC 7
























































- Slides: 62

CHÖÔNG 6 NHIEÄT ÑOÄNG LÖÏC HOÙA HOÏC (7 tiết) 1

MỤC TIÊU CỦA NHIỆT ĐỘNG HỌC • Nghiên cứu các quy luật về sự biến chuyển tương hỗ của hóa năng và các dạng năng lượng khác trong các quá trình hóa học. • Nghiên cứu các điều kiện tự diễn biến (phản ứng hóa học) và các điều kiện bền vững (trạng thái cân bằng) của các hệ hóa học. 2

6. 1. Đối tượng nghiên cứu Một trong những tính chất không thể tách rời của vật chất là sự chuyển động và thöôùc ño söï chuyeån ñoäng cuûa caùc chaát laø naêng löôïng. Nhieät ñoäng löïc hoïc (NĐLH) - Nhieät ñoäng hoïc: khoa hoïc veà söï chuyeån bieán töông hoã cuûa caùc daïng naêng löôïng (NL) khaùc nhau; nghieân cöùu nhöõng quy luaät NL (lyù thuyeát naêng löôïng) veà caùc quaù trình chuyeån ñoäng cuûa vaät chaát. Cô sôû cuûa nhieät ñoäng löïc hoïc laø 3 nguyeân lyù I, III trong ñoù nguyeân lyù I, II laø hai nguyeân lyù quan troïng. 3

Vieäc aùp duïng nhieät ñoäng lực hoïc vaøo hoùa hoïc laøm xuaát hieän moät lónh vöïc khoa hoïc ñoäc laäp laø nhieät ñoäng hoùa hoïc Nhieät ñoäng hoùa hoïc được xây dựng dựa trên các định luật của nhiệt động học, nghieân cöùu söï biến đổi naêng löôïng (NL) trong các phản ứng hóa học và các quá trình chuyển pha (hòa tan, bay hơi, …) bao gồm nhiệt hóa học, lí thuyết về các dung dịch, … Nhiệt hóa học mà cơ sở lí thuyết là nguyên lí I của nhiệt động học, là lĩnh vực hóa học nghiên cứu hiệu ứng nhiệt của các quá trình hóa học. Dựa trên hiệu ứng nhiệt có thể xác định: §NL liên kết (giúp hiểu được cấu tạo và khả năng tương tác của các chất). § Chiều diễn ra của caùc quaù trình hoùa hoïc (ở đkiện bình thường). §Tính toán caân baèng nhiệt cho các quá trình kỹ thuật. 4

6. 2. MỘT SỐ KHÁI NIỆM CƠ BẢN 6. 2. 1. Heä vaø moâi tröôøng: § Heä laø taäp hôïp caùc vaät theå xaùc ñònh trong khoâng gian naøo ñoù vaø phaàn coøn laïi xung quanh laø moâi tröôøng § Đ/v hóa học, hệ laø löôïng nhaát ñònh cuûa moät hay nhieàu chaát ôû ñieàu kieän nhieät ñoä, aùp suaát, noàng ñoä naøo ñoù Các loại hệ: *Heä kín: là hệ chæ coù söï trao ñoåi NLvôùi moâi tröôøng beân ngoaøi *Heä hôû: laø heä coù söï trao ñoåi chaát vaø NL vôùi moâi tröôøng beân ngoaøi * Heä coâ laäp: laø heä khoâng coù söï trao ñoåi chaát hoaëc NL vôùi moâi tröôøng beân ngoaøi. * Hệ đoạn nhiệt: hệ không trao đổi chất và nhiệt, nhưng có thể trao đổi công với môi trường. Hệ cô lập bao giờ cũng đoạn nhiệt. 5

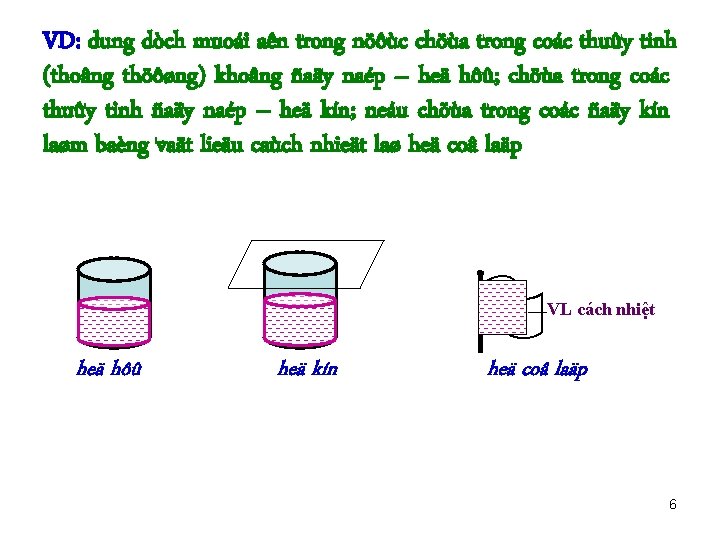
VD: dung dòch muoái aên trong nöôùc chöùa trong coác thuûy tinh (thoâng thöôøng) khoâng ñaäy naép – heä hôû; chöùa trong coác thuûy tinh ñaäy naép – heä kín; neáu chöùa trong coác ñaäy kín laøm baèng vaät lieäu caùch nhieät laø heä coâ laäp VL cách nhiệt heä hôû heä kín heä coâ laäp 6

Heä ñoàng theå: heä coù caùc tính chaát lyù hoùa gioáng nhau ôû moïi ñieåm cuûa heä (nghóa laø khoâng coù beà maët phaân chia heä thaønh nhöõng phaàn coù tính chaát hoùa lyù khaùc nhau) Heä dò theå: trong heä coù beà maët phaân chia VD: Nếu hệ hóa học muối ăn trong nước là dung dịch trong suốt - hệ đồng thể và nếu trong hệ, ngoài dung dịch muối ăn còn chứa các tinh thể muối ăn - hệ dị thể. Pha: phaàn ñoàng theå cuûa heä dò theå, coù thaønh phaàn caáu taïo, tính chaát nhaát ñònh vaø ñöôïc phaân chia vôùi caùc phaàn khaùc baèng beà maët phaân chia naøo ñoù. Hệ ñoàng theå - hệ một pha, hệ dị thể - hệ nhiều pha VD: Hệ gồm nước đá và nước lỏng là hệ dị thể, gồm nước đá (pha rắn) và nước lỏng (pha lỏng) Heä caân baèng: heä coù nhieät ñoä, aùp suaát, thaønh phaàn gioáng nhau ôû moïi ñieåm cuûa heä vaø khoâng thay ñoåi theo thôøi gian 7

6. 1. 2. Traïng thaùi nhieät ñoäng cuûa heä, thoâng soá traïng thaùi, haøm traïng thaùi: Traïng thaùi – TT (vó moâ) cuûa heä ñöôïc xaùc ñònh baèng taäp hôïp caùc thoâng soá bieåu dieãn caùc tính chaát lyù hoùa cuûa heä nhö nhieät ñoä, aùp suaát, theå tích, thaønh phaàn, naêng löôïng, … Thoâng soá dung ñoä: laø nhöõng thoâng soá tyû leä vôùi löôïng chaát nhö theå tích, khoái löôïng, soá mol, … Với hệ lý tưởng có cộng tính, nghiã là dung độ của cả hệ thống bằng dung độ các hợp phần. Thoâng soá cöôøng ñoä: laø nhöõng thoâng soá khoâng phuï thuoäc vaøo löôïng chaát nhö nhieät ñoä, aùp suaát, thaønh phaàn, khoái löôïng rieâng, … Trạng thái cân bằng là TT tương ứng với hệ CB (khi các thông số TT giống nhau ở mọi điểm của hệ và không thay đổi theo thời gian). 8

6. 1. 3. Haøm traïng thaùi, phöông trình traïng thaùi cuûa khí LT ØHaøm traïng thaùi: laø ñaïi löôïng nhieät ñoäng coù giaù trò § chæ phuï thuoäc vaøo caùc thoâng soá traïng thaùi cuûa heä; § khoâng phuï thuoäc vaøo ñöôøng ñi cuûa heä (caùch bieán ñoåi cuûa heä) Ø Phöông trình traïng thaùi cuûa khí lyù töôûng: PV = n. RT § P (áp suất), § U (nội năng), § V (thể tích), § H (entanpi), § T(nhiệt độ), laø nhöõng haøm traïng thaùi. § S (entropi), § G (theá ñaúng aùp), …. 9

6. 1. 4. Quaù trình – haøm quaù trình: a. Quaù trình: laø sự bieán ñoåi xảy ra trong hệ gắn liền với sự thay đổi của (ít nhất) là một thông số traïng thaùi. Quaù trình xảy ra ở đk: P = const (ñaúng aùp); T = const (ñaúng nhieät); V = const (ñaúng tích); Q = 0 (ñoaïn nhieät). + Quaù trình töï dieãn bieán + Quaù trình khoâng töï dieãn bieán + Quaù trình thuaän nghòch + Quaù trình baát thuaän nghòch + Quaù trình caân baèng b. Haøm quaù trình: haøm soá phuï thuoäc vaøo con ñöôøng tieán haønh. VD: nhiệt, công, … 10

6. 1. 5. Năng lượng, nhiệt và công: Bất kỳ quá trình nào xảy ra cũng luôn có kèm theo sự trao đổi NL của hệ với môi trường bên ngoài Nhiệt và công chính là 2 hình thức trao đổi NL đó của hệ và môi trường v Nhiệt (NL truyền dưới dạng nhiệt), được thực hiện khi hệ tiếp xúc nhiệt với môi trường sự CB nhiệt độ. Nhiệt là dạng truyền NL vô hướng, không có trật tự, được thực hiện qua chuyển động nhiệt hỗn loạn. Công (NL truyền dưới dạng công), được thực hiện khi hệ tiếp xúc cơ học với môi trường. Công là dạng truyền NL có hướng, có trật tự, được truyền từ hệ thực hiện công đến hệ nhận công. 11

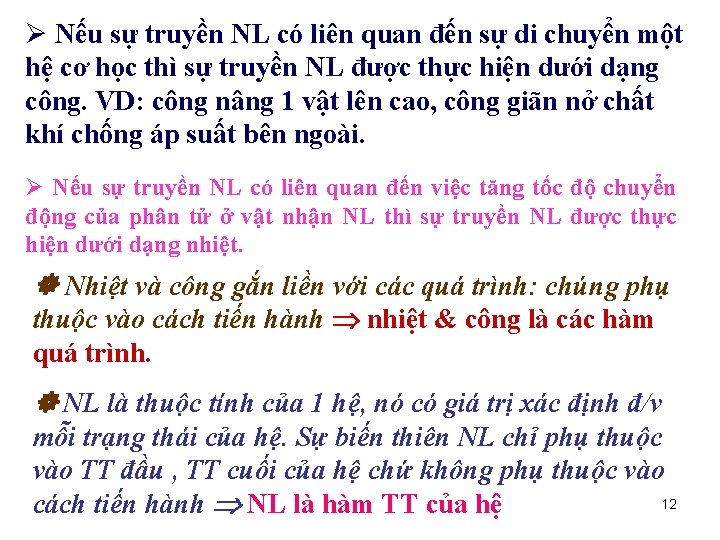
Ø Nếu sự truyền NL có liên quan đến sự di chuyển một hệ cơ học thì sự truyền NL được thực hiện dưới dạng công. VD: công nâng 1 vật lên cao, công giãn nở chất khí chống áp suất bên ngoài. Ø Nếu sự truyền NL có liên quan đến việc tăng tốc độ chuyển động của phân tử ở vật nhận NL thì sự truyền NL được thực hiện dưới dạng nhiệt. Nhiệt và công gắn liền với các quá trình: chúng phụ thuộc vào cách tiến hành nhiệt & công là các hàm quá trình. NL là thuộc tính của 1 hệ, nó có giá trị xác định đ/v mỗi trạng thái của hệ. Sự biến thiên NL chỉ phụ thuộc vào TT đầu , TT cuối của hệ chứ không phụ thuộc vào 12 cách tiến hành NL là hàm TT của hệ

Có thể định nghĩa: Ø NL là thước đo sự chuyển động của các chất. Ø Nhiệt là thước đo sự chuyển động nhiệt hỗn loạn của các tiểu phân tạo nên hệ. Ø Công là thước đo sự chuyển động có trật tự, có hướng của các tiểu phân trong trường lực. A = P(V 2 –V 1) 13

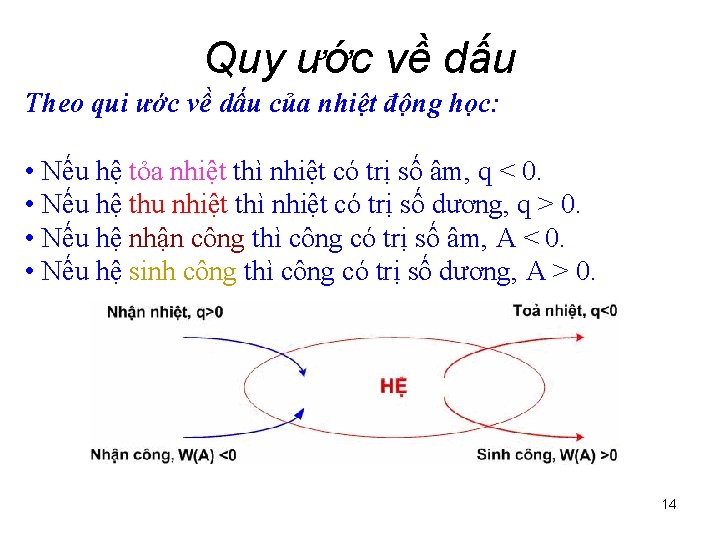
Quy ước về dấu Theo qui ước về dấu của nhiệt động học: • Nếu hệ tỏa nhiệt thì nhiệt có trị số âm, q < 0. • Nếu hệ thu nhiệt thì nhiệt có trị số dương, q > 0. • Nếu hệ nhận công thì công có trị số âm, A < 0. • Nếu hệ sinh công thì công có trị số dương, A > 0. 14

Các đơn vị quốc tế đo lường về năng lượng Jun (hệ SI- J) 1 N x 1 m = 107 erg; 1 N= 105 dyn Erg (CGS) 1 erg = 1 dynx 1 cm = 10 -7 J; 1 dyn = 10 -5 N Calori (cal) 1 cal = 4, 184 J = 4, 184. 107 erg Electronvon (e. V) 1 e. V = 1, 602. 10 -19 J= 1, 602. 10 -12 erg = 23061 cal 15

6. 2. NGUYÊN LÍ I VÀ HIEÄU ÖÙNG NHIEÄT: 6. 2. 1. Nguyên lí I và noäi naêng, công, hiệu ứng nhiệt: Nguyeân lyù I laø ñònh luaät baûo toaøn NL: ÔÛ ñieàu kieän nhieät ñoä, aùp suaát khoâng ñoåi, NL cuûa heä luoân ñöôïc baûo toaøn. Trong moïi quaù trình, daïng NL naøy maát ñi bao nhieâu thì daïng NL khaùc hình thaønh baáy nhieâu, Neáu ta cung caáp cho heä moät löôïng nhieät laø Q ñeå dòch chuyeån heä töø traïng thaùi 1 sang traïng thaùi 2 thì löôïng nhieät naøy moät phaàn sinh coâng A, moät phaàn laøm bieán ñoåi noäi naêng cuûa heä Bieåu thöùc toaùn hoïc cuûa nguyeân lyù I: Q = A + U hay U = Q - A “Độ tăng nội năng U = U 2 - U 1 của hệ đúng bằng phần NL chuyển từ ngoài vào hệ dưới dạng nhiệt Q trừ phần NL chuyển từ hệ ra ngoài dưới dạng công A” 16

Nội năng U NL toaøn phaàn E cuûa heä bao gồm: ñoäng naêng của toàn hệ Eđ theá naêng của toàn hệ Et noäi naêng U của hệ E = Eđ + E t + U Nếu hệ không chuyển động, tương tác của môi trường đ/v hệ nhỏ và không đổi thì: E = 0, E = 0 E = U đ t Nội năng của hệ chỉ bao gồm động năng của các tiểu phân và thế năng tương tác giữa các tiểu phân trong hệ. Nội năng là: tính chất của hệ, U (kcal/ mol; k. J/mol) đại lượng NL xác định TT của hệ, thông số dung độ (tỉ lệ với lượng chất), hàm trạng thái. Độ biến đổi nội năng của hệ khi chuyển từ TT 1 (U 1) TT 2 (U 2) U = U 2 - U 1 17

Ñaëc ñieåm: U laø moät haøm traïng thaùi, bieán ñoåi haøm traïng thaùi : U > 0: noäi naêng cuûa heä taêng, heä noùng leân U < 0: noäi naêng cuûa heä giaûm Nội năng của hệ nói chung phụ thuộc vào bản chất, lượng chất, nhiệt độ, áp suất, thể tích và thành phần, nhưng đ/v hệ gồm n mol khí lý tưởng, nội năng chỉ phụ thuộc vào nhiệt độ vì áp suất và thể tích không ảnh hưởng lên thế năng của các hạt. 18

c. Coâng A: laø moät hình thaùi truyeàn naêng löôïng gaén lieàn vôùi söï thay ñoåi theå tích cuûa heä. Ñôn vò: kcal/ mol, k. J/ mol Công A là công mà hệ thực hiện được trong quá trình hệ chuyển từ TT 1 TT 2 để chống lại các lực từ bên ngoài tác dụng lên hệ như: áp suất, điện trường, từ trường, sức căng bề mặt, … Đ/v các quá trình hóa học công A chủ yếu là công dãn nở (công cơ học) chống lại áp suất bên ngoài được tính theo bieåu thöùc V 2 A > 0: heä sinh coâng 2 A < 0: heä nhaän coâng A = Pd. V P: aùp suaát ngoaøi, atm V 1 1 ò ò § Quá trình đẳng tích: vì V = const A = 0. § Quá trình đẳng áp: vì P = const A = P (V 2 – V 1) = P V n mol khí lí tưởng: A = P V = n. R T § Quá trình đẳng nhiệt (đ/v hệ khí lí tưởng): V 2 ò V 2 = n. RTln P Pd. V = n. RTln 1 vì T= const và P 1 V 1 = P 2 V 2 A = V 1 P 19 V 1 2

6. 2. 2. Các quá trình đẳng tích, đẳng áp và nội năng, entanpi, hiệu ứng nhiệt: Áp dụng nguyên lý 1 xét các quá trình đẳng tích, đẳng áp: a. Quá trình đẳng tích: nội năng & nhiệt đẳng tích Vì V= const d. V = 0 A = 0 Qv = U = CV. To Qv: nhiệt đẳng tích; CV : nhieät dung mol thöïc ñaúng tích (J/ mol. ñoä ; cal/ mol. ñoä) Như vậy trong quá trình đẳng tích: nhiệt năng thu vào dùng để tăng nội năng U của hệ. 20

b. Quá trình đẳng áp: entanpi & nhiệt đẳng áp: Vì P = const A= P V = P(V 2 – V 1) = n. R (T 2 – T 1) Qp = U + P V = (U 2 + PV 2) - (U 1 + PV 1) Đặt: U + PV = H QP = H 2 – H 1 = Hp § U: haøm traïng thaùi § H: haøm entanpi Entanpi § H: độ biến đổi entanpi. § Qp: nhiệt đẳng áp là: * tính chất của hệ, như : P, T, V, U, …. * đại lượng NL xác định trạng thái của hệ, * thông số dung độ, * hàm trạng thái. Trong quá trình đẳng áp: lượng nhiệt thu vào (hay tỏa ra) đúng bằng sự tăng (hay giảm) entanpi của hệ 21

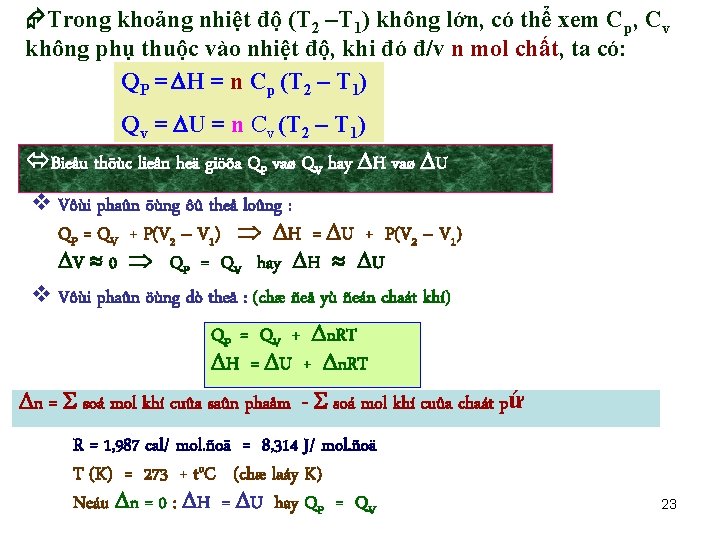
Nhiệt đẳng tích, nhiệt đẳng áp và nhiệt dung: Nhiệt dung của một chất là lượng nhiệt cần dùng để nâng nhiệt độ của chất đó lên 10. Nhiệt dung của: 1 g chất được gọi là nhiệt dung riêng hay tỉ nhiệt, ¡ 1 mol chất được gọi là nhiệt dung mol (nguyeân töû , phaân töû). v Đ/v khí lý tưởng: Cp = Cv + R Ø R: hằng số khí , có gía trị 8, 314 J/mol. độ, hoặc 1, 987 cal/mol. độ d. Q d. H Ø Nhiệt dung mol đẳng áp (J/mol. độ): Cp = d. T d. Qv d. U ØNhiệt dung mol đẳng tích (J/mol. độ): Cv= = d. T § Đ/v khí thực, hiệu số Cp – Cv R § Đ/v chất rắn và lỏng Cp và Cv có gía trị gần bằng nhau. 22

Trong khoảng nhiệt độ (T 2 –T 1) không lớn, có thể xem Cp, Cv không phụ thuộc vào nhiệt độ, khi đó đ/v n mol chất, ta có: QP = H = n Cp (T 2 – T 1) Qv = U = n Cv (T 2 – T 1) Bieåu thöùc lieân heä giöõa QP vaø QV hay H vaø U v Vôùi phaûn öùng ôû theå loûng : QP = QV + P(V 2 – V 1) H = U + P(V 2 – V 1) V 0 QP = QV hay H U v Vôùi phaûn öùng dò theå : (chæ ñeå yù ñeán chaát khí) QP = QV + n. RT H = U + n. RT n = soá mol khí cuûa saûn phaåm - soá mol khí cuûa chaát pứ R = 1, 987 cal/ mol. ñoä = 8, 314 J/ mol. ñoä T (K) = 273 + to. C (chæ laáy K) Neáu n = 0 : H = U hay QP = QV 23

VD 1: Cho phaûn öùng ÔÛ 25 o. C coù QP = - 94, 1 kcal/ mol. Tính QV cuûa pö ôû nhieät ñoä treân? Giaûi : QP = QV + n. RT QV = QP - n. RT QV = QP = - 94, 1 kcal/ mol n = 1 – 1 = 0 VD 2 : ÔÛ 25 o. C coù QP = - 22 kcal. Tính QV cuûa pöù ôû nhieät ñoä treân? Giaûi : QP = QV + n. RT QV = QP - n. RT n = 2 – (3 + 1) = - 2 QV = - 22 – (-2). 1, 987. (25 + 273). 10 -3 = - 20, 82 kcal 24

VD 3: Hệ gồm 2 mol khí argon (Ar) được truyền một lượng nhiệt là 1, 00 k. J ở 250 C và 1 atm. Xác định nhiệt độ cuối Tc và độ biến đổi nội năng U của hệ trong 2 trường hợp: qúa trình xảy ra ở V = const và P = const. Biết Cv của Ar ở 250 C và 1 atm là 12, 47 J/mol. độ. Giải: v Ở điều kiện V = const Qv = U = n Cv (T 2 – T 1) ta có: U = Qv = 1000 J = n Cv (T 2 – T 1) 1000 = 2 x 12, 47 x (Tc - 298) Tc = 338, 1 K (40, 10 C) v Ở đk : P = const QP= H= n Cp (T 2 – T 1) vì Cp = Cv + R, ta có: 1000 = 2 x (12, 47+ 8, 314) x (Tc - 298) Tc = 322, 1 K (24, 10 C) U = 2 x 12, 47 x (322, 1 -298) = 600 J Độ chênh lệch 400 J giữa lượng nhiệt Qp hệ nhận và độ biến đổi U của hệ chính là lượng công A hệ thực hiện được trong quá trình dãn nở khí Ar 25

c. Nội năng, entanpi và hiệu ứng nhiệt: v Ñònh nghóa: löôïng nhieät toûa ra hay thu vaøo cuûa moät quaù trình hoùa hoïc ñöôïc goïi laø hieäu öùng nhieät cuûa quaù trình H < 0: phaûn öùng toûa nhieät H > 0: phaûn öùng thu nhieät Hieäu öùng nhieät ñöôïc xác định bằng: óđộ biến đổi entanpi H (hiệu ứng nhiệt đẳng áp)* Lượng nhiệt thu vào (hay tỏa ra) đúng bằng sự tăng (hay giảm) entanpi của hệ. hoaëc óđộ biến đổi nội năng U (hiệu ứng nhiệt đẳng tích) Sự tăng (hay giảm) nội năng của hệ đúng bằng nhiệt lượng hệ thu vào (hay phát ra) 26

6. 2. 3. Hiệu ứng nhiệt của các phản ứng hóa học: Nhiệt lượng tỏa ra hay hấp thụ của một phản ứng hóa học được gọi là hiệu ứng nhiệt phản ứng Đ/v những quá trình hóa học, hiệu ứng nhiệt thường được xác định bằng H vì các pứ hóa học thường xảy ra ở áp suất không đổi § Pứ chỉ có chất rắn & chất lỏng tham gia H U do V 0 § Pứ có chất khí tham gia: H = U + P V = U + n RT n: hiệu số giữa số mol của các sản phẩm khí với số mol của các chất pứ khí § Khi n = 0 H = U; § Khi n 0 H U một đại lượng n RT 27

Ø Hiệu ứng nhiệt: là đại lượng dung độ, không phụ thuộc vào đường đi của phản ứng, trong khoảng nhiệt độ không quá lớn có thể xem như không thay đổi theo nhiệt độ. ØHiệu ứng nhiệt tiêu chuẩn: tương ứng điều kiện chuẩn là áp suất 1 atm, nhiệt độ thường lấy là 250 C và thường tính đ/v 1 mol chất: ký hiệu H 0. Các đại lượng nhiệt tạo thành và nhiệt đốt cháy: v Nhiệt tạo thành là hiệu ứng nhiệt của pứ tạo thành 1 mol chất từ các đơn chất ở trạng thái tự do bền vững nhất. Ho 298(TT) (kcal/ mol; k. J/ mol); Ho 298(TT) ñôn chaát = 0 VD: Al (r), C (graphit), Cl 2 (k), … có H 0 tt 298 = 0 C O 2 (k ) VD: C (g r) + O 2 (k ) o o / mol , kcal 94, 1 H H = = 298 (TT 298 pö - ) CO ( k ) 2 H 2(k) + 1/2 O 2(k) H 2 O (l) Htt (H 2 O) = - 68, 32 kcal 28

v Nhiệt phân hủy một hợp chất là hiệu ứng nhiệt của pứ phân hủy 1 mol chất đó thành các đơn chất H 2 O (l) H 2 (k) + ½ O 2 (k) Hoph = + 68, 32 kcal/ mol v Nhiệt đốt cháy là hiệu ứng nhiệt của pứ đốt cháy bằng oxy một mol chất hữu cơ để tạo thành khí CO 2, nước lỏng và một số sản phẩm khác. Nhiệt đốt cháy tiêu chuẩn: H 0đc 298 (kcal/ mol ; k. J/ mol) VD: o o H 94 , 1 kcal / mol H 298 pö = = 298 ( TT ) CO 2 ( k ) o H = 298 ( ñc ) C ( gr ) VD : H 2 (k) + ½ O 2 (k) H 2 O (l) Hopö = - 68, 32 kcal/ mol = Hopö VD: = - 26, 42 kcal/ mol Ho 298(ñc) C (do chöa taïo thaønh oxit cao nhaát) 29

6. 2. 4. Phương trình nhiệt hóa học bao goàm: + Traïng thaùi cuûa caùc chaát: raén (r), loûng (l), khí (k), dung dịch (d), graphit (gr) + Ñieàu kieän pứ: P, t 0 (tại đó xác định giá trị entanpi) + Nhieät löôïng trao đổi: dấu - với pứ phát nhiệt (entanpi giảm), có khả năng tự xảy ra dấu + với pứ thu nhiệt (entanpi tăng), không thể tự xảy ra + Hệ số của phương trình Ñeå thuaän tieän cho vieäc tính toaùn vaø so saùnh ñöa veà ñieàu kieän chuaån: P = 1 atm, to = 25 o. C (298 K), khoái löôïng caùc chaát baèng 1 ñôn vò VD: Zn (r) + 2 HCl (d) = Zn. Cl 2 (d) + H 2 (k) , H 0298 = - 36, 5 kcal/mol 30

6. 4. CAÙC ÑÒNH LUAÄT NHIEÄT HOÙA HỌC VÀ HỆ QUẢ: 6. 4. 1. Ñònh luaät Lavoisier – Laplace: Löôïng nhieät ñöôïc haáp thuï khi moät chaát phaân huûy thaønh caùc nguyeân toá baèng löôïng nhieät phaùt ra khi taïo thaønh hôïp chaát ñoù töø caùc nguyeân toá Nhiệt tạo thành và nhiệt phân hủy của một hợp chất bằng nhau về giá trị và trái dấu VD: Ho 298 pö = Ho 298 ph = 94, 1 kcal/ mol Ho 298 pö = Ho 298 tt. CO 2 = - 94, 1 kcal/ mol 31

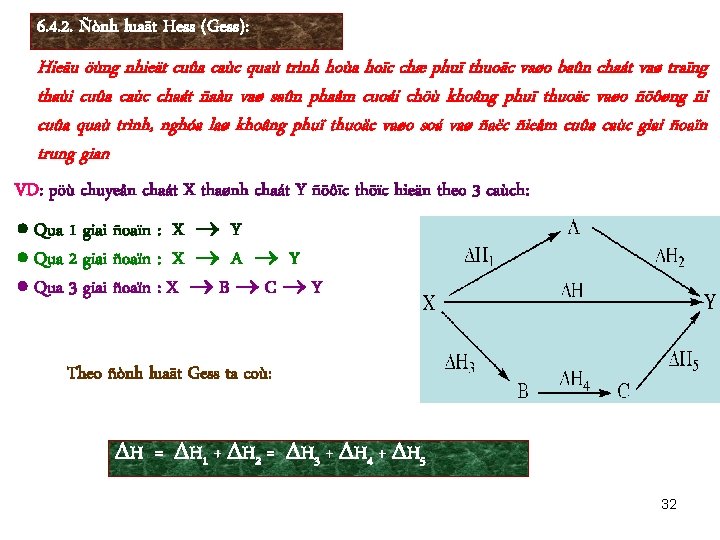
6. 4. 2. Ñònh luaät Hess (Gess): Hieäu öùng nhieät cuûa caùc quaù trình hoùa hoïc chæ phuï thuoäc vaøo baûn chaát vaø traïng thaùi cuûa caùc chaát ñaàu vaø saûn phaåm cuoái chöù khoâng phuï thuoäc vaøo ñöôøng ñi cuûa quaù trình, nghóa laø khoâng phuï thuoäc vaøo soá vaø ñaëc ñieåm cuûa caùc giai ñoaïn trung gian VD: pöù chuyeån chaát X thaønh chaát Y ñöôïc thöïc hieän theo 3 caùch: Qua 1 giai ñoaïn : X Y Qua 2 giai ñoaïn : X A Y Qua 3 giai ñoaïn : X B C Y Theo ñònh luaät Gess ta coù: H = H 1 + H 2 = H 3 + H 4 + H 5 32

VD: Có nhiều cách để chuyển hóa: 1 mol Na + ½ mol H 2 + ½ mol O 2 1 mol Na. OH Tuy nhiên hiệu ứng nhiệt tổng cộng theo bất kỳ cách nào cũng bằng: H = - 102, 0 kcal. v Cách 1: Na (r) + ½ O 2 (k) ½ Na 2 O 2 (r) H 1 = - 60, 3 kcal ½ H 2 (k) + ¼ O 2 (k) ½ H 2 O (l) H 2 = - 34, 1 kcal ½ Na 2 O 2 + ½ H 2 O (l) Na. OH (r) + ¼ O 2 H 3 = - 7, 6 kcal Tổng cộng: Na (r) + ½ H 2 (k) + ½ O 2 (k) Na. OH (r) H = ? H = - 60, 3 - 34, 1 - 7, 6 = - 102, 0 kcal v Cách 2: H 2 (k) + ½ O 2 (k) H 2 O (l) H 1 = - 68, 3 kcal Na (r) + H 2 O (l) Na. OH (r) + ½ H 2 (k) H 2 = - 33, 7 kcal Tổng cộng: Na (r) + ½ H 2 + ½ O 2 Na. OH (r) H = ? H = - 68, 3 - 33, 7 = - 102, 0 kcal 33

6. 4. 3. Heä quaû cuûa ñònh luaät Hess: Heä quaû 1: Hieäu öùng nhieät phaûn öùng baèng toång nhieät taïo thaønh cuûa caùc saûn phaåm tröø ñi toång nhieät taïo thaønh cuûa caùc chaát ñaàu Heä quaû 2: Hieäu öùng nhieät phaûn öùng baèng toång nhieät ñoát chaùy cuûa caùc chaát ñaàu tröø ñi toång nhieät ñoát chaùy cuûa caùc saûn phaåm pứ. o H 298 pö = å H o 298(tt)sp 2 o - å H 298(tt) Chaát đầu o - å H o = å H 298 ( ñc ) Chaát đầu 298 ( ñc )sp 2 VD: Đ/v pứ tổng quát: a. A + b. B c. C + d. D a, b, c, d : soá mol; A, B: chaát đầu và C, D: saûn phaåm 34

IV. 2. 6. Tính hiệu ứng nhiệt phản ứng hóa học: Cơ sở tính tóan là định luật Hess, các hệ quả, nhiệt tạo thành, nhiệt đốt cháy, … Tính hiệu ứng nhiệt ở điều kiện chuẩn: trong trường hợp này sử dụng nhiệt tạo thành, nhiệt đốt cháy, …tiêu chuẩn. VD 1: Xác định H 0298 của pứ: C (gr) + ½ O 2 (k) = CO (k) , biết: C (gr) + O 2 (k) = CO 2 (k) , H 0(1) = - 94, 1 kcal và CO (k) + ½ O 2 (k) = CO 2 (k) , H 0(2)= - 67, 64 kcal Từ sơ đồ chuyển hóa, theo định luật Hess: H 0(1) = H 0298 + H 0(2) H 0298 = H 0(1) - H 0(2) = -94, 1 + 67, 64 = -26, 46 kcal C (gr) H 0(1) H 0298 CO 2 (k) H 0(2) CO(k) 35

VD 2: Căn cứ vào gía trị nhiệt tạo thành tiêu chuẩn của Ca. CO 3, Ca. O, CO 2, tìm hiệu ứng nhiệt của pứ: Ca. CO 3 (r) Ca. O (r) + CO 2 (k) H = ? Htt -288, 5 -151, 9 -94, 1 (kcal) Giải: Hpứ = Htt (Ca. O) + Htt (CO 2) - Htt (Ca. CO 3) = -151, 9 – 94, 1 + 288, 5 = + 42, 5 kcal = + 177, 82 KJ/mol Ca. CO 3 là chất bền nhiệt ( pứ này không thể tự xảy ra), muốn nó xảy ra phải đốt nóng trên 6000 C VD 3: Tìm hiệu ứng nhiệt của pứ ester hóa sau: CH 3 COOH (l) + C 2 H 5 OH (l) CH 3 COOC 2 H 5(l) + H 2 O H = ? Hđc -208, 2 Giải: -326, 7 -545, 9 0 (kcal) H = - 208, 2 - 326, 7 + 545, 9 = + 11, 0 kcal 36

Tính hiệu ứng nhiệt ở điều kiện khác chuẩn: v. Tính gần đúng: Trong trường hợp này vẫn dựa vào đại lượng nhiệt tạo thành, đốt cháy , …. tiêu chuẩn để tính vì trong khoảng nhiệt độ không quá lớn có thể xem H không thay đổi theo nhiệt độ. v. Tính chính xác (theo nhiệt độ): dựa trên phương trình T 1 Kirchoff: òT H 2 = H 1 + Cp d. T Ø Cp = Cp(sp) - Cp (cđ) 2 (hiệu số nhiệt dung giữa nhiệt dung mol đẳng áp của các chất) Ø Cp : nhiệt dung đẳng áp. 37

Khi (T 2 – T 1) không quá lớn có thể xem Cp không phụ thuộc vào nhiệt độ. H 2 = H 1 + Cp (T 2 – T 1) VD: Tính H 398 của pứ: CO (k) + ½ O 2 = CO 2(k) Cp (cal/mol. độ) H 0298 (kcal/mol) 6, 97 -26, 42 7, 02 0 8, 88 -94, 10 § Gần đúng H 398 = H 0298 = - 94, 10 –(-26, 42) = - 67, 68 kcal/mol 7, 02 -3 § Chính xác: H 398 = [(8, 88 - 6, 97 - )(398 -298)] x 10 2 = - 67, 84 kcal/mol H 0298 + 38

Tính naêng löôïng lieân keát: Elieân keát Hopö = naêng löôïng ñöùt lkeát - naêng löôïng hình thaønh lkeát = H lk (tác chất) - Hlk (sản phẩm) H 2 (k) + Cl 2 (k) 2 HCl(l) Hopö = - 184, 2 k. J Tính NL liên kết trung bình EH-Cl? Bieát: EH-H = 453, 56 k. J/ mol ; ECl-Cl = 244, 51 k. J/ mol VD: Giải: Ho 298 pö = - 184, 2 = EH-H + ECl-Cl - 2 EH-Cl = 1/2(453, 56 + 244, 51 + 184, 2) = 431, 14 k. J/mol 39

Tính naêng löôïng maïng lưới tinh theå : U (kcal/ mol; k. J/ mol) Maïng tinh theå cuûa caùc chaát coù theå ñöôïc taïo thaønh töø: § nguyeân töû (kim cương, Si, Ge, khí hiếm, …) § phaân töû (H 2, O 2, N 2, X 2, H 2 O, CO 2, …. ) § hoaëc ion ( Na. Cl, Ca. F 2, …). Naêng löôïng mạng ion là NL tạo thành maïng tinh theå hợp chất từ các ion ở trạng thái khí. Naêng löôïng maïng nguyeân töû laø naêng löôïng taïo thaønh daïng tinh theå cuûa hôïp chaát töø caùc nguyeân töû töï do ôû thể khí 40

VD: NL maïng ion cuûa tinh theå muối ăn Na. Cl chính là hiệu ứng nhiệt của pứ: Na+ (k) + Cl- (k) Na. Cl (r) ; H 0 = ? Giải: §Nhiệt thăng hoa của Na: §NL lk Cl- Cl: Na (r) Na (k) H 1 = 20, 64 kcal ½ Cl 2 (k) Cl (k) H 2= ½ x 58 kcal §Ái lực với electron của clo: Cl (k) + e Cl- (k) H 3= - 83, 17 kcal §NL ion hóa Natri : §NLmạng ion: Na (k) – e Na+ (k) + Cl- (k) Na. Cl (r) H 4= +119, 98 kcal H 0 = ? Hiệu ứng nhiệt của pứ: Na (r)+ ½ Cl 2 (k) Na. Cl (r) H = - 98, 23 kcal Theo ĐL Hess ta có: H 1 + H 2 + H 3 + H 4 + H 0 = H 20, 64 + 1/2 x 58 + (-83, 17) + 119, 98 + H 0 = - 98, 23 H 0 = - 184, 68 kcal 41

6. 5. Nguyên lí II và chiều diễn ra của quá trình hóa học 6. 5. 1. Khái niệm về Entropi S Ña soá moïi quaù trình laø keát quaû cuûa 2 hieän töôïng: § Truyeàn naêng löôïng (töø heä coù T 0 cao ñeán heä coù T 0 thaáp) § Thay ñoåi traät töï saép xeáp giöõa caùc phaân töû, nguyeân tö, û ion: coù xu höôùng chuyeån ñoäng töø TT chuyeån ñoäng hoãn loaïn thaáp TT chuyeån ñoäng hoãn loaïn cao hôn Möùc ñoä chuyeån ñoäng hoãn loaïn cuûa heä ñöôïc ñaëc tröng baèng ñaïi löôïng entropi S (J/ mol. ñoä; cal/ mol. ñoä) VD: H 2 O ñaù H 2 O loûng S nhoû nhaát S taêng daàn heä seõ toàn taïi ôû S lôùn H 2 O hôi S lôùn nhaát 42

Các đặc điểm của entropi: § Laø tính chaát khaùc cuûa heä như: T 0, P, U, H, … laø ñaïi löôïng xaùc ñònh TT cuûa heä, laø ñaïi löôïng dung ñoä, laø haøm traïng thaùi. § Bản thân entropi S phụ thuộc mạnh vào nhiệt độ, nhưng độ biến đổi entropi S lại ít phụ thuộc vào nhiệt độ. § Entropi tiêu chuaån So 298 P = 1 atm; T = 298 K(250 C), khí là khí lý tưởng, dung dịch có nồng độ 1 đơn vị (1 mol/lít). § Đôn vò tính entropi: cal/mol. ñộ hay J/mol. ñoä (1 cal/mol. ñoä = 1 ñôn vò entropi (1 ñ. v. e) § Dựa trên entropi có thể xác định chiều xảy ra của quá trình trong hệ cô lập Trong heä coâ laäp: Q = 0 S = S 2 – S 1 0 Neáu S > 0 : quá trình tự xaûy ra theo chieàu thuaän S < 0 : pứ xaûy ra theo chieàu nghòch S = 0 : pứ ôû traïng thaùi caân baèng 43

Nguyeân lyù II – bieåu thöùc toaùn hoïc: ÔÛ 0 K ( - 273 o. C) heä ôû traïng thaùi oån ñònh nhaát (traät töï) Sähệ 0 Taêng T 0 cuûa heä caùc phaân töû seõ chuyeån ñoäng hoãn loaïn Sheä taêng Neáu cung caáp moät löôïng nhieät Q nhö nhau cho 2 heä ôû T 1 T 2 (với T 1 > T 2) möùc ñoä chuyeån ñoäng hoãn loaïn tyû leä nghòch vôùi T 0 Vaäy: trong quaù trình voâ cuøng nhoû, neáu cung caáp moät löôïng nhieät Q ôû nhieät ñoä T seõ toàn taïi haøm: Bieåu thöùc toaùn hoïc của nguyeân lyù II : Q S = S 2 – S 1 T Daáu “ > ”: chæ quaù trình baát thuaän nghòch Daáu “ = “: chæ quaù trình thuaän nghòch 44

6. 5. 2. Ý nghiã vật lý của entropi và công thức Boltzmann Ý nghiã vật lý: v. Entropi là thước đo độ hỗn loạn của hệ (S tăng độ hỗn loạn tăng) v. Entropi là thước đo xác suất TT của hệ (S tăng xác suất trạng thái W tăng) Trong heä neáu soá phaân töû lôùn traïng thaùi vi moâ caøng lôùn W taêng S heä taêng Heä caøng phöùc taïp S heä taêng; Ví duï: + Taêng nhieät ñoä cuûa heä S taêng + Taêng aùp suaát cuûa heä S giaûm 45

Công thức Boltzmann: § Đ/v một phân tử: S = k ln W = R ln W N 0 § Đ/v một mol: S = R ln W Trong đó: v k: haèng soá Boltzmann (k = R/N 0= 1, 38066. 10 -23) v R = 8, 314 J/mol. ñoä = 1, 987 cal/mol. ñoä v N 0: soá Avogadro = 6, 02. 1023 v W: xaùc suaát traïng thaùi cuûa heä 46

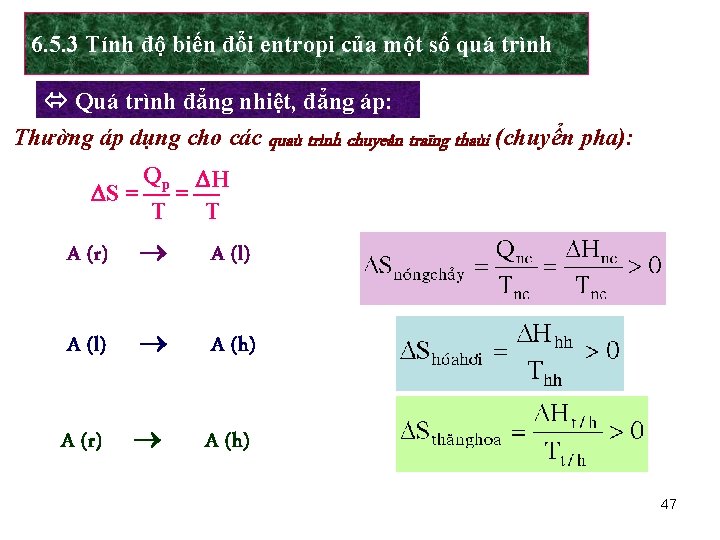
6. 5. 3 Tính độ biến đổi entropi của một số quá trình Quá trình đẳng nhiệt, đẳng áp: Thường áp dụng cho các quaù trình chuyeån traïng thaùi (chuyển pha): Qp H S = = T T A (r) A (l) A (h) A (r) A (h) 47

VD: Tính S của quá trình chuyển 1 mol nước đá thành nước lỏng ở 00 C và tính S của 1 mol nước lỏng ở nhiệt độ trên, biết nhiệt nóng chảy của nước đá là 1463, 3 cal/mol và S của nước đá ở 00 C là 12, 4 cal/mol. độ Giải: Phương trình nhiệt hóa biểu diễn quá trình nóng chảy nước đá: H 2 O (r) H 2 O (l) Đây là quá trình đẳng nhiệt, đẳng áp nên: W Hcp 1463, 3 S = Sl - Sr = R ln l = = = 5, 36 cal/mol. độ Wr T 273 Entropi của nước lỏng ở 00 C: Snl = Snđ + S = 12, 4 + 5, 36 = 17, 76 cal/mol. độ 48

Quaù trình giãn nở đẳng nhieät của khí lý tưởng: Theo Joule, U của khí lý tưởng chỉ phụ thuộc nhiệt độ nên khi T = const thì U = 0 và QT = AT Q T A T V V 1 P P 2 T S = T = = n. R ln 2 = n. Rln 1 VD: Tính S của quá trình nén đẳng nhiệt 1 mol oxy từ P 1 = 0, 001 đến P 2= 0, 01 atm P 0, 001 S= 1 x R ln 1 =1, 987 ln = - 4, 576 đve 0, 01 P 2 49

Quá trình biến đổi nhiệt độ đẳng áp: Trong khoảng nhiệt độ khảo sát không quá lớn có thể xem Cp, S không phụ thuộc vào nhiệt độ nên: T 2 v Tính chính xác: S = n. Cpln T 1 v Tính gần đúng: dùng entropi tiêu chuẩn để tính S VD: Tính S của quá trình đốt nóng 1 mol nước lỏng ở 00 C lên 250 C và tính S của 1 mol nước lỏng ở nhiệt độ này, biết nhiệt nóng chảy của nước đá là 1463, 3 cal/mol và S của nước đá ở 00 C là 12, 4đve. Biết Cp của nước lỏng ở 250 C bằng 18, 0 cal/mol. độ. Giải: Tính S quá trình đốt nóng nước lỏng: 298 = 1, 58 đve S = 1 x 18 x ln 273 0 Tính S nước lỏng ở 25 C: Snl= Snđ+ Snđ nl + S 0 25 1463, 3 Snl = 12, 4 + + 1, 58 = 19, 34 đve 50 273

Quá trình pứ hóa học: Định tính: Khoâng caàn tính toaùn coù theå xaùc ñònh daáu cuûa S, döïa vaøo: bieán ñoåi theå tích V (cuûa chaát loûng) hay bieán ñoåi soá mol cuûa caùc chaát khí n Neáu V, n > 0 S > 0 V, n < 0 S < 0 VD 1: Khoâng caàn tính toaùn, haõy xaùc ñònh daáu cuûa S? (a) C(gr) + CO 2(k) 2 CO(k) V= 2 V – 1 V > 0 S >0 (b) N 2(k) + 3 H 2(k) 2 NH 3(k) V= 2 V – 4 V < 0 S <0 (c) C(gr) + O 2 (k) CO 2 (k) V= 1 V – 1 V = 0 S = 0 51

Định lượng: S= Ssp - Scđ Cho phaûn öùng: a. A + b. B c. C + d. D VD: Tính S của pứ sau ở 298 K và 1500 K: C (gr) + CO 2 (k) = 2 CO (k) S 0298 (cal/mol. độ) 1, 37 51, 06 47, 22 S 1500 (cal/mol. độ) 8, 0 69, 80 59, 50 Ø Ở 298 K: S 298 = 2 x 47, 22 – ( 1, 37+ 51, 06) = 42, 01 đve Ø Ở 1500 K: S 1500 = 2 x 59, 50 – ( 8, 0 + 69, 80) = 41, 20 đve Sự sai lệch giữa 2 giá trị S (ở 2 nhiệt độ cách nhau 12000) là hoàn toàn không đáng kể có thể dùng entropi tiêu chuẩn để tính S ở đk khác chuẩn 52

Tính S cuûa pứ ôû ñkieän khaùc chuaån P = 1 atm vaø nhieät ñoä T: + Neáu xem Spö khoâng thay ñoåi theo T: o STo( pö ) = S 298 (pö ) + Neáu cho giaù trò nhieät dung ñaúng aùp CP cuûa caùc chaát (vaø CP cuûa caùc chaát khoâng ñoåi theo T 0): 53

6. 5. 4. Theá ñaúng aùp và chieàu xảy cuûa quaù trình hóa học: 6. 5. 4. 1. Khái niệm về thế đẳng áp: Neáu bieát daáu cuûa S coù theå suy ra chieàu cuûa quaù trình: v S > 0: pöù xaûy ra theo chieàu thuaän v S < 0: pöù xaûy ra theo chieàu nghòch Tuy nhieân, coù nhieàu pứ daáu cuûa S khoâng cho bieát chính xaùc chieàu xaûy ra cuûa quaù trình. VD 1: C(gr) + H 2 O(k) CO(k) + H 2(k) n = 2 – 1 > 0 S > 0, pöù xaûy ra theo chieàu thuaän nhöng thöïc teá pöù khoâng xaûy ra ôû 25 o. C maø phải đốt nóng đến hơn 700 o. C pứ mới xaûy ra được. VD 2: ROH + H 2 O dd. ROH V = V 2 – V 1< 0, pöù giảm thể tích S < 0 _ nhưng quá trình hoøa tan ROH trong nöôùc xảy ra ôû moïi nhieät ñoä 54

Vì vaäy nguyeân lyù II ít ñöôïc aùp duïng moät caùch rieâng reõ ñeå xaùc ñònh chieàu cuûa quaù trình. Muoán xaùc ñònh chieàu quaù trình phaûi keát hôïp caû 2 nguyeân lyù Moät phaûn öùng deã xaûy ra khi: + Theo nguyeân lyù I: H < 0 (pöù toûa nhieät) + Theo nguyeân lyù II: S > 0 (entropi tăng) Keát hôïp caû nguyeân lyù I vaø II: xuaát hieän theá ñaúng aùp ñaúng nhieät (theá ñaúng aùp) hay naêng löôïng töï do Gibbs, kyù hieäu laø G G = H – TS G = G 2 – G 1 = H – T S 55

Các đặc điểm của thế đẳng áp: v Là tính chất của hệ như: U, H, … là đại lượng năng lượng xác định trạng thái của hệ, là đại lượng dung độ, không phụ thuộc vào đường đi của hệ. v Thế đẳng áp cũng như độ biến đổi thế đẳng áp G phụ thuộc vào áp suất và nhiệt độ. v Để xét chiều xảy ra của quá trình dựa vào G. Trong quá trình đẳng nhiệt đẳng áp: G = H – T S _ đây là phương trình cơ bản của nhiệt động lực học , cho phép tính được G của các quá trình xảy ra ở điều kiện T = const và P= const 56

YÙ nghóa cuûa haøm Gibbs xaùc ñònh chieàu cuûa quaù trình § G = G 2 – G 1 < 0 pöù xaûy ra theo chieàu thuaän § G = G 2 – G 1 > 0 pöù xaûy ra theo chieàu nghòch § G = G 2 – G 1 = 0 pöù caân baèng v. Thế đẳng áp tiêu chuẩn: Go 298 hay Go là độ biến đổi thế đẳng áp ở ñkieän chuaån: ünồng độ hoặc Priêng phần của mỗi chất = 1 đvị (1 mol/lít hoặc 1 atm), üchất khí phải là khí lý tưởng, üchất rắn và lỏng phải ở dạng đa hình bền. v. Thế đẳng áp tạo thành tiêu chuẩn của một chất là độ biến đổi thế đẳng áp của pứ tạo thành 1 mol chất từ các đơn chất ứng với TT tự do bền vững ở P = 1 atm, T 0 = 298 K Go 298 tt (kcal/mol; k. J/mol) Go 298 tt ñôn chaát bền qui ước bằng 0 57

6. 5. 4. 2. Độ biến đổi thế đẳng áp và điều kiện xảy ra của các quá trình hóa học: Lý thuyết nhiệt động chứng minh rằng: A’max= - G A’max là công có ích cực đại hệ thực hiện được trong quá trình thuận nghịch. Quá trình (tự) xảy ra khi A’max> 0, nghĩa là khi G < 0 (giảm G) hệ chỉ sinh ra công trong quá trình tự xảy ra. Quá trình không xảy ra khi A’max< 0, nghĩa là khi G > 0 (tăng G) muốn quá trình xảy ra phải tiêu tốn công cho hệ Khi G = 0 hệ đạt trạng thái cân bằng bền vững Vai trò của các đại lượng H, S trong việc xác định chiều xảy ra của các quá trình hóa học 58

Ảnh höôûng cuûa nhieät ñoä ñeán G cuûa quaù trình: Ở nhiệt độ thấp ( 0 K): T S 0 G = H dấu G được quyết định bởi dấu của H , nghĩa là ở điều kiện này có thể dựa vào hiệu ứng nhiệt để xét chiều xảy ra quá trình: § Quá trình phát nhiệt: H < 0 G < 0 (tự xảy ra). § Quá trình thu nhiệt: H > 0 G > 0 (không thể tự xảy ra). Ở T 0 cao: vì T S có giá trị rất lớn G hầu như chỉ phụ thuộc S: § S > 0: khi T càng cao - T S càng âm, quá trình càng có khả năng tự xảy ra. § S < 0: khi T càng cao - T S càng dương, quá trình càng ít có khả năng xảy ra. Ở điều kiện này S chiếm ưu thế nên có thể dựa vào nó xét chiều quá trình 59

Ở nhiệt độ không cao không thấp: dựa vào cả H và S để xét chiều xảy ra • H < 0, S > 0 G < 0 pöù xaûy ra ôû moïi nhieät ñoä H > 0, S < 0 G > 0 pöù khoâng xaûy ra ôû moïi T 0 • H < 0, S < 0 muoán G < 0 H > T S (khi T < Tcb) Nếu T > Tcb quá trình phải xảy ra theo chiều ngược lại • H > 0, S > 0 muoán G < 0 (khi T > Tcb) Nếu T < Tcb quá trình phải xảy ra theo chiều ngược lại • Khi H = T S G = H - T S =0 hệ đạt TTCB bền vững Tcb= H S 60

6. 5. 4. 3. Tính bieán ñoåi G cuûa quaù trình hóa học: v Chủ yếu dựa vào phương trình: Có 2 cách: G = H - T S Trong trường hợp này khi khoảng nhiệt độ khảo sát không quá lớn, có thể sử dụng trực tiếp Ho 298 , So 298 để tính G Go 298 pö = Ho 298 pö - 298 So 298 pö v Ngoài ra có thể dựa vào: VD: a. A + b. B G= Gttsp - Gttcđ c. C + d. D Go 298 pö = (c. Go 298(C) + d. Go 298 (D)) - (a. Go 298(A) + b. Go 298(B)) 61

VD: Tính G 0 ở 298 và 1000 K của pứ: Ho 298 tt (kj/mol) So 298 (j/mol. ñoä) Go 298 tt (kj/mol) 5, 7 -0 0 C (gr) + H 2 O (k) = CO (k) + - 241, 8 - 110, 5 0 188, 7 197, 9 -228, 6 -137, 3 0 H 2 (k) 136, 0 v Tính ở 298 K: G 0298= H 0298 - 298 S 0298 = (-110, 5+241, 8) - 298(197, 9+130, 6 -5, 7 -188, 7)x 10 -3= 91, 3 kj/mol G 0298 = G 0298 tt. CO - G 0298 tt. H 2 O = -137, 3 + 228, 6 = 91, 3 kj/mol v. Tính ở 1000 K: G 0298= H 0298 - 1000 S 0298= 131, 3 – 1000 x 134, 1 x 10 -3 = -2, 8 kj/mol 62
 Chng finance
Chng finance Inikos va uning shakllari
Inikos va uning shakllari đường dầu
đường dầu Chu trình hồi nhiệt
Chu trình hồi nhiệt Post hoc ergo procter hoc
Post hoc ergo procter hoc Denying the antecedent fallacy
Denying the antecedent fallacy Gmat
Gmat Post hoc ergo propter hoc fallacy
Post hoc ergo propter hoc fallacy Is ea id chart
Is ea id chart Post hoc fallacy
Post hoc fallacy Studentized range statistic
Studentized range statistic Straw hat fallacy
Straw hat fallacy Cấu tạo xinap
Cấu tạo xinap Lập công thức hóa học của ca2 với oh1
Lập công thức hóa học của ca2 với oh1 Các phương thức biểu đạ
Các phương thức biểu đạ Hoa có cả nhị và nhụy
Hoa có cả nhị và nhụy Những cây nào sau đây thuộc cây ngắn ngày
Những cây nào sau đây thuộc cây ngắn ngày Nhược điểm của túi tiêu hóa
Nhược điểm của túi tiêu hóa Mrs ong jia miin
Mrs ong jia miin Triêu từ bạch đế thái vân gian
Triêu từ bạch đế thái vân gian ông tổ nghề thêu
ông tổ nghề thêu Granturi ong
Granturi ong Marc ong
Marc ong ông mặt trời rực rỡ chiếu ngàn tia nắng vàng
ông mặt trời rực rỡ chiếu ngàn tia nắng vàng Nathan ong
Nathan ong Ubicacion ong
Ubicacion ong ông hai hì hục vỡ một vạt đất rậm
ông hai hì hục vỡ một vạt đất rậm Iso ong
Iso ong Ong falsafasi
Ong falsafasi тушунчалар тахлили методи
тушунчалар тахлили методи Intervida ong
Intervida ong Charlene wilkinson
Charlene wilkinson Empirik sotsiologiya
Empirik sotsiologiya Hành trình của bầy ong
Hành trình của bầy ong Dr nicole ong
Dr nicole ong Ong buzilishlari
Ong buzilishlari Mian li ong
Mian li ong Doctora ong
Doctora ong Gấp tàu thủy hai ống khói
Gấp tàu thủy hai ống khói Hành trình của bầy ong
Hành trình của bầy ong ống nối chữ l dùng để làm gì
ống nối chữ l dùng để làm gì Qu es una ong
Qu es una ong Estetik tarbiyaning mohiyati
Estetik tarbiyaning mohiyati Kiki ong
Kiki ong ông là ai
ông là ai Ong
Ong Determinizim
Determinizim Axloqiy kategoriyalar
Axloqiy kategoriyalar Ong juice
Ong juice Ong
Ong Semen ong
Semen ong Ilmiy bilish
Ilmiy bilish Joshua ong photos
Joshua ong photos Paulus ong
Paulus ong Nizomulmulk siyosatnoma
Nizomulmulk siyosatnoma Quần xã rừng thường có cấu trúc nổi bật là
Quần xã rừng thường có cấu trúc nổi bật là ông trời mặc áo giáp đen ra trận
ông trời mặc áo giáp đen ra trận Bài hát chiếc đèn ông sao của nhạc sĩ nào
Bài hát chiếc đèn ông sao của nhạc sĩ nào Orality and literacy walter j. ong
Orality and literacy walter j. ong Charlene baldwin
Charlene baldwin Ekologik madaniyat haqida
Ekologik madaniyat haqida Rey ong
Rey ong Las ms
Las ms